Нозокомиальные инфекции, вызванные бактериями семейства Enterobacteriacae, в онкологической клинике
Автор: Дмитриева Наталья Владимировна, Агинова Виктория Викторовна, Петухова Ирина Николаевна, Григорьевская Злата Валерьевна, Дмитриева Анна Игоревна, Багирова Наталья Сергеевна, Терещенко Инна Васильевна, Хмаладзе Елена Николаевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Цель исследования - проанализировать частоту выделения мультирезистентных (MDR) возбудителей госпитальных инфекций - Escherichia coli и Klebsiella pneumoniae. материал и методы. Проанализи-ровано 862 штамма E. coli и 1 461 штамм K. pneumoniae, выделенных в 2014-16 гг. из раневого отде-ляемого, крови, мочи и других патологических материалов от онкологических больных, находившихся в НМИЦ онкологии им. Н.Н. Блохина МЗ РФ. Результаты. За 3 года отмечено значимое (p≤0,0001) увеличение числа E. coli, устойчивых к пиперациллину-тазобактаму (с 8,1 до 25 %), цефтриаксону (с 15,7 до 100 %), эртапенему (c 8,1 до 97,7 %), амикацину (c 4,5 до 14,6 %). Количество E. coli, про-дуцирующих карбапенемазы, увеличилось с 5,8 до 20,8 % (p≤0,0001). Среди K. pneumoniae отмечено значимое (p≤0,0001) увеличение числа штаммов, устойчивых к пиперациллину-тазобактаму (с 59,7 до 89,7 %), цефтазидиму (с 62,8 до 82,8 %), цефтриаксону (с 62,8 до 100 %), цефепиму (с 63,1 до 83,8 %), эртапенему (c 62,1 до 100 %), имипенему (c 30,0 до 81,0 %), меропенему (c 53,9 до 86,8 %). заключение. Оценка частоты выделения MDR-микроорганизмов в динамике является важнейшим элементом эпидемиологического надзора и необходима для правильного лечения пациентов с ин-фекционными осложнениями.
Энтеробактерии, мультирезистентные микроорганизмы, онкологические больные, внутрибольничные инфекции, антибактериальные препараты, лекарственная устойчивость
Короткий адрес: https://sciup.org/140254239
IDR: 140254239 | УДК: 616-006-06:616.9-022 | DOI: 10.21294/1814-4861-2019-18-1-36-42
Текст научной статьи Нозокомиальные инфекции, вызванные бактериями семейства Enterobacteriacae, в онкологической клинике
Нозокомиальные инфекции (НИ) представляют серьезную проблему для клиник, особенно он‑ кологических. Нозокомиальные инфекции – это группа различных инфекций, объединенных по признаку общего эпидемиологического характера инфицирования, возникающих в стационаре спустя 24–72 ч после госпитализации больного. Онколо‑ гические больные являются группой риска в от‑ ношении развития НИ [1]. Частота инфекционных осложнений в различных группах онкологических больных составляет от 12 до 50 %, а среди больных лейкозами достигает 75 % [2]. В последние годы отмечается значительное увеличение интереса к проблеме нозокомиальных инфекций в связи с вы‑ соким уровнем заболеваемости и связанным с этим серьезным социально‑экономическим ущербом. По данным ЦНИИ эпидемиологии МЗ РФ, ежегодное количество госпитальных инфекций составляет не менее 2–2,5 млн случаев в год, а ежегодный эконо‑ мический ущерб – более 5 млрд руб. [3].
Спектр возбудителей инфекционных ослож‑ нений у онкологических больных широк и раз‑ нообразен. Он включает аэробные и анаэробные бактерии, патогенные грибы, вирусы, простейшие, однако ведущими возбудителями являются грам‑ отрицательные неферментирующие бактерии ( Acinetobacter baumannii, Pseudomonas aeruginosa ), характеризующиеся множественной лекарствен‑ ной устойчивостью.
Пациенты с инфекциями, вызванными рези‑ стентными бактериями, имеют повышенный риск отрицательных клинических результатов и леталь‑ ного исхода, а также потребляют больше медицин‑ ских ресурсов, чем пациенты, инфицированные чувствительными к антибиотикам штаммами тех же возбудителей [4]. Например, устойчивость Klebsiella pneumoniae – распространенной кишеч‑ ной бактерии, которая может вызывать угрожающие жизни инфекции и резистентной к карбапенемам, препаратам, используемым в качестве «последней лечебной возможности», – распространилась на все регионы мира [5]. K. pneumoniae часто становится причиной внутрибольничных инфекций, таких как пневмонии, инфекции кровотока, а также инфекции новорожденных и пациентов отделений интенсив‑ ной терапии. В некоторых странах из‑за развившей‑ ся устойчивости K. pneumoniae к карбапенемам они оказываются неэффективны при лечении более чем половины пациентов с этой инфекцией [6, 7].
Широкое распространение получила устой‑ чивость E. coli к фторхинолонам, антибиотикам, наиболее часто применяемым при лечении ин‑ фекций мочевыводящих путей. Теперь во многих странах и на разных континентах терапия фтор‑ хинолонами неэффективна более чем в половине случаев. Количество карбапенем‑резистентных вариантов несколько меньше, чем у клебсиелл, и обычно не превышает 30 % [8]. Согласно данным по Европейскому региону, НИ приводят к значи‑ тельному увеличению нагрузки на экономику и здравоохранение европейских стран: число паци‑ ентов, погибших в результате внутрибольничных инфекций, вызванных резистентными бактериями, ежегодно превышает 25 тысяч человек [9]. По‑ мимо роста уровня заболеваемости и смертности, среди пациентов, следует принимать во внимание и такие факторы, как увеличение сопутствующих расходов на здравоохранение, которые ежегодно составляют более 1,5 млрд евро [10]. В последние годы к проблеме антимикробной резистентности (АМР) усилено внимание со стороны не только врачей, но и политиков, экономистов, так как АМР преодолела межгосударственные границы и получила повсеместное распространение [11]. В Российской Федерации также предпринята попытка разработки стратегии предупреждения распространения антимикробной резистентности на период до 2030 г. [12].
Материал и методы
Работа выполнена в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Проана‑ лизирована таксономическая структура микро‑ организмов (без учета грибковой микрофлоры), выделенных в 2014–2016 гг. из 24 357 патологиче‑ ских биоматериалов от онкологических больных, проходивших лечение в клинике. Пристальное внимание было уделено наиболее часто выделяе‑ мым микроорганизмам, общее количество которых составило 6 218 (52,1 %). Данные микроорганизмы являются клинически значимыми и были устойчи‑ вы к большинству антибактериальных препаратов. Все изоляты были идентифицированы до вида колориметрическим методом на анализаторах «Microscan WalkAway – 40 SI» (Siemens Healthcare Diagnostics, США) и «Vitek 2» (BioMerieux, Фран‑ ция), а также методом матрично‑ассоциированной лазерной десорбции/ионизации – времяпролетной масс‑спектрометрии (MALDI‑TOF) и программ‑ ного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия).
Результаты
Исследованию подвергались такие биома‑ териалы, как отделяемое нижних дыхательных путей (ОНДП), полученное при бронхоскопии, бронхоальвеолярном лаваже, посеве мокроты, а также отделяемое по дренажам (ОД) и раневое отделяемое (РО), моча, кровь, прочие патологи‑ ческие материалы (кал, ликвор, аспират суставной жидкости, мазки и т. д.) (табл. 1).
Причиной инфекционных осложнений нижних дыхательных путей в 21,0 % случаев являлась K. рneumoniaе. Число выделенных из ОНДП штам‑ мов было больше, чем из мочи (18,7 %) (p>0,05), однако разница была недостоверна, в то время как из мочи (18,7 %) и ОД + РО (15,9 %) K. рneumoniaе выделялись достоверно чаще, чем из крови (3,9 %) (р<0,0001).
E. coli становилась причиной инфекций моче‑ выводящих путей в 67,9 % случаев, что достоверно выше частоты ее выделения при инфекциях нижних дыхательных путей (5,9 %), инфекциях кровотока (6,6 %) и частоты выделения данного микроорга‑ низма в отделяемом из дренажей и ран (13,6 %). Разница статистически достоверна (р<0,0001). Причем число выделенных штаммов из ОД + РО больше, чем из ОНДП и крови (р<0,0001).
В ходе исследований также был проведен ана‑ лиз выявления резистентных штаммов E. coli и K. pneumoniae из патологических материалов от больных. В период исследований отмечена тенден‑ ция к увеличению устойчивости кишечной палочки к ингибитор‑защищенным пенициллинам (табл. 2). Установлена достоверная разница в увеличении количества резистентных штаммов к пиперацил‑ лину/тазобактаму с 8,1 % в 2014 г. до 15,8 % в 2015 г. (p<0,05) и до 25,1 % в 2016 г. (p≤0,0001). По отношению к ампициллину/сульбактаму число устойчивых штаммов в 2014 г. составило 58,6 %, таблица 1
Частота выделения проблемных грамотрицательных микроорганизмов из патологических материалов, 2014–16 гг.
Динамика выявления устойчивых к антибиотикам штаммов E. coli
|
Препараты |
Годы/количество штаммов E.coli 2014 г. (n=223) 2015 г. (n=227) 2016 г. (n=403) |
|
Ампициллин/сульбактам Пиперациллин/тазобактам Цефтазидим Цефтриаксон Цефепим Имипенем Меропенем Эртапенем Амикацин Ципрофлоксацин Триметоприм/сульфаметок‑ сазол |
130 (58,6 %) 121(53,3 %) 253 (62,8 %) 18 (8,1 %) 36 (15,8 %) 101 (25,1 %) 41 (18,3 %) 42 (18,5 %) 120 (29,8 %) 35 (15,7 %) 47 (20,7 %) 403 (100,0 %) 33 (14,7 %) 40 (17,6 %) 106 (26,3 %) 7 (3,1 %) 11 (4,8 %) 68 (16,9 %) 13 (5,8 %) 15 (6,6 %) 84 (20,8 %) 18 (8,1 %) 27(11,8 %) 394 (97,7%) 10 (4,5 %) 18 (7,9 %) 59 (14,6 %) 77 (34,5 %) 106 (46,7 %) 193 (47,8 %) 100 (44,8 %) 102 (44,9 %) 209 (51,8 %) |
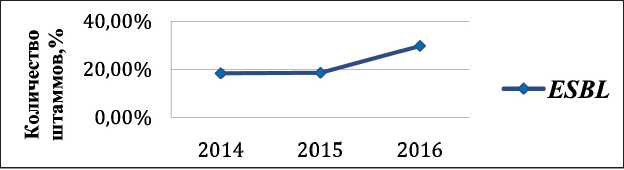
Рис. 1. Динамика частоты выделения E. coli, продуцирующих бета-лактамазы расширенного спектра действия ( ESBL – бета-лактамазы расширенного спектра действия)
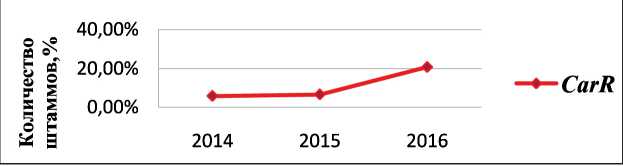
Рис. 2. Динамика частоты выделения карбапенем-резистентных ( CarR- карбапенем-резистентный штамм ) E. coli
в 2015 г. незначительно снизилось – до 53,3 %, а в 2016 г. возросло до 62,8 %, однако достоверной разницы обнаружено не было (p>0,05).
По отношению к цефалоспоринам число устойчивых штаммов увеличилось. Причем, если к цефтазидину и цефепиму наблюдался постепен‑ ный достоверный рост числа устойчивых штаммов (18,3–29,8 % и 14,7–26,3 % соответственно), то количество штаммов, устойчивых к цефтриаксо‑ ну, в 2016 г. составило 100,0 % против 15,7 % в 2014 г. Разница достоверна (p≤0,0001).
В 2016 г. существенно увеличилось выделение карбапенем‑резистентных кишечных палочек. Так, число штаммов, резистентных к эртапенему, возросло с 8,1 % в 2014 г. до 97,7 % в 2016 г. По отношению к имипенему и меропенему общий процент устойчивых штаммов был невелик (не‑ много более 20 %), однако наблюдалась тенденция к увеличению количества таких штаммов с 3,1 % до 16,9 % для имипенема и от 5,8 % до 20,8 % для меропенема (p≤0,0001).
При анализе устойчивости кишечной палочки к аминогликозидам (амикацин) была обнаружена достоверная разница в увеличении количества устойчивых штаммов с 4,5 % в 2014 г. до 14,6 % в 2016 г. (p≤0,0001), однако общее количество таких штаммов незначительно. По отношению к фторхинолонам (ципрофлоксацин) резистентных штаммов за период исследований было выделено менее 50 %, при этом достоверного увеличения (34,5–47,8 %) в динамике не отмечалось. Коли‑ чество устойчивых штаммов к триметоприму/ сульфаметоксазолу в период 2014–15 гг. не из‑ менилось и составило 44,8–44,9 %, а в 2016 г. их число увеличилось до 51,8 % (p>0,05). Разница недостоверна (p>0,05).
Динамика частоты выделения продуцентов бета‑лактамаз расширенного спектра действия (англ. – ESBL) и карбапенем‑резистентных ( СarR) штаммов E. coli за период 2014–16 гг. представлена на рис. 1 и 2. В период 2014–2016 гг. произошло увеличение частоты выделения ESBL- продуцентов с 18,3 % до 29,8 % (p<0,05) и СarR штаммов E. coli с 5,8 % до 20,8 % (p≤0,0001). В табл. 3 показана динамика устойчивости K.pneumoniaе к антибак‑ териальным препаратам.
Анализ данных показал, что K. pneumoniae ха‑ рактеризуются высоким процентом резистентных штаммов к большому количеству антибиотиков. На протяжении 2014–2016 гг. происходило нарас‑ тание числа устойчивых штаммов K. pneumoniae практически ко всем применяемым антибиотикам. Отмечено увеличение количества устойчивых штаммов к «защищенным» антибиотикам пени‑ циллинового ряда. Так, число резистентных к ампициллину/сульбактаму штаммов увеличилось за период 2014–2015 гг. незначительно – с 77,7 до 78,8 % (p>0,05), а в 2016 г. – до 89,8 %. Раз‑ ница за период 2014–16 гг. достоверна (p≤0,0001). Число устойчивых штаммов к пиперациллину/ тазобактаму увеличилось с 59,7 % в 2014 г. до 87,9 % в 2016 г. (p≤0,0001). Произошло дальнейшее таблица 3
Динамика выявления устойчивых к антибиотикам штаммов K. pneumoniae
|
Препараты |
2014 г. (n=293) |
Годы/количество штаммов 2015 г. (n=402) |
2016 г. (n=766) |
|
Ампициллин/сульбактам |
213 (77,7 %) |
317 (78,8 %) |
688 (89,8 %) |
|
Пиперациллин/тазобактам |
175 (59,7 %) |
277 (68,9 %) |
667 (87,1 %) |
|
Цефтазидим |
184 (62,7 %) |
261 (64,9 %) |
635 (82,8 %) |
|
Цефтриаксон |
184 (62,8 %) |
289 (71,9 %) |
766 (100,0 %) |
|
Цефепим |
185 (63,1 %) |
265 (65,9 %) |
642 (83,8 %) |
|
Имипенем |
88 (30,0 %) |
147 (36,7%) |
621 (81,0 %) |
|
Меропенем |
158 (53,9 %) |
248 (61,9 %) |
665 (86,8 %) |
|
Эртапенем |
182 (62,1 %) |
284 (70,6 %) |
766 (100,0 %) |
|
Амикацин |
41 (13,9 %) |
127 (31,7 %) |
168 (21,9 %) |
|
Ципрофлоксацин |
187 (63,8 %) |
275 (68,4 %) |
668 (87,2 %) |
|
Триметоприм/сульфаметок‑ сазол |
186 (63,4 %) |
260 (64,7 %) |
664 (86,6 %) |
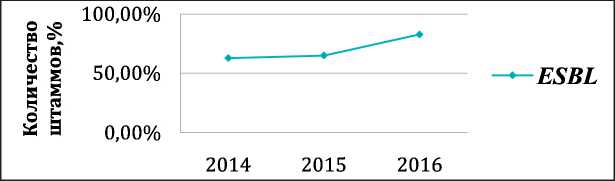
Рис. 3. Частота выделения ESBL- продуцирующих штаммов K. pneumoniae за период 2014–16 гг.
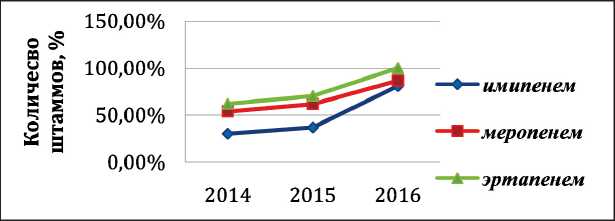
Рис. 4. Частота выделений ÑarR штаммов K. pneumoniaå за период 2014–16 гг.
увеличение количества резистентных штаммов к цефалоспоринам. Так, к препаратам III поколения устойчивость возросла с 62,7 до 82,8 % для цефта‑ зидима (p≤0,0001) и с 62,8 до 100,0 % (p≤0,0001) для цефтриаксона. Также достоверно увеличи‑ лось число устойчивых штаммов по отношению к цефепиму (IV поколение цефалоспоринов) – с 63,1 % в 2014 г. до 83,8 % в 2016 г. (p≤0,0001). Аналогично выросло и количество CarR штаммов. Значимо повысилась устойчивость к имипенему – с 30,0 % в 2014 г. до 81,0 % в 2016 г. (p≤0,0001) и к меропенему – с 53,9 % в 2014 г. до 61,9 % в 2015 г. (p<0,05) и до 86,8 % в 2016 г. (p≤0,0001). Устойчи‑ вость к эртапенему в 2016 г. увеличилась до 100,0 против 62,1 % в 2014 г. (p≤0,0001). Количество резистентных к аминогликозидам (амикацину) штаммов было достаточно невелико (21,9 %), тем не менее отмечен достоверный рост резистентно‑ сти. В 2014 г. было выделено 13,1 % устойчивых штаммов, в 2015 г. – 31,7 % (p≤0,0001), в 2016 г. – 21,9 % (p<0,002). Значимо возросла устойчивость к фторхинолонам (ципрофлоксацину) – с 63,8 % в 2014 г. до 87,2 % в 2016 г. (p≤0,0001). Количество штаммов, нечувствительных к бисептолу (триме‑ топриму/сульфаметоксазолу), в период 2014–15 гг. было примерно на одном уровне (63,4–64,7 %), а в 2016 г. увеличилось до 86,6 % (p≤0,0001).
Динамика частоты выделения ESBL- продуцен‑ тов и СarR штаммов K. pneumoniaе за период 2014–16 гг. представлена на рис. 3 и 4. Отмечено достоверное нарастание числа ESBL- продуцентов (62,7–82,8%) и СarR (53,9–86,8 %) штаммов K. pneumoniaе (p≤0,0001).
Список литературы Нозокомиальные инфекции, вызванные бактериями семейства Enterobacteriacae, в онкологической клинике
- Maschmeyer G., Haas A. The epidemiology and treatment of infections in cancer patients. Int J Antimicrob Agents. 2008; 31: 193-7.
- Дмитриева Н.В., Петухова И.Н., Смолянская А.З. Инфекционные осложнения в онкологической клинике. Практическая онкология. 2001; 1 (5): 18-20. [Dmitrieva N.V., Petukhova I.N., Smolyanskaya A.Z. Infectious complications in the oncological clinic. Practical Oncology. 2001; 1 (5): 18-20. (in Russian)].
- Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль. Клиническая микробиология и антимикробная химиотерапия. 2000; 2 (1): 16-30. [Kozlov R.S. Nosocomial infections: epidemiology, pathogenesis, prevention, control. Clinical microbiology and antimicrobial chemotherapy. 2000; 2 (1): 16-30. (in Russian)].
- Григорьевская З.В., Петухова И.Н., Багирова Н.С., Шильникова И.И., Терещенко И.В., Григорьевский Е.Д., Дмитриева Н.В. Нозокомиальные инфекции у онкологических больных: проблема нарастающей резистентности грамотрицательных микроорганизмов. Сибирский онкологический журнал. 2017; 16 (1): 91-97. [Grigorievskaya Z.V., Petukhova I.N., Bagirova N.S., Shilnikova I.I., Tereshchenko I.V., Grigorievsky E.D., Dmitrieva N.V. Nasocomial infectoions in cancer patients: problem of gram-negative bacterial resistance. Siberian Journal of Oncology. 2017; 16 (1): 91-97. (in Russian)]. DOI: 10.21294/1814-4861-2017-16-1-91-97
- Kallen A., Guh A. United States centers for disease control and prevention issue updated guidance for tackling carbapenem-resistant Enterobacteriaceae. Euro Surveill. 2012 Jun 28; 17 (26). pii: 20207.


