Нозокомиальные инфекции, вызванные Pseudomonas aeruginosa, в онкологической клинике
Автор: Дмитриева Наталья Владимировна, Эйдельштейн Михаил Владимирович, Агинова Виктория Викторовна, Петухова Ирина Николаевна, Григорьевская Злата Валерьевна, Багирова Наталья Сергеевна, Терещенко Инна Васильевна, Кулага Елена Валентиновна, Ключникова Ирина Александровна, Соколова Елена Николаевна, Шек Евгений Александрович, Склеенова Елена Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.18, 2019 года.
Бесплатный доступ
Цель исследования - оценить частоту выделения мультирезистентных Pseudomonas aeruginosa и выявить механизмы резистентности к карбапенемам. Материал и методы. Проанализировано 866 штаммов синегнойных палочек, выделенных из патологических материалов от онкологических больных в 2014-16 гг. Определен уровень резистентности к пиперациллину/тазобактаму, цефтазидиму, цефепиму, имипенему, меропенему, ципрофлоксацину, амикацину в динамике. Резистентные к карбапенемам (car-R) штаммы исследовали на наличие ферментов. Результаты. Число штаммов, резистентных к пиперациллину/тазобактаму в период 2014-2016 гг., составляло 20,1 % и 12,9 %, цефтазидиму - 33,0-32,9 %, цефепиму - 25,6-32,9 %, ципрофлоксацину - 36,8-43,8 %, амикацину - 23,8-24,9 %. Разница во всех случаях недостоверна (p>0,05). В то же время наблюдалось увеличение числа car-R штаммов с 31,7 до 43,8 % (p
Онкологические больные, резистентность, продукция карбапенемаз, внутрибольничные инфекции, антибактериальные препараты
Короткий адрес: https://sciup.org/140254249
IDR: 140254249 | УДК: 616-006-022:616.9:615.281 | DOI: 10.21294/1814-4861-2019-18-2-28-34
Текст научной статьи Нозокомиальные инфекции, вызванные Pseudomonas aeruginosa, в онкологической клинике
Синегнойная палочка является типичным условно-патогенным микроорганизмом. Обладая многочисленными факторами вирулентности (токсинами, адгезинами и т. д.), она встречается у 3–5 % здоровых людей на коже, в носоглотке и кале [1–6]. Наибольшую проблему представляют внутрибольничные инфекции, вызванные синегнойными палочками. P. aeruginosa – четвертый по частоте выделения возбудитель, отвечающий за возникновение 10 % госпитальных инфекций [7, 8]. При этом доля штаммов, резистентных как к фторхинолонам, так и к карбапенемам, постоянно растет [9, 10]. P. aeruginosa – один из наиболее опасных патогенов для онкологических больных [1, 2].
По данным ECDC за 2016 г., треть изолятов P. aeruginosa (33,9 %) в Европейском союзе была устойчивой по меньшей мере к одной из трех групп антибиотиков (пиперациллин-тазобактам, фторхинолоны, цефтазидим, аминогликозиды и карбапенемы) [11]. Наибольший средний процент резистентности был зарегистрирован для пиперациллина-тазобактама (16,3 %), за которым следуют фторхинолоны (15,0 %), карбапенемы
(15,0 %), цефтазидим (13,0 %) и аминогликозиды (10,0 %) (рис. 1).
Материал и методы
Исследовали 4104 штамма грамотрицательных микроорганизмов, выделенных из патологических материалов от пациентов и отличавшихся высокой и множественной лекарственной резистентностью в 2014–16 гг., в том числе 866 штаммов, выделенных в 2014 г., 1243 штамма – в 2015 г. и 1995 штаммов, выделенных в 2016 г. Культивирование микроорганизмов проводилось по стандартным микробиологическим методикам с применением стандартизированных питательных сред, согласно нормативным документам (Приказ МЗ СССР от 22 апреля 1985 г. № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебнопрофилактических учреждений»).
Все изоляты были идентифицированы до вида колориметрическим методом на анализаторах «Mi-croscan WalkAway-40 SI» (производитель Siemens Healthcare Diagnostics, США) и «Vitek 2» (произ-
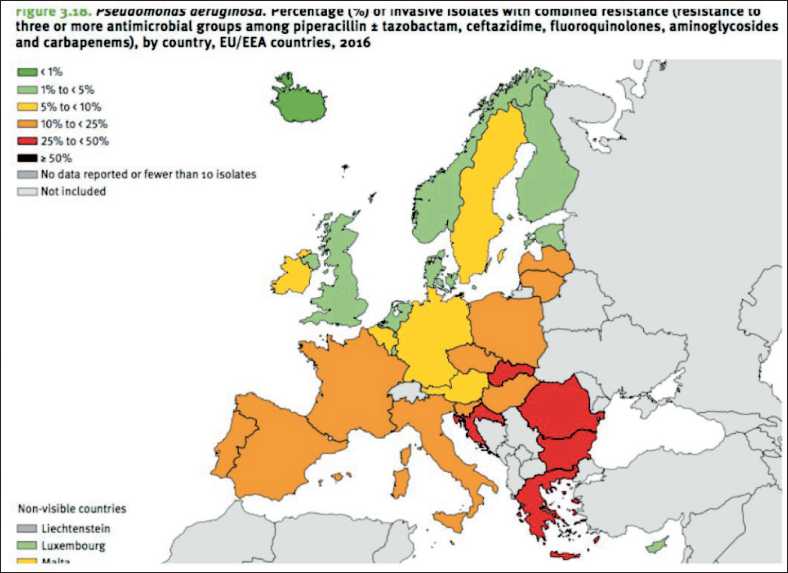
Рис. 1. Распространение MDR- штаммов P. aeruginosa в странах Европы (2016 г.) [11]. Примечание: темно-зеленый цвет – случаев не отмечено; светло-зеленый – спорадические случаи; светло-желтый – единичные госпитальные вспышки; темно-желтый – спорадические госпитальные вспышки; оранжевый – региональное распространение;
красный – межрегиональное распространение; вишневый – эндемическая ситуация; серый – данные недоступны
водитель BioMerieux, Франция), а также методом матрично-ассоциированной лазерной десорбции/ ионизации – времяпролетной масс-спектрометрии (MALDI-TOF) и программного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия). Определение лекарственной устойчивости к антибиотикам проводили, согласно ISO 20776–1:2006 и ГОСТ Р ИСО 20776–1–2010, турбидиметрическим методом на анализаторах «Vitek 2» и методом флуоресцентной детекции на анализаторе «Microscan WalkAway-40 SI».
Нечувствительные (умеренно-резистентные или резистентные) к карбапенемам штаммы исследовали на наличие карбапенемаз. Фенотипическую экспрессию карбапенемаз оценивали с использованием теста инактивации карбапенемов (CIM-test). Гены приобретенных карбапенемаз групп VIM, IMP, NDM и GES (подгруппа GES-2 (Gly170-Asn) и подгруппы GES-5 (Gly170-Ser)) определяли с помощью ПЦР в режиме реального времени. Выявление продукции карбапенемаз проводилось в лаборатории (заведующий – к.б.н. М.В. Эйдельштейн) НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленского государственного медицинского университета» Минздрава России – Сотрудничающего центра ВОЗ по укреплению потенциала в сфере надзора и исследований антибиотикорезистентности
Результаты
Всего за 2014–16 гг. было выделено 839 штаммов P. aeruginosa . При изучении выделения штаммов синегнойной палочки по годам отмечено, что в 2014 г. выделено 239 (27,6 %), в 2015 г. – 251 (20,2 %), в 2016 г. – 349 (17,5 %) штаммов P. aeruginosa . Данные представлены относительно общего числа проанализированных в каждом году штаммов. Разница в частоте выделения синегнойной палочки в 2014–15 гг. и в 2014–16 гг. статистически значима (p<0,0001). Однако достоверной разницы частоты выделения P. aeruginosa в 2015–16 гг. не обнаружено (p>0,05).
При анализе динамики выделения P. aeruginosa в абсолютных цифрах за 2014–16 гг. отмечено увеличение абсолютного числа штаммов синегнойной палочки (рис. 2), однако в то же время относительное количество клинических изолятов P. aeruginosa имело тенденцию к снижению: в 2014 г. – 27,6 %; в 2015 г. – 20,2 %; в 2016 г. – 17,5 % (рис. 3).
Чаще всего синегнойная палочка обнаруживалась в отделяемом из нижних дыхательных путей (25,9 %), что достоверно выше (p<0,001) такового в раневом отделяемом, отделяемом из дренажей – 15,5 %, мочи – 12,9 %, крови – 7,0 % (табл. 1). За исследуемый период отмечена тенденция к снижению устойчивости P. aеruginosa к антибиотикам пенициллинового ряда (пиперациллину/ тазобактаму) с 20,1 % в 2014 г. до 17,1 % в 2015 г. (p<0,001) и до 12,9 % в 2016 г., разница значима
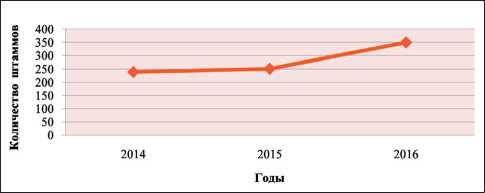
Рис. 2. Динамика выделения штаммов P. aeruginosa из биологических материалов в 2014–16 гг. (абсолютные значения)
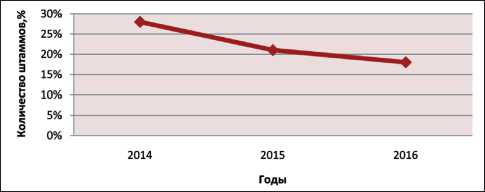
Рис. 3. Динамика выделения штаммов P. aeruginosa из биологических материалов в 2014–16 гг. (относительные значения)
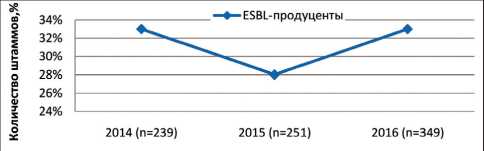
Рис. 4. Динамика выявления ESBL- продуцентов среди штаммов P. aеruginosa в 2014–16 гг.
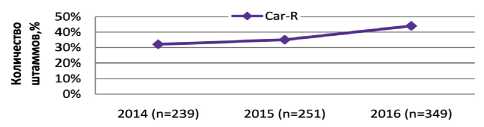
Рис. 5. Динамика выявления карбапенем-резистентных ( CarR) штаммов P. aеruginosa в 2014–16 гг.
(р<0,05). По отношению к цефалоспоринам значимых изменений в устойчивости не произошло, уровень резистентности был невысок. Так, число устойчивых к цефтазидиму штаммов находилось в диапазоне от 27,8 до 33,0 %, к цефепиму – от 24,7 до 32,9 % (p>0,05) (табл. 2).
Наблюдалось увеличение устойчивости P. aеruginosa к карбапенемам. За исследуемый период число резистентных штаммов к имипенему возросло с 38,9 % в 2014 г. до 40,6 % в 2015 г. и до 46,9 % в 2016 г., однако различия недостоверны (р>0,05). Относительное количество устойчивых штаммов к меропенему значимо возросло – с 31,7 до 43,8 % (p<0,05). Отмечено незначитель- ное увеличение числа резистентных штаммов к фторхинолонам (ципрофлоксацину) – с 36,8 до 43,8 % (р>0,05). По отношению к аминогликозидам (амикацин) число резистентных штаммов было невысоким (23,8–24,9 %), значимых различий в увеличении резистентности не выявлено.
Динамика выявления резистентных штаммов P. aеruginosa к цефалоспоринам (продукция бета-лактамаз расширенного спектра действия, англ. ESBL) и карбапенемам (продукция карбапенемаз) представлена на рис. 4 и 5. В 2014–16 гг. произошло нарастание количества CarR штаммов синегнойной палочки – с 31,7 до 43,8 % (p<0,05), в то время как количество ESBL- продуцирующих P. aeruginosa в
Таблица 1
Частота выделения P. aeruginosa из различных патологических материалов
|
Виды патологических материалов |
Частота выделения P. aeruginosa |
|
Отделяемое из нижних дыхательных путей |
218 (25,9 %) |
|
Отделяемое из ран и дренажей |
130 (15,5 %) |
|
Моча |
109 (12,9 %) |
|
Кровь |
59 (7,0 %) |
|
Прочие биоматериалы |
323 (38,5 %) |
|
Всего |
839 (16,9 %) |
Таблица 2
Устойчивость P. aåruginosa к различным классам антибактериальных препаратов по годам
|
Препараты |
Годы/количество штаммов P. aeruginosa , резистентных к тому или иному антибиотику 2014 (n=239) 2015 (n=251) 2016 (n=349) |
|
Пиперациллин/ тазобактам Цефтазидим Цефепим Имипенем Меропенем Ципрофлоксацин Амикацин |
48 (20,1 %) 43 (17,1 %) 45 (12,9 %) 79 (33,0 %) 70 (27,8 %) 115 (32,9 %) 61 (25,6 %) 62 (24,7 %) 115 (32,9 %) 93 (38,9 %) 102 (40,6 %) 164 (46,9 %) 76 (31,7 %) 87 (34,6 %) 153 (43,8 %) 88 (36,8 %) 100 (39,8 %) 153 (43,8 %) 57 (23,8 %) 83 (33,1 %) 87 (24,9 %) |
Таблица 3
Продукция карбапенемаз штаммами P. aeruginosa (n=7), циркулирующими в онкологической клинике
|
Наименование патологического материала |
Виды карбапенемаз |
CIM-тест |
||
|
VIM |
IMP |
GES |
||
|
Моча |
– |
– |
– |
– |
|
Желчь |
– |
– |
GES-5 |
+ |
|
Желчь |
– |
– |
– |
– |
|
Желчь |
– |
– |
– |
– |
|
Желчь |
+ |
+ |
||
|
Отделяемое из нижних дыхательных путей |
– |
– |
||
|
Моча |
+ |
+ |
||
Примечание: VIM, IMP, GES – типы карбапенемаз; CIM-тест – тест инактивации карбапенемов.
2015 г. снизилось до 27,8 % против 33,0 % в 2014 г. и снова возросло до 32,9 % в 2016 г. (p>0,05).
Результаты определения продукции и типов карбапенемаз, вырабатываемых циркулирующими в клинике штаммами P. aeruginosa, представлены в табл. 3. Из 7 штаммов P. aeruginosa, исследованных на наличие приобретенных карбапенемаз, продукция металло-бета-лактамаз группы VIM выявлена у 2 штаммов, карбапенемазы класса A, группы GES-5 – у 1 штамма. У всех трех штаммов фенотипическая экспрессия карбапенемаз была подтверждена с использованием CIM-теста. Таким образом, у 3 (42,9 %) из 7 исследованных штаммов P. aeruginosa были генетически устойчивы к препаратам группы карбапенемов.
Заключение
Резистентность штаммов P. aеruginosa ко всем группам антибиотиков составила менее 50 % и не изменялась за последние годы, однако количество карбапенем-резистентных штаммов увеличилось
Список литературы Нозокомиальные инфекции, вызванные Pseudomonas aeruginosa, в онкологической клинике
- Григорьевская З.В., Петухова И.Н., Дьякова С.А., Дмитриева Н.В. Эпидемиология внутрибольничных инфекций в онкологическом стационаре. Сибирский онкологический журнал. 2016; 15 (3):62-66.
- Дмитриева Н.В., Петухова И.Н., Багирова Н.С. Резистентность микроорганизмов -возбудителей инфекций у онкологических больных. Сопроводительная терапия в онкологии. 2005; 1: 17.
- Демиховская Е.В. Неферментирующие бактерии в аспекте множественной антибиотикорезистентности возбудителей внутрибольничных инфекций. Болезнь и антибиотики. 2012; 1 (6): 88-95.
- Решедько Г.К., Рябкова Е.Л., Фаращук А.Н., Страчунский Л.С., Туркутюков В.Б., Нехаева Г.И., Розанова С.М., Боронина Л.Г., Агапова Е.Д., Марусина Н.Е., Мултых И.Г., Тарабан В.К., Здзитовецкий Д.Э., Сарматова Н.И., Тихонов Ю.Г., Поликарпова С.В., Большаков Л.В., Богомолова Н.С., Дмитриева Н.В., Петухова И.Н., Галеева Е.В., Круглов А.Н., Вышелесская Н.Д., Александрова И.А., Белобородова Н.В., Вострикова Т.Ю., Ильина В.Н., Иванова С.Ф., Скальский С.В., Зубарева Н.А., Суборова Т.Н., Кречикова О.И., Щетинин Е.В., Николаева Т.А., Мартьянова Н.М., Гудкова Л.В., Ортенберг Э.А., Ушакова М.А., Хасанова С.Г., Габбасова Л.А., Колесник Т.И., Торопова И.А., Палютин Ш.Х., Монахова С.И. Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2006; 8 (3): 243-259.
- Parkins M.D., Gregson D.B., Pitout J.D., Ross T., Laupland K.B. Population-based study of the epidemiology and the risk factors for Pseudomonas aeruginosa bloodstream infections. Infection. 2010 Feb; 38 (1): 25-32. DOI: 10.1007/s15010-009-9145-9


