Нужна ли реабилитация больным с гиперпластическими процессами и раком эндометрия на фоне метаболического синдрома?
Автор: Бочкарева Н.В., Коломиец Л.А., Чернышова А.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 (41), 2010 года.
Бесплатный доступ
Представлена проблема метаболической коррекции гормонально-метаболических нарушений у больных гиперпласти- ческими процессами (ГПЭ) и раком эндометрия (РЭ) в сочетании с метаболическим синдромом. Можно предположить, что наряду с традиционным лечением метаболическая корреция, проводимая у больных с ГПЭ на фоне метаболического синдро- ма, будет способствовать снижению риска развития РЭ. В этом плане эффективна разработка как методов прогнозирования течения ГПЭ на фоне метаболического синдрома, так и вариантов метаболической реабилитации таких больных
Метаболическая реабилитация, рак эндометрия, гиперпластические процессы эндометрия, метаболический синдром
Короткий адрес: https://sciup.org/14055683
IDR: 14055683 | УДК: 616.14-006.6-008.9-036.838
Текст обзорной статьи Нужна ли реабилитация больным с гиперпластическими процессами и раком эндометрия на фоне метаболического синдрома?
Рак эндометрия на фоне метаболического синдрома: анализ выживаемости. В настоящее время сформулирована концепция метаболического синдрома, согласно которой ожирение, преимущественно андроидного типа, артериальная гипертензия, дислипидемия, нарушение толерантности к глюкозе являются звеньями единой цепи обменных расстройств, ведущим звеном в которой является инсулинорезистентность и компенсаторная гиперинсулинемия [7]. Вопрос о частоте метаболического синдрома у больных раком эндометрия (РЭ) связан с рядом практических проблем: особенностями клинического течения РЭ (рецидивирование, метастазирование, выживаемость), влиянием на выбор тактики лечения. Наличие метаболического синдрома у онкологических больных ассоциировано с угне- тением иммунологической реактивности организма, более выраженным повреждением ДНК, влиянием на процессы ангиогенеза и метастазирования, а также индукцией дополнительной коморбидности, включая сердечно-сосудистую и почечную патологии [10]. Сведения о влиянии метаболического синдрома на прогноз у больных РЭ противоречивы. Наряду с данными о повышении частоты рецидивирования и/или снижении общей выживаемости [10, 24] есть мнение, что ожирение (даже значительно выраженное, так называемое смертельное ожирение) у больных РЭ ассоциировано с I стадией процесса, высокой степенью дифференцировки и не влияет на прогноз отрицательным образом [4, 16, 21].
По данным американской группы исследователей во главе с V. Von Gruenigen (2006)
[24], у больных РЭ с выраженным ожирением (индекс массы тела более 40) частота рецидивов статистически значимо не отличалась от таковой у больных РЭ без ожирения и с незначительно выраженным ожирением, однако общая пятилетняя выживаемость при значительном ожирении была статистически значимо ниже. При детальном рассмотрении причин смерти у больных РЭ с ожирением выяснилось, что в 66 % случаев они погибли от заболеваний, не связанных с онкологическим процессом и его лечением, в первую очередь от осложнений сердечно-сосудистой патологии и сахарного диабета II типа. У больных РЭ (особенно с ожирением) высока вероятность развития первичномножественных злокачественных опухолей и, соответственно, повышен риск смерти от этих новообразований [12]. Дискутируется вопрос о синдроме гормонозависимых полинеоплазий. При первично-множественном РЭ второй синхронной или метахронной опухолью чаще всего оказывались карцинома молочной железы, рак яичников или рак толстой кишки, по-видимому, вследствие некоторой общности патогенеза и гормонально-метаболических нарушений.
Анализируя приведенные данные, можно предположить, что снижение массы тела, контроль течения сахарного диабета и гипертонии, контроль профиля липидов сыворотки крови у больных РЭ после проведенного противоопухолевого лечения могут влиять на выживаемость вследствие снижения выраженности сопутствующей сердечно-сосудистой патологии и ее осложнений, минимизации проявлений поздних сосудистых осложнений сахарного диабета, снижения риска развития множественных злокачественных новообразований. Кроме того факта, что сам метаболический синдром является, по-видимому, фактором, ассоциированным с общей и безрецидивной выживаемостью, можно предположить, что больные РЭ с метаболическим синдромом имеют свои специфические факторы риска и прогноза.
Факторы риска и прогноза рака эндометрия на фоне метаболического синдрома. Гиперпластические процессы эндометрия (ГПЭ), являясь пролиферативными заболеваниями, при длительном их течении и частом рецидивиро-вании, особенно в сочетании с метаболическим синдромом, могут быть фоном, на котором возможно развитие злокачественного поражения. Нами ранее был проведен анализ факторов риска развития РЭ у больных с ГПЭ на фоне метаболического синдрома с построением формулы для оценки индивидуального риска. При анализе наиболее информативных показателей, вошедших в дискриминантную модель, оказалось, что наряду с некоторыми антропомерическими параметрами (обхват талии и бедер, сагиттальный диаметр) для этой группы больных значимыми оказались некоторые клинико-анамнестические данные: возраст, возраст появления вторичных половых признаков, масса пациентки при рождении, вид вскармливания [10]. Известно, что риск развития РЭ повышается с возрастом [4], однако у больных ГПЭ с метаболическим синдромом это параметр должен интерпретироваться, по-видимому, только во взаимосвязи с другими известными факторами риска, так как значительная часть больных с атипичной гиперплазией эндометрия и метаболическим синдромом в репродуктивном возрасте имеет значительный риск развития РЭ, особенно при бесплодии [14]. При оценке факторов, формирующихся внутриутробно и создающих предиспозицию к возникновению РЭ, необходимо отметить, что больные РЭ с метаболическим синдромом имели большую массу тела (4326 ± 125,71 г), находились преимущественно на искусственном вскармливании (до 75% случаев) и имели несколько больший возраст появления вторичных половых признаков (14,21 ± 2,87 года) по сравнению с больными ГПЭ с метаболическим синдромом, у которых средняя масса тела при рождении составила 3876 ± 121,85 г, искусственное вскармливание получали в 35 % случаев, возраст появления вторичных половых признаков составил 13,36 ± 2,89 года [10].
Можно предположить, что избыточные метаболические сигналы (гипергликемия, гиперин-сулинемия) во время беременности являются одним из стимулов к прибавке массы на ранних этапах жизни. Принято считать, что гипергликемия у матери во время беременности приводит к гиперинсулинемии у плода. Повышение секреции инсулина является одной из причин увеличения массы новорожденного в связи с усилением липосинтеза и жироотложения.
Большая, чем в норме, масса плода сочетается, как правило, с усилением эстрогенообразования и более высокой гиперэстрогенемией во время беременности, а у женщин, родившихся с массой свыше 4000 г, в возрасте 15–30 лет имеется тенденция к более высокой инсулинемии в глюкозотолерантном тесте, а в случае раннего менархе – к более высокой концентрации в крови свободного эстрадиола [1, 2]. Известно также, что гиперэстрогенемия является значимым фактором риска развития РЭ [4]. Кроме того, одним из важных моментов в развитии метаболических нарушений является характер вскармливания. Искусственное вскармливание, как известно, в большинстве случаев вызывает нарушения углеводного и липидного обменов в условиях сниженного иммунитета [2].
При оценке риска развития РЭ у больных с ГПЭ с метаболическим синдромом вошедшие в уравнение дискриминантной функции гормонально-метаболические показатели (ХС-ЛПНП, лептин, тестостерон, прогестерон, уровень гликемии натощак) демонстрируют широкий спектр соответствующих нарушений, выраженных в наибольшей степени у больных РЭ с метаболическим синдромом. Наряду с другими показателями, уровень экспрессии PTEN явился значимым признаком, что согласуется с данными ряда авторов о наличии данного белка в большинстве случаев в гиперплазированном эндометрии и о постепенной утрате экспрессии этого онкосупрессора, в значительной степени блокирующего проведение сигнала с активированного рецептора инсулиноподобного фактора роста I типа, преимущественно в эндометриоидных карциномах [18, 27].
Выявлено, что факторы, ассоциированные с метаболическим синдромом (гиперинсули-немия, избыток инсулиноподобных факторов роста (ИФР), недостаток экспрессии белков, связывающих ИФР, гиперлептинемия, гиперлипидемия, сочетающиеся часто с гиперэстроге-немией), способны оказывать модифицирующее воздействие на прогноз больных РЭ через связь с глубиной инвазии опухоли в миометрий и распространением опухоли на цервикальный канал [8, 15]. Полученные собственные данные предварительных исследований выявили, что уровень ИФР-I, основного белка, связывающего
ИФР (IGFBP-3) и протеиназы IGFBP-4 и -5 – PAPP-A, в опухолях эндометрия был достоверно выше по сравнению с гиперплазированным эндометрием с максимальным уровнем у больных РЭ с метаболическим синдромом. Уровень ИФР-I и PAPP-A в опухолях эндометрия зависел от экспрессии рецепторов стероидных гормонов и онкосупрессора PTEN и был значительно выше в PTEN-негативных и рецептор-положительных опухолях. Полученные данные представляют значительный интерес, поскольку PTEN подавляет антиапоптогенные эффекты фосфоинозитол-3 киназа/серин-треонин про-теинкиназа/Akt сигнального пути, который активируется в клетке при связывании рецептора ИФР со своими лигандами. Получены данные о взаимосвязи между уровнем основного белка, связывающего ИФР – IGFBP-3 – у больных РЭ с метаболическим синдромом, и уровнем лептина, инсулина и глюкозы в сыворотке крови, что, возможно, свидетельствует о наличии регуляции внутриопухолевого уровня IGFBP-3 лептином, инсулином и глюкозой [10].
Анализ наиболее значимых факторов, вошедших в дискриминантные прогностические модели для больных РЭ с метаболическим синдромом и без метаболических нарушений, показал, что статистически значимым фактором в обеих моделях является уровень металлопротеиназы PAPP-A в опухоли. Данный белок обладает свойствами специфической протеиназы IGFBP-4 и -5, секретируется не только клетками трофобласта, но и обнаруживается в фолликулярной жидкости, в семенной и простатической жидкости, продуцируется стромальными клетками нормального, гиперплазированного и малигнизированного эндометрия, а также рядом опухолей эпителиального происхождения [22, 25, 26]. Причем в малигнизированном эндометрии уровень экспрессии PAPP-A был значительно выше по сравнению с гиперплазированным [25], что созвучно полученным нами данным. В то же время в нашем исследовании показано, что в части опухолей PAPP-A не продуцируется. В плане прогноза в обеих группах высокий уровень PAPP-A в опухоли ассоциировался с неблагоприятным прогнозом. Учитывая полученные результаты и имеющиеся данные литературы, можно предположить, что больные с ГПЭ и РЭ с метаболическим синдромом имеют собственные факторы прогноза, отличные от общей группы больных и ассоциированные с системой инсулиноподобных факторов роста.
Метаболическая реабилитация больных раком эндометрия: возможности и перспективы. Возможность лечения и коррекции метаболического синдрома (а также отдельных составляющих этого синдрома) представлена во многих исследованиях. Наиболее значимым медицинским последствием ожирения является сахарный диабет II типа, так как ожирение является важнейшим фактором риска развития диабета [5, 9]. Необходимо отметить определенные особенности метаболического синдрома у больных РЭ. Больные РЭ – достаточно соматически отягощенный контингент пациенток с длительным анамнезом по гипертонической болезни и сахарному диабету. Причем более 40 % больных РЭ получали до установки основного диагноза систематическую антигипертензивную терапию, а 14 % – антидиабетическое лечение [28]. Частота диабета у больных РЭ, по данным литературы, составляет 1,3–22 %, причем отмечается, что у 72 % больных РЭ выявляются нарушения при проведении теста на толерантность глюкозе, что созвучно и нашим собственным данным [6, 10]. Закономерно, что у больных РЭ в сочетании с метаболическим синдромом эти изменения выявляются еще чаще, причем нарушение толерантности к глюкозе превалирует.
В этом аспекте необходимо отметить многочисленные многоцентровые исследования по предупреждению сахарного диабета II типа у больных с ожирением и нарушением толерантности к глюкозе, в абсолютном большинстве которых было показано, что интенсивное изменение стиля жизни (диетотерапия, повышение физической активности) или изменение стиля жизни в сочетании с некоторыми антидиабетическими и весоредуцирующими препаратами (метформин, акарбоза, троглитазон, орлистат) при их длительном использовании (не менее года) не только снижает риск возникновения сахарного диабета II типа более чем на 25 %, но и даже смертность от его осложнений. Причем четко показано, что средством повышения действенности лечения ожирения является фармакотерапия, которая помогает более интенсивно снижать массу тела, предотвращает развитие рецидивов, улучшает метаболические показатели и закрепляет приверженность больных лечению [5].
В ряде исследований показано, что возможна коррекция метаболических нарушений в составе комплексной терапии как у больных ГПЭ в плане профилактики РЭ, так и у больных РЭ в плане повышения качества жизни и снижения не ассоциированной с основным заболеванием летальности. Уникальной особенностью РЭ является то, что эти больные, как правило, страдают ожирением, которое явилось значимым фактором риска развития РЭ у этих больных, и эти больные, как правило, не предпринимают никаких усилий по изменению стиля жизни и борьбе с ожирением после установки диагноза. Показано, что интервенционные программы по изменению образа жизни (гипокалорийная диета, физические нагрузки, формирование ограничительного типа пищевого поведения) у больных РЭ с ожирением возможны и достаточно эффективны, высока приверженность больных такому лечению [23]. Интересно отметить, что даже у значительной части соматически здоровых женщин с ожирением имеются психо-эмоциональные нарушения (тревога, депрессии, тревожно-депрессивные нарушения, ипохондрия) и нарушение пищевого поведения [9]. У больных РЭ с ожирением, ведущих обычный для себя образ жизни после проведенного лечения, качество жизни обычно не страдает, однако со временем статистически значимо по сравнению с больными РЭ, изменившими стиль жизни (питание, физические нагрузки), возрастает количество депрессий [23]. Результаты 12-месячного рандомизированного интервенционного исследования по изменению стиля жизни у тучных больных РЭ I–II стадии показали, что, хотя в целом данная интервенция не влияла на глобальное качество жизни, у похудевших пациенток статистически значимо повысилась самоэффективность (психологический термин, означающий убеждение человека, что в сложных ситуациях он сможет действовать активно, вера в эффективность собственных действий), эмоциональное здоровье, изменился тип пищевого поведения с преобладанием самоограничительного варианта. Однако у успешно похудевших больных РЭ частота эпизодов дисингибирования (растормаживания), т.е. количество эпизодов потери контроля над питанием вследствие дисингибиторов (стресс, изменение настроения, алкоголь), была выше, чем у пациенток, набравших вес, что диктует необходимость пристального изучения данного феномена [23].
Известно еще одно исследование по изучению ассоциации качества жизни у больных РЭ в зависимости от индекса массы тела и уровня физической нагрузки. Выявлено, что женщины, регулярно консультирующиеся у специалистов здравоохранения по вопросам снижения веса и физических нагрузок, по сравнению с женщинами, не получающими такой помощи, имеют более высокий уровень качества жизни. Многофакторный регрессионный анализ выявил, что у больных РЭ как уровень физических нагрузок, так и значения индекса массы тела явились факторами, ассоциированными с качеством жизни [20]. Результаты данных исследований наглядно демонстрируют существенную роль онкогинеколога и психотерапевта в формировании мотивации и повышении приверженности и в целом эффективности данного вида метаболической реабилитации больных РЭ с метаболическим синдромом.
Как было отмечено, рациональная фармакотерапия помогает более интенсивно снижать массу тела, предотвращает развитие рецидивов, улучшает метаболические показатели и закрепляет приверженность больных лечению. В данном аспекте интересно исследование L.A. Cantrell et al. (2010) [19], установивших, что известный антидиабетический препарат метформин ингибирует пролиферацию в клеточных линиях РЭ ECC-1 и Ishikawa за счет активации аденозинмонофосфаткиназ и ингибирования mTOR сигнального пути. Недавно были представлены новые аспекты метформина, который, кроме своего мягкого гипогликемического действия, снижает выраженность гиперинсу-линемии, облегчает высвобождение инсулина из бета-клеток поджелудочной железы, увеличивает экспрессию инсулиновых рецепторов на адипоцитах, уменьшает пролиферацию эндоте-лиоцитов, гладкой мускулатуры и фибробластов в условиях гипоксии [13]. На клиническом материале [3, 17] показано, что при высоко- и умереннодифференцированном РЭ наблюдался статистически более высокий уровень инсулина и С-пептида в сыворотке крови по сравнению с больными с низкодифференцированными и неэндометриоидными новообразованиями. Кроме того, уровень инсулинемии позитивно коррелировал со стадией заболевания только у первой группы больных. У части пациенток с РЭ гиперинсулинемия и инсулинорезистент-ность ассоциировались с агрессивным течением заболевания, но это не являлось результатом повреждения ДНК, что, по-видимому, позволяет предположить эффективность антидиабетических препаратов, глитазонов и статинов в лечении этой категории больных.
Лечение больных с гиперпластическими процессами эндометрия на фоне метаболического синдрома. Известно, что риск опухолевой трансформации ГПЭ возрастает в 7–9 раз при различных метаболических нарушениях гормонального обмена [10]. Вместе с тем нет единой точки зрения на то, как рассматривать в данном контексте метаболический синдром – как один из многих известных модифицирующих факторов риска или как фундамент, на котором формируются ГПЭ, которые при определенных условиях переходят в рак. Традиционные методы лечения ГПЭ, в том числе на фоне метаболического синдрома, не включают коррекцию метаболических нарушений [11]. Однако имеются примеры регрессии атипичной эндометриальной гиперплазии, резистентной к прогестинам, у больных в сочетании с диабетом, инсулинорезистентностью, синдромом поликистозных яичников и бесплодием при терапии метформином или метформином в сочетании с оральными контрацептивами [29, 30]. Можно предположить, что метаболическая коррекция гормонально-метаболических нарушений у больных ГПЭ в сочетании с метаболическим синдромом и высоким риском развития РЭ будет способствовать снижению риска развития РЭ. В этом плане эффективна разработка как методов прогнозирования течения ГПЭ на фоне метаболического синдрома, так и вариантов метаболической реабилитации таких больных. На рис. 1 и 2 представлены факторы риска прогрессии ГПЭ с метаболическим синдромом и предполагаемая роль метаболической коррекции в профилактике РЭ, а также возможное влияние МК на выживаемость и качество жизни у больных РЭ с метаболическим синдромом.
Заключение. Гиперпластические процессы
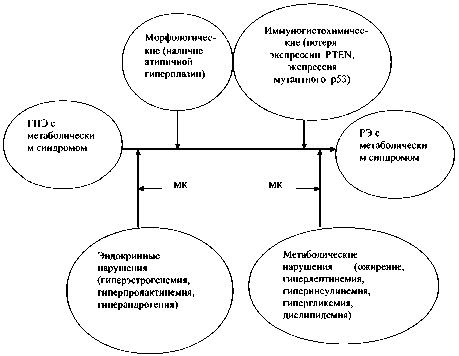
Рис. 1. Факторы риска прогрессии ГПЭ с метаболическим синдромом и предполагаемая роль метаболической коррекции в профилактике РЭ:
ГПЭ – гиперпластические процессы эндометрия, РЭ – рак эндометрия, МК – метаболическая коррекция
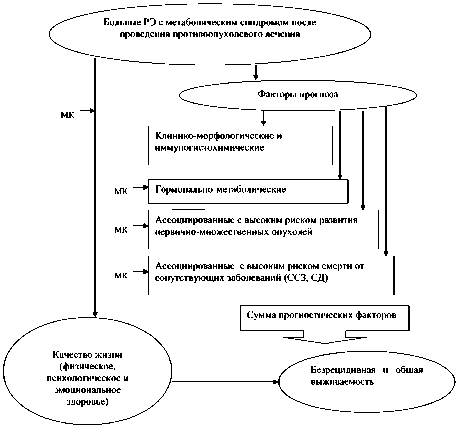
Рис. 2. Предполагаемая роль метаболической коррекции у больных РЭ с метаболическим синдромом – влияние на выживаемость и качество жизни:
РЭ – рак эндометрия, МК – метаболическая коррекция, ССЗ – сердечно-сосудистые заболевания, СД – сахарный диабет второго типа и рак эндометрия на фоне метаболического синдрома являются важной медико-социальной проблемой. Метаболическая коррекция гормонально-метаболических нарушений у больных ГПЭ в сочетании с метаболическим синдромом и высоким риском развития РЭ будет способствовать снижению риска РЭ. В этом плане эффективна разработка как методов прогнозирования течения ГПЭ на фоне метаболического синдрома, так и вариантов метаболической реабилитации таких больных. Метаболическая реабилитация больных РЭ с метаболическим синдромом (изменение стиля жизни в сочетании с рациональной фармакотерапией) позволит улучшить качество жизни этих больных, повысить показатели выживаемости вследствие снижения выраженности сердечнососудистой патологии и ее осложнений, минимизации проявлений поздних сосудистых осложнений сахарного диабета, снижения риска развития множественных злокачественных новообразований.


