О дегидрирующих свойствах 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазола)
Автор: Живечкова Лариса Александровна, Самсонкин Александр Александрович, Мурюмин Евгений Евгеньевич, Пряничникова Маргарита Константиновна, Коновалова Евгения Петровна, Танасейчук Борис Сергеевич
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Химия
Статья в выпуске: 1-2, 2014 года.
Бесплатный доступ
В статье представлены результаты изучения дегидрирующих свойств 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазола), а также кинетики взаимодействия фенотиазина с 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазолом); высказывается предположение о строении продукта присоединения фенотиазина к 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазолу).
Бисимидазол, фенотиазин, кинетика, скорость реакции, дегидрирование, строение, свойства
Короткий адрес: https://sciup.org/14720069
IDR: 14720069 | УДК: 547.569
Текст научной статьи О дегидрирующих свойствах 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазола)
Ди- и полирадикалы представляют интерес в качестве строительных блоков для создания органических магнитов [3]. Радикалы триарилимидазолильного ряда в этом отношении являются весьма перспективными, поскольку устойчивы на воздухе и не реагируют с кислородом.
Простейшими системами, способными при окислении образовывать бирадикал, могли бы быть 1,4-бис(4,5-дифенилимидазолил-2)бензолы (I а–b). Однако при их окислении образуются хиноны (III а–b) [6]. Существование бирадикального состояния (II б) наблюдается только в случае X=F, что
подтверждается образованием соответствующего димера (схема 1). Роль атомов фтора в стабилизации бирадикального состояния объясняется влиянием, как их электронных, так и стерических эффектов [4]. На схеме 1 представлены возможные превращения структур (I), где в качестве заместителей в бензольном кольце могут быть атомы H и F.
Схема 1
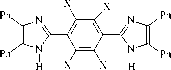
I a,b где а – Н; b – F. Нам представилось, что аналогичное равновесие должно существовать и в том случае, когда два имидазолильных остатка связаны через фрагмент, создающий определенные пространственные затруднения к образованию хиноидной системы.
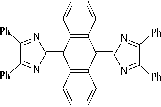
В качестве такого затрудняющего фрагмента был использован антрацен, и осуществлен синтез (2,2′-антрацен-9,10-диил)бис(4,5-дифенил-2Н-имидазола) (IV), который при окислении гексацианоферратом (III) калия в щелочной среде образует хиноидное соединение 2,2′-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазол) (V) [1].
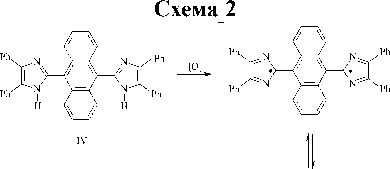
Хинон (V) представляет собой черные с красноватым блеском кристаллы, растворы которого в органических растворителях имеют ярко-красную окраску, но не дают сигнала ЭПР. Соединение (V) обладает дегидрирующими свойствами, его растворы обесцвечиваются при добавлении дифениламина, уксусной кислоты и гидрохинона. При этом в реакционной смеси был обнаружен исходный бисимидазол (IV).
Дегидрирующие свойства хинона (V) достаточно слабы. Так, если хинон (III b) способен дегидрировать спирт, то у хинона (V) эта способность практически отсутствует. Дегидрирующая способность хинона (V) ниже и по сравнению с аналогичной способностью 2,4,5-трифенилими-дазола. Это подтверждается отсутствием обесцвечивания (V) в реакции хинона (V) с 2,4,5-трифенилимидазолом.
Низкие дегидрирующие свойства хинона (V) связаны с тем, что в бисмидазоле (IV) оба имидазольных цикла «вывернуты» из плоскости сопряжения с антраценовым циклом на ~82о, а в хиноидной системе (V) имидазольные кольца сопряжены с антраценовым фрагментом. Квантовохимический расчет, выполненный неэмпирическим методом Хартри-Фока в базисе 6–31 G из пакета прикладных программ GAMESS [5] показал, что более стабильной системой является бисимидазол (IV). Относительная стабильность (IV) составляет -9427,52 ккал/моль, а хинона (V) – -9261,92 ккал/моль. Разность энергий этих соединений равна 165,6 ккал/моль, что составляет ~2 % от относительной стабильности (IV) и (V).
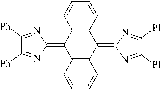
Очень интересным является то, что хинон (V) реагирует с ДФПГ∙Н (VI) с образованием в результате ДФПГ (VII) и бисимидазола (IV). Реакция является обратимой, и при взаимодействии бисимидазола (IV) с ДФПГ (VII) образуются соответственно хинон (V) и ДФПГ∙Н (VI) (схема 3). Однако, протекание обратной реакции с образованием соединений (V) и (VI) происходит несколько труднее, что подтверждается квантово-химическими расчетами.
Серия «Естественные и технические науки»
Схема 3
VII
ВЕСТНИК Мордовского университета | 2014 | № 1-2
В случае реакции хинона (V) с фенотиазином (VIII) красная окраска первого постепенно ослабевает, и через некоторое время раствор становится зеленым. В реакционной смеси по данным ТСХ (элюент хлороформ) нет бисимидазола (IV), но присутствует новое соединение (XI), которое, скорее всего, является продуктом взаимодействия фено-тиазинильного радикала (X) c хиноном (V).
При ЭПР исследованиях зеленого раствора не было обнаружено сигнала, т. е. образующийся продукт (XI) не имеет радикальной формы, а также не может являться комплексом с переносом заряда, поскольку обладающий более сильными электронодонорными свойствами N-метилфенотиазин с хиноном (V) не реагирует. Об этом свидетельствует отсутствие изменения окраски реакционной смеси.
Взаимодействие хинона (V) с фенотиазином (VIII) протекает достаточно медленно, что позволило изучить кинетику данной реакции.
Для этого на спектрофотометре «Specord UV VIS» были предварительно сняты электронные спектры поглощения хинона (V) и фенотиазина (VIII) в дихлорметане в видимой области. Фенотиазин (VIII) в данном растворителе не имеет максимумов поглощения, а для хинона (V) зафиксированы два: при длине волны 400–410 нм и – очень интенсивный – в области 513–518 нм. Изучение электронных спектров поглощения хинона (V) в дихлорметане (рис. 1) и бензоле при разных концентрациях показало подчинение оптической плотности растворов закону Бугера-Ламберта-Бера.
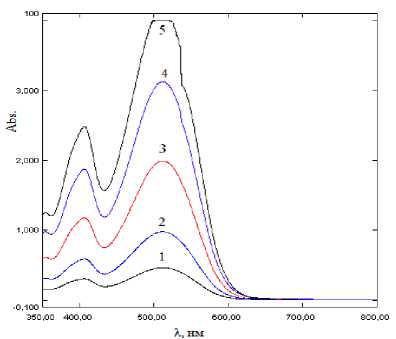
Р и с . 1. Электронные спектры поглощения растворов хинона (V) различной концентрации в дихлорметане (1 – 1•10-5М, 2 – 2•10-5М, 3 – 4•10-5М, 4 – 6•10-5М, 5 – 8•10-5М)
Изучение кинетики реакции хинона (V) с фенотиазином (VIII) проводилось в дихлорметане на максимуме поглощения хинона (V) (513 нм) и соотношении компонентов 1:1 при исходных концентрациях реагентов 1∙10-4 моль/л. Спектрофотометрические измерения проводили на спектрометре «UV-1800» в режиме спектрофотометрических и кинетических исследований. При этом интенсивность максимума поглощения при длине волны 513 нм с течением времени уменьшалась и появлялся новый максимум в области 650–660 нм (рис. 2).
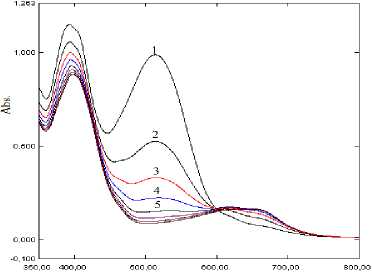
Р и с . 2. Изменение электронных спектров поглощения системы хинон (V) + фенотиазин (1:1) в дихлорметане во времени (1 – начало реакции; 2–5 мин; 3–10 мин;
4–15 мин; 5–20 мин и т. д. через 5 мин)
Полученные экспериментальные данные были использованы для определения порядка реакции графическим способом. Наличие линейной зависимости в координатах 1/С = f(t) в пределах превращения хинона (V) до 70–75 % свидетельствует об общем втором порядке реакции (первом по каждому из реагентов). Расчет экспериментальных данных с помощью программы Microcoft Office Excel представлен уравнением:
y = 35,7х + 2,33∙104; R = 0,9978.
Коэффициент корреляции подтверждает наличие линейной зависимости. Константа скорости реакции равна 35,7 л/моль∙с. Отложенный на оси ординат отрезок, равный 2,33∙104, соответствует величине 1/Со.
При попытке изучения кинетики данной реакции в менее полярном растворителе (бензоле) при тех же концентрациях, что и в дихлорметане, было обнаружено, что она протекает очень медленно. В связи с этим исходную концентрацию хинона (V) мы оставили прежней, а фенотиазина (VIII) – увеличили в 10 раз и реакционную смесь готовили в соотношении компонентов хинон
-
(V) : фенотиазин (VIII) = 1:20. Использование такого соотношения привело к тому, что реакция стала реакцией псевдопервого порядка по отношению к хинону (V).
Проведенные кинетические исследования при длине волны 513 нм показали, что реакция протекает на 90 % за 35 мин. Построение графиков в координатах ln C о /C = f(t) и расчет с помощью программы Excel указывает на наличие линейной зависимости, проходящей через начало координат, что соответствует реакции первого порядка.
y = 0,0015х; R = 0,9959
Константа скорости реакции при данных условиях равна 1,5∙10-3 с-1.
Методом наименьших квадратов были рассчитаны среднее значение константы и доверительный интервал:
К ср =(1,55±0,16) х 10-3с-1.
Полученные кинетические данные позволяют предложить возможный механизм реакции (схема 4).
Серия «Естественные и технические науки»
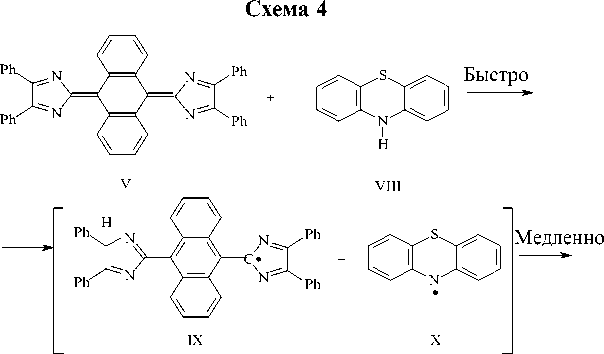
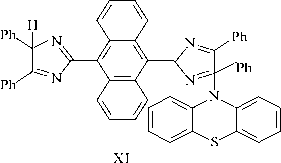
На медленной первой стадии происходит отрыв атома водорода из положения 10 (N–H-связи) фенотиазина (VIII) с промежуточной стадией образования двух радикалов (IX–X), которые затем быстро реагируют друг с другом. При этом из-за стерических затруднений, создаваемых антраценовым кольцом, присоединение атома водорода и фено-тиазинильного радикала (Х) происходит по положениям 4(5) имидазольного цикла.
Экспериментальная часть
Анализ продуктов проводили методом ТСХ на пластинках Silufol UV-254 (элюент – хлороформ), проявляли при УФ-облучении.
Синтез 2,2′-(антрацен-9,10-диилиден)-бис (4,5-дифенил-2Н-имидазола) (IV) был осуществлен согласно литературной методике [2].
Электронные спектры поглощения в видимой области в бензоле и дихлормета-не регистрировались на приборах «Specord UV VIS» и «UV-1800» при толщине поглощающего слоя 10 мм. За скоростью реакции хинона (V) с фенотиазином (VIII) следили по изменению оптической плотности раствора с течением времени при длине волны 513 нм. Исходные концентрации реагентов варьировали в пределах 10-4– 10-3 моль/л. Константы скорости реакции рассчитывали графически, используя зависимость 1/С = f(t), где С – текущая концентрация хинона (V), и с помощью программы «Microcoft Office Excel». Порядок реакции определяли в соответствии с [1].
Квантово-химический расчет был выполнен неэмпирическим методом Хартри-Фока в базисе 6–31 G из пакета прикладных программ GAMESS [5].
ВЕСТНИК Мордовского университета | 2014 | № 1-2
Список литературы О дегидрирующих свойствах 2,2'-(антрацен-9,10-диилиден)бис(4,5-дифенил-2Н-имидазола)
- Основы физической химии: Теория и задачи: учебное пособие для вузов/В. В. Еремин [и др.]. -Москва: Изд-во Экзамен, 2005. -480 с.
- Редокс-индуцированная обратимая трансформация системы хинон -дианион на основе 2,2'-ан-трацент-9,10-диилиденбис(4,5-дифенил-2Н-имидазола)/Б. С. Танасейчук [и др.]//Журнал органической химии. -2013. -Т. 4. -№ 5. -С. 756-759.
- Allinson, G. Organic molecular magnets -the search for stable building blocks/G. Allinson, R. J. Bushby, J.-L. Paillaud//Journal Materials Sciense: Materials in Electronics. -1994. -Vol. 5. -Р. 67-74.
- Kikuchi, A. Definitive evidence for the contribution of biradical character in a-closed-shell molecule, derivative of 1,4-bis-(4,5-diphenylimidazol-2-ylidene)cyclohexa-2,5-diene/A. Kikushi, F. Iwahori, J. Abe//Journal American Chemical Society. -2004. -Vol. 126. -Р. 6526-6527.
- General atomic and molecular electronic structure system/M.W. Schmidt [et al.]//J. Comput. Chem. -1993. -Vol. 14. -P. 1347-1363.
- Structures and chromotropic properties of 1,4-bis-(4,5-diphenylimidazol-2-yl)benzene derivatives/Y. Sakaino [et al.]//Journal American Chemical Society. -1979. -Vol. 5. -№ 8. -Р. 1241-1244.
- Veciana, J. Organic Magnets/J. Veciana, H. Ivamura//MRS Bulletin. -2000. -P. 41-15.


