О кластерной системе фосфолипидов в онтогенезе бройлерных цыплят
Автор: Колесник Е.А., Дерхо М.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Функциональные системы и гомеостаз в онтогенезе
Статья в выпуске: 2 т.50, 2015 года.
Бесплатный доступ
Индивидуальный рост и развитие организма - поступательный векторный процесс. Каждый период онтогенеза характеризуется определенными морфологическими и функциональными изменениями систем и организма в целом. Органические и функциональные модификации детерминированы генетически и реализуются при участии адаптирующего воздействия внешней среды. Они проявляются на разных уровнях, но в основе этого лежат события, происходящие внутри клетки. Образование пластических веществ и циркуляция метаболитов разобщены пространственно и по времени, поэтому представляется, что наиболее эффективно они могут координироваться и регулироваться через некие организующие элементы, например компоненты внутренней структуры клетки, обеспечивающие ее морфологическую и, как следствие, функциональную целостность. Такие структуры представляют собой и продукт метаболизма, и элемент его регуляции, то есть выполняют набор функций, напрямую отражая взаимное состояние происходящих в клетке процессов. На роль таких структур прежде всего подходят клеточные мембраны. Их основной компонент - фосфолипиды, которые фактически представляют собой функциональную систему, наиболее чувствительную к внешним и внутренним эффекторным воздействиям и в то же время относительно устойчивую благодаря генетической детерминированности и адаптационной лабильности. Вопросы участия и роли подклассов фосфолипидов в системе функций в организме бройлерной птицы мало описаны. В связи с этим мы изучили состав и динамику фосфолипидного профиля у кросса ISA-15 Hubbard F15 в пренатальном онтогенезе (в яйце до закладки на инкубацию и в срединную стадию инкубации на 10-е сут) и в постнатальном онтогенезе (в сыворотке крови бройлерных цыплят в возрасте 1, 7, 23 и 42 сут) в условиях птицефабрики (ООО «Чебаркульская птица», Челябинская обл.). Для выявления функциональных групп среди подклассов фосфолипидов в онтогенезе бройлеров применили многомерный математический метод - кластерный анализ. Было показано, что в эмбриональный период до закладки яйца на инкубацию фосфолипиды объединяются в два раздельных (фосфатидилхолины и цереброзиды, евклидово расстояние 1,08; фосфатидилэтаноламины, евклидово расстояние 1,61) и один объединенный кластер (фосфатидилинозитолы со сфингомиелинами и лизолецитины с кардиолипинами, евклидово расстояние 0,23), на 10-е сут инкубации - в два совместных (лецитины с кефалинами, евклидово расстояние 1,61; фосфатидилинозитолы, сфингомиелины, лизолецитины и цереброзиды, евклидово расстояние 2,06) и одну переходную группу (кардиолипины). В период постнатального онтогенеза у цыплят в 1-суточном возрасте выявили три группы фосфолипидов (лецитины, евклидово расстояние 2,07; фосфатидилэтаноламин с кардиолипином, евклидово расстояние 0,26; лизолецитин), в 7-суточном - два объединенных (фосфатидилхолины, евклидово расстояние 2,03; сложный, включающий кефалины с фосфатидилинозитолами, сфингомиелинами и лизофосфатидилхолинами) и один промежуточный кластер (кардиолипин), в 23-суточном - три кластера фосфолипидов (лецитины; фосфатидилэтаноламины с фосфатидилинозитолами; кардиолипин совместно со сфингомиелином и лизолецитином). У 42-суточных бройлерных цыплят обнаружили присутствие двух функциональных групп фосфолипидов - сложной объединенной (кефалины в группе с кардиолипином, фосфатидилинозитолом, сфингомиелином и лизолецитином) и монокомпонентной (фосфатидилхолины). Это позволило охарактеризовать структурно-функциональную организацию фосфолипидов, которая, как мы полагаем, обеспечивает регуляцию гомеостаза (на мембранно-клеточном и в итоге на организменном уровне) в раннем онтогенезе цыплят-бройлеров.
Фосфолипиды, онтогенез, метаболизм, гомеостаз, функциональная система, бройлерные цыплята
Короткий адрес: https://sciup.org/142133582
IDR: 142133582 | УДК: 636.52/.58:591.3:577.125:57.05:573.22 | DOI: 10.15389/agrobiology.2015.2.217rus
Текст научной статьи О кластерной системе фосфолипидов в онтогенезе бройлерных цыплят
Онтогенез рассматривается как совокупность взаимосвязанных процессов роста и развития (1, 2). Организм представляет собой реагирующую на внешние воздействия открытую систему (1, 2), в которой в обмене веществ, необходимых для поддержания жизнеспособности, роста и развития, участвуют как поступающие извне и ассимилируемые питательные, пластические и энергетические субстраты, так и реутилизируемые соединения, образовавшиеся при распаде ранее синтезированных структур. Динамическое равновесие внутренней среды организма обеспечивается гомеостазом (1, 3, 4). Напряжение функций, поддерживающих гомеостаз, огра- ничивает метаболические ресурсы, которые организм может направлять на развитие (1-3). Иными словами, онтогенез и метаболизм тесно связаны с гомеостазом, что предполагает наличие у них общей системы регуляции.
Фосфолипиды — одни из ключевых структур и метаболитов, обеспечивающих функционирование организма на протяжении всей жизни (312). Подклассы фосфолипидов — глицерофосфолипиды (13) и сфинго-фосфолипиды (14) служат элементами, напрямую объединяющими метаболизм липидов, белков и углеводов (2, 3, 15-17), определяют все рецепторные реакции (1, 6, 11, 18, 19) и участвуют в процессах адаптации к изменяющимся условиям среды на мембранном уровне во всех системах организма (5, 10, 11, 13, 14), в частности за счет сохранения пространственной асимметрии бислоя плазмалеммы (20, 21), изменения состава фосфолипидов в мембранах миоцитов скелетной мускулатуры, которые, например, приводят к повышению тонуса в ответ на действия возрастающих физических нагрузок (22). Иными словами, фосфолипиды можно рассматривать как связующее звено в системе компонентов, обеспечивающих гомеостаз (4, 23, 24).
Целью работы было изучение организации функциональных групп фосфолипидов, участвующих в процессах онтогенеза у бройлерных цыплят.
Методика. Эксперименты проводили в 2010 году на Чебаркульской птицефабрике (ООО «Чебаркульская птица», Челябинская обл.). Объектом исследования служили яйца и цыплята-бройлеры кросса ISA-15 Hubbard F15. Цыплят содержали в клетках в цехе выращивания. Кормление и содержание осуществляли в соответствии с требованиями технологии и нормами, рекомендованными ВНИТИП (25) и I.S.A. (Institut de Selection Animale, Франция) (26). Для эксперимента были сформированы четыре сбалансированные группы птицы (по n = 10) разного возраста — 1, 7, 23 и 42 сут. Кровь получали при декапитации птицы в возрасте 1 и 7 сут и прижизненно из яремной вены у 23- и 42-суточных цыплят.
Фосфолипидный состав желтка яиц изучали до закладки на инкубацию и на 10-е сут инкубации. Подготовка проб включала гомогенизацию цельного содержимого желтка и тканей эмбриона. В гомогенате желтка яйца и эмбриональных тканей, а также в сыворотке крови оценивали содержание фракций фосфолипидов методом тонкослойной хроматографии на пластинах Silufol («Kavalier», Чехия) (27).
Для определения функциональных групп фосфолипидов, а также исследования организации функциональной структуры их кластеров в процессе индивидуального роста и развития бройлерных цыплят применяли многомерный метод математического анализа (multivariate exploratory techniques). Были выполнены кластерные анализы (cluster analysis) (28, 29) с использованием профессионального пакета программ Statistica v. 8.0 (2007 год) (28). Подклассы фосфолипидов по функциональным группам выявляли иерархическим агломеративным методом минимальной дисперсии — древовидной кластеризацией (joining tree-clustering) (28, 29). Вычисляли евклидово расстояние (euclidean distances) между подклассами (28, 29). Кластеризацию выполняли по правилу взвешенного попарного среднего (weighted pair-group average) (28, 29). Идентификацию функциональных групп фосфолипидов в онтогенезе осуществляли методом двухвходовой кластеризации (two-way joining) по выявленным подклассам с учетом переменных (периоды индивидуального роста и развития птицы) (28, 29).
Результаты. В организме у бройлерных цыплят анаболизм и катаболизм, то есть процессы роста, развития, распада и обновления структур, высокоинтенсивны (30). Это, в свою очередь, может сказаться на самом 218
чувствительном уровне организации — мембранном, где так называемые кластеры фосфолипидов способны отражать вектор обмена веществ и приспособительные реакции. Фактически выступая в роли регуляторных образований (13, 14), они участвуют в изменении модальности функций сопряженных с ними структур и метаболитов, таких как мембранные белки, липо- и гликопротеиды, липопротеины (11, 17, 21). Фосфолипиды, повышая эффективность их взаимодействия, увеличивают функциональные пороги и в итоге способны расширять границы относительного динамического постоянства внутренней среды организма (17, 31).
В связи с этим в качестве принципов структурной и функциональной организации системы фосфолипидов в онтогенезе бройлеров можно выделить комплементарность, синергетичность и регуляцию по принципу обратной связи. Благодаря комплементарности фосфолипиды дополняют действие друг друга, что дает возможность выстраивать целостную систему. Синергетичность позволяет взаимно усиливать или ослаблять эффекты фосфатидов. Реализация принципа обратной связи базируется на способности фосфолипидов крови регулировать количество и активность метаболитов и состояние мембранных структур, что, в свою очередь, определяет концентрацию фосфатидов в крови.
В ранние периоды пренатального онтогенеза на стадии зиготы— яйца фосфолипиды группируются в три кластера: первый — фосфатидил-холины и цереброзиды, второй — фосфатидилэтаноламины, третий сдвоенный кластер — фосфатидилинозитолы со сфингомиелинами и лизоле-цитины с кардиолипинами (рис. 1, 2, табл. 1).

Рис. 1. Кластеризация фосфолипидов на разных этапах онтогенеза у бройлерных цыплят кросса ISA-15 Hubbard F15: А — пренатальный период, Б — постнатальный период; ФХ — фосфа-тидилхолины, Цер — цереброзиды, ФЭ — фосфатидилэтаноламины, ФИ — фосфатидилинозитолы, СфМ — сфингомиелины, ЛЛ — лизолецитины, КЛ — кардиолипины (ООО «Чебар-кульская птица», Челябинская обл., 2010 год). Применен метод минимальной дисперсии; для кластеризации использовали метод взвешенного попарного среднего с определением евклидова расстояния.
Формирование этих групп фосфатидов мы объясняем следующим. Лецитины и цереброзиды обеспечивают функционально-структурное и метаболитное развитие и рост эмбриона, фактически будучи первичными витальными фосфолипидами (3-9, 11, 12). Фосфатидилхолины — основа всех мембранных структур (3, 32, 33) и липопротеинов высокой плотности, которые служат пластическими и энергетическими субстратами в эмбриогенезе (3-5). Цереброзиды составляют основу структур нервной ткани и будущей нервной системы (3-5). Как и лецитины, они имеют высокое сродство к холестерину, жирным кислотам (3, 32, 34), определяя адаптацию и стабилизацию клеточных мембран к изменениям окружающей среды. Наконец, цереброзиды выступают активаторами и регуляторами всех процессов эмбриогенеза на молекулярном уровне, в том числе посредством взаимодействия с регуляторными белками (9, 23, 24, 35-40).
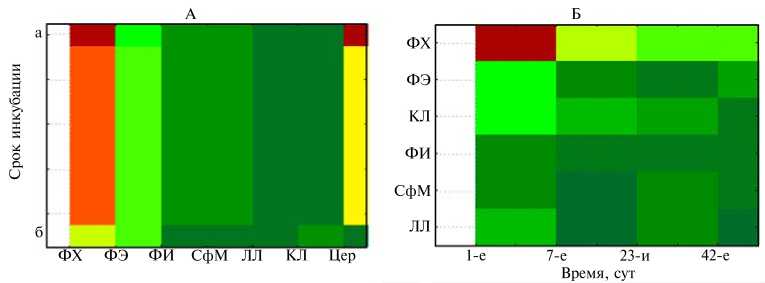
Рис. 2. Цветное отображение кластеризации фосфолипидов на разных этапах онтогенеза у бройлерных цыплят кросса ISA-15 Hubbard F15: А — пренатальный период, Б — постнатальный период; а — до инкубации, б — середина инкубации (10-е сут); ФХ — фосфатидилхо-лины, Цер — цереброзиды, ФЭ — фосфатидилэтаноламины, ФИ — фосфатидилинозитолы, СфМ — сфингомиелины, ЛЛ — лизолецитины, КЛ — кардиолипины (ООО «Чебаркульская птица», Челябинская обл., 2010 год). Использован метод двухвходовой кластеризации. Спектральные градации обозначают каждый отдельный подкласс фосфолипидов в структуре выделенных кластеров.
1. Евклидово расстояние на дендрограмме, отражающей кластеризацию фосфолипидов у бройлерных цыплят кросса ISA-15 Hubbard F15 в период пренатального онтогенеза (ООО «Чебаркульская птица», Челябинская обл., 2010 год)
|
Показатель |
1 ФХ | |
ФЭ |
| ФИ |
| ЛЛ |
| КЛ |
1 Цер |
| СфМ |
|
Фосфатидилхолины (ФХ) |
0,00 |
1,61 |
2,78 |
3,06 |
2,90 |
1,08 |
2,71 |
|
Фосфатидилэтаноламины (ФЭ) |
1,61 |
0,00 |
1,22 |
1,49 |
1,32 |
1,22 |
1,16 |
|
Фосфатидилинозитолы (ФИ) |
2,78 |
1,22 |
0,00 |
0,30 |
0,23 |
2,06 |
0,06 |
|
Лизолецитины (ЛЛ) |
3,06 |
1,49 |
0,30 |
0,00 |
0,19 |
2,36 |
0,36 |
|
Кардиолипины (КЛ) |
2,90 |
1,32 |
0,23 |
0,19 |
0,00 |
2,24 |
0,26 |
|
Цереброзиды (Цер) |
1,08 |
1,22 |
2,06 |
2,36 |
2,24 |
0,00 |
2,00 |
|
Сфингомиелины (СфМ) |
2,71 |
1,16 |
0,06 |
0,36 |
0,26 |
2,00 |
0,00 |
В свою очередь, активность цереброзидов (по обратной связи) регулируется лецитинами через диглицериды как промежуточные звенья цикла (3). Совместно с фосфатидилхолинами цереброзиды выполняют роль атеропротекторов и противоопухолевых агентов (9, 41, 42).
Основные фосфолипиды нервной ткани — фосфатидилинозитолы и сфингомиелины (3, 5, 20) служат в развивающемся эмбрионе одними из предшественников при формировании систем гуморальной и нейрогумо-ральной регуляции (3, 19, 43-45). Так, фосфатидилинозитолы — ведущие доноры диглицеридов, жирных кислот для синтеза эйкозаноидов, в том числе простагландинов (3, 43). Сфингомиелины образуют все мембранноволоконные нейтральные структуры (3, 41, 42).
В эмбриогенезе птицы лизолецитин и кардиолипин обеспечивают метаболитную циркуляцию сопряженных фосфолипидов — лецитина, фос-фатидилэтаноламина, а также этерификацию холестерина и жирных кислот. Фосфатидилэтаноламин представляется одновременно и самостоятельным компонентом мембранных структур, и звеном, необходимым для связи с другими фосфолипидами на ранних этапах пренатального онтогенеза у бройлерных цыплят.
На 10-е сут эмбриогенеза (срединный период инкубации) происходила консолидация групп фосфолипидов в более крупные кластеры (см. рис. 1, 2, табл. 1), что мы объясняем общим усложнением систем развивающегося и растущего эмбриона. Возможно, это также обусловлено значительным потреблением пластических и энергетических субстратов, даль-220
нейшей функциональной индукцией групп фосфолипидов на указанной стадии пренатального онтогенеза. Лецитины группировались с кефалинами в первый кластер, во второй общий кластер объединялись фосфатидилинозитолы, сфингомиелины, лизолецитины и цереброзиды. Эти процессы у цыплят, видимо, были связаны с активным гистогенезом и началом органогенеза при минимизации затрат используемых ресурсов.
Фосфатидилхолин и фосфатидилэтаноламин в метаболизме взаимосвязаны друг с другом, а также с циркуляцией и функционированием всех форм холестерина, жирных кислот и их производных — ряда биологически активных веществ (2, 3). Кардиолипин занимает переходное положение между первым и вторым кластером.
В 1-е сут постнатального онтогенеза цыплят фосфолипиды крови распределялись в три кластера (рис. 1, 2, табл. 2). Фосфатидилхолины как фосфолипиды, наиболее задействованные в процессах жизнедеятельности, формировали самостоятельную группу.
Кардиолипин объединялся с фосфатидилэтаноламином, что мы объясняем прежде всего высокой интенсивностью жирового обмена и его энергоемкостью. Стабильной была группировка фосфатидилинозитола, сфингомиелина и лизофосфатидилхолина. Лизолецитин в большей мере занимал промежуточное положение между группами кефалина—кардиолипина и сфингомиелина—фосфатидилинозитола (см. рис. 1, 2, табл. 2).
2. Евклидово расстояние на дендрограмме, отражающей кластеризацию фосфолипидов у бройлерных цыплят кросса ISA-15 Hubbard F15 в период постнатального онтогенеза (ООО «Чебаркульская птица», Челябинская обл., 2010 год)
|
Показатель |
| ФХ |
| ФЭ |
| ФИ |
| ЛЛ |
| КЛ |
| СфМ |
|
Фосфатидилхолины (ФХ) |
0,00 |
2,07 |
2,56 |
2,50 |
2,03 |
2,60 |
|
Фосфатидилэтаноламины (ФЭ) |
2,07 |
0,00 |
0,54 |
0,50 |
0,26 |
0,62 |
|
Фосфатидилинозитолы (ФИ) |
2,56 |
0,54 |
0,00 |
0,28 |
0,59 |
0,22 |
|
Лизолецитины (ЛЛ) |
2,50 |
0,50 |
0,28 |
0,00 |
0,55 |
0,23 |
|
Кардиолипины (КЛ) |
2,03 |
0,26 |
0,59 |
0,55 |
0,00 |
0,69 |
|
Сфингомиелины (СфМ) |
2,60 |
0,62 |
0,22 |
0,23 |
0,69 |
0,00 |
У птицы в 7-суточном возрасте фосфатидилэтаноламины фактически группировались вместе с фосфатидилинозитолами, сфингомиелинами и лизолецитинами. Кардиолипин занимал отдельное промежуточное положение между устойчивым самостоятельным кластером лецитинов и группой кефалинов, фосфатидилинозитолов, сфингомиелинов и лизофос-фатидилхолинов (см. рис. 1, 2, табл. 2).
Тем не менее, наблюдалась тенденция к объединению кефалинов с фосфатидилинозитолами в группу, которая у 23-суточных цыплят формировала отдельный функциональный кластер фосфатидилэтаноламинов и фосфатидилинозитолов. Это объясняется активным внутриклеточным метаболизмом липопротеинов, который при участии фосфатидилинозитолов обеспечивается сигнальной регуляцией с помощью специфичных белков и диглицеридов. Кардиолипин присоединялся к группе сфингомиелина и лизолецитина (см. рис. 1, 2, табл. 2).
У 42-суточных бройлеров отмечалась наибольшая консолидация функциональных групп фосфолипидов за весь исследуемый постнатальный период. В первую группу кластеризовался фосфатидилхолин, во вто-роую — кардиолипин, фосфатидилинозитол, сфингомиелин и лизолецитин. Фосфатидилэтаноламин сближался со второй группой (см. рис. 1, 2, табл. 2). Такую кластеризацию можно объяснить продолжением активного развития отдельных групп скелетных мышц и сердечно-сосудистой системы, а также стабилизацией обменных процессов, направленной на обес- печение нормального функционирования печени и других желез внутренней секреции в условиях усиленного синтеза протеинов, необходимых при гипертрофированном формировании скелетной мускулатуры.
В целом наблюдалась тенденция к некоторой ретроградной обратной симметрии: кластерная система фосфолипидов, характерная для по-следователных периодов роста и развития бройлерных цыплят в постнатальном онтогенезе, может повторять таковую в предшествующие периоды пренатального онтогенеза в обратном порядке.
Таким образом, в пре- и постнатальном онтогенезе у бройлерной птицы проявляется структурно-функциональная организация фосфолипидов. Подклассы фосфолипидов образуют функциональную систему, которая, вероятно, наследственно обусловлена, формируется под влиянием эндогенных и экзогенных факторов и направлена на реализацию адаптационных механизмов с целью поддержания гомеостаза и сохранения витальных функций организма.
Л И Т Е Р А Т У Р А
-
2 ФГБ0У ВПО Уралъская государственная академия ветеринарной медицины,
457100 Ðîññèÿ, ×åëÿáèíñêàÿ îáë., ã. Òðîèöê, óë. Ãàãàðèíà, 13, e-mail: derkho2010@yandex.ru
Sel’skokhozyaistvennaya biologiya / Agricultural Biology , 2015, V. 50, № 2, pp. 217-224
ABOUT CLUSTER SYSTEM OF PHOSPHOLIPIDS IN ONTOGENESIS OF BROILER CHICKENS
E.A. Kolesnik1, M.A. Derkho2
Список литературы О кластерной системе фосфолипидов в онтогенезе бройлерных цыплят
- Эллиот В., Эллиот Д. Биохимия и молекулярная биология (пер. с англ.)/Под ред. А.И. Арчакова, М.П. Кирпичникова, А.Е. Медведева, В.П. Скулачева. М., 2002.
- Alberts B., Bray D., Hopkin K., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Essential сell biology (3d ed.). NY, London, 2010.
- Климов А.Н., Никульчева Н.Г. Обмен липидов и липопротеидов и его нарушения. СПб, 1999.
- Колесник Е.А., Дерхо М.А. Оценка сохранности и жизнеспособности цыплят по фосфолипидному профилю крови. Сельскохозяйственная биология, 2013, 6: 89-93 ( , 10.15389/agrobiology.2013.6.89eng) DOI: 10.15389/agrobiology.2013.6.89rus
- Gundermann K.-J. The «essential» phospholipids as a membrane therapeutic. Polish Section of European Society of biochemical pharmacology. Szczecin, Jota Press, 1993.
- Бергельсон Л.Д. Мембраны, молекулы, клетки. М., 1982.
- Van Meer G., Holthuis J.C. Sphingolipid transport in eukaryotic cells. BBA, 2000, 1486: 145-170.
- Hannun Y.A., Luberto C. Ceramide in the eukaryotic stress response. Trends Cell Biol., 2000, 10: 73-80 (PMID: 10652518; PubMed -indexed for MEDLINE).
- Spiegel S., Merrill A.H. Sphingolipid metabolism and cell growth regulation. FASEB J. 1996, 10: 1388-1397.
- Borchman D., Byrdwell W.C., Yappert M.C. Regional and age-dependent differences in the phospholipid composition of human lens membranes. Invest. Ophthalmol. Vis. Sci., 1994, 35: 3938-3942 (PMID: 7928192; PubMed -indexed for MEDLINE).
- Killian J.A., Van Meer G. The «double life» of membrane lipids. EMBO Reports, 2001, 21: 91-95.
- Pomorski T., Hrafnsdottir S., Devaux P.F., Van Meer G. Lipid distribution and transport across cellular membranes. Semin. Cell Dev. Biol., 2001, 12: 139-148 (PMID: 11292380; PubMed -indexed for MEDLINE).
- Lambeth J.D., Ryu S.H. Glycerolipids in signal transduction. In: Biochemistry of lipids, lipoproteins and membranes/D.E. Vance, J.E. Vance (eds.). Elsevier Science, Amsterdam, 1996: 237-255.
- Merrill A.H.J., Sweely C.C. Sphingolipid: metabolism and cell signalling. In: Biochemistry of lipids, lipoproteins and membranes/D.E. Vance, J.E. Vance (eds.). Elsevier Science, Amsterdam, 1996: 1-34.
- Pulfer M., Murphy R.C. Electrospray mass spectrometry of phospholipids. Mass Spectrom. Rev., 2003, 22: 332-364 ( ) DOI: 10.1002/mas.10061
- Wang Y., Krull I.S., Liu C., Orr J.D. Derivatization of phospholipids. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 2003, 793: 3-14.
- Hatch G.M. Cell biology of cardiac mitochondrial phospholipids. Biochem. Cell. Biol., 2004, 82: 99-112 (PMID: 15052331; PubMed -indexed for MEDLINE).
- Проказова Н.В., Звездина Н.Д., Коротаева А.Л. Влияние лизофосфатидилхолина на передачу трансмембранного сигнала внутрь клетки. Биохимия, 1998, 63(1): 38-46.
- Sattler M., Verma S., Pride Y.B., Salgia R., Rohrschneider L.R., Griffin J.D. SHIP1, an SH2 domain containing polyinositol-5-phosphatase, regulates migration through two critical tyrosine residues and forms a novel signaling complex with DOK1 and CRKL. J. Biol Chem., 2001, 276: 2451-2458.
- Calderon R.O., DeVries G.H. Lipid composition and phospholipid asymmetry of membrane from Schwann cell line. J. Neurosci. Res., 1997, 49: 372-380.
- Kato N., Nakanishi M., Hirashima N. Transbilayer asymmetry of phospholipids in plasma membrane rergulates exocytotic release in mast cells. Biochemistry, 2002, 41: 8068-8074 (PMID: 12069598; PubMed -indexed for MEDLINE).
- Gorski J., Zendzian-Piotrowska M., DeJong Y.F., Niklinska W., Glatz J.F. Effect of endurance training on the phospholipid content of skeletal muscles in the rat. Eur. J. Appl. Physiol. Occup. Physiol., 1999, 79: 421-425 ( ) DOI: 10.1007/s004210050532
- Holthuis J.C., Pomorski T., Raggers R.J., Sprong H., Van Meer G. The organizing potential of sphingolipids in intracellular membrane transport. Physiol Rev., 2001, 81: 1689-1723 (PMID: 11581500; PubMed -indexed for MEDLINE).
- Wu J., Spiegel S., Sturgill T.W. Sphingosine 1-phosphate rapidly activates the mitogen-activated protein kinase pathway by a G protein-dependent mechanism. J. Biol Chem., 1995, 270: 11484-11488 (PMID: 7744787; PubMed -indexed for MEDLINE).
- Рекомендации по кормлению сельскохозяйственной птицы/Под ред. В.И. Фисинина, Ш.А. Имангулова, И.А. Егорова, Т.М. Околеловой. Сергиев Посад, 2004.
- Руководство по выращиванию бройлеров Hubbard ISA. Hendrix Genetics Inc., 2012 (http://hubbardbreeders.com).
- Шаршунова M., Шварц В., Михалец С. Тонкослойная хроматография в фармации и клинической биохимии. Т. 1/Под ред. В.Г. Березкина, С.Д. Соколова. М., 1980.
- Халафян А.А. Statistica v. 6. Статистический анализ данных. М., 2007.
- Миркин Б.Г. Методы кластер-анализа для поддержки принятия решений. М., 2011.
- Колесник Е.А., Дерхо М.А. Сезонная динамика физиологических параметров крови и их связь с уровнем сохранности бройлеров. Вестник Томского государственного университета, 2013, 368: 186-188.
- Knoll W., Frank C.W., Heibel C., Naumann R., Offenhausser A., Ruhe J., Schmidt E.K., Shen W.W., Sinner A. Functional tethered lipid bilayers. J. Biotechnol., 2000, 74: 137-158 (PMID: 11143794; PubMed -indexed for MEDLINE).
- Ивков В.Г., Берестовский Г.Н. Липидный бислой биологических мембран. М., 1982.
- Coste H., Martel M.B., Got R. Topology of glucosylceramide synthesis in Golgi membranes from porcine submaxillary glands. BBA, 1986, 858: 6-12 (PMID: 2939881; PubMed -indexed for MEDLINE).
- Yeagle P.L. Cholesterol and the cell membrane. BBA, 1985, 822: 267-287 (PMID: 3904832; PubMed -indexed for MEDLINE).
- Auge N., Negre-Salvayre A., Salvayre R., Levade T. Sphingomyelin metabolites in vascular cell signaling and atherogenesis. Prog. Lipid Res., 2000, 39: 207-229 (PMID: 10799716; PubMed -indexed for MEDLINE).
- Prieschl E.E., Baumruker T. Sphingolipids: second messengers, mediators and raft ñonstituents in signaling. Immunol. Today, 2000, 21: 555-560 (PMID: 11094259; PubMed -indexed for MEDLINE).
- Levade T., Auge N. Sphingolipid mediators in cardiovascular cell biology and pathology. Circulation Res., 2001, 89: 957-977.
- Heringdorf D.M., Van Koppen C.J., Jakobs K.H. Molecular diversity of sphingolipid signalling. FEBS Lett., 1997, 410: 34-38 ( ) DOI: 10.1016/S0014-5793(97)00320-7
- Boucher L.M., Wiegmann K., Futterer A., Pfeffer K., Machleidt T., Schutze S., Mak T.W., Kronke M. CD28 signals through acidic sphingomyelinase. J. Exp. Med., 1995, 181: 2059-2068 (PMCID: PMC2192051).
- Kim M.Y., Linardic C., Obeid L., Hannun Y. Identification of sphingomyelin turnover as an effector mechanism for the action of tumor necrosis factor alpha and gamma-interferon. Specific role in cell differentiation. J. Biol. Chem., 1991, 266: 484-489 (PMID: 1845977; PubMed -indexed for MEDLINE).
- Silins I., Nordstrand M., Hogberg J., Stenius U. Sphingolipids suppress preneoplastic rat hepatocytes in vitro and in vivo. Carcinogenesis, 2003, 24: 1077-1083 (PMID: 12807752; PubMed -indexed for MEDLINE).
- Chatterjee S. Sphingolipids in atherosclerosis and vascular biology. Arterioscler. Thromb. Vasc. Biol., 1998, 18: 1523-1533 ( ) DOI: 10.1161/01.ATV.18.10.1523
- Pendaries C., Tronchere H., Plantavid M., Payrastre B. Phosphoinositide signaling disorders in human diseases FEBS Lett., 2003, 546: 25-31 ( ) DOI: 10.1016/S0014-5793(03)00437-X
- Breitschopf K., Zeiher A.M., Dimmeler S. Pro-atherogenic factors induce telomerase inactivation in endothelial cells through an Aktdependent mechanism. FEBS Lett., 2001, 493: 21-25 ( ) DOI: 10.1016/S0014-5793(01)02272-4
- Cerbon J., Falcon A., Hernandez-Luna C., Segura-Cobos D. Inositol phosphoryl ceramide synthase a regulator of intracellular levels of diacylglcerol and ceramide during the G1 to S transition in Saccharomyces cerevisae. Biochem. J., 2004, Nov 24 ( ) DOI: 10.1042/BJ20040475


