О морфологических свойствах штамма S. cerevisiae Y-503 в условиях осмотического, температурного и кислотного стресса
Автор: Халилова Эсланда Абдурахмановна, Исламмагомедова Эльвира Ахмедовна, Котенко Светлана Цалистиновна, Гасанов Расул Закирович, Абакарова Аида Алевдиновна, Аливердиева Динара Алиевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-2 т.21, 2019 года.
Бесплатный доступ
В статье приводятся результаты влияния осмотического, температурного и кислотного стресса на морфолого-культуральные особенности штамма S. cerevisiae Y-503, полученного в результате лазерного воздействия. Концентрацию NaCl (5 %, 10 %, 15 %, 20 %) варьировали при различных значениях рН (3,0; 4,5; 7,0; 9,0; 11.0) и температуры (30оС и 37оС). Длительное культивирование штамма Y-503 проводили без предварительной адаптации. Выявлены оптимальные условия для сохранения жизнеспособности клеток культуры в отсутствие NaCl в среде при следующей последовательности значений рН 4,5>рН 3,0>рН 7,0>рН 9,0>рН 11,0 (30оС) и рН 3,0>рН 11,0>рН 7,0>рН 9,0>рН 4,5 (37оС); и с 5 % NaCl при рН 9,0>рН 4,5>рН 7,0>рН 3,0>рН 11,0 (30оС) и рН 7,0>рН 11,0>рН 3,0>рН 9,0>рН 4.5 (37оС). Показано, что при всех факторах стресса повышение температуры приводило к увеличению почкующихся клеток, образованию включений и спор. Результаты исследований могут быть использованы в разработке биотехнологий различного назначения, основанных на использовании устойчивых к экстремальным условиям дрожжей S. cerevisiae.
Гетерозиготный тетраплоид s. cerevisiae y-503, кислотность, температура, nacl, морфологические и культуральные свойства
Короткий адрес: https://sciup.org/148314162
IDR: 148314162 | УДК: 579.246.4
Текст научной статьи О морфологических свойствах штамма S. cerevisiae Y-503 в условиях осмотического, температурного и кислотного стресса
По современным представлениям дрожжи рода Saccharomyces характеризуются хорошо изученным геномом, протеомом и метаболизмом в различных экологических и физиологических условиях, что делает их важной биологической моделью для изучения адаптации к стрессу [1]. Они могут расти в широком диапазоне температур от 0°C до 45°C [2], рН от 2.0 до 7.0 [3], концентраций соли [4]. В ряде работ при изучении действия экстремальных воздействий стрессовые факторы используют по отдельности, создавая
условия «моностресса». Такой принцип исследований оправдывает себя простотой постановки экспериментов и интерпретации полученных данных. Наиболее изученными являются такие стрессоры, как гипертермия [5], гипо – или гиперосмотическое воздействие [6, 7], окислительный стресс [8, 9], этанол [10] и др.
В экстремальных условиях среды микроорганизмы, как правило, подвергаются влиянию не одного, а нескольких стресс - факторов, действующих одновременно или последовательно. Однако последствия воздействия на метаболизм единичных стресс-факторов могут существенно отличаться от последствий, вызываемых одновременным их воздействием. Наибольшее внимание уделяется таким сочетаниям, как гипертермия и неоптимальные концентрации NaCl [11], осмотические стрессоры и Н2О2 [12] воздействие ультрафиолетового излучения и углеродное голодание [13] и др. В условиях одновременного воздействия нескольких стресс - факторов между ними может возникать антагонизм, снижающий вредные последствия. Кросспротекторное (перекрестная защита) или антагонистическое взаимодействие стрессоров в настоящее время известно для целого ряда воздействий [14]. Причем, температура является одним из важных факторов, влияющих на микробную активность, скорость роста, окислительный стресс и экспрессию генов антиоксидантных ферментов S. cerevisiae .
Размер клетки является важной характеристикой, которая влияет практически на все аспекты клеточной физиологии. В процессе клеточного цикла эукариотных микрорганизмов молекулярные механизмы регулируют деление, рост и контроль размера клеток [15, 16].
Исследуемый нами штамм Y-503 является гетерозиготным тетраплоидом и увеличение копий его генома коррелирует с морфологическими изменениями размеров, формы клеток и колоний; физиологической активностью, устойчивостью к различным воздействиям окружающей среды по сравнению с гаплоидными клетками [17, 18].
Целью настоящего исследования являлось изучение влияния двух (рН, t о С) и нескольких стресс – факторов (рН, NaCl и t о С) на морфологические и культуральные свойства штамма S. cerevisiae Y-503 (рис. 1).
температур* pH NaCI длительность
Рис. 1. Одновременное воздействие стресс-факторов на гетерозиготный тетраплоид S. cerevisiae Y-503
МЕТОДИКА ИССЛЕДОВАНИЙ
Объектами исследований являлся штамм Saccharomyces cerevisiae Y-503, гетерозиготный тетраплоид, полученный в результате лазерного воздействия, из коллекции лаборатории биохимии и биотехнологии ПИБР ДНЦ РАН и Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИГенетика (Россия) [17]. Принадлежность штамма к таксону Saccharomyces показана с помощью молекулярно-генетических методов [18].
Морфолого-культуральные свойства. Морфологию клеток (форма, величина клеток, способ вегетативного размножения) изучали на световом микроскопе СХ21 FS1 (Olympus, Япония). Спорообразование дрожжей определяли на стандартной ацетатной среде, г/л : бакто – агар – 20 (Difco, Нидерланды); СН3СООNa – 10 (Вектон, Россия); KCl хч – 5 (Вектон, Россия). Основным критерием для определения морфотипов колоний служила совокупность признаков : формы, пигментации, окраски, поверхности, профиля, края, структуры. Штамм дрожжей выращивался на твердой среде YPD: дрожжевой экстракт – 0,5 % (BD, США), пептон – 0,5 % (BD, США), глюкоза (D-глюкоза) – 2,0 % (Merk, Германия), агар-агар – 2,5 % (Difco, Нидерланды) [19]. Кислот- ность среды корректировали 1N HCl или 4М KOH (Россия).
Для изучения стрессоустойчивости дрожжей (морфология клеток, гигантские колонии) к концентрациям NaCl (0 %, 5 %, 10 %, 15 %, 20 %), рН (3,0; 4,5; 7,0; 9,0; 11,0) и температуре 30 о С и 37 о С культивирование осуществляли на стандартной среде YPD на чашках Петри в течение двадцати суток.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
-
I. Исследование влияния величин кислотного (3,0; 4,5; 7,0; 9,0; 11,0), осмотического (5, 10, 15, 20 % NaCl) и температурного (30оС и 37оС) стресс – факторов на морфологические свойства клеток штамма S. cerevisiae Y-503 (рис. 2).
Влияние 2 стрессоров (рис. 2,а,б). При 30 о С и различных значениях рН клетки штамма S. cerevisiae Y-503 приобретали характерные овально-округлую и округло-овальную формы , в отдельных случаях присутствовали округлые (рН 3,0), яйцеобразные (рН 4,5; 7,0; 9,0) и овальные (рН 7,0; 11,0) (рис. 2,а). Определены условия, обеспечивающие жизнедеятельность дрожжевой культуры, которые подтвердили ранее полученные результаты [20]. Установлен ряд вариантов, оптимальных для метаболизма клеток, в следующей последовательности: рН 4.5>рН 9.0>рН 11.0>рН 7.0>рН 3.0. Размеры клеток составляли для: рН 4,5 (9×10 μкм, 8×10 μкм, 5×12 μкм, 9×9 μкм, 8×8 μкм, 7×7 μкм, 6×6 μкм и др.), рН 9,0 (6×9 μкм, 6×8 μкм, 5×8 μкм, 4×7 μкм, 4×4 μкм, 3×5 μкм, 3×3 μкм и др.), рН 11,0 (6×8 μкм, 6×7 μкм, 4×7 μкм, 4×5 μкм, 3×8 μкм, 3×5 μкм, 3×3 μкм и др.). Во всех случаях присутствовало достаточное количество мелких клеток. Отличительной особенностью культивирования при 37 о С являлось радикальное изменение формы с формированием круглых клеток и несколько меньший размер (6×6 μкм, 5×5 μкм, 4×4 μкм, 3×3 μкм, 2×2 μкм) на среде с рН 11,0 . по сравнению с 30 о С. Аналогичные результаты с уменьшением размера клеток были получены при рН 4,5 и 7,0 .
В клетках живого организма в экстремальных условиях включаются механизмы, регулирующие реакцию на стресс. В литературе имеются сведения, что повышение температуры может привести к изменению размера, объема, внутриклеточной гранулярности и фракции почкующихся клеток S. cerevisiae [21]. Контроль размера клеток в ответ на воздействие различных стресс - факторов осуществляется регуляторным механизмом клеточного цикла на уровне G1/S и G2/M интерфазы [22]. В условиях эксперимента на средах с рН 3,0 и 9,0 обнаружено увеличение размера клеток сообразно с предыдущим вариантом (при 30 о С). При рН 3,0
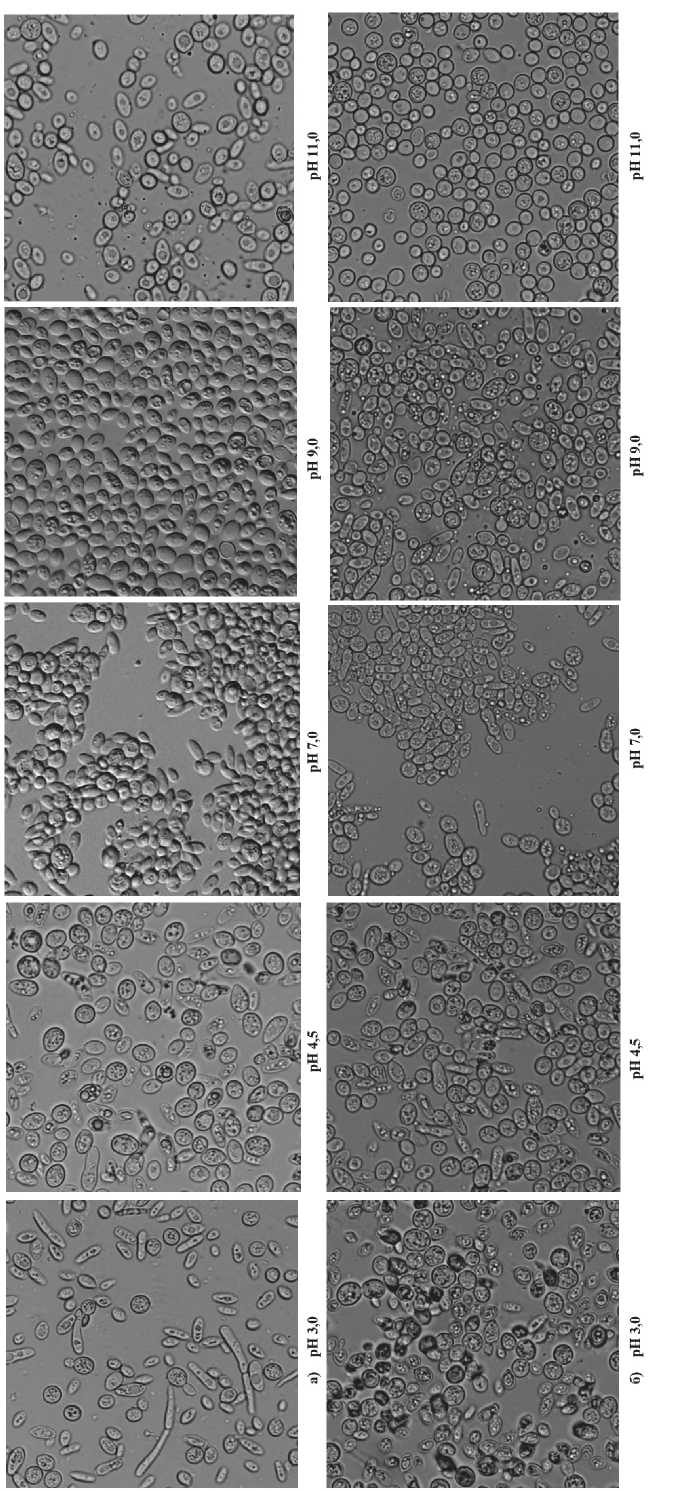
Рис. 2. Морфология клеток штамма S. cerevisiae Y-503 при воздействии различных значений рН, отсутствии NaCl и температуре: а) 30оС, б) 37оС самый крупный размер составлял: 6×6 μкм, 5×5 μкм, 5×6 μкм (30оС), при увеличении температуры на 7оС - 7×7 μкм, 8×8 μкм, 9×9 μкм. В варианте с рН 9,0 размеры 6×9 μкм, 6×8 μкм, 5×8 μкм увеличились до 9×9 μкм, 8×8 μкм, 7×8 μкм.
При 30 о С показано отсутствие почкующихся клеток почти во всех вариантах, кроме рН 3,0 и 11,0 (до 10 %). Увеличение температуры приводило к их росту, соответственно, в опытах с рН 7,0 (до 20 %), рН 3,0; 4,5 – единицы, за исключением рН 11,0. Обнаружено, что накопление включений в клетках выявлено на средах с рН 3,0 и 11,0, но в большей степени, при повышенной температуре (рН 4,5; 7,0 и 9,0). Из ранних исследований известно, что R-формы характерны для клеток штамма Y-503 в неблагоприятных условиях [23]. Наибольшее количество R -форм при 30оС обнаружено в клетках на среде с рН 3,0 (до 40 %); отсутствие - при рН 9,0 и всех видах стресса - рН 11,0. Повышение температуры до 37 о С приводило к увеличению числа удлиненных клеток в вариантах с рН 4,5; 7,0; 9,0, наряду с отсутствием их – при рН 3,0 и 11,0. Общеизвестно, что мейотически продуцируемые споры в почкующихся клетках S. cerevisiae имеют состояние повышенной стрессовой устойчивости, которая сохраняется для многочисленных поколений. Обнаружено, что образование спор у гетерозиготного штамма Y -503 характерно только для повышенной температуры.
Внесение 10 % NaCl в среду для культивировании Y-503 выявило овально – округлые клетки, вариабельность по размеру, появление редких клеток R-формы. В случае с 15 и 20 %NaCl практически все клетки овальные и очень много мелких; обнаружены сумки со спорами, много клеток R-формы. Интерпретируя полученные данные, можно заключить, что добавление 1020 % NaCl в среду привело к ингибированию метаболизма дрожжей и, как следствие, гибели клеток, что подтверждало результаты ранее проведенных исследований [24]. Соответственно, в эксперименте с 3 стрессорами будет использован вариант исключительно с 5 % NaCl.
Влияние 3 стрессоров (рис. 3,а,б). В условиях одновременного воздействия нескольких стресс - факторов может возникнуть внутренний антагонизм, снижающий вредные последствия, приводящий к перекрёстной адаптации/ защите. Показано, что клетки штамма Y-503 при 30оС в абсолютном большинстве, как и в опытах с 2 стрессорами, имели округло-овальную и овально-округлую форму, за исключением небольшого количества овальной – 5-20 % (рН 3,0; 4,5; 7,0), округлой – до 20 % (рН 3,0) и яйцеобразной - 10 % (рН 9,0). Следует отметить, что увеличение температуры (37оС) приводило к большему разнообразию форм клеток при доминировании тех же клеток, что и при 30оС, за исключением однородной культуры с округлыми клетками при рН 11,0. Более того, известно, что добавление NaCl способствует высокому накоплению глицерина и трегалозы, что позволяет избежать уменьшение воды и усадку клеток [25].
Действительно, поверхность клетки в отдельных вариантах сред с увеличением соли и температуры практически не уменьшалась, но становилась менее эллипсовидной (рис 2, 3).
Наибольшее число почкующихся при 30оС обнаружено на среде с рН 11,0 (50 %), рН 4,5 и 7,0 (20-30 %), где выявлены клетки с 3-4 почками. Между тем, на среде с рН 9.0 они отсутствовали. Согласно литературным данным, продолжительное воздействие соли и температуры на культуру дрожжей приводит к росту клеток [26]. Обнаружена следующая закономерность: у величение температуры до 37оС в вариантах с 2 и 3 стрессорами приводило к увеличению почкующихся до 30-40 % по сравнению с более низкой температурой. Наименьший рост почкующихся клеток выявлен при рН 3,0 и 7,0. Очевидно, доля ювенильных клеток при 30оС была ниже в 0,5-2,0 раза, что свидетельствовало о различной длительности прохождения клеткой ранних стадий митоза, которая может зависеть от разного рода экстремальных факторов.
Относительно клеток R-формы отмечено, что при 30 о С они присутствовали в вариантах с рН 3,0; 4,5; 7.0 (10-40 %). Одновременное воздействие стрессоров, приводило к активному образованию включений при всех диапазонах концентраций pH и NaCl (рис. 3,а,б). Необходимо отметить полное отсутствие вакуолей при воздействии 3 стрессоров на клетки штамма S. cerevisiae Y -503 . Результаты исследований показали, что наличие спор при воздействии 2 или 3 стрессоров на клетки штамма Y-503 характерно только при повышенной температуре.
-
II. Морфология колоний штамма S. cerevisiae Y-503 при воздействии кислотного (3,0; 4,5; 7,0; 9,0; 11,0), осмотического (5 % NaCl ) и температурного (30оС и 37оС) стресса (рис. 4).
В благоприятных условиях выращивания дрожжи S. cerevisiae формируют гладкие, округлой формы колонии. В условиях изменения состава среды, голодании или генетических изменениях дрожжи могут менять картину роста для создания сложной коммуникации, состоящей из многочисленных взаимодействующих клеток. Известно предположение, что колонии со сложной структурой способствуют защите клеток от агрессивной среды, поскольку морфологический ответ колонии на стресс связан с клеточной коммуникацией, дифференциацией, специализацией и клеточной адгезией [27].
Первая серия опытов по воздействию 2 стресс - факторов на культуральные свойства штамма

Рис. 3. Морфология клеток штамма S. cerevisiae Y-503 при воздействии различных значений кислотного, осмотического (5 % NaCl) и температурного (30оС-а, 37оС-б) стресса
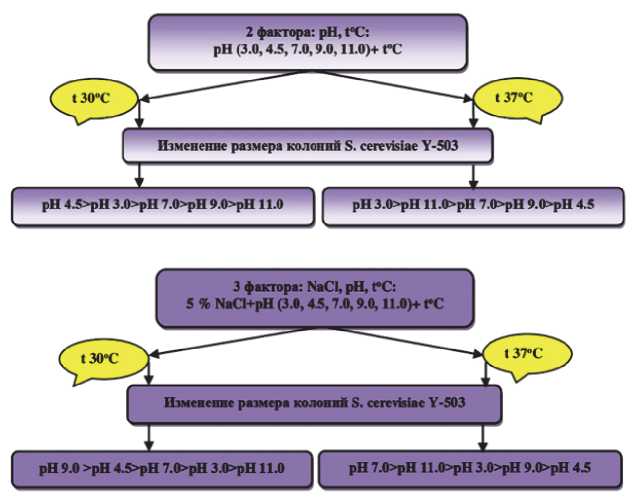
Рис. 4. Изменение размеров гигантских колоний штамма S. cerevisiae Y-503 в условиях осмотического, температурного и кислотного стресса
Y-503 осуществлялась при 30оC (рис. 4). Во всех вариантах обнаружена закономерность образовывать характерные для штамма колонии округлой формы в виде цветка с фестончатым краем. В дальнейшем, с увеличением концентрации соли, колонии приобретали неправильный контур. Окраска менялась от светлого пигмента на более темный, начиная с варианта с 10 % NaCl в среде; поверхность приобретала бугристость, а с 15 % NaCl появлялся легкий блеск. Установлено, что присутствие летальных доз 15-20 % NaCl приводило к угнетению жизнеспособности клеток; показаны точечные колонии (меньше 1 мм). Ингибирование роста клеток при внесении в среду повышенных количеств NaCl обусловлено подавлением дыхания и снижением синтеза антиоксидантных ферментов [28].
Установлено, что лучшие условия для роста колоний при 30оC и 37оC наблюдались в кислотных средах (за исключением варианта с щелочной средой рН 11.0 при 37оC), затем следовала нейтральная (рН 7.0), когда клетки штамма не являлись достаточно активными, но и не гибли в условиях стресса (рис. 5). Действительно, подкисление среды (рН 3.0, 4.5) оказывало стабилизирующее действие на рост колоний штамма Y-503.
Добавление 5 % NaCl в среду при всех вариантах температур привело к изменению окраски колоний со светло-бежевой на более темную, причем при 30оС наблюдались более глубокие борозды и радиальная исчерченность, чем при 37оС (рис. 6). Наряду с этим, с 5 % NaCl в среде при любой температуре относительная скорость роста наблюдалась вблизи щелочной зоны (рН
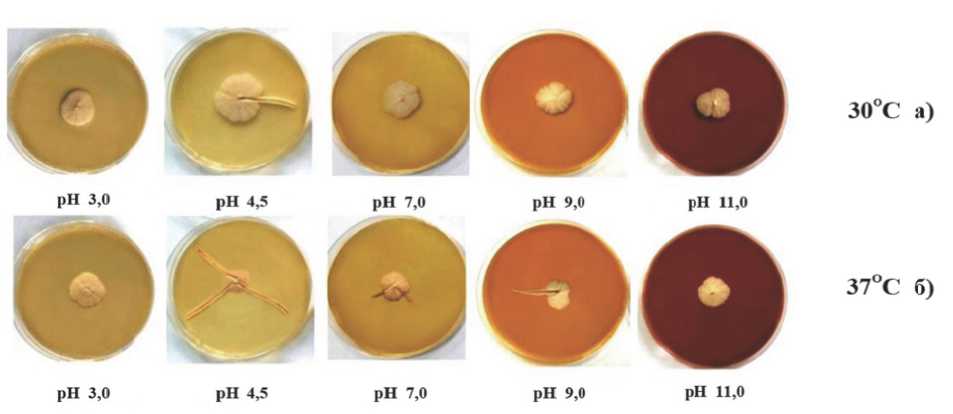
Рис. 5. Морфология колоний штамма S. cerevisiae Y-503 на средах при различных значениях кислотного и температурного (30оС-а, 37оС-б) стресса в отсутствие NaCl
pH 3,0 pH 4,5 pH 7,0 pH 9,0 pH 11,0
M9OO"
pH 3,0 pH 4,5 pH 7,0 pH 9,0 pH 11,0
Рис. 6. Морфология колоний штамма S. cerevisiae Y-503 на средах при различных значениях кислотного, осмотического (5 % NaCl) и температурного (30оС-а, 37оС-б) стресса
9.0 и 11.0), в которой более высокий pH является превентивным фактором роста [29]. Безусловно, при данной концентрации NaCl дрожжи сохраняли жизнеспособность, хотя диаметр колонии значительно уменьшился.
Нельзя не учитывать тот факт, что штамм Y-503, который ранее был получен в результате лазерного воздействия [17], способен выдерживать длительное культивирование (20 суток) без предварительной адаптации, которое значительно усиливало антагонизм совместного действия осмотического, температурного и кислотного стресса.
ЗАКЛЮЧЕНИЕ
Штамм S. cerevisiae Y -503, являясь гетерозид-ным тетраплоидом, способен сохранять жизнеспособность и метаболическую активность в условиях осмотического, температурного и кислотного стресса при длительном культивировании без предварительной адаптации.
Изменение морфолого – культуральных свойств дрожжей при воздействии различных стрессоров является следствием перекрестной адаптации и особенностям полиплоида Y-503. Выявлены оптимальные условия для сохранения жизнеспособности клеток культуры в отсутствие NaCl в среде при следующей последовательности значений рН 4,5>рН 3,0>рН 7,0>рН 9,0>рН 11,0 (30оС) и рН 3,0>рН 11,0>рН 7,0>рН 9,0>рН 4,5 (37оС); и с 5 % NaCl при рН 9,0>рН 4,5>рН 7,0>рН 3,0>рН 11,0 (30оС) и рН 7,0>рН 11,0>рН 3,0>рН 9,0>рН 4.5 (37оС). При этом доминирующими формами клеток для штамма Y-503 являлись овально – округлые и округло – овальные; с увеличением температуры – наблюдали преобразование эллипсовидных форм в более округлые. Установлено, что при всех факторах стресса повышение температуры приводило к увеличению почкующихся клеток, образованию включений и спор. Выявлено наибольшее количество R-форм в клетках на кислых средах и полное их отсутствие на средах с рН 11.0 при любых видах стресса. Присутствие вакуолей, независимо от температуры, характерно для клеток дрожжей на средах с нейтральным и щелочным значением рН исключительно при воздействии 2 стрессоров.
Представленные результаты исследований влияния различных видов стресса могут быть полезны для решения научных и практических задач, связанных с разработкой биотехнологий различного назначения, основанных на использовании устойчивых к экстремальным условиям дрожжей S. cerevisiae .
Список литературы О морфологических свойствах штамма S. cerevisiae Y-503 в условиях осмотического, температурного и кислотного стресса
- Hanson P.K. Bell A.N., Bhaganna P. Saccharomyces cerevisiae: a unicellular model genetic organism of enduring importance // Current protocols essential laboratory techniques. 2018. V. 16. № 1. P. 1-15.
- Cray J.A., Mswaka A.Y., Timson D.J. The biology of habitat dominance; can microbes behave as weeds? // Microb biotechnol. 2013. V. 6 (5). P. 453-492.
- Arroyo-López N., Orlić S., Querol A. Effects of temperature, pH and sugar concentration on the growth parameters of S. cerevisiae, S. kudriavzevii and their interspecific hybrid // International journal of food microbiology. 2009. V. 131. P. 120-127.
- Hohmann S. Osmotic stress signaling and osmoadaptation in yeasts // Microbiol mol biol rev. 2002. V. 66 (2). P. 300-372.
- Khmelinskii I., Makarov V.I. EPR hyperthermia of S. cerevisiae using superparamagnetic Fe3O4 nanoparticles // Journal of Thermal Biology. 2018. V. 77. P. 55-61.


