О применении морфофизиологических маркеров в исследовании внутривидового полиморфизма льна обыкновенного (Linum usitatissimum L.)
Автор: Королев К.П., Боме Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические основы селекции
Статья в выпуске: 5 т.53, 2018 года.
Бесплатный доступ
Генетическое разнообразие растений и увеличения набора используемых культур необходимы для повышения устойчивости сельскохозяйственного производства при ухудшении условий окружающей среды и обеспечения качественными экологически безопасными продуктами. Эти задачи требуют быстрой оценки получаемых форм растений и обработки информации о биологии их развития. Лен - одна из перспективных сельскохозяйственных культур, однако в Тюменской области он сейчас практически не выращивается, здесь не проводятся государственные сортоиспытания культуры. В выполненном нами исследовании для группы российских и иностранных сортов льна выявлены наиболее информативные морфометрические критерии, определяющие адаптивный потенциал генотипов в условиях региона, впервые дополненные экспресс-оценкой динамики накопления и деградации хлорофилла в листьях, выполненной неинвазивно с использованием оптического счетчика SPAD 502. Целью работы было изучение реакции генотипов Linum usitatissimum L. на воздействие факторов окружающей среды и выявление признаков для использования в качестве индикаторов адаптационных свойств...
Лен культурный, коллекционный образец, счетчик хлорофилла spad 502, моделируемые и естественные условия
Короткий адрес: https://sciup.org/142216599
IDR: 142216599 | УДК: 633.521:581.15:575.167(571.12) | DOI: 10.15389/agrobiology.2018.5.927rus
Текст научной статьи О применении морфофизиологических маркеров в исследовании внутривидового полиморфизма льна обыкновенного (Linum usitatissimum L.)
Радикальные стрессы от воздействий факторов окружающей среды, известные как стохастические события, представляют значительные от- клонения от нормальных условий и могут нанести существенный ущерб растительной популяции (1). Устойчивое растениеводство на юге Тюменской области возможно при сочетании следующих условий: подбор видов растений, толерантных к лимитирующим факторам среды, создание новых высокоадаптивных сортов, их ускоренное размножение, правильное экологическое размещение (2). Климатические изменения, проявляющиеся в повышении среднегодовой температуры приземного слоя воздуха на 0,7 °С на всех континентах за последнюю четверть XX века (3), указывают на необходимость внесения корректировок в стратегию подбора видов и сортов культивируемых растений.
Обеспечение качественными экологически безопасными продуктами питания в определенной степени достигается за счет увеличения набора сельскохозяйственных культур, разработки принципиально новых способов оценки форм растений и быстрой обработки информации о биологии их развития. Генетическое разнообразие растений увеличивает возможность выбора и обеспечивает защиту от неблагоприятных условий.
Лен — одна из культур, заслуживающих внимания и внедрения в сельскохозяйственное производство. В настоящее время в Тюменской области он практически не выращивается, не проводится испытание сортов на государственных сортоиспытательных участках (ГСУ). При этом еще в 1970-1980-е годы в Сибири было развито льноводство, посевные площади льна-долгунца на юге Тюменской области составляли более 10 000 га (4). Интродукция и подбор сортов льна, экологически адаптированных к местным почвенно-климатическим условиям, представляется важным для сельскохозяйственной практики.
При фенотипировании признаков на проростках в контролируемых (моделируемых в лаборатории) и на взрослых растениях — в естественных полевых условиях может ускорить выявление селекционно ценных форм растений. Морфологические признаки проростков рассматриваются как биометрические показатели реакции формирующегося растительного организма на факторы окружающей среды. Так, соотношение длины корня и побега в стандартных и стрессовых условиях могут служить удобным индикатором, характеризующим онтогенетическое развитие. К числу информативных этот показатель отнесен при оценке степени неблагоприятного воздействия на растения тритикале (5), кукурузы (6), сафлоры (7), сосны (8).
К физиологическим признакам, характеризующим взаимодействие генотип ½ среда, относят содержание хлорофилла в листьях. Стационарные методы определения этого показателя с использованием спектрофотометров трудоемки, длительны и требуют изъятия растений из агроценозов. Показана возможность быстрого и точного определения количества хлорофилла с помощью оптического счетчика SPAD-502 («Minolta Camera Co, Ltd», Япония) в листьях пшеницы (9, 10), ячменя (11, 12), овса (13), риса (14), картофеля (15), томатов (16), сельдерея (17), сахарного тростника (18), папайи (19), лавровых (20) и древесных (21) растений, эвкалипта (22), арахиса (23), сои (24, 25), арабидопсиса (26), декоративных культур (27). Выявлены различия между видами и сортами по количеству хлорофилла при воздействии засоления (28), контрастной температуры (29, 30), недостатка влаги (31) и в культуре in vitro (32). В России исследования с использованием указанного прибора носят фрагментарный характер (33).
В настоящей работе впервые в условиях юга Тюменской области на примере 20 образцов льна обыкновенного разного эколого-географического происхождения изучена изменчивость морфофизиологических признаков и установлены наиболее информативные критерии, определяющие адап-928
тивный потенциал культуры. Проведена экспресс-диагностика накопления и деградации хлорофилла в листьях на разных этапах онтогенеза растений с использованием оптического счетчика SPAD 502.
Цель исследования состояла в изучении реакции генотипов льна обыкновенного ( Linum usitatissimum L.) на воздействие факторов окружающей среды и выявлении популяционных и индивидуальных признаков для использования в качестве индикаторов адаптационных свойств.
Методика. Были изучены 20 коллекционных образцов льна обыкновенного различного эколого-географического происхождения из России (6 образцов), Беларуси (7 образцов), Чехии (2 образца), по одному образцу из Украины, Франции, Канады, Австралии, Германии. Лабораторные и полевые опыты проводили в 2016-2017 годах.
Семена проращивали в чашках Петри на увлажненной дистиллированной водой фильтровальной бумаге при 20 °С в термостате ТС-1/80 СПУ (Россия) в соответствии с ГОСТ Р 52325-2005 (34). Определяли энергию прорастания, лабораторную всхожесть семян, морфометрические параметры и биомассу проростков.
Для тестирования растений на начальных этапах онтогенеза в вегетационные сосуды высевали по 20 семян в 4-кратной повторности. В сосуд помещали по 280 г почвы с влажностью 60 % полной влагоемкости. Растения выращивали на специализированных стеллажах (освещенность 5000 лк, фотопериод 16 ч). Оценивали всхожесть семян, высоту растений, содержание хлорофилла в листьях, массу надземой и подземной частей. Для характеристики структуры биомассы рассчитывали соотношение для побегов и корней.
Полевое изучение коллекционных образцов льна выполняли на экспериментальном участке биостанции Тюменского государственного университета «Озеро Кучак» (Нижнетавдинский р-н, Тюменская обл., 57°21' с.ш., 66°04' в.д.) на окультуренной дерново-подзолистой почве, супесчаной по гранулометрическому составу. Закладку полевых опытов, наблюдения и учеты признаков проводили в соответствии с методическими указаниями (35). Посев осуществляли в I декаде мая рядовым способом по 200 семян на делянку с учетной площадью 1 м2, повторность опыта 3-кратная. Размещение делянок рендомизированное. Предшественник — яровой ячмень.
Содержание хлорофилла в листьях определяли с использованием оптического счетчика SPAD 502 («Minolta Camera Co, Ltd», Япония) при X = 650 нм (максимальное поглощение хлорофиллов а и b) и X = 940 нм (с учетом толщины листа). Перед началом измерения прибор калибровали. Оценивали количество хлорофилла в 20 листьях из верхней части типичных растений каждого образца. Серединную часть листовой пластинки располагали на нижней части прибора, зажимали на несколько секунд до появления числового значения. Прибор автоматически запоминает все показания и рассчитывает средние значения (SPAD units, SPAD ед.). Проводили 3 измерения с интервалом 5 сут в лабораторном опыте и 7 измерений в полевых условиях на разных стадиях фенологического развития: всходы, елочка, быстрый рост, бутонизация, цветение, зеленая спелость, ранняя желтая спелость.
В каждую фенологическую фазу измеряли высоту растений. В период уборки подсчитывали число сохранившихся растений льна на каждой делянке и рассчитывали выживаемость по отношению к числу всходов.
Статистическую обработку данных выполняли по Б.А. Доспехову (36), Г.Ф. Лакину (37), A. Field с соавт. (38) с использованием табличного процессора Microsoft Excel и программного обеспечения STATISTICA 6.0
(«StatSoft, Inc.», США). Представлены средние значения ( M ) и ошибки средних (±SEM). Различия между средними значениями вариантов оценивали с использованием t -критерия Стьюдента и считали их статистическую значимыми при р < 0,05 и р < 0,01.
Результаты. Гетерогенный материал льна различался по линейным размерам (длина, ширина семян) и массе 1000 семян. В соответствии Международным классификатором вида Linum usitatissimum L. (39) образцы были разделены на две группы: со средними (3 образца) и мелкими (17 образцов) семенами (табл.).
Характеристика семян изученных образцов льна обыкновенного ( Linum usitatis-simum L.) ( M ±SEM, лабораторный опыт)
|
Образец, фенотип (происхождение) |
Размеры семян, мм |
Отношение длина/ширина |
Масса 1000 семян, г |
|
|
длина |
ширина |
|||
|
Средние |
семена ( n = 3) |
|||
|
Ручеек, м (Россия) |
5,21±0,83 |
3,54±0,11 |
1,47 |
6,12±0,17 |
|
Флиз, м (Россия) |
5,21±0,12 |
3,30±0,77 |
1,58 |
6,00±0,91 |
|
Бирюза, м (Россия) |
5,05±0,77 |
4,31±1.22 |
1,17 |
6,57±0,25 |
|
Мелкие |
семена ( n = 17) |
|||
|
36.3.-4, д (Россия) |
4,42±0,81 |
3,25±0,50 |
1,36 |
4,51±0,66 |
|
Велижский кряж, д (Россия) |
3,02±0,12 |
3,12±0,71 |
0,97 |
4,48±0,59 |
|
Печерский кряж, д (Россия) |
4,13±0,99 |
3,54±0,66 |
1,17 |
4,36±0,33 |
|
Грант, д (Беларусь) |
5,01±0,89 |
3,10±0,63 |
1,61 |
5,25±0,34 |
|
Маяк, д (Беларусь) |
3,06±0,12* |
5,23±0,32* |
0,59 |
4,50±0,65 |
|
Мара, д (Беларусь) |
4,21±0,54 |
3,42±0,65 |
1,23 |
4,83±1,03 |
|
Рубин, д (Беларусь) |
3,15±0,78 |
2,11±1,23 |
1,49 |
4,66±0,34 |
|
Ива, д (Беларусь) |
4,25±0,75 |
3,32±0,90 |
1,28 |
4,74±0,43 |
|
Ярок, д (Беларусь) |
4,21±0,57 |
3,15±0,80 |
1,34 |
5,00±0,72 |
|
Веста, д (Беларусь) |
3,35±0,28 |
3,42±0,64 |
0,98 |
5,39±0,94 |
|
Глинум, д (Украина) |
4,45±0,45 |
2,25±1,12 |
1,98 |
4,89±0,77 |
|
Bertelsdorfer, д (Германия) |
4,06±0,10 |
8,21±0,21** |
0.49 |
5,25±0,95* |
|
Currong, д (Австралия) |
4,05±0,45 |
3,05±0,32 |
1,33 |
4,37±0,76 |
|
Svalof, д (Чехия) |
5,34±0,90* |
3,15±0,32 |
1,70 |
4,59±0,91 |
|
Hermes, д (Чехия) |
4,21±0,91 |
3,11±0,36 |
1,35 |
5,03±0,49 |
|
Ottava 770 B See, д (Канада) |
5,36±0,21 |
3,48±0,79 |
1,54 |
5,50±0,20 |
|
Alizee, д (Франция) |
4,54±0,54 |
3,27±0,25 |
1,38 |
5,61±0,63 |
|
Среднее по образцам |
4,31±0,55 |
3,58±0,62 |
1,30 |
5,08±0,60 |
П р и м еч а ни е. Р аспределение образцов на группы проведено по массе 1000 семян (39); д — долгунец (прядильный лен), м — межеумок (масличный лен).
*, ** Различия со средним значением по образцам статистически значимы соответственно при р < 0,05 и р < 0,01.
По окраске семян у льна выделяют два типа: темный (коричневый) и светлый (желтый). В работе М.Н. Ягло с соавт. (40) этот признак рассматривается как важный маркер для идентификации сортов. Желтую окраску определяет доминантный ген YSED1 , темно-желтую — рецессивный ysed2 , светло-желто-коричневую — ген rs1 (41). Окраска семян изученных нами образцов была коричневой (разной интенсивности) у 19 образцов и желтой — у одного (Ottava 770 B See).
Средняя длина семени составила 4,31±0,55 мм и колеблясь по образцам от 3,02±0,12 (Велижский кряж) до 5,36±0,21 мм (Ottava 770 B See). По ширине семени минимальное значение (2,11±1,23 мм) отмечали у сорта Рубин, максимальное (8,21±0,21 мм) — у сорта Bertelsdorfer при среднем значении по образцам 3,58±0,62 мм (см. табл.). У большинства изученных образцов линейные размеры семян не имели существенных отличий от средних популяционных значений. Достоверные различия выявили у образцов Маяк и Svalof по длине, у образцов Маяк и Bertelsdorfer — по ширине семени. Расчет индекса соотношения длины и ширины семян позволил оценить их различия по форме. Удлиненно-эллиптическую форму имели семена 16 образцов, у которых соотношение длины и ширины составляло 1,17-1,98. У четырех образцов форма семян была яйцевидная сплюснутая (соотношения длины и ширины 0,49-0,98). По массе 1000 се930
мян достоверное различие со средним популяционным значением отмечали только у образца Bertelsdorfer.
Тестирование физиологического качества семян проводится в строго регулируемых условиях по энергии прорастания и лабораторной всхожести. Однако есть мнение (42), что эти тесты не предназначены для прогнозирования точного количества проростков в полевых условиях, поскольку воздействие стрессовых факторов (пониженные температуры почвы, недостаток влаги, патогены и др.) снижают скорость прорастания. В связи с этим информативным дополнением к оценке биологических свойств семян было изучение начального онтогенетического развития растений на основании изменчивости их морфологических признаков. Показатели энергии прорастания и лабораторной всхожести подтвердили высокие посевные качества изученных семян. По энергии прорастания ни один из образцов достоверно не отличался от среднего значения (95,6±0,74 %) по всей экспериментальной группе. Лабораторная всхожесть семян сортов Грант (99,8±0,66 %) и Глинум (97,1±0,21 %) была существенно выше (р < 0,05), сортов Ярок (93,7±0,90 %) и Флиз (94,6±0,99 %) — ниже средней.
Варьирование значений признака под действием экологических факторов называется фенотипической адаптацией и определяется нормой реакции (43). Способность семян прорастать и формировать полноценные всходы отражает адаптационные свойства культуры в новых условиях среды. Средняя полевая всхожесть семян у изученных образцов льна была ниже лабораторной на 25 %, что характерно для почвенно-климатических условий Тюменской области и согласуется с данными по другим культурам (44). Реакция образцов на выращивание в полевых условиях оказалась неоднозначной. Достоверно (р < 0,05) от средних по коллекции отличались показатели у 6 образцов, из них Грант, Маяк, Велижский кряж характеризовались высокой (77,3-76,5 %), Hermes, Bertelsdorfer, Ручеек — пониженной (66,3-67,9 %) всхожестью семян. Варьирование образцов по всхожести в полевом опыте было выше, чем в лабораторных тестах ( Cv соответственно 25,18 и 9,13 %).
Представляет определенный интерес выявление особенностей роста в регулируемых условиях среды и возможность интерпретации данных применительно к условиям полевого опыта. Так, при выращивании в вегетационных сосудах наибольшую длину побега отмечали у сортов Маяк (13,1±0,77 см), Рубин (12,5±0,94 см), Ива (12,1±0,31 см). По результатам полевой оценки эти сорта были отнесены к высокорослым (соответственно 100,0; 96,1; 100,2 см). То есть их высокий ростовой потенциал сохранялся в течение всего периода развития растений.
Анализ структуры сырой биомассы выявил преобладание побегов, доля которых в среднем по образцам составила 66,7 %. Высокое долевое участие побега (87,5-90,0 %) в формировании биомассы растения на начальных этапах онтогенеза выявили у образцов Велижский кряж, Грант, Ива, Веста, Глинум, Bertelsdorfer, Ottava 770 B See. В полевом опыте относительно высокие показатели урожайности тресты (166,5-170,0 г/м2) имели Грант, Глинум, Маяк, семян (66,5-77,7 г/м2) — Грант, Маяк, Bertelsdorfer.
Экологическую пластичность экспериментальных образцов льна характеризовали показатели выживаемости растений в течение вегетационного периода, которая была выше 80 %. Варьирование признака составляло 30,33 % и было выше, чем по энергии прорастания, лабораторной и полевой всхожести семян. Следовательно, выживаемость растений в большей степени определялась показателями индивидуальной жизнеспособности образцов. Лучшую жизнеспособность продемонстрировали Грант, Ма- як, Рубин, Currong, Ведижский кряж, а наименьшей пластичностью характеризовались Флиз, Мара, Hermes, Ручеек. Образцы с высокой устойчивостью к факторам окружающей среды по биологическим свойствам семян, их способности к прорастанию, а также по показателям линейного роста корней и побегов в раннем онтогенезе в большинстве случаев минимально отклонялись от средних значений по коллекции. Образцы с пониженной выживаемостью часто отклонялись от среднего значения как в сторону увеличения длины побега (Мара), полевой всхожести семян (Hermes), так и уменьшения лабораторной и полевой всхожести семян, длины побега (Флиз, Ручеек).
Таким образом, примененные нами широко распространенные тесты, основанные на изучении характеристик растений в условиях лабораторного и полевого эксперимента, позволяют выявить особенности внутри-популяционной изменчивости на фенотипическом уровне. Однако существуют возможности улучшения этой традиционно используемой методологии. Например, важными представляются тесты, использующие физиологические маркеры, например содержания хлорофилла.
А
Б
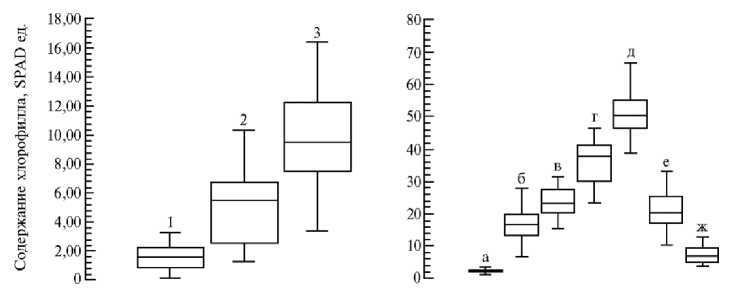
Рис. 1. Результаты измерения содержание хлорофилла в листьях коллекционных образцов льна ( Linum usitatissimum L.) с помощью прибора SPAD 502 («Minolta Camera Co, Ltd», Япония) в лабораторном (А) и полевом (Б) опытах: 1, 2, 3 — учеты с интервалом 5 сут; а — полные всходы, б — елочка, в — быстрый рост, г — бутонизация, д — цветение, е — зеленая спелость, ж — ранняя желтая спелость; черта — средняя арифметическая; □ — стандартная ошибка, ±; 1 — минимальное значение признака; 1 — максимальное значение признака ( n = 20; полевые тесты выполнены на биостанции Тюменского государственного университета «Озеро Кучак», Нижнетавдинский р-н, Тюменская обл., 2016-2017 годы).
При анализе динамики накопления хлорофилла в листьях в лабораторном эксперименте мы не выявили достоверных различий между образцами при первом и втором измерении оптическим счетчиком SPAD 502, что, вероятно, связано с невысокой интенсивностью линейного роста на начальных этапах онтогенеза. При третьем измерении отмечали увеличение внутрипопуляционных различий. У шести сортов (Маяк, Гли-нум, Ива, Велижский кряж, Currong, Hermes) показатели были достоверно (р < 0,05) ниже среднего значения, у остальных существенно не отличались. От начала до окончания эксперимента показатель изменялся от 1,29 до 9,14 SPAD ед. Чтобы оценить изменчивость содержания хлорофилла в листьях, дать полную статистическую характеристику анализируемой совокупности в лабораторных и полевых условиях, а также сравнить одно распределение с другим, использовали диаграммы размахов («ящики с усами») разработанные J. Tukey (38) (рис. 1).
В естественных условиях наибольшие значения (70,05 SPAD ед.) по хлорофиллу отмечали в листьях льна в фазу цветения. В период формиро-932
вания и созревания семян показатель снижался до 4,23-13,24 SPAD ед. Характер изменения количества хлорофилла может существенно повлиять на урожайность и качество семян (45). Минимальное среднесуточное накопление хлорофилла регистрировали в фазу всходов (0,37 ед. SPAD). Дальнейшее развитие растений было связано с увеличением относительной скорости накопления хлорофилла в периоды всходы—елочка (до 1,29 SPAD ед.), елочка—быстрый рост (до 1,79 ед. SPAD), быстрый рост—бутонизация (до 2,18 SPAD ед.), бутонизация—цветение (до 4,36 SPAD ед.). От цветения до зеленой и ранней желтой спелости показатели резко снижались и составили соответственно 1,52 и 0,75 (рис. 2).
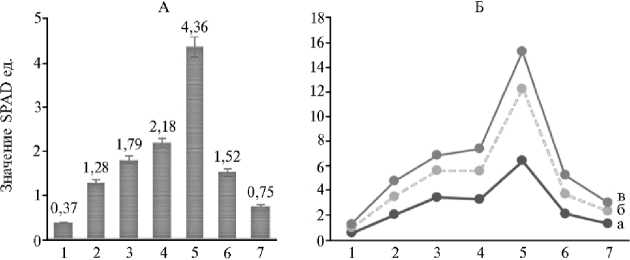
Фенологическая фаза
Рис. 2. Динамика среднесуточного накопления и деградации хлорофилла в листьях льна ( Linum usitatissimum L.) по фенологическим фазам в среднем по всем образцам ( n = 20) (А) и по образцам с существенными различиями ( n = 3) (Б) : 1 — полные всходы, 2 — елочка, 3 — быстрый рост, 4 — бутонизация, 5 — цветение, 6 — зеленая спелость, 7 — ранняя желтая спелость; а — Грант, б — Svalof, в — селекционный образец 36.3.4 (полевые тесты выполнены на биостанции Тюменского государственного университета «Озеро Кучак», Нижнетавдинский р-н, Тюменская обл., 2016-2017 годы).
При выявленной общей закономерности в динамике накопления и деградации хлорофилла изученные образцы существенно различались между собой (см. рис. 2, Б). Так, у сорта Грант выявили самую высокую интенсивность накопления хлорофилла в листьях: суточное увеличение пигмента в среднем за вегетационный период составило 2,71 SPAD ед. Относительно других образцов сорт характеризовался быстрым увеличением содержания хлорофилла до цветения растений и ярко выраженной деградацией в период формирования семян. У него отмечали более высокую урожайность тресты (170,0 г/м2) и семян (68,3 г/м2) при среднепопуляционном значении соответственно 147,1 и 59,85 г/м2. У селекционного образца 36.3.4 в период вегетации увеличение количества хлорофилла в пересчете на сутки происходило медленно (со скоростью 1,42 ед. SPAD), самый низкий показатель (1,53 ед. SPAD) по сравнению с другими образцами зарегистрировали в фазу цветения, урожайность тресты была низкой (100,2 г/м2). При относительно медленном разрушении хлорофилла в фазы зеленой спелости (1,58 ед. SPAD) и ранней желтой спелости (0,70 ед. SPAD) урожайность семян составила 33,3 г/м2. Промежуточное положение между описанными образцами по среднесуточной динамике накопления хлорофилла в листьях (2,10 ед. SPAD за вегетационный период) занял сорт Svalof. Он выделился по этому показателю в период цветения растений (2,43 ед. SPAD), формирования и созревания семян (1,57-1,00 ед. SPAD), а также по семенной продуктивности (116,5 г/м2). В целом по изученным образцам урожайность семян изменялась от 33,3 до 116,5 г/м2, тресты — от 100,2 до 171,7 г/м2.
Расчет коэффициентов корреляции позволил выявить сопряжен- ность накопления хлорофилла с другими показателями в лабораторных и полевых условиях. Так, для высоты растений в лабораторном и полевом тесте значения составили соответственно r = 0,65 и r = 0,89; для числа листьев — r = 0,36 и r = 0,25; для площади листовой пластинки в лабораторном опыте — r = 0,35 (в полевых условиях сопряженность между признаками была слабой). Обнаружены положительные корреляции между результатами измерения с использованием SPAD 502 и выживаемостью растений в фазы бутонизации (r = 0,22) и ранней желтой спелости (r = 0,24).
Наши данные согласуются с представлениями о содержании хлорофилла в листьях как значимом параметре физиологического статуса растений (46, 47). Информативным показателем фотосинтетической способности, особенностей роста и развития многих культур служит содержание хлорофилла на единицу площади листа (плотность хлорофилла) (48). Показания SPAD 502 рассматриваются как удобные критерии наблюдения за процессом фотосинтеза с учетом изменений, вызванных факторами окружающей среды, что дает возможность проводить отбор генотипов, адаптирующихся к стрессу (49-51).
По результатам дисперсионного анализа были выявлены различия факторов по доле влияния на содержание хлорофилла в листьях в общей фенотипической изменчивости. Накопление хлорофилла прежде всего определялось условиями выращивания растений льна (46,2 %), а также взаимодействием этого фактора с генотипом (34,4 %). Генотипические различия составили 16,6 %. Одновременное действие других факторов на признак было незначительным.
Итак, по результатам лабораторных и полевых экспериментов выделены популяционные и индивидуальные признаки растений, имеющие решающее значение для адаптации сортов льна в новых агроэкологических условиях. Тестирование семян показало, что информативными критериями их биологического состояния, наряду с традиционными показателями энергии прорастания и лабораторной всхожести, можно считать морфологические признаки проростков и молодых растений, индексы развития корней и побегов, структуру биомассы. Закономерности изменчивости некоторых признаков (длина побега, биомасса растения, содержание хлорофилла), выявленные у образцов льна на начальных этапах онтогенеза, подтверждены в полевом испытании, что дает основание для отбора генотипов с полезными признаками в моделируемых условиях лаборатории. В полевых условиях критериями для выявления сортов льна, устойчивых к гидротермическим стрессам, можно считать полевую всхожесть семян и выживаемость растений в период вегетации, поскольку эти показатели достаточно полно характеризуют ряд взаимосвязанных процессов онтогенеза и отражают реакцию растений на факторы окружающей среды. Оценка генотипов в полевых условиях основана на характеристике ряда признаков: высота растений, линейные размеры, площадь и число листьев. При отборе генотипов льна удобно использовать оптический счетчик хлорофилла SPAD 502, который позволяет существенно сократить время диагностики без потери объективности. Обнаружены взаимосвязи между измеренными показателями (ед. SPAD), морфологическими признаками и выживаемостью растений на разных этапах онтогенеза. На основании комплексного исследования выделены сорта, сочетающие высокие адаптивные и продуктивные свойства — Грант, Маяк (Беларусь), Bertelsdorfer (Германия), Svalof (Чехия), Ottava 770 B See (Канада), которые могут быть использованы в качестве исходного материала в селекционно-генетических программах.
за консультации по работе с оптическим счетчиком хлорофилла SPAD 502.
Список литературы О применении морфофизиологических маркеров в исследовании внутривидового полиморфизма льна обыкновенного (Linum usitatissimum L.)
- Джарвис Д.И., Майер Л., Клемик Х., Гуарино Л., Смейл М., Браун А.Х.Д., Садики М., Шапит Б., Ходкин Т. Учебное пособие по in situ сохранению в условиях хозяйства (on-farm). Рим, 2002.
- Боме Н.А. Подбор культур и методы создания сортов для экстремальных условий Северного Зауралья. Автореф. докт. дис. СПб, 1996.
- Тютюма Н.В. Теоретические и прикладные аспекты изучения селекционной ценности генофонда зерновых колосовых культур в аридных условиях Нижнего Поволжья. Автореф. докт. дис. Астрахань, 2009.
- Основные показатели сельского хозяйства Тюменской области (1913-1996). Тюмень, 1997.
- Kaydan D., Yagmur M. Germination, seedling growth and relative water content of shoot in different seed sires of triticale under osmotic stress of water and NaCl. Afr. J. Biotechnol., 2008, 7(16): 2862-2868.
- Ma X.F., Yu T., Wang L.H., Shi X., Zheng L.X., Wang M.X., Yao Y.Q., Gai H.J. Effects of water deficit at seedlings stage on maize root development and anatomical structure. The Journal of Applied Ecology (Chine), 2010, 21(7): 1731-1736.
- Khodadad M. An evaluation of safflower genotypes (Carthamus tinctorius L.), seed germination and seedlings characters in salt stress conditions. African Journal Agriculture Research, 2011, 2(3): 1667-1672.
- Taeger S., Sparks T.H., Menzel A. Effects of temperature and drought manipulations on seedlings of Scots pine provenances. Plant Biol., 2015, 17(2): 361-372 ( ) DOI: 10.1111/plb.12245
- Pour-Aboughadareh A., Ahmadi J., Mehrabi A. Physiological responses to drought stress in wild relatives of wheat: implications for wheat improvement. Acta Physiol. Plant., 2017, 39: 106 ( ) DOI: 10.1007/s11738-017-2403-z
- Ogbonnaya F., Rasheed A., Okechukwu E. Genome-wide association study for agronomic and physiological traits in spring wheat evaluated in a range of heat prone environments. Theor. Appl. Genet., 2017, 130(9): 1819-1835 ( ) DOI: 10.1007/s00122-017-2927-z
- Honsdorf N., March T., Hecht A., Eglinton J. Evaluation of juvenile drought stress tolerance and genotyping by sequencing with wild barley introgression lines. Mol. Breeding, 2014, 34(3): 1475-1495 ( ) DOI: 10.1007/s11032-014-0131-2
- Buschmann C., Konanz S., Zhou M. Excitation kinetics of chlorophyll fluorescence during light-induced greening and establishment of photosynthetic activity of barley seedlings. Photosynthetica, 2013, 51(2): 221-230 ( ) DOI: 10.1007/s11099-013-0017-2
- Sánchez-Martín J., Mur L.A.J., Rubiales D. Targeting sources of drought tolerance within an Avena spp. collection through multivariate approaches. Planta, 2012, 236(5): 1529-1545 ( ) DOI: 10.1007/s00425-012-1709-8
- Aghaee A., Moradi F., Zare-Maivan H., Zarinkamar F., Irandoost H., Sharifi P. Physiological responses of two rice (Oryza sativa L.) genotypes to chilling stress at seedling stage. Afr. J. Biotechnol., 2011, 10(39): 7617-7621.
- Gianquinto G., Goffart J., Olivier M. The use of hand-held chlorophyll meters as a tool to assess the nitrogen status and to guide nitrogen fertilization of potato crop. Potato Res., 2004, 47(1-2): 35-80 ( ) DOI: 10.1007/BF02731970
- Wu Q., Su N., Shen W., Cui J. Analyzing photosynthetic activity and growth of Solanum lycopersicum seedlings exposed to different light qualities. Acta Physiol. Plant., 2014, 36(6): 1411-1420 ( ) DOI: 10.1007/s11738-014-1519-7
- Torricelli R., Tiranti B., Spataro G. Differentiation and structure of an Italian landrace of celery (Apium graveolens L.): inferences for on farm conservation. Genet. Resour. Crop Ev., 2013, 60(3): 995-1006 ( ) DOI: 10.1007/s10722-012-9896-5
- Martins М., Souza W. Characterization of sugarcane (Saccharum spp.) leaf senescence: implications for biofuel production. Biotechnol. Biofuels, 2016, 9: 153 ( ) DOI: 10.1186/s13068-016-0568-0
- De Castro F.A., Campostrini E., Netto A. Portable chlorophyll meter (PCM-502) values are related to total chlorophyll concentration and photosynthetic capacity in papaya (Carica papaya L.). Theor. Exp. Plant Phys., 2014, 26(3-4): 201-210 ( ) DOI: 10.1007/s40626-014-0018-y
- Scotti I., Calvo-Vialettes L., Scotti-Saintagne C. Genetic variation for growth, morphological, and physiological traits in a wild population of the Neotropical shade-tolerant rainforest tree Sextonia rubra (Mez) van der Werff (Lauraceae). Tree Genet. Genomes, 2010, 6(2): 319-329 ( ) DOI: 10.1007/s11295-009-0251-8
- Wang Y., Hong W., Wu C., Lin H., Fan H. Variation of SPAD values in uneven-aged leaves of different dominant species in Castanopsis carlessi forest in Lingshishan National Forest Park. J. Forestry Res., 2009, 20(4): 362-366 ( ) DOI: 10.1007/s11676-009-0061-8
- Barry K., Newnham G., Stone C. Estimation of chlorophyll content in Eucalyptus globulus foliage with the leaf reflectance model PROSPECT. Agr. Forest Meteorol., 2009, 149(6-7): 1209-1213.
- Nigam S., Aruna R. Stability of soil plant analytical development (SPAD) chlorophyll meter reading (SCMR) and specific leaf area (SLA) and their association across varying soil moisture stress conditions in groundnut (Arachis hypogaea L.). Euphytica, 2008, 160(1): 111-117 ( ) DOI: 10.1007/s10681-007-9581-5
- Kühling I., Hüsing B., Bome N., Trautz D. Soybeans in high latitudes: effects of Bradyrhizobium inoculation in Northwest Germany and southern West Siberia. Organic Agriculture, 2018, 8(2): 159-171 ( ) DOI: 10.1007/s13165-017-0181-y
- Thompson J., Schweitzer L., Nelson R. Association of specific leaf weight, an estimate of chlorophyll, and chlorophyll concentration with apparent photosynthesis in soybean. Photosynth. Res., 1996, 49: 1-10.
- Ling Q., Huang W. Jarvis, P. Use of a SPAD-502 meter to measure leaf chlorophyll concentration in Arabidopsis thaliana. Photosynth. Res., 2011, 107(2): 209-214 ( ) DOI: 10.1007/s11120-010-9606-0
- Gratani L., Crescente M., Fabrini G., Varone L. Growth pattern of Bidens cernua L.: relationships between relative growth rate and its physiological and morphological components. Photosynthetica, 2008, 46: 179 ( ) DOI: 10.1007/s11099-008-0029-5
- Kiani-Pouya A., Rasouli F. The potential of leaf chlorophyll content to screen bread-wheat genotypes in saline condition. Photosynthetica, 2014, 52(2): 288-300 ( ) DOI: 10.1007/s11099-014-0033-x
- Figueiredo N., Carranca C., Trindade H. Elevated carbon dioxide and temperature effects on rice yield, leaf greenness, and phenological stages duration. Paddy Water Environ., 2015, 13(4): 313-324 ( ) DOI: 10.1007/s10333-014-0447-x
- Hund А., Frascarol E., Leipner J., Jompuk C. Cold tolerance of the photosynthetic apparatus: Pleiotropic relationship between photosynthetic performance and specific leaf area of maize seedlings. Mol. Breeding, 2005, 16(4): 321-331 ( ) DOI: 10.1007/s11032-005-1642-7
- Caser M., Lovisolo C., Scariot V. The influence of water stress on growth, ecophysiology and ornamental quality of potted Primula vulgaris ‘Heidy’ plants. New insights to increase water use efficiency in plant production. Plant Growth Regul., 2017, 83(3): 361-373 ( ) DOI: 10.1007/s10725-017-0301-4
- Erturk U., Sivritepe N., Yerlikaya C., Bor M., Ozdemir F., Turkan I. Responses of the cherry rootstock to salinity in vitro. Biol. Plantarum, 2007, 51(3): 597-600 ( ) DOI: 10.1007/s10535-007-0132-7
- Kapotis G., Zervoudakis G., Veltsistas T. comparison of chlorophyll meter readings with leaf chlorophyll concentration in Amaranthus vlitus: correlation with physiological processes. Russian Journal of Plant Physiology, 2003, 50(3): 395-397 ( ) DOI: 10.1023/A:1023886623645
- ГОСТ Р 52325-2005 «Семена сельскохозяйственных растений. Сортовые и посевные качества. Общие и технические условия». М., 2005.
- Павлова Л.Н., Александрова Т.А., Марченков А.Н., Рожмина Т.А., Лошакова Н.И., Кудрявцева Л.П., Крылова Т.В., Герасимова Е.Г. Методические указания по селекции льна-долгунца. М., 2004.
- Доспехов Б.А Методика полевого опыта. М., 2014.
- Лакин Г.Ф. Биометрия. М., 1990.
- Field A., Mieles J., Field Z. Discovering statistics using R. SAGE Publication LTD, London, 2012.
- Международный классификатор СЭВ вида Linum usitatissimum L. Л., 1989.
- Ягло М.Н. Характеристика окраски семян льна с применением современных инструментальных технологий. Вicнiк Запорiзького нацiонального унiверсiтету. Бiологiчнi науки, 2014, 1: 39-46.
- Пороховинова Е. Генетический контроль морфологических признаков проростков, плода и семян у льна (Linum usitatissimum L.). Вавиловский журнал генетики и селекции, 2012, 16(4/2): 936-947.
- Filho J.M. Seed vigor testing: an overview of the past, present and future perspective. Sci. Agr., 2015, 72(4): 363-374 ( ) DOI: 10.1590/0103-9016-2015-0007
- Косулина Л.Г., Луценко Э.К., Аксенова В. Физиология устойчивости растений к неблагоприятным факторам среды. Ростов-на-Дону, 1993.
- Боме Н.А., Боме А.Я., Тетянников Н.В. Полевая всхожесть семян и выживаемость растений ячменя как показатели адаптации к меняющимся условиям среды. Аграрный вестник Урала, 2015, 4(134): 15-18.
- Cicero S., van der Schoor R., Jalink H. Use of chlorophyll fluorescence sorting to improve soybean seed quality. Revista Brasileira de Sementes, 2009, 31(4): 145-151 ( ) DOI: 10.1590/S0101-31222009000400017
- Sims D.A., Gamon J.A. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages. Remote. Sens. Environ., 2002, 81(2-3): 337-354 ( ) DOI: 10.1016/S0034-4257(02)00010-X
- Steele M., Gitelson A.A., Rundquist D. Non-destructive estimation of leaf chlorophyll content in grapes. Am. J. Enol. Viticult., 2008, 59: 299-305.
- Bowyer J.B., Leegood R.C. Photosynthesis. In: Plant Biochemistry/P.M. Dry, J.B. Harborne (eds.). Academic Press, San Diego, 1997: 49-110 ( ) DOI: 10.1016/B978-0-12-214674-9.X5000-0
- Wiesler F., Bauer M., Kamh M., Engels T., Reusch S. The crop as indicator for sidedress nitrogen demand in sugar beet production -limitations and perspectives. J. Plant Nutr. Soil Sc., 2002, 165: 93-99.
- Wang Q., Chen J., Li Y. Nondestructive and rapid estimation of leaf chlorophyll and nitrogen status of peace lily using chlorophyll meter. J. Plant Nutr., 2004, 27(3): 557-569 ( ) DOI: 10.1081/PLN-120028878
- Uddling J., Gelang-Alfredson J., Piikki K., Pleijel H. Evaluating the relationship between leaf chlorophyll concentration and SPAD-502 chlorophyll meter readings. Photosynth. Res., 2007, 91(1): 37-46 ( ) DOI: 10.1007/s11120-006-9077-5


