О роли экстракардиальной васкуляризации и интрамиокардиальных коллатералей у больных ИБС
Автор: Шевченко Ю.Л., Борщев Г.Г., Багаудин Т.З., Масленников М.А., Зайниддинов Ф.А.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 2 т.19, 2024 года.
Бесплатный доступ
Ведущая роль в структуре смертности от заболеваний системы органов кровообращения принадлежит ишемической болезни сердца. В основе стенозирующего поражения коронарных артерий, в большинстве случаев, лежит атеросклеротический процесс. Современные способы лечения ИБС, в частности, оптимальная медикаментозная терапия и хирургические вмешательства (операции коронарного шунтирования и чрескожные коронарные вмешательства), в некоторых случаях, не способны в полной мере обеспечить реваскуляризацию миокарда. В связи с этим, рядом исследователей проводятся поиски новых методов решения данной проблемы. Одним из направлений поиска является стимуляция роста и развития экстракардиальных источников кровоснабжения миокарда. В обзоре рассмотрены современные представления о коллатеральном кровоснабжении миокарда, физиологические аспекты процесса регенерации сосудистой сети в организме человека, данные об интра- и экстракардиальных источниках кровотока, существующие подходы к функциональной оценке тех или иных коллатералей, принципы стимуляции непрямой реваскуляризации миокарда (на примере методики ЮрЛеон).
Ангиогенез, ишемическая болезнь сердца, коронарное шунтирование, коллатеральное кровообращение, методика ЮрЛеон
Короткий адрес: https://sciup.org/140307076
IDR: 140307076 | DOI: 10.25881/20728255_2024_19_2_94
Текст научной статьи О роли экстракардиальной васкуляризации и интрамиокардиальных коллатералей у больных ИБС
По данным эпидемиологических исследований, в 2022 году в Российской Федерации от болезней органов кровообращения скончалось около 830 тыс. человек. Примечательно, что на долю смертности от ИБС пришлось 54% вышеупомянутых летальных исходов [1].
Целью лечения ИБС являются улучшение прогноза и обеспечение контроля симптомов. Основные методы лечения ИБС представлены оптимальной медикаментозной терапией и хирургическими вмешательствами — прямой реваскуляризацией посредством операций коронарного шунтирования и эндоваскулярными вмешательства (ЧКВ, чрескожные коронарные вмешательства), обеспечивающими, в той или иной мере, восстановление тока крови по пораженному участку артерии [2]. Каждый из методов обладает рядом преимуществ и недостатков, дополняют, а порой — заменяют друг друга. При этом сравнительные исследования операций коронарного шунтирования (КШ) и ЧКВ обнаруживают некоторое преимущество КШ в уровне выживаемости пациентов, снижении частоты ИМ [3]. Последнее, вероятно, обусловлено тем, что при операциях коронарного шунтирования венозный или артериальный графт обеспе- чивает т. н. «хирургическую коллатерализацию» (surgical collateralization), осуществляя кровоснабжение хронически ишемизированного миокарда и предотвращая новые инфаркты миокарда, которые могут возникнуть в результате других поражений [4].
Следует отметить, что ни один из методов не является исчерпывающим, поскольку, у части пациентов, они применяются с теми или иными ограничениями или не могут быть осуществлены вовсе. Например, у пациентов с диффузным дистальным поражением коронарного русла [5], лимитирующей сопутствующей патологией (например, с сахарным диабетом) [6], а также с хронической окклюзией одной или нескольких коронарных артерий [7].
К тому же, достижение полной реваскуляризации миокарда посредством хирургических вмешательств может оказаться весьма сложной задачей при наличии определенной сопутствующей патологии, особенностей анатомии коронарных артерий, технических проблем и т. д. [8].
Несовершенство современных подходов к лечению в совокупности с широкой распространенностью ИБС привели к активному поиску иных методов реваскуляризации миокарда. Благодаря рутинному выполнению рентгенконтрастных исследований коронарных артерий,

существование сети коллатеральных сосудов в миокарде, на сегодняшний день, не подвергается сомнению. Известно, что хорошо развитая сеть анастомозов в сосудистой сети миокарда оказывает протективное действие и ассоциирована с более низким уровнем смертности от инфаркта миокарда (ИМ) [9].
В данном обзоре будут рассмотрены современные представления о коллатеральном кровоснабжении миокарда, физиологические аспекты процесса регенерации сосудистой сети в организме человека, данные об интра-и экстракардиальных источниках кровотока, существующие подходы к функциональной оценке тех или иных коллатералей, принципы стимуляции непрямой реваскуляризации миокарда (на примере методики ЮрЛеон).
Процессы формирования сосудистой сети: васкулогенез, ангиогенез и артериогенез
В целом, рост и развитие сосудистой сети в организме человека осуществляется посредством трех механизмов: васкулогенеза, ангиогенеза и артериогенеза.
У взрослого человека ведущая роль в процессах восстановления кровеносных сосудов принадлежит ангиогенезу и артериогенезу, изучению которых посвящено большинство экспериментальных исследований в этой области. Несмотря на то, что эти термины часто отождествляют, они представляют собой разные процессы.
Васкулогенез
Васкулогенез — процесс образования сосудов в организме человека de novo, из эндотелиальных клеток-предшественников. Примечательно, что согласно некоторым данным, уже в младенческом возрасте у человека наблюдается сформированная сеть коллатералей в миокарде [10].
По данным ряда исследований, у взрослых пациентов также возможен т. н. «adult angiogenesis» (артериогенез в организме взрослого человека), однако его роль в механизмах компенсации ишемии выяснена не до конца [11].
Ангиогенез
В результате ангиогенеза происходит формирование коллатеральных сосудов из уже существующих капилляров. Увеличение плотности капиллярной сети способствует улучшению перфузии тканей. Этот компенсаторный механизм наблюдается как в физиологических условиях (заживление ран, нормальный рост тканей, овуляция и менструальный цикл и пр.), так и при некоторых патологиях (опухолевый рост, артриты, ретинопатии, воспаление и др.) [12].
Ангиогенез осуществляется посредством двух механизмов: при первом типе ангиогенеза, т. н. спрутинге («sprouting», или разрастание сосудистой сети), эндотелиальные клетки образуют плотные ростки, между которыми располагается просвет будущего сосуда; при втором типе новый сосуд формируется путем возникновения инвагинаций в стенке уже существующего сосуда
(т. н. «intussusceptive angiogenesis», инвагинационный ангиогенез) [13].
Триггером цепочки реакций, посредством которой реализуется ангиогенез, является гипоксия. Именно напряжение кислорода крови является движущей силой, от которой зависит активация каскада необходимыхфакто-ров [14]. Первым звеном реакции является фактор, индуцируемый гипоксией-1 (гипоксией индуцированный фактор, HIV, hypoxia-inducible factor-1) — транскрипционный белок, реагирующий на снижение уровня кислорода в тканях [15; 16]. Далее происходит усиление транскрипции генов сосудистых эндотелиальных факторов роста, в частности, вазоэндотелиального фактора роста-A (сосудистый эндотелиальный фактор роста, VEGF-A, vascular endothelial growth factor A), который, в свою очередь, стимулирует миграцию, пролиферацию эндотелиоцитов и образование новой микрососудистой сети.
Помимо VEGF-A, обнаружен ряд других ангиогенных факторов. У пациентов с заболеваниями периферических артерий (ЗПА), положительное влияние на процессы регенерации сосудистой сети, было отмечено также у FGF (фактор роста фибробластов, fibroblast growth factor), HGF (factorфактор роста гепатоцитов, hepatocyte growth), PDGF (platelet-derived growth factor, тромбоцитарный фактор роста), ангиопоэтина, PROK2 (прокинетин 2) [17].
Артериогенез
Артериогенез — формирование коллатеральных сосудов из предсуществующих, но не функционирующих артериолярных соединений. Происходит ремоделирование уже имеющихся в организме, нативных, коллатералей, которые в физиологических условиях практически не участвуют в кровоснабжении миокарда.
Основными факторами, запускающими процесс арте-риогенеза, являются изменение напряжения сдвига, воспаление и собственно ишемия миокарда. Современные представления о природе указывают на немаловажную роль воспалительного ответа, ведущую роль в котором играют моноциты [18]. Описано также положительное влияние некоторых цитокинов, факторов роста и стволовых клеток [19].
При окклюзии крупного сосуда изменяется градиент давления между пораженной и нормально функционирующими артериями. Это приводит к увеличению кровотока по коллатералям, росту давления в них и изменению напряжения сдвига. Последнее считается ключевым звеном в запуске артериогенеза. Увеличение кровотока обеспечивает усиленную выработку оксида азота, что в свою очередь, приводит к миграции эндотелиальных клеток, и выработке ангиогенных факторов. Дальнейшее перемещение моноцитов и Т-клеток, их адгезия к эндотелию стимулируют синтез протеаз [20]. Под действием этих ферментов происходит деструкция межклеточного вещества, обеспечивающая пространство для роста сосудов. Гладкомышечные клетки трансформируются из контрактильного в пролиферативный фенотип [21]. В результате, происходит рост сосудов в ди-

аметре и протяженности, утолщение их стенок, коллатерали начинают функционировать практически как нормальные сосуды, обеспечивая перфузию тканей, находящихся в зоне ишемии.
По некоторым данным, процесс артериогенеза может приводить к увеличению диаметра того или иного сосуда до 12 раз [22].
Анастомозы, образующиеся во время артериогенеза, на ангиограммах отличаются от обычных сосудов, формируя, в силу особенностей роста, извитые структуры.
Согласно современным представлениям, граница между артериогенезом и ангиогенезом, с точки зрения их роли в регенерации сосудистой сети, проведена весьма условно. Не совсем ясно, чем именно обусловлено образование коллатеральной сети в ответ на ишемию — формированием новых сосудов или ремоделированием уже существующих [23]. Вероятно, оба процесса, в большей мере, дополняют друг друга, нежели заменяют. На данный момент также нет крупных исследований, исключающих рост новых сосудов при развитии коллатерального сосудистого русла.
Коллатеральное кровообращение в миокарде
Механизмы адаптации к изменениям кровотока в миокарде разнообразны и варьируют от быстрых реакций в виде изменения тонуса сосудов до более постепенных процессов, таких ремоделирование (изменение количества сосудов, их диаметра и структуры). И в этой системе, очевидно, происходит активное взаимодействие разных участков сосудистого русла, ведь выпадение из кровотока любого звена, будь то крупные эпикардиальные артерии или сосуды микроциркуляторного русла, неизбежно приведет к нарушению перфузии тканей. И если вопрос тактики лечения при поражениях крупных эпикардиальных артерий, в некоторой мере, был решен посредством внедрения хирургических методик, лечение нарушений микроциркуляции, по сей день, остается довольно сложной задачей [24].
Коллатеральное кровообращение в миокарде является предметом активного изучения еще с середины прошлого столетия [25]. В ходе многочисленных исследований были обнаружены анастомозы между артериями сердца у многих видов животных, в наивысшей степени развития — у морской свинки (коллатеральная сеть миокарда, в данном случае, способна компенсировать обширную ишемию, возникающую при окклюзии главной коронарной артерии). Также коллатерали, в разной степени развитые, были выявлены в миокарде кошек и собак, крыс, свиней, кроликов и др. У человека коллатеральная сеть представляет собой сосуды небольшого диаметра (в среднем, 20–350 нм), соединяющие сегменты одного сосуда или разные сосуды, т. н. «естественные шунты».
Как известно, такого рода компенсаторные механизмы, а именно — наличие внутри- и межсистемных анастомозов в миокарде, улучшают прогноз при ИБС. Например, у пациента с ИБС в анамнезе, при наличии достаточно выраженных коллатералей, последние могут снизить степень ишемического повреждения при инфаркте [26; 27]. Более того, у некоторых пациентов с окклюзией/субокклюзией обеих коронарных артерий, по какой-то причине, не развивались тяжелые симптомы стенокардии. Оказывается, в таких случаях обнаруживается хорошо развитая сеть коллатералей [28]. Следовательно, существуют «запасные» источники кровоснабжения, позволяющие тканям сердца адаптироваться к ишемии, особенно со временем [29; 30].
Отмечается взаимосвязь степени атеросклеротического поражения коронарных артерий и степени развития сосудистых анастомозов в них. Так, прогрессирование стеноза увеличивает развитие коллатеральной сети, и наоборот, регрессирование поражения приводит к уменьшению плотности коллатералей [31].
К факторам, являющимся независимыми детерминантами хорошего коллатерального кровотока, также относят: ЛПНП-С, ЛПВП-С, TNF-α (фактор некроза опухоли, tumor necrosis factor), hs-CRP СРБ высокочувствительный, high sensitivity CRP, hs-CRP) и оксид азота [32], низкую частоту сердечных сокращений и отсутствие артериальной гипертензии в [33].
По данным исследования, проведенного Helfant R.H. с соавт., оценивавшим функциональную значимость коллатеральной сети миокарда, не было обнаружено достоверной разницы в частоте развития инфаркта миокарда у пациентов со стенозирующим поражением коронарного русла и развитыми коллатералями и группы контроля. Вместе с тем, были получены данные о том, что первая группа продемонстрировала более низкий уровень летальности. Было выдвинуто предположение, что не снижая частоту инфаркта, коллатерали способны компенсировать неблагоприятные исходы, связанные с ним.
Высокая степень развития сосудистых анастомозов в миокарде коррелирует с диастолической и систолической функцией левого желудочка, оказывая положительное влияние на размер очага инфаркта и фракцию выброса левого желудочка [34; 35].
Zoll с соавт. провели контрастное исследование 1050 сердец, в результате которого межсистемные анастомозы коронарных артерий были найдены в 95% случаев у пациентов с хронической окклюзией коронарных артерий и в 25% — у пациентов с гипертрофией миокарда и клапанной патологией [36].
Примечательно, что у пациентов с интактными коронарными артериями диаметр сосудистых анастомозов был в несколько раз меньше, чем у пациентов с выраженным атеросклеротическим поражением магистральных ветвей [37], у последних также наблюдалось меньшее количество коллатералей, что объясняется таким процессом как pruning (механизм сокращения, редукции количества сосудов).
Экстракардиальные источники коллатерального кровотока в миокарде
Экстракардиальные источники кровоснабжения миокарда, то есть артерии тканей, окружающих сердце, участвующие в формировании анастомозов с коронарными

артериями, были впервые описаны еще в XIX веке швейцарским анатомом Albrecht von Haller [38].
Однако, подробным изучением морфологии и функции этих анастомозов никто не занимался.
В 1931 году Hudson C.L. в ходе экспериментального исследования на вскрытии ввел в коронарные артерии краситель. Им было отмечено, что, помимо артерий сердца, окрасились также и участки париетального перикарда, сеть сосудов в толще адвентиции аорты и легочного ствола. Эта находка подтолкнула автора на мысль о наличии анастомозов экстракардиальных артерий с артериями сердца [39].
В 1960-х гг. Moberg A. с соавт. провели ряд экспериментов, посвященных изучению анастомозов между экстракардиальными и коронарными артериями. После детального изучения их строения у пациентов разных возрастных групп, коллатерали были обнаружены даже у младенцев. Moberg A. описал сосуды, прорастающие к сердцу от бронхиальных артерий, правой и левой внутренних грудных артерий, средостенных и диафрагмальных артерий, межреберных артерий, пищеводных ветвей аорты (Рис. 1).
Чаще всего коллатерали обнаруживаются в области переходных складок перикарда [25], в местах выхода магистральных сосудов. Очевидно, немаловажную роль играет расположение тех или иных источников кровотока относительно сердца. Причем патология, приводящая к развитию спаечного процесса, облегчает близость перикарда к артериям сердца, что может способствовать формированию сосудистых анастомозов [40].
Наиболее мощными источниками коллатерального кровотока в миокарде являются: бронхиальные артерии, перикардо-диафрагмальная ветвь ВГА, передние средостенные ветви, перикардиальные, межреберные и пищеводные ветви грудной аорты [41].
Bjork L. с соавт., проанализировав 200 коронарографий, отметили, что у пятой части пациентов есть анастомозы между бронхиальными артериями и правопредсердными артериями (бассейн правой коронарной артерии, ПКА). Они имеют небольшой диаметр, а направление тока крови в них зависит от соотношения давления в системе коронарных и бронхиальных артерий, которое может кардинально меняться при различных условиях (например, при аортальном стенозе и хронической обструктивной болезни легких) [42].
Внутренняя грудная артерия сообщается с артериями сердца непосредственно, либо через свою крупную ветвь — перикардо-диафрагмальную артерию [43]. Правая и левая ВГА анастомозируют с бассейнами правой и левой коронарных артерий, соответственно, что подтверждается и экспериментальными исследованиями — при временной окклюзии правой ВГА, кровоток к зоне временной ишемии осуществлялся через ипсилатеральное сообщение с правой коронарной артерией. Аналогичные наблюдения были отмечены и в бассейне левой коронарной артерии (ЛКА) [44].
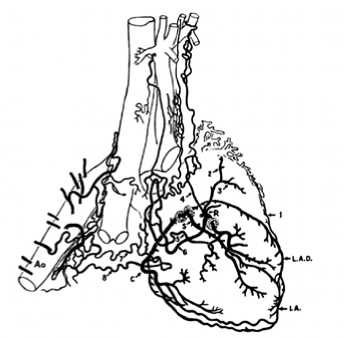
Рис. 1. Топография экстракардиальных источников коллатерального кровотока в миокарде.
Качественная и количественная оценка коллатерального сосудистого русла
Рентгеноконтрастная ангиография коронарных артерий
Традиционным методом оценки коллатералей коронарного русла является коронарография. Существует два основных способа визуализации «естественных шунтов».
Первый — прямое заполнение основной артерии контрастом и визуализация. Второй — окклюзия артерии-реципиента и введение контраста в артерию-донор с дальнейшей оценкой коллатералей. Однако, в силу того, что большинство подобных сосудов имеют диаметр 20–400 нм, а пространственное разрешение даже самых современных цифровых ангиографических систем системы визуализации составляет 0,2 мм и выше, данный метод оценки может применятся с некоторыми ограничениями [45].
На сегодняшний день не существует общепринятой классификации как интракардиальных, так и экс-тракардиальных источников коллатерального кровотока в миокарде.
Классификация Rentrop-Cohen позволяет полуколичественно оценить степень развития интракардиальных анастомозов коронарных артерий, для чего проводится баллонная окклюзия необходимого сегмента, заполнение контрастом контралатеральной артерии и визуализация контрастирования зоны дистальнее окклюзии. Исходя из рентгенографической картины, выделено 4 степени развития коллатералей: 0 — нет заполнения дистального русла; 1 — заполнение дистальной части коронарной через коллатеральные сосуды без визуализации эпикардиального сегмента; 2 — частичное заполнение эпикардиального сегмента через коллатерали; 3 — полное заполнение эпикардиального сегмента артерии [46].
Метод обладает рядом недостатков: достаточно инвазивен, а если не выполняется окклюзия артерии, то обрат-

ное давление крови препятствует полному заполнению коллатералей, что отрицательно сказывается на результате. К тому же, степень заполнения коллатералей, в данном случае, зависит от уровня артериального давления, силы введения контраста, а также длительности съемки [47].
Визуальная оценка экстракардиальных источников является еще менее изученным вопросом. На сегодняшний день, не существует единой объективной методики оценки, что затрудняет объективное описание клинических случаев, а также статистическую обработку полученных данных.
Индекс коллатерального кровотока
Более точным методом оценки значимости коллатеральных сосудов является т. н. индекс коллатерального кровотока (collateral flow index, CFI). Метод может быть выполнен двумя способами: с использованием внутрисосудистого УЗИ или при помощи измерения давления в коронарных артериях.
В первом случае выполняется временная окклюзия коронарной артерии баллоном для чрескожной транслюминальной баллонной ангиопластики, после чего дистальнее проводится измерение скорости кровотока с помощью внутрисосудистого УЗИ-датчика. В таком случае, вычисление индекса (CFIv) проводится по следующей формуле: Vioccl/Vio-occl, где Vioccl (flow velocity time integral) — интеграл от скорости кровотока дистальнее места окклюзии по времени; Vio-occl — то же измерение, но в отсутствие окклюзии. Методика расчета CFI с использованием значений давления внутри коронарных артерий, CFIp, не сильно отличается от CFIv: после 1-минутной окклюзии целевой коронарной артерии, проводятся измерения давления в аорте, давления в коронарной артерии дистальнее окклюзии, центрального венозного давления. Формула для вычисления CFIp: CFIp=(Poccl-CVP)/(Pao-CVP), где CFIp -—индекс коллатерального кровотока, Poccl — давление внутри коронарной артерии дистальнее окклюзии, Pao — среднее давление в аорте, CVP — центральное венозное давление (ЦВД) [44; 47].
Seiler C. с соавт. определили пороговое значение индекса коллатерального кровотока, позволяющее классифицировать пациентов на группы с клинически значимым и недостаточным развитием коронарных коллатералей — 30%. Чувствительность и специфичность такого подхода составляют: 100% и 92% (при определении индекса с помощью Допплер-УЗИ) и 75% и 92% (при измерении интракоронарного давления), соответственно [47].
В исследовании Meier. с соавт., было продемонстрировано, что среди пациентов со слабо развитыми коллатералями коронарных сосудов (о чем свидетельствовал низкий индекс коллатерального кровотока, СFI<0,25 [48]), уровень смертности от всех причин (в том числе, смерть от сердечно-сосудистых причин) превышал таковой в группе пациентов с СFI≥25. Исходя из этого, авторы полагают, что индекс коллатерального кровотока может быть рассмотрен как предиктор неблагоприятного исхода [45].
Методика стимуляции непрямой реваскуляризации миокарда (ЮрЛеон)
В 2007 году академиком Ю.Л. Шевченко, на основании опыта предшественников, экспериментальным путем была разработана авторская методика непрямой реваскуляризации миокарда — «ЮрЛеон I». В ходе многочисленных исследований, в дальнейшем методика была дополнена и усовершенствована и с 2017 года выполняется в окончательной модификации «ЮрЛеон» [49; 50].
Методика ЮрЛеон включает в себя интраоперационный этап с механической обработкой эпикарда и перикарда с целью стимуляции асептического перикардита и послеоперационный этап – введение стерильного дренажного экссудата, содержащего факторы роста сосудов.
ЮрЛеон III состоит из следующих этапов:
-
• Интраоперационный этап. После окончания основного этапа КШ проводится обработка перикарда и эпикарда абразивным материалом — перчаткой или губкой. Перикардиальный жир, ткани инволютивно изменённого тимуса отсепаровывают от перикарда с дальнейщей частичной перикардэктомией над передней и боковой стенками левого желудочка; Липокардиопексия — окутывание сердца подготовленными медиастинальными тканями и фиксация их к эпикарду. В полость перикарда по диафрагмальной поверхности устанавливается тонкий дренаж и подключается к стерильному резервуару с системой активной аспирации.
-
• Послеоперационный этап. Отделяемое, собравшееся по тонкому дренажу за первые сутки после операции (содержащее факторы роста эндотелия сосудов), далее хранится в стерильном резервуаре при температуре +4 °С. На третьи сутки после операции, аспират центрифугируется для отделения разрушившихся форменных элементов крови и в объёме 50 мл вводится обратно через тонкий дренаж, который удаляется тотчас после процедуры. До этого момента все другие дренажи из грудной полости должны быть удалены [51].
При выполнении методики непрямой реваскуляризации миокарда (ЮрЛеон) отмечено формирование коллатералей в значительной мере [28], по сравнению со стандартной операцией АКШ. Отмечен рост экстра-кардиальных источников кровотока из целого ряда сосудистых бассейнов: левая внутренняя грудная артерия (Рис. 2), бронхиальные артерии (Рис. 3), межреберные артерии (Рис. 4) и т. д.
Заключение
Современные методы хирургического лечения ИБС лишь в некоторой мере позволяют замедлить проявление симптомов патологического процесса в коронарных артериях. К тому же существует целая группа пациентов, которым, по тем или иным причинам, не может быть выполнена прямая реваскуляризация, а оптимальная медикаментозная терапия недостаточно эффективна в условиях тяжелого поражения коронарного русла.
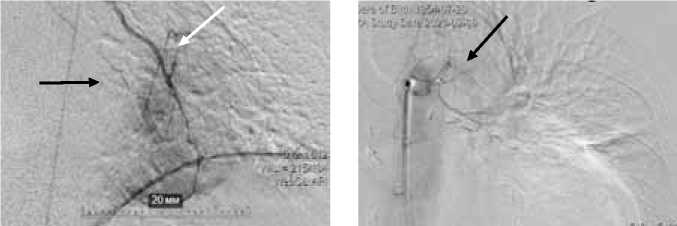
Рис. 3. Экстракардиальные источники коллатерального кровотока из верхней левой бронхиальной артерии (указаны стрелкой).
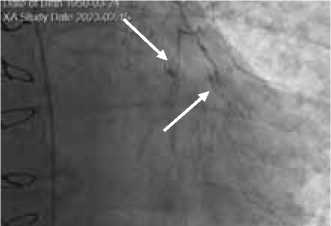
Рис. 4. Экстракардиальные источники коллатерального кровотока из наивысшей межреберной артерии (указаны стрелкой).
Рис. 2. Экстракардиальные источники коллатерального кровотока из левой ВГА (белая стрелка) и левой бронхиальной артерии (черная стрелка).
Хорошо развитая сеть сосудистых коллатералей миокарда способствует более благоприятному течению ишемической болезни сердца и улучшает исходы, как острых, так хронических состояний.Развитие и рост сосудов коллатеральной сети миокарда представляет собой сложный механизм, находящийся под воздействием множества факторов. Изучению его составляющих (артериогенеза, ангиогенеза, образования сосудов de novo) посвящено довольно обширное количество исследований. Несмотря на это, на данный момент, не совсем ясно, какую именно роль играет каждый процесс при формировании коллатеральных сосудов. Лишь глубокое, всестороннее понимание устройства системы компенсаторных механизмов сосудистого русла способно создать фундамент для поиска оптимальных методов непрямой реваскуляризации миокарда, что может стать серьезным подспорьем в профилактике и лечении пациентов с ИБС. В этом отношении, экстракардиальные источники коллатерального кровоснабжения миокарда являются привлекательным и перспективным направлением для исследований.
При выполнении методики непрямой реваскуляризации миокарда (ЮрЛеон) в значительной мере отмечено формирование экстракардиальных источников кровоснабжения миокарда по сравнению со стандартной операцией АКШ. Подобные обнадеживающие результаты наталкивают на мысль о необходимости дальнейшего активного поиска способов оптимизации методики и изучения факторов, поддерживающих рост сосудистых коллатералей.
Смогут ли т. н. «естественные шунты» дополнить, а возможно, и стать достойной заменой хирургическим методам реваскуляризации — главный вопрос, на который предстоит ответить современным экспериментальным исследованиям.
Список литературы О роли экстракардиальной васкуляризации и интрамиокардиальных коллатералей у больных ИБС
- Здравоохранение в России / Под ред. Окладникова С.М., Никитиной С.Ю. — Москва: Росстат, 2023.
- Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020 // Российский кардиологический журнал. – 2020. – №25(11). – С.4076. doi: 10.15829/1560-4071-2020-4076.
- Doenst T, Haverich A, Serruys P, et al. PCI and CABG for Treating Stable Coronary Artery Disease: JACC Review Topic of the Week. J Am Coll Cardiol. 2019; 73(8): 964-976. doi: 10.1016/j.jacc.2018.11.053.
- Doenst T, Sigusch H. Surgical collateralization: The hidden mechanism for improving prognosis in chronic coronary syndromes. J Thorac Cardiovasc Surg. 2022; 163(2): 703-708. e2. doi: 10.1016/j.jtcvs.2020.10.121.
- Stathogiannis K, Fearon WF. Untangling diffuse CAD: Light at the end of the tunnel? Int J Cardiol. 2022; 362: 20-21. doi: 10.1016/ j.ijcard.2022.05.042.
- Armstrong EJ, Rutledge JC, Rogers JH. Coronary artery revascularization in patients with diabetes mellitus. Circulation. 2013; 128(15): 1675-1685. doi: 10.1161/circulationaha.113.002114.
- Muraca I, Carrabba N, Virgili G, et al. Chronic total occlusion revascularization: A complex piece to «complete» the puzzle. World J Cardiol. 2022; 14(1): 13-28. doi: 10.4330/wjc.v14.i1.13.
- Gaba P, Gersh BJ, Ali ZA, Moses JW, Stone GW. Complete versus incomplete coronary revascularization: definitions, assessment and outcomes. Nat Rev Cardiol. 2021; 18(3): 155-168. doi: 10.1038/ s41569-020-00457-5.
- Meier P, Hemingway H, Lansky AJ, Knapp G, Pitt B, Seiler C. The impact of the coronary collateral circulation on mortality: a meta-analysis. Eur Heart J. 2012; 33(5): 614-621. doi: 10.1093/eurheartj/ehr308.
- Moberg A. Anastomoses between extracardiac vessels and coronary arteries. I. Via bronchial arteries. Post-mortem angiographic study in adults and newborn infants. Acta Radiol Diagn (Stockh). 1967; 6(2): 177-192. doi: 10.1177/028418516700600209.
- Tepper OM, Capla JM, Galiano RD, et al. Adult vasculogenesis occurs through in situ recruitment, proliferation, and tubulization of circulating bone marrow-derived cells. Blood. 2005; 105(3): 1068-1077. doi: 10.1182/blood-2004-03-1051.
- Griffioen AW. Angiogenesis. In: Schwab M. Encyclopedia of Cancer. Springer, Berlin, Heidelberg. 2011. doi: 10.1007/978-3-642-16483-5_274.
- Васильев И.С., Васильев С.А., Абушкин И.А. и др. Ангиогенез (литературный обзор) // Человек. Спорт. Медицина. – 2017. – №17(1). – С.36-45. doi: 10.14529/hsm170104.
- Allahwala UK, Khachigian LM, Nour D, et al. Recruitment and maturation of the coronary collateral circulation: Current understanding and perspectives in arteriogenesis. Microvasc Res. 2020; 132: 104058. doi: 10.1016/j.mvr.2020.104058.
- Wang GL, Jiang BH, Rue EA, Semenza GL. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-pas heterodimer regulated by cellular o2 tension. Proc Natl Acad Sci U S A. 1995; 92: 5510-5514
- Шевченко Ю.Л., Борщев Г.Г. Стимуляция ангиогенеза эндогенными факторами роста // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. – 2018. – №13(3). – С.96-102. doi: 10.25881/bpnmsc.2018.73.55.022.
- Cooke JP, Meng S. Vascular Regeneration in Peripheral Artery Disease. Arterioscler Thromb Vasc Biol. 2020; 40(7): 1627-1634. doi: 10.1161/atvbaha.120.312862.
- Liao LS, Bai YP. The dynamics of monocytes in the process of collateralization. Aging Med (Milton). 2019; 2(1): 50-55. doi: 10.1002/agm2.12054.
- Jamaiyar A, Juguilon C, Dong F, et al. Cardioprotection during ischemia by coronary collateral growth. Am J Physiol Heart Circ Physiol. 2019; 316(1): H1-H9. doi: 10.1152/ajpheart.00145.2018.
- Fung E, Helisch A. Macrophages in collateral arteriogenesis. Front Physiol. 2012; 3: 353. doi: 10.3389/fphys.2012.00353.
- Heil M, Eitenmüller I, Schmitz-Rixen T, Schaper W. Arteriogenesis versus angiogenesis: similarities and differences. J Cell Mol Med. 2006; 10(1): 45-55. doi: 10.1111/j.1582-4934.2006.tb00290.x.
- Scholz D, Ito W, Fleming I, Deindl E, Sauer A, Wiesnet M, Busse R, Schaper J, Schaper W. Ultrastructure and molecular histology of rabbit hind-limb collateral artery growth (arteriogenesis). Virchows Arch. 2000; 436: 257-270.
- Merkus D, Muller-Delp J, Heaps CL. Coronary microvascular adaptations distal to epicardial artery stenosis. Am J Physiol Heart Circ Physiol. 2021; 320(6): H2351-H2370. doi: 10.1152/ajpheart.00992.2020.
- Pries AR, Badimon L, Bugiardini R, et al. Coronary vascular regulation, remodelling, and collateralization: mechanisms and clinical implications on behalf of the working group on coronary pathophysiology and microcirculation. Eur Heart J. 2015; 36(45): 3134-3146. doi: 10.1093/eurheartj/ehv100.
- Moberg A. Anastomoses between extracardiac vessels and coronary arteries. I. Via bronchial arteries. Post-mortem angiographic study in adults and newborn infants. Acta Radiol Diagn (Stockh). 1967; 6(2): 177-192. doi: 10.1177/028418516700600209.
- Habib GB, Heibig J, Forman SA, Brown BG, Roberts R, Terrin ML, Bolli R; The TIMI Investigators. Influence of coronary collateral vessels on myocardial infarct size in humans. Results of phase I thrombolysis in myocardial infarction (TIMI) trial. Circulation. 1991; 83: 739-746. doi: 10.1161/01.CIR.83.3.739.
- Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С. Отдаленные результаты коронарного шунтирования, дополненного хирургической стимуляцией экстракардиальной васкуляризации миокарда, у пациентов с диффузным поражением коронарного русла // Комплексные проблемы сердечно-сосудистых заболеваний. – 2023. – №12(1). – С.160-171. doi: 10.17802/2306-1278-2023-12-1-160-171.
- Meier P. The sword of Damocles: an illustrative example of the life-saving effect of the collateral circulation. J Invasive Cardiol. 2011; 23(3): E47-E48.
- Fefer P, Knudtson ML, Cheema AN, et al. Current perspectives on coronary chronic total occlusions: the Canadian Multicenter Chronic Total Occlusions Registry. J Am Coll Cardiol. 2012; 59(11): 991-997. doi: 10.1016/j.jacc.2011.12.007.
- Zoll PM, Wessler S, Schlesinger MJ. Interarterial coronary anastomoses in the human heart, with particular reference to anemia and relative cardiac anoxia. Circulation. 1951; 4(6): 797-815. doi: 10.1161/01.cir.4.6.797.
- Niebauer J, Hambrecht R, Marburger C, et al. Impact of intensive physical exercise and low-fat diet on collateral vessel formation in stable angina pectoris and angiographically confirmed coronary artery disease. Am J Cardiol. 1995; 76(11): 771-775. doi: 10.1016/s0002-9149(99)80224-0.
- Liu L, Gao L, Tan H, et al. Effect of different doses of atorvastatin on collateral formation in coronary artery disease patients with coronary atherosclerosis. Coron Artery Dis. 2022; 33(6): 473-478. doi: 10.1097/MCA.0000000000001148.
- de Marchi SF, Streuli S, Haefeli P, et al. Determinants of prognostically relevant intracoronary electrocardiogram ST-segment shift during coronary balloon occlusion. Am J Cardiol. 2012; 110(9): 1234-1239. doi: 10.1016/ j.amjcard.2012.06.023.
- Werner GS, Ferrari M, Betge S, Gastmann O, Richartz BM, Figulla HR. Collateral function in chronic total coronary occlusions is related to regional myocardial function and duration of occlusion. Circulation. 2001. 104: 2784-2790. doi: 10.1161/hc4801.100352.
- Habib GB, Heibig J, Forman SA, Brown BG, Roberts R, Terrin ML, Bolli R. The TIMI Investigators. Influence of coronary collateral vessels on myocardial infarct size in humans. Results of phase I thrombolysis in myocardial infarction (TIMI) trial. Circulation. 1991. 83: 739-746. doi: 10.1161/01.CIR.83.3.739.
- Zoll PM, Wessler S, Schlesinger MJ. Interarterial coronary anastomoses in the human heart, with particular reference to anemia and relative cardiac anoxia. Circulation. 1951; 4: 797-815. doi: 10.1161/01.CIR.4.6.797.
- Fulton WF. Arterial anastomoses in the coronary circulation. I. Anatomical features in normal and diseased hearts demonstrated by stereoarteriography. Scott Med J. 1963; 8: 420-434. doi: 10.1177/003693306300801102.
- Von Haller A. First Lines of Physiology. 1 st American ed. Troy O.Penniman; 1803.
- Hudson CL, Moritz AR, Wearn JT. The extracardiac anastomoses of the coronary arteries. J Exp Med. 1932; 56(6): 919-925. doi: 10.1084/jem.56.6.919.
- Loukas M, Hanna M, Chen J, Tubbs RS, Anderson RH. Extracardiac coronary arterial anastomoses. Clin Anat. 2011; 24(2): 137-142. doi: 10.1002/ca.21088.
- Picichè M. Noncoronary Collateral Myocardial Blood Flow: The Human Heart’s Forgotten Blood Supply. Open Cardiovasc Med J. 2015; 9: 105-113. doi: 10.2174/1874192401509010105.
- Björk L. Angiographic demonstration of extracardial anastomoses to the coronary arteries. Radiology. 1966; 87(2): 274-277. doi: 10.1148/87.2.274.
- Bigler MR, Seiler C. The Human Coronary Collateral Circulation, Its Extracardiac Anastomoses and Their Therapeutic Promotion. Int J Mol Sci. 2019; 20(15): 3726. doi: 10.3390/ijms20153726.
- Seiler C, Stoller M, Pitt B, Meier P. The human coronary collateral circulation: development and clinical importance. Eur Heart J. 2013; 34(34): 2674-2682. doi: 10.1093/eurheartj/eht195.
- Meier P, Gloekler S, Zbinden R, et al. Beneficial effect of recruitable collaterals: a 10-year follow-up study in patients with stable coronary artery disease undergoing quantitative collateral measurements. Circulation. 2007; 116(9): 975-983. doi: 10.1161/circulationaha.107.703959.
- Rentrop KP, Cohen M, Blanke H, Phillips RA. Changes in collateral channel filling immediately after controlled coronary artery occlusion by an angioplasty balloon in human subjects. J Am Coll Cardiol. 1985; 5(3): 587-592. doi: 10.1016/s0735-1097(85)80380-6.
- Meier P, Schirmer SH, Lansky AJ, Timmis A, Pitt B, Seiler C. The collateral circulation of the heart. BMC Med. 2013; 11: 143. doi: 10.1186/1741-7015-11-143.
- Pohl T, Seiler C, Billinger M, et al. Frequency distribution of collateral flow and factors influencing collateral channel development. Functional collateral channel measurement in 450 patients with coronary artery disease. J Am Coll Cardiol. 2001; 38(7): 1872-1878. doi: 10.1016/ s0735-1097(01)01675-8.
- Шевченко Ю.Л., Зайниддинов Ф.А., Борщев Г.Г. и др. Качество жизни больных ИБС с диффузным поражением коронарного русла в разные сроки после АКШ, дополненного методикой ЮрЛеон // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. – 2021. – №16(4). – С.30-35. doi: 10.25881/20728255_2021_16_4_30.
- Шевченко Ю.Л., Зайниддинов Ф.А., Ульбашев Д.С. Стимуляция экстракардиальной реваскуляризации при коронарном шунтированиии у больных ИБС с диффузным поражением венечного русла // Вестник Авиценны. – 2021. – №23(3). – С.462-472. doi: 10.25005/2074-0581-2021-23-3-462-472.
- Патент на изобретение RU №2758024 С1, 25.10.2021.Заявка №2021105731 от 05.03.2021. Шевченко Ю.Л. Способ индукции экстракардиальной реваскуляризации миокарда у больных ишемической болезнью сердца.


