О роли левосимендана в восстановлении функции гибернированного миокарда у больных ИБС со сниженной контрактильностью сердца при операциях АКШ
Автор: Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Цель исследования: изучить влияние периоперационного применения левосимендана на восстановление жизнеспособного миокарда у больных ИБС со значительно сниженной фракцией выброса левого желудочка при реваскуляризации миокарда.Проведено открытое, проспективное, рандомизированное исследование, включавшее 98 больных. Больные были распределены на две группы. В I группе (n = 55) периоперационно использовали инфузию левосимендана. Введение препарата (нагрузочная доза 12 мкг/кг/мин. в течение 10 мин.) начинали после вводной анестезии и продолжали инфузию на всех этапах операции и в ближайшем послеоперационном периоде. Общее время введения препарата составило 24 часа. Во II группе (n = 43) использовали стандартные препараты для коррекции системы кровообращения. Установлено, что включение левосимендана в комплексную программу кардиопротекции вызывало более быстрое восстановление гибернированного миокарда. Такое предположение основано на том, что у больных I группы использование левосимендана приводило к уменьшению объема гибернации после операции, в сравнении с дооперационным уровнем, на 42%. При этом, во II группе больных, оперированных без использования препарата, процент сокращения объема жизнеспособного миокарда составил 13%. Кроме того, обнаружена отчетливая зависимость состояния насосной функции сердца от гемодинамических влияний левосимендана. Так, у больных I группы выявлено увеличение сердечного индекса с 2,23±0,49 до 2,96±0,52 л./мин./м2 (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ибс, левосимендан, гибернированный миокард, реперфузия, кардиопротекция, реваскуляризация миокарда
Короткий адрес: https://sciup.org/140307876
IDR: 140307876 | DOI: 10.25881/20728255_2024_19_3_19
Текст научной статьи О роли левосимендана в восстановлении функции гибернированного миокарда у больных ИБС со сниженной контрактильностью сердца при операциях АКШ
Успешное развитие кардиохирургии позволило улучшить результаты лечения больных, несмотря на увеличение объемов и сложности вмешательств. На сегодня
ON THE ROLE OF LEVOSIMENDAN IN RESTORING THE FUNCTION OF HIBERNATED MYOCARDIUM IN PATIENTS WITH CORONARY ARTERY DISEASE WITH REDUCED CARDIAC CONTRACTILITY DURING CABG OPERATIONS
Shevchenko Yu.L., Stepanova A.S.*, Gorokhovatsky Yu.I., Vakhromeeva M.N.
St. George thoracic and cardiovascular surgery clinic Pirogov National Medical and Surgical Center, Moscow
в отдельных группах больных летальность составляет 1–3% [1–4]. Однако, несмотря на успехи, нельзя не признать существование серьезных проблем. В настоящее время по-прежнему высока частота послеоперационных

Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ осложнений, достигающая 20–30% [6–10]. Такое положение обусловлено ростом числа оперируемых пожилого и старческого возраста с коморбидностью и больных с ишемической дисфункцией миокарда [2; 5; 6; 8].
Операция реваскуляризации миокарда играет важную роль в лечении больных ИБС с поражением крупных коронарных артерий и нарушением контрактильности сердца [11]. Реваскуляризация дисфункционального, но жизнеспособного миокарда, может улучшить региональную и общую систолическую функцию сердца. Такое улучшение контрактильности миокарда было продемонстрировано в многочисленных одноцентровых нерандомизированных исследованиях и впоследствии подтверждено в ходе 10-летнего наблюдения в рандомизированном многоцентровом исследовании STICH [12–14].
Помимо непосредственного влияния на функциональное состояние сердца, реваскуляризация, проводимая на основе оценки жизнеспособности миокарда, может улучшить результаты лечения рассматриваемой категории больных [15–18]. Однако, эти результаты не были подтверждены в трех проспективных рандомизированных исследованиях [14; 19; 20]. В свете этих исследований, согласно текущим рекомендациям, рутинное тестирование жизнеспособности миокарда для выбора метода реваскуляризации у пациентов с сердечной недостаточностью не рекомендовано [17; 22]. Тем не менее, остаются серьезные споры о том, как следует интерпретировать эти результаты, а оценка жизнеспособности миокарда, по-прежнему, широко используется в клинической практике [23–27].
Таким образом, расхождения в приведенных данных свидетельствуют о необходимости дальнейшего исследования роли угнетенного, но жизнеспособного миокарда в улучшении функции сердца и клинического статуса больного после операций коронарного шунтирования.
В то же время, при изучении динамики сердечного выброса после операций реваскуляризации миокарда, у многих больных выявлено резкое ослабление систолической функции левого желудочка, возникшее несмотря на улучшение коронарного кровотока.
Интраоперационное повреждение миокарда относят к наиболее опасным и часто встречающимся осложнениям у кардиохирургических больных. Согласно статистическим данным, угнетение контрактильности миокарда сразу или в ближайшие часы после операций на сердце развивается у 20% больных [28].
Установлено, что острая сердечная недостаточность служит предиктором развития органной дисфункции и летальности у кардиохирургических больных [2; 4]. Так, у пациентов с синдромом низкого сердечного выброса летальность превышает 20% [2]. Принято считать, что основным фактором риска развития синдрома малого сердечного выброса служит предоперационное снижение функции левого желудочка [29; 30].
В основе снижения сократительных свойств миокарда при проведении кардиохирургических операций лежат процессы, связанные с ишемией и реперфузией сердца.
Реперфузия миокарда может приводить к различным и взаимосвязанным состояниям: 1 – оглушению миокарда (stunning); 2 – «феномену не восстановленного кровотока» (no-rellow); 3 – летальной реперфузии с некрозом миокарда (инфаркту миокарда); 4 – реперфузионным аритмиям. [31–33]. Результаты проведенных клинических исследований свидетельствуют, что в профилактике гипоксических повреждений миокарда во время операции, наряду с усовершенствованием методов общей анестезии и хирургической техники, ведущая роль принадлежит фармакологической цитопротекции [32–35].
В последние два десятилетия увеличилось количество работ, подтверждающих кардиопротекционный эффект левосимендана [36; 37]. Левосимендан обладает тройным механизмом действия, включая кальцийзависимое связывание с тропонином С миокарда (инотропный эффект), открытие КАТФ-каналов в гладкомышечных клетках сосудов (вазодилатация) и открытие КАТФ-каналов в митохондриях (кардиопротекция) [4; 5; 38].
В ранних исследованиях было продемонстрировано снижение летальности и частоты острой сердечной недостаточности при дооперационном и периоперационном введении препарата у больных со сниженной функцией левого желудочка [39–41]. Три крупных рандомизированных исследования, однако, не продемонстрировали снижения частоты развития синдрома низкого сердечного выброса и смертности в смешанной популяции после коронарного шунтирования, клапанной и комбинированной хирургии у больных с дисфункцией левого желудочка [42–44]. В свете изложенных доказательств в 2017 году в международном консенсусном документе был сделан вывод о том, что левосимендан не может быть рекомендован в качестве рутинного лечения в кардиохирургии [45].
В отличие от этого, в немецких рекомендациях 2018 года по терапии в отделениях интенсивной терапии после кардиохирургических операций рекомендовано применение левосимендана для коррекции сердечного выброса у больных с тяжелыми нарушениями контрактильности миокарда [46]. Кроме того, ретроспективный анализ данных исследования LEVO-CTS показал, что у пациентов с изолированным коронарным шунтированием летальность была ниже в группе левосимендана [41; 45]. Считается, что наличие серьезных ограничений в имеющихся исследованиях LICORN, CHEETAH, LEVO-CTS, позволяет ожидать положительного влияния препарата на результаты лечения кардиохирургических больных [41].
Есть основание полагать, что левосимендан может оказывать существенное влияние на процессы, связанные с реперфузией гибернированного миокарда. Так, при изучении механизмов постинфарктного ремоделирования миокарда было установлено, что в зоне ишемического повреждения образуется микст из гибернированного и оглушенного миокарда, определяющий условие для восстановления сократимости после успешной реваскуляризации [47]. Таким образом, влияние левосимендана на коронарное кровообращение и антистаннинг-эффект

Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ могут ускорить процесс восстановления гиберниро-ванного миокарда при адекватной реваскуляризации сердца.
Важно подчеркнуть, что на сегодня в литературе нет убедительных материалов, отражающих динамику гибер-нированного миокарда на фоне введения левосимендана у больных ИБС со сниженной фракцией выброса ЛЖ при операциях коронарного шунтирования.
Цель исследования – изучить влияние периопера-ционного применения левосимендана на восстановление жизнеспособного миокарда у больных ИБС со значительно сниженной фракцией выброса левого желудочка при реваскуляризации миокарда.
Материалы и методы
Выполнено открытое, проспективное, рандомизированное исследование. Для рандомизации использовали метод случайных чисел. Было включено 98 пациентов с ИБС, которым была проведена операция АКШ, дополненная методикой стимуляции экстракардиальной васкуляризации миокарда «ЮрЛеон» в Клинике грудной и сердечно-сосудистой хирургии им. Св. Георгия ФГБУ НМХЦ им. Н.И. Пирогова в период с 2021 по 2023 гг.
Все пациенты были с многососудистым диффузным гемодинамически значимым поражением коронарных артерий, клиническими проявлениями стенокардии напряжения III-IV ФК, резистентные к традиционной медикаментозной терапии, наличием постинфарктного кардиосклероза, фракцией выброса ЛЖ≤50% (по результатам ЭХО-КГ) и наличием зоны гибернированного миокарда не менее 15 % (по данным сцинтиграфии миокарда (синхро-ОФЭКТ)). Возраст больных колебался от 46 лет до 71 года, из них 92 (93,9%) – мужчины и 6 (6,1%) – женщин. Критерии не включения пациентов в исследование были следующие: выраженные почечная и печёночная недостаточность, наличие тромбоза полостей сердца, гемодинамически значимая патология клапанного аппарата сердца, наличие онкологических заболеваний.
На этапе госпитализации всем пациентам, соответствующим критериям включения, было предложено участие в исследовании. Согласие пациента на включение в исследование и обработку данных было подтверждено письменно. Исследование одобрено локальным этическим комитетом ФГБУ НМХЦ им. Н.И. Пирогова.
Перед оперативным вмешательством пациентам было выполнено полное обследование с целью предоперационной оценки дисфункции миокарда методом ЭКГ, ЭХО-КГ и сцинтиграфии миокарда. Перед выпиской из стационара эти же исследования выполнялись повторно. В качестве первичной конечной точки выбрали уровень объема гибернированного миокарда на 7 сутки после операции. К вторичным конечным точкам отнесли сердечный индекс (СИ), минутный объем крови (МОК), фракция выброса левого желудочка (ФВ ЛЖ), давление заклинивания клапана легочной артерии (ДЗЛК) и концентрацию тропонина I в первые сутки после операции.
Всем больным выполняли операцию АКШ в условиях ИК и холодовой кровяной кардиоплегии по методике Калафиори. Общая анестезия была многокомпонентной с применением ингаляционных анестетиков севофлурана (0,7–1,2 МАК) и десфлурана (0,5–0,7 МАК). Основным компонентом был фентанил (общая доза 15–20 мкг/кг). Миорелаксацию достигали введением рокурония бромида. ИК проводили аппаратом с роликовым насосом и пузырьковым оксигенатором. Во всех случаях осуществляли гипертермическую перфузию со снижением температуры тела до 34 °С.
У всех пациентов с многососудистым диффузным поражением коронарных артерий при выполнении операции АКШ в нашей клинике используется метод стимуляции экстракардиального неоангиогенеза – ЮрЛеон, предложенный академиком Ю.Л. Шевченко. Однако, сама методика никак не влияет на функцию миокарда в ближайшем послеоперационном периоде. Ее эффект ожидается только спустя 1,5–2 месяца после выполненной операции, когда сформируется экстракардиальная васкуляризация сердца.
Больные были распределены на две группы: первую группу сформировали 55 (56,2%) пациентов, которым было выполнено АКШ с использованием левосимендана; вторая группа включала 43 (43,8%) пациента, которым была проведена операция АКШ без применения левосимендана.
Пациенты обеих групп статистически не отличались по возрасту, дооперационной ФВ ЛЖ, длительности ИК, времени пережатия аорты и длительности ИВЛ.
У больных первой группы использовали инфузию левосимендана. До начала ИК внутривенно вводили нагрузочную дозу препарата 12 мкг/кг в течение 10 минут. В последующем осуществляли непрерывную инфузию поддерживающей дозы левосимендана в течение 24 часов со скоростью 0,1 мкг/мин.
Была выполнена оценка динамики восстановления гибернированного миокарда в послеоперационном периоде. Анализ показателей синхро-ОФЭКТ с выявлением зон дефекта перфузии, нарушения регионального систолического утолщения и процентного содержания жизнеспособного миокарда проводился до операции и на 7–10 сутки после выполненной операции.
Табл. 1. Клинические характеристики групп больных (М± σ )
|
Показатель |
1 группа (n = 55) |
2 группа (n = 43) |
|
Пол: женщины мужчины |
9,1% 90,9% |
4,7% 95,3% |
|
Возраст, лет |
59,36±8,04 |
59,66±7,97 |
|
ФВ ЛЖ до операции, % |
40,1±5,2 |
40,5±5,8 |
|
Объем гибернации, % |
38,1±13,3 * |
30,1±10,1 |
|
Количество шунтов |
2,5±1,01 |
2,3±1,1 |
|
Длительность ИК, мин. |
106,9±51,7 |
105,8±53,1 |
|
Время пережатия Ао, мин. |
44,4±20,4 |
45,1±19,7 |
|
Длительность ИВЛ, час. |
16,8±13,9 |
16,7±12,6 |
Примечание :* – р<0,05 при сравнении между группами.
Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ
Табл. 2. Изменение показателей центральной гемодинамики в периоперационном периоде (M± σ )
|
Показатель |
I группа (n = 55) |
II группа (n = 43) |
||||
|
После вводной анестезии |
После завершения ИК |
В 8 часов следующего дня п/о |
После вводной анестезии |
После завершения ИК |
В 8 часов следующего дня п/о |
|
|
СИ, л./мин./м2 |
2,23±0,4* |
3,01±0,7* |
2,96±0,5* |
2,27±0,5 |
2,26±0,4 |
2,11±0,4** |
|
МОК, л./мин. |
4,51±0,9* |
6,12±1,4* |
6,04±1,1* |
4,51±1,2 |
4,53±0,9 |
4,26±1,02** |
|
ДЗЛК, мм рт. ст. |
13,3±4,6* |
11,6±3,6* |
9,8±3,07* |
13,4±4,5* |
11,7±4,05 |
11,6±4,1*/** |
|
ЧСС, уд./мин. |
68±16,1* |
75,8±11,6* |
81,3±16,9* |
70,7±14,7* |
74,03±17,4* |
74,5±13,2** |
|
АД ср., мм рт. ст. |
77,9±17,7* |
66,96±11,9* |
72,8±17,8* |
75,4±13,03 |
70,2±12,7 |
70,7±15,5** |
Примечание : * – р<0,05 при сравнении внутри группы (Т-критерий Стьюдента); ** – р<0,05 при сравнении между группами (U-критерий Манна-Уитни).
Исследование параметров центральной гемодинамики проводилось с использованием методики термодилюции. Всем пациентам после вводной анестезии в легочную артерию устанавливали катетер Сван-Ганса 7F («В. Braun», Германия). Интраоперационно и в первые сутки послеоперационного периода оценивали следующие показатели центральной гемодинамики: среднее артериальное давление (АД ср.), частота сердечных сокращений (ЧСС), МОК, СИ и ДЗЛК. Показатели фиксировали с помощью компьютерной программы мониторинговой системы GE Healthcare (Финляндия). Контроль выполненных измерений был на следующих этапах: 1 – после вводной анестезии; 2 – после завершения ИК; 3 – в 8 часов следующего дня после операции.
В первые сутки после операции и перед выпиской пациента из стационара исследовали данные ЭХО-КГ. При этом оценивали конечный диастолический объем (КДО), конечный систолический объем (КСО), ФВ ЛЖ и ударный объем (УО), оценивали регионарную и глобальную систолическую функцию ЛЖ.
В качестве маркера повреждения миокарда определяли концентрацию тропонина I. Забор крови осуществляли на следующих этапах: 1 – в первые сутки после операции; 2 – во вторые сутки после операции; 3 – в третьи сутки после операции.
При помощи методов описательной статистики были определены средние значения исследуемых показателей, проведено их сравнение. Статистическая обработка результатов проводилась с использованием компьютерной программы «Statistica 10». Нормальность распределения оценивалась с помощью критерия Шапиро-Уилка. Исходя из этого, при сравнении средних значений для нормально распределенных величин и медиан данных 2-х групп использовался Т-критерий Стьюдента. Учитывая отличное от нормального распределения количественных показателей, их анализ выполнялся с помощью непараметрического U-критерия Манна-Уитни. Результаты исследования представлены как среднее арифметическое (±) и стандартное отклонение (M± σ ). За критический уровень значимости (p) при проверке гипотез было принято значение 0,05.
Результаты и их обсуждение
Полученные данные показали, что в условиях периоперационной инфузии левосимендана объем гиберниро-
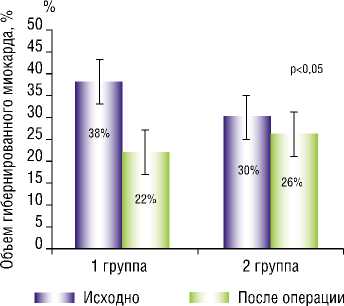
Рис. 1. Динамика объема гибернированного миокарда в раннем послеоперационном периоде.
ванного миокарда после коронарного шунтирования снизился на 42%. Во второй группе больных, оперированных без использования препарата, процент уменьшения объема жизнеспособного миокарда составил 13% (Рис. 1).
Объяснение выявленных фактов представляет довольно сложную задачу. Прежде всего это относится к оценке роли гемодинамических эффектов левосимендана в судьбе жизнеспособного миокарда.
В ходе исследования установлено, что на фоне введения препарата и в ближайший период после операции отмечено увеличение СИ и МОК. Кроме того, в группе терапии левосименданом наблюдалось значимое снижение ДЗЛК (Табл. 2). Тогда как во второй группе, без применения препарата, различия между показателями центральной гемодинамики на этапах операции отсутствовали (Табл. 2).
У больных I группы по результатам ЭХО-КГ была отмечена положительная динамика сократимости миокарда после хирургического вмешательства, по сравнению с дооперационным состоянием. Это нашло выражение в увеличении ФВ ЛЖ и УО, а также в уменьшении КДО и КСО. У больных II группы динамики функциональных и объемных показателей не обнаружено. Определенное влияние на динамику объемных показателей оказывали изменения пред- и постнагрузки, развившиеся вследствие действия препарата (Табл. 3).
Наши данные совпадают с имеющимися исследованиями о влиянии левосимендана на систему кровоо-
Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ
Табл. 3. Динамика фракции выброса, ударного объема и объемных показателей ЛЖ
|
Показатель |
I группа (n = 55) |
II группа (n = 43) |
||||
|
До операции |
В 8 часов следующего дня п/о |
7 сутки п/о |
Исходно до операции |
В 8 часов следующего дня п/о |
7 сутки п/о |
|
|
ФВ ЛЖ, % |
40,1±5,2* |
46±6,4* |
48,9±8,7* |
40,5±5,8 |
43,4±5,6 |
42,9±7,2** |
|
УО, мл |
61,6±20,3 |
68,5±12,6* |
71,9±11,3* |
64,1±13,5** |
62,5±12,6** |
59,4±13,2** |
|
КДО, мл |
166,4±47,9* |
152,8±36,9* |
153,03±33* |
145,7±32,9** |
142,8±30,6 |
149,1±34,9 |
|
КСО, мл |
97,05±36,5* |
84±28,5* |
81,05±30,2* |
86,2±24,1 |
80,1±22,6 |
84,7±27,2 |
Примечание : * – р<0,05 при сравнении внутри группы (Т-критерий Стьюдента); ** – р<0,05 при сравнении между группами (U-критерий Манна-Уитни).
бращения. Левосимендан – положительный инотропный агонист, обладающий сосудорасширяющими свойствами, также называемый инодилятатором [4; 5; 32]. С одной стороны, он повышает чувствительность тропонина С к кальцию в клетках миокарда, что приводит к инотропии без влияния на потребление кислорода. С другой стороны, препарат открывает КАТФ-каналы в гладкомышечных клетках, что вызывает расширение сосудов.
Кроме того, инфузия левосимендана приводит к увеличению коронарного кровотока у пациентов, перенесших операцию АКШ, и улучшает перфузию миокарда у больных с хронической сердечной недостаточностью [5; 48]. Считается, что возрастание кровоснабжения миокарда под влиянием препарата обусловлено как открытием КАТФ- каналов, так и улучшением функции эндотелия за счет увеличения продукции NO [48].
Известно, что гибернация представляет собой защитное состояние подавления контрактильности миокарда пропорционально снижению кровотока [25; 49]. Важно отметить, что дисфункция кардиомиоцитов в гибернированном миокарде обратима при реваскуляризации миокарда. В соответствии со сложившимся представлением, диагностику жизнеспособного миокарда в зоне ишемического поражения после реперфузии относят к важным прогностическим критериям развития ремоделирования и сердечной недостаточности [47; 50].
На основании этих представлений можно считать, что у больных первой группы на фоне введения левосимендана реализация инотропного резерва гибернированного миокарда и улучшение кровоснабжения в зоне реваскуляризации способствовали ускоренному восстановлению контрактильности жизнеспособного миокарда.
Помимо отмеченных изменений, у больных первой группы в сравнении с больными второй группы, в раннем послеоперационном периоде был более низкий уровень тропонина I (I группа 2,78±2,31нг./мл, II группа 3,45±4,9 нг./мл, р<0,05). Сравнительный анализ динамики тропонина I у наших больных соответствует известному представлению о кардиопротекторных свойствах левосимендана, реализуемых через клеточные механизмы прекондиционирования и посткондиционирования [47; 32].
Прекондиционирование – это термин, который используют для характеристики толерантности клетки к воздействию повреждающих факторов в результате предварительного влияния на клетку стрессогенных стимулов. Применительно к миокарду, ишемическое прекондициони- рование характеризует адаптационный ответ на короткий эпизод ишемии/реперфузии, формирующий парадоксальную устойчивость миокарда к последующей длительной ишемии. Левосимендан относят к группе препаратов, оказывающих «подобное ишемическому прекондиционированию» действие. Этот эффект принято обозначать термином фармакологическое прекондиционирование [51; 52].
Как и при ишемическом прекондиционировании, в условиях фармакологического прекондиционирования левосименданом результатом действия различных внутриклеточных медиаторов служит открытие митохондриальных КАТФ-каналов. АТФ-зависимые калиевые каналы играют роль важного медиатора и/или исполнительного звена кардиопротекции. Активация КАТФ-каналов блокирует открытие неспецифической митохондриальной поры (мРТР), предотвращает апоптоз и/или некроз путем сохранения нуклеотидов и высокоэнергетических фосфатов во время ишемии/реперфузии [1].
Наряду с сохранением структуры и функции митохондрий, антистаннинг эффект препарата связывают с активацией синтеза NO и участием сигнального пути фосфатидилинозитол-3-киназы (PI3K) [48]. Благоприятное влияние кондиционирования миокарда левосименданом было выявлено при операциях коронарного шунтирования с ИК у больных с дисфункцией миокарда левого желудочка и при реваскуляризации миокарда у пациентов с острым коронарным синдромом [51–53].
Современные преставления о механизмах развития гибернированного миокарда особую роль отводят оглушенному миокарду. Считается, что повторяющиеся эпизоды оглушения приводят к гибернации миокарда. Согласно этой теории гибернации, ключевое звено патогенеза заключается в недостаточном резерве коронарного кровотока. При этом, предполагается, что в состоянии покоя кровоток остается нормальным. Однако, коронарные артерии не могут приспособиться к увеличению потребности миокарда в кислороде. В результате, повторяющиеся эпизоды дисбаланса между потребностью в кислороде и его транспортом приводят к снижению контрактильности миокарда и адаптации метаболизма с целью предупреждения ишемического повреждения [50].
Следует подчеркнуть, также, что реваскуляризация может не привести к немедленному восстановлению функции. Было установлено, что клетки миокарда могут пройти фазу оглушения и может потребоваться значительное время для восстановления их сократительного аппарата [48].
Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ
Таким образом, анализ динамики концентрации тропонина I и увеличение ФВ у больных I группы свидетельствовал о реализации механизмов фармакологического кондиционирования миокарда со снижением зон оглушенного миокарда. В связи с вышеизложенными данными имеются все основания полагать, что у больных I группы уменьшение объема гибернированного миокарда частично было обусловлено кардиопротекторным действием левосимендана.
Обращал на себя внимание тот факт, что до операции у больных I группы объем гибернированного миокарда был достоверно большим, чем у больных II группы (I группа – 38%, II группа – 30%, (p<0,05). Следует отметить, что накопленные в настоящее время данные свидетельствуют о важности тестирования жизнеспособности миокарда перед выполнением операции по реваскуляризации миокарда. Было показано, что пациенты с большим количеством гибернированного миокарда имели лучшие клинические исходы после хирургической коррекции коронарного кровотока [54; 55].
Наши данные свидетельствуют, что улучшение функции левого желудочка после АКШ у больных I группы в значимой мере было обусловлено и большим объемом жизнеспособного миокарда до операции.
С целью изучения возможного влияния дополнительных факторов на состояние гибернированного миокарда в условиях инфузии левосимендана больные I группы были распределены на две подгруппы. В подгруппу «А» (n = 43) включены больные с увеличением ФВ ЛЖ после операции. У 12 больных (подгруппа «Б») после операции не выявлено достоверных изменений ФВ ЛЖ.
Больные подгруппы «А» отличались положительной динамикой восстановления жизнеспособности миокарда и более низкой концентрацией тропонина I после операции. Таким образом, восстановление контрактильности сердца было связано с реализацией антистаннинг эффекта левосимендана. Мы полагаем, что меньшая степень повреждения миокарда у больных подгруппы «А» была обусловлена лучшей реализацией фармакологического посткондиционирования при более полном коронарном кровотоке в период реперфузии, хотя мы последний и не изучали.
Мы использовали косвенные признаки, отражающие состояние коронарного кровоснабжения после реваскуляризации. С этой целью изучали частоту применения внутренней грудной артерии. У больных подгруппы «А» частота шунтирования коронарных артерий с использованием внутренней грудной артерии составила 77%, а у больных подгруппы «Б» – 45%. Следствием этого могло быть улучшение микроциркуляции в зоне большего объема гибернации у больных подгруппы «А» [56–59] .
По всей видимости, реализация клеточных механизмов фармакологического пре- и посткондиционирования миокарда полностью зависит от способности сердца к восстановлению его функционального состояния.
Табл. 4. Клинические характеристики подгрупп больных (Ме 25%; 75%)
|
Показатель |
Подгруппа «А» (n = 43) |
Подгруппа «Б» (n = 12) |
р* |
|
Объем гибернированного миокарда до операции, % |
35 (35; 45) |
35 (27,5; 38) |
>0,05 |
|
Объем гибернированного миокарда после операции, % |
22 (10; 25,5) |
30 (26; 36,5) |
<0,05 |
|
ФВ ЛЖ до операции, % |
43 (40; 48) |
38 (34,5; 43,5) |
>0,05 |
|
ФВ ЛЖ в 1 сутки после операции, % |
53 (50; 59) |
39 (35,3; 41) |
<0,05 |
|
Тропонин I в 1 сутки после операции, нг/мл |
1,46(1,1; 2,0) |
5,8 (4,34; 6,48) |
<0,05 |
Примечание : * – р<0,05 при сравнении между подгруппами (U-критерий Манна-Уитни).
Такая трактовка обнаруженных изменений совпадает с имеющимися в литературе знаниями о том, что помимо простой реваскуляризации миокарда возможно фармакологическое воздействие, направленное на восстановление жизнеспособного миокарда и улучшение коронарной перфузии [60–63].
Заключение
Приведенные данные свидетельствуют, что восстановление функции жизнеспособного миокарда в определенной степени связано с реализацией механизмов фармакологического кондиционирования миокарда. Следует полагать, что более значимое улучшение контрактильности сердца после операции на фоне инфузии левосимендана, происходит при большем объеме гибернации и более полноценной реперфузии после АКШ.
Применение левосимендана при операциях АКШ у больных ИБС со сниженной контрактильностью ЛЖ оказывает благоприятное влияние на систему венечной перфузии. Использование препарата вызывает увеличение СИ с 2,23 до 2,96 л/мин./м2 (р<0,05), рост МОК с 4,51 до 6,04 л/мин. (р<0,05), снижение ДЗЛК с 13,3 до 9,8 мм рт. ст. (р<0,05) и увеличение ФВ ЛЖ с 40% до 49% (р<0,05).
Кардиопротекторные и гемодинамические эффекты левосимендана способствуют более быстрому восстановлению жизнеспособного миокарда. Об этом достоверно свидетельствует уменьшение объема гибернированного миокарда с 38% до 22% на 5–7 сутки после операции у больных I группы.
Наши результаты коррелируют с данными мировой литературы, демонстрируя эффективность левосимендана, который способствует улучшению гемодинамических показателей в интраоперационном и раннем послеоперационном периодах, тем самым позволяет преодолеть повреждающее действие реперфузии, ишемического повреждения, а также снизить вероятность станнинга кардиомиоцитов и способствовать кардиопротекции на время непосредственно операционного периода и в самом ближайшем послеоперационном периоде госпитального этапа.
Шевченко Ю.Л., Степанова А.С., Гороховатский Ю.И., Вахромеева М.Н.
О РОЛИ ЛЕВОСИМЕНДАНА В ВОССТАНОВЛЕНИИ ФУНКЦИИ ГИБЕРНИРОВАННОГО МИОКАРДА У БОЛЬНЫХ ИБС СО СНИЖЕННОЙ КОНТРАКТИЛЬНОСТЬЮ СЕРДЦА ПРИ ОПЕРАЦИЯХ АКШ
Особенно это важно в группе пациентов со значительно сниженной контрактильностью миокарда, которым коронарное шунтирование дополняется методикой стимуляции экстракардиальной васкуляризации миокарда (ЮрЛеон) с целью обеспечения комплексной реваскуляризации сердца в ближайшие 1,5–2 месяца после операции. Однако, в данной группе пациентов наше исследование продолжается.
Список литературы О роли левосимендана в восстановлении функции гибернированного миокарда у больных ИБС со сниженной контрактильностью сердца при операциях АКШ
- Kunst G, Klein AA. Peri-operative anaesthetic myocardial preconditioning and protection – cellular mechanisms and clinical relevance in cardiac anaesthesia. Anaesthesia. 2015; 70(4): 467-482. doi: 10.1111/anae.12975.
- Lomivorotov VV, Efremov SM, Kirov MY. Low-Cardiac-Output syndrome after cardiac surgery. J Cardiothorac Vasc Anesth. 2017; 31(1): 291-308. doi: 10.1053/j.jvca.2016.05.029.
- Bridgewater B. Adult Cardiac Surgeons of North West England. Mortality data in adult cardiac surgery for named surgeons: retrospective examination of prospectively collected data on coronary artery surgery and aortic valve replacement. BMJ. 2005; 330(7490): 506-510. doi: 10.1136/bmj. 330.7490.506.
- Ломиворотов В.В., Еременко А.А., Бобошко В.А. и др. Периоперационное использование левосимендана в кардиохирургии // Патология кровообращения и кардиохирургия. – 2015. – Т.19. – № 2. – С.113-123. doi: 10.21688/1681-3472-2015-2-113-123.
- Бобошко В.А., Зибарева Е.И., Ломиворотов В.В. Современные и потенциальные возможности применения левосимендана в лечении сердечной недостаточности и септического шока: обзор литературы // Вестник интенсивной терапии им. А.И. Салтанова. – 2023. – №3. – С.122-136. doi: 10.21320/1818-474X-2023-3-122-136.
- Kunst G. From coronary steal to myocardial, renal, and cerebral protection: more questions than answers in anaesthetic preconditioning? Br J Anaesth. 2014; 112(6): 958-960. doi: 10.1093/bja/aeu007.
- Lomivorotov VV, Efremov SM, Pokushalov EA, et al. Randomized trial of fish oil infusion to prevent atrial fibrillation after cardiac surgery: data from an implantable continuous cardiac monitor. J Cardiothorac Vasc Anesth. 2014; 28(5): 1278-1284. doi: 10.1053/j.jvca.2014.02.019.
- Mebazaa A, Pitsis AA, Rudiger A, et al. Clinical review: practical recommendations on the management of perioperative heart failure in cardiac surgery. Crit Care. 2010; 14(2): 201. doi: 10.1186/cc8153.
- Laffey JG, Boylan JF, Cheng DC. The systemic inflammatory response to cardiac surgery: implications for the anesthesiologist. Anesthesiology. 2002; 97(1): 215-252. doi: 10.1097/00000542-200207000-00030.
- Chen JC, Kaul P, Levy JH, et al. Myocardial infarction following coronary artery bypass graft surgery increases healthcare resource utilization. Crit Care Med. 2007; 35(5): 1296-1301. doi: 10.1097/01.CCM.0000262403. 08546.A2.
- Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization [published correction appears in Eur Heart J. 2019; 40(37): 3096. doi: 10.1093/eurheartj/ehz507]. Eur Heart J. 2019; 40(2): 87-165. doi: 10.1093/eurheartj/ehy394.
- Bax JJ, Poldermans D, Elhendy A, et al. Sensitivity, specificity, and predictive accuracies of various noninvasive techniques for detecting hibernating myocardium. Curr Probl Cardiol. 2001; 26(2): 147-186. doi: 10.1067/ mcd.2001.109973.
- Romero J, Xue X, Gonzalez W, Garcia MJ. CMR imaging assessing viability in patients with chronic ventricular dysfunction due to coronary artery disease: a meta-analysis of prospective trials. JACC Cardiovasc Imaging. 2012; 5(5): 494-508. doi: 10.1016/j.jcmg.2012.02.009.
- Panza JA, Ellis AM, Al-Khalidi HR, et al. Myocardial viability and long-term outcomes in ischemic cardiomyopathy. N Engl J Med. 2019; 381(8): 739-748. doi: 10.1056/NEJMoa1807365.
- Bax JJ, Poldermans D, Elhendy A, et al. Improvement of left ventricular ejection fraction, heart failure symptoms and prognosis after revascularization in patients with chronic coronary artery disease and viable myocardium detected by dobutamine stress echocardiography. J Am Coll Cardiol. 1999; 34(1): 163-169. doi: 10.1016/s0735-1097(99)00157-6.
- Wolff G, Dimitroulis D, Andreotti F, et al. Survival benefits of invasive versus conservative strategies in heart failure in patients with reduced ejection fraction and coronary artery disease: a meta-analysis. Circ Heart Fail. 2017; 10(1): e003255. doi: 10.1161/CIRCHEARTFAILURE.116.003255.
- Allman KC, Shaw LJ, Hachamovitch R, et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol. 2002; 39(7): 1151-1158. doi: 10.1016/s0735-1097(02)01726-6.
- Bourque JM, Hasselblad V, Velazquez EJ, et al. Revascularization in patients with coronary artery disease, left ventricular dysfunction, and viability: a meta-analysis. Am Heart J. 2003; 146(4): 621-627. doi: 10.1016/S0002-8703(03)00428-9.
- Beanlands RS, Nichol G, Huszti E, et al. F-18-fluorodeoxyglucose positron emission tomography imaging-assisted management of patients with severe left ventricular dysfunction and suspected coronary disease: a randomized, controlled trial (PARR-2). J Am Coll Cardiol. 2007; 50(20): 2002-2012. doi: 10.1016/j.jacc.2007.09.006.
- Cleland JG, Calvert M, Freemantle N, et al. The Heart Failure Revascularisation Trial (HEART). Eur J Heart Fail. 2011; 13(2): 227-233. doi: 10.1093/eurjhf/hfq230.
- Bonow RO, Maurer G, Lee KL, et al. Myocardial viability and survival in ischemic left ventricular dysfunction. N Engl J Med. 2011; 364(17): 1617-1625. doi: 10.1056/NEJMoa1100358.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure [published correction appears in Eur Heart J. 2021; 42(48): 4901. doi: 10.1093/eurheartj/ehab670]. Eur Heart J. 2021; 42(36): 3599-3726. doi: 10.1093/eurheartj/ehab368.
- Shah BN, Khattar RS, Senior R. The hibernating myocardium: current concepts, diagnostic dilemmas, and clinical challenges in the post-STICH era. Eur Heart J. 2013; 34(18): 1323-1336. doi: 10.1093/eurheartj/eht018.
- Garcia MJ, Kwong RY, Scherrer-Crosbie M, et al. State of the Art: Imaging for myocardial viability: a scientific statement from the American Heart Association. Circ Cardiovasc Imaging. 2020; 13(7): e000053. doi: 10.1161/HCI.0000000000000053.
- Almeida AG, Carpenter JP, Cameli M, et al. Reviewers: This document was reviewed by members of the 2018–2020 EACVI Scientific Documents Committee: chair of the 2018–2020 EACVI Scientific Documents Committee; 2018–2020 EACVI President:. Multimodality imaging of myocardial viability: an expert consensus document from the European Association of Cardiovascular Imaging (EACVI). Eur Heart J Cardiovasc Imaging. 2021; 22(8): e97-e125. doi: 10.1093/ehjci/jeab053.
- Шурупова И.В., Ключников И.В., Асланиди И.П. и др. Выявление гибернации в подостром периоде инфаркта миокарда // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. – 2014. – Т.15. – №1. – С.23-32.
- Вахромеева М.Н., Вахрамеева А.Ю. Радионуклидные методы в оценке эффективности альтернативных технологий реваскуляризации миокарда // Вестник Национального медико-хирургического Центра им. Н. И. Пирогова. – 2008. – Т.3. – №1. – С.100-105.
- Landoni G, Lomivorotov VV, Alvaro G, et al. CHEETAH Study Group. Levosimendan for hemodynamic support after cardiac surgery. N Engl J Med. 2017; 376(21): 2021-2031. doi: 10.1056/NEJMoa1616325.
- Rao V, Ivanov J, Weisel RD, et al. Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg. 1996; 112(1): 38-51. doi: 10.1016/s0022-5223(96)70176-9.
- Açil T, Türköz R, Açil M, et al. Value of prolonged QRS duration as a predictor of low cardiac output syndrome in patients with impaired left ventricular systolic function who undergo isolated coronary artery bypass grafting. Am J Cardiol. 2006; 98(10): 1357-1362. doi: 10.1016/j.amjcard.2006.06.031.
- Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007; 357(11): 1121-1135. doi: 10.1056/NEJMra071667.
- Bolli R, Marbán E. Molecular and cellular mechanisms of myocardial stunning. Physiol Rev. 1999; 79(2): 609-634. doi: 10.1152/physrev. 1999.79.2.609.
- Яворовский А.Г., Мещеряков А.В. Дисфункция миокарда при кардиохирургических вмешательствах. Руководство по кардиоанестезиологии и интенсивной терапии. Под ред. Бунятяна А.А., Трековой Н.А., Еременко А.А. – М.: Медицинское информационное агентство, 2015. – С.134-181.
- Лихванцев В.В., Мороз В.В., Гребенчиков О.А., Гороховатский Ю.И. и др. Ишемическое и фармакологическое прекондиционирование (часть 1) // Общая реаниматология. – 2011. – Т.7 – №6. – C.59-65. doi: 10.15360/1813-9779-2011-6-59.
- De Hert SG, Preckel B, Hollmann MW, Schlack WS. Drugs mediating myocardial protection. Eur J Anaesthesiol. 2009; 26(12): 985-995. doi: 10.1097/EJA.0b013e32832fad8b.
- Лихванцев В.В., Мороз В.В., Гребенчиков О.А., Гороховатский Ю.И. и др. Ишемическое и фармакологическое прекондиционирование (часть 2) // Общая реаниматология. – 2012. – Т.8 – №1. – C.61-66.
- Гороховатский Ю.И., Азизова О.А., Гудымович В.Г. Механизмы кардиопротекторного действия севофлурана // Вестник интенсивной терапии. – 2007. – №4. – С.3-13.
- Papp Z, Agostoni P, Alvarez J, et al. Levosimendan Efficacy and Safety: 20 Years of SIMDAX in Clinical Use. J Cardiovasc Pharmacol. 2020; 76(1): 4-22. doi: 10.1097/FJC.0000000000000859.
- Putzu A, Clivio S, Belletti A, Cassina T. Perioperative levosimendan in cardiac surgery: A systematic review with meta-analysis and trial sequential analysis. Int J Cardiol. 2018; 251: 22-31. doi: 10.1016/j.ijcard.2017.10.077.
- Papp Z, Édes I, Fruhwald S, et al. Levosimendan: molecular mechanisms and clinical implications: consensus of experts on the mechanisms of action of levosimendan. Int J Cardiol. 2012; 159(2): 82-87. doi: 10.1016/j. ijcard.2011.07.022.
- Mebazaa A, Pitsis AA, Rudiger A, et al. Clinical review: practical recommendations on the management of perioperative heart failure in cardiac surgery. Crit Care. 2010; 14(2): 201. doi: 10.1186/cc8153.
- Harrison RW, Hasselblad V, Mehta RH, et al. Effect of levosimendan on survival and adverse events after cardiac surgery: a meta-analysis. J Cardiothorac Vasc Anesth. 2013; 27(6): 1224-1232. doi: 10.1053/j.jvca. 2013.03.027.
- Бабаев М.А., Еременко А.А., Дымова О.В. и др. Применение левосимендана при подготовке пациентов с хронической сердечной недостаточностью к кардиохирургическим операциям // Российский кардиологический журнал. – 2017. – №3. – С.59-62. doi: 10.15829/1560-4071-2017-3-59-62.
- Cholley B, Caruba T, Grosjean S, et al. Effect of levosimendan on low cardiac output syndrome in patients with low ejection fraction undergoing coronary artery bypass grafting with cardiopulmonary bypass: The LICORN randomized clinical trial. JAMA. 2017; 318(6): 548-556. doi: 10.1001/jama.2017.9973.
- Landoni G, Lomivorotov VV, Alvaro G, et al. Levosimendan for hemodynamic support after cardiac surgery. N Engl J Med. 2017; 376(21): 2021-2031. doi: 10.1056/NEJMoa1616325.
- Mehta RH, Leimberger JD, van Diepen S, et al. LEVO-CTS Investigators. Levosimendan in patients with left ventricular dysfunction undergoing cardiac surgery. N Engl J Med. 2017; 376(21): 2032-2042. doi: 10.1056/NEJMoa1616218.
- Guarracino F, Heringlake M, Cholley B, et al. Use of Levosimendan in cardiac surgery: an update after the LEVO-CTS, CHEETAH, and LICORN trials in the light of clinical practice. J Cardiovasc Pharmacol. 2018; 71(1): 1-9. doi: 10.1097/FJC.0000000000000551.
- Habicher M, Zajonz T, Heringlake M, et al. S3-Leitlinie zur intensivmedizinischen Versorgung herzchirurgischer Patienten : Hämodynamisches Monitoring und Herz-Kreislauf – ein Update. Anaesthesist. 2018; 67(5): 375-379. doi: 10.1007/s00101-018-0433-6.
- Перуцкий Д.Н., Макеева Т.И., Константинов С.Л. Основные концепции постинфарктного ремоделирования миокарда левого желудочка // Научные ведомости БелГУ. Сер. Медицина. Фармация. – 2011. – №10(105). – Вып.14. – С.51-59.
- Farmakis D, Alvarez J, Gal TB, et al. Levosimendan beyond inotropy and acute heart failure: Evidence of pleiotropic effects on the heart and other organs: An expert panel position paper. Int J Cardiol. 2016; 222: 303-312. doi: 10.1016/j.ijcard.2016.07.202.
- Кенжаев М.Л., Аляви А.Л., Кенжаев С.Р., и др. Обратимая дисфункция миокарда у больных с острыми формами ишемической болезни сердца // Вестник экстренной медицины. – 2018. – Т.11. – №2. – C.100-104.
- Kloner RA. Stunned and Hibernating Myocardium: Where Are We Nearly 4 Decades Later? J Am Heart Assoc. 2020; 9(3): e015502. doi: 10.1161/ JAHA.119.015502.
- Zangrillo A, Biondi-Zoccai G, Mizzi A, et al. Levosimendan reduces cardiac troponin release after cardiac surgery: a meta-analysis of randomized controlled studies. J Cardiothorac Vasc Anesth. 2009; 23(4): 474-478. doi: 10.1053/j.jvca.2008.11.013.
- Jiménez-Rivera JJ, Álvarez-Castillo A, Ferrer-Rodríguez J et al. Preconditioning with levosimendan reduces postoperative low cardiac output in moderate-severe systolic dysfunction patients who will undergo elective coronary artery bypass graft surgery: a cost-effective strategy. J Cardiothorac Surg. 2020; 15(1): 108. doi: 10.1186/s13019-020-01140-z.
- Nieminen MS, Buerke M, Cohen-Solál A, et al. The role of levosimendan in acute heart failure complicating acute coronary syndrome: A review and expert consensus opinion. Int J Cardiol. 2016; 218: 150-157. doi: 10.1016/j.ijcard.2016.05.009.
- Рафаели И.Р., Панков А.Н., Савелов Е.А., и др. Применение правой внутренней грудной артерии свободным лоскутом в составе бимаммарного шунтирования // Кардиология и сердечно-сосудистая хирургия. – 2018. – Т.11. – №4. – С.26 30. doi: 10.17116/kardio201811426.
- Gaudino M, Bakaeen FG, Sandner S, et al. Expert Systematic Review on the Choice of Conduits for Coronary Artery Bypass Grafting: Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS) and The Society of Thoracic Surgeons (STS). Ann Thorac Surg. 2023; 116(4): 659-674. doi: 10.1016/j.athoracsur.2023.06.010.
- Gaudino M, Dangas GD, Angiolillo DJ, et al. American Heart Association Council on Cardiovascular Surgery and Anesthesia; Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; and Stroke Council. Considerations on the management of acute postoperative ischemia after cardiac surgery: a scientific statement from the American Heart Association. Circulation. 2023; 148(5): 442-454. doi: 10.1161/CIR.0000000000001154.
- Баутин А.Е., Карпова Л.И., Маричев А.О. и др. Кардиопротективные эффекты ишемического кондиционирования: современные представления о механизмах, экспериментальные подтверждения, клиническая реализация // Трансляционная медицина. – 2016. – Т.3. – №1. – С.50-62. doi: 10.18705/2311-4495-2016-3-1-50-62.
- Caricati-Neto A, Errante PR, Menezes-Rodrigues FS. Recent Advances in Pharmacological and Non-Pharmacological Strategies of Cardioprotection. Int J Mol Sci. 2019; 20(16): 4002. doi: 10.3390/ijms20164002.
- Шляхто Е.В., Нифонтов Е.М., Галагудза М.М. Ограничение ишемического и реперфузионного повреждения миокарда с помощью пре- и посткондиционирования: молекулярные механизмы и мишени для фармакотерапии // Креативная кардиология. – 2007. – Т.2 – №1. – С.75-101.
- Roth S, Torregroza C, Feige K, et al. Pharmacological conditioning of the heart: an update on experimental developments and clinical implications. Int J Mol Sci. 2021; 22(5): 2519. doi: 10.3390/ijms22052519.
- Torregroza C, Raupach A, Feige K, et al. Perioperative cardioprotection: general mechanisms and pharmacological approaches. Anesth Analg. 2020; 131(6): 1765-1780. doi: 10.1213/ANE.0000000000005243.


