О роли наноразмерных частиц оксида алюминия в саморегулируещемся электролите хромирования
Автор: Тюриков Евгений Владимирович, Семнычев Валентин Владимирович, Ильин Вячеслав Александрович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-3 т.14, 2012 года.
Бесплатный доступ
Представлены исследования влияния наночастиц оксида алюминия на седиментационную устойчивость и рН электролита хромирования, на выход хрома по току, на пористость и шероховатость покрытия и определена функциональная роль наночастиц в электролите хромирования.
Наноразмерные частицы, электролитическое осаждение, электролит хромирования
Короткий адрес: https://sciup.org/148201282
IDR: 148201282 | УДК: 621.357.7
Текст научной статьи О роли наноразмерных частиц оксида алюминия в саморегулируещемся электролите хромирования
Первоочередной задачей при разработке технологии получения покрытий в электролитах, содержащих наночастицы оксидов металлов, является создание стабильных электролитов-суспензий, обладающих высокой седиментационной устойчивостью.
Рис. 1. иллюстрирует седиментационную устойчивость электролитов хромирования содержащих нанопорошок оксида алюминия в зависимости от времени.
Из приведенного графика видно, что с увеличением концентрации нанопорошка с 5 г/л до 10 г/л седиментационная устойчивость системы повышается из-за того, что увеличивает вязкость дисперсионной среды и по этому скорость осаждения частиц в соответствии снижается. За 8 часов коэффициент светопропускания достигает 50 %, что свидетельствует о хорошей устойчивости нанопорошка в электролите. Через 37 часов коэффициент светопропускания достигает постоянной величины 108 %. Это показывает, что происходит осветление электролита хромирования. Окрашенные анионы CrO42-, HCrO4-, Cr2O72- , образующиеся при растворении хромового ангидрида, адсорбируются на частицах оксида алюминия, что и приводит к осветлению электролита в процессе осаждения нанопорошка оксида алюминия во времени.
На поверхности частиц оксида алюминия образуется двойной электрический слой, поэтому с целью определения состава адсорбционных и диффузионных слоёв проведены исследования зависимости изменения pH от концентрации наночастиц Al2O3 в электролите хромирования.
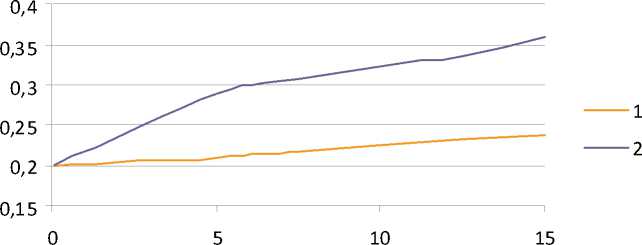
На рис. 2. представлена зависимость изменения рН от концентрации Al2O3 и влияния перемешивания или отстаивания электролита.
Из рисунка видно, что для электролитов при непрерывном перемешивании и электролитов после отстаивания и декантации с ростом концентрации нанопорошка рН возрастает. Для
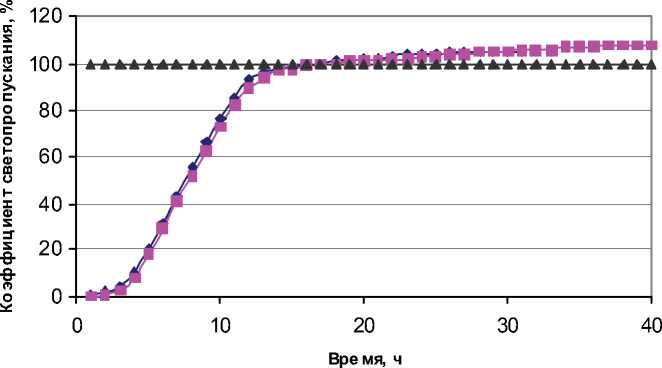
Рис. 1. Зависимость коэффициента светопропускания в электролите хромирования от времени: 1 – Al2O3 5 г/л– обработка ацетоном и ультразвуком; 2 – Al2O3 10 г/л– обработка ацетоном и ультразвуком;
3 – электролит без нанопорошка.
концентрация нанопорошка, г/л
Рис. 2. Зависимость изменения рН от концентрации Al2O3 при температуре 60 оС: 1 – при непрерывном перемешивании; 2 – отстаивание и декантация
электролитов отстаивавшихся 48 часов рН выше, чем в электролите при перемешивании.
На основании проведенных исследований изменения рН электролита хромирования в зависимости от концентрации нанопорошка, в соответствии с методикой изложенной в работе [3] видно, что на поверхности частиц оксида алюминия при введении их в электролит образуется двойной электродный слой. Во внутреннем слое адсорбируются катионы K+, Sr2+, H3О+, во внешнем слое адсорбируются анионы хромовой, серной и кремнефтористой кислот и в диффузионном слое находятся анионы хромовой, серной и кремнефтористой кислот. Концентрация ионов H3О+ в электролите снижается, что и приводит к увеличению рН электролита содержащего нанопорошок оксида алюминия.
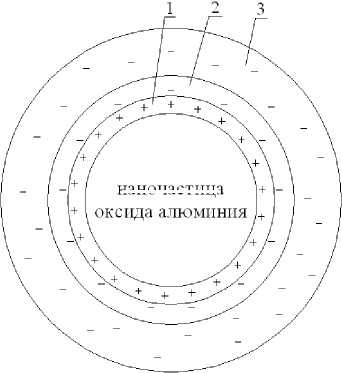
Таким образом, введение в электролит нанопорошка оксида алюминия приводит к образованию на частицах двойного электрического слоя (рис. 3.).
Из рис. 3. видно, что на наночастице оксида алюминия образуются в электролите хромирования три слоя:
-
1. Внутренний слой Гельмгольца, который содержит адсорбированные катионы K+, Sr2+, H3О+ и молекулы воды;
-
2. Внешний слой Гельмгольца, который содержит адсорбированные анионы хромовой,
-
3. Диффузный слой, в котором находятся анионы хромовой, серной и кремнефтористой кислот, а также молекулы воды.
rid HD 4dC 1И Lid
Рис. 3. Образование двойного электрического слоя на наночастице оксида алюминия, находящейся в электролите хромирования серной и кремнефтористой кислот, а также молекулы воды;
Частицу дисперсной фазы в гетерогеннодисперсной системе вместе с двойным электрическим слоем называют мицеллой. Строение мицеллы можно показать следующей формулой: Al2O3 / n H3О+, m Sr2+, p K+/ n-x Cr2O72-, m-y SO42-, p-z SiF62- / x Cr2O72-, y SO42-, z SiF62-.
Внутреннюю часть мицеллы составляет агрегат оксида алюминия. На поверхности агрегата расположены потенциалопределяющие катионы K+, Sr2+, H3О+. Агрегат вместе с потенциалопреде-ляющими ионами составляет ядро мицеллы. Ядро с противоионами плотной части двойного электрического слоя образует гранулу. Гранулу окружают противоионы диффузионного слоя. Мицелла в отличие от гранулы электронейтральна.
На рис. 4. представлены графики влияния
С ростом плотности тока выход хрома по току увеличивается. Температура в пределах 5662 оС не оказывает влияния на выход хрома по току. В данном диапазоне температур нанопорошок оксида алюминия оказывает наибольшее влияние на выход хрома по току. Это объясняется тем, что скорость процесса депассивации поверхности катода за счет абразивного действия частиц, очищающих поверхности анода и катода от пассивных пленок, оксидов, газов и транспортного действия наночастиц оксида алюминия по доставке анионов хрома к катоду выше скорости процесса экранирования поверхности катода наночастицами.
Определение скорости осаждения хромового покрытия проводили при различных параметрах тока в электролитах, содержащих нанопорошок в концентрации 0 г/л, 5 г/л и 10 г/л, температура электролита – 60 оС.
На рис. 5. переставлены результаты определения скорости осаждения хромового покрытия температуры электролита и плотности тока на в зависимости от плотности тока и концентра- выход хрома по току при концентрации нанопо- ции нанопорошка.
рошка оксида алюминия 10 г/л. Приведенные на рис. 5. зависимости показы-
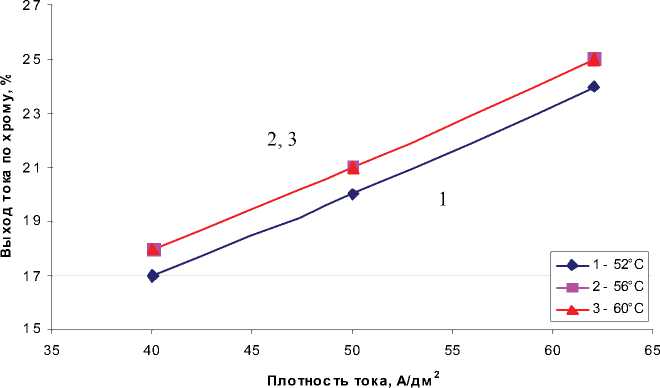
Рис. 4. Влияние плотности тока и температуры электролита на выход хрома по току при концентрации
нанопорошка оксида алюминия 10 г/л и температуре электролита:
Плотность тока, А/дм2
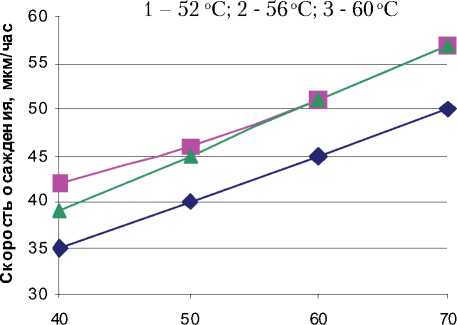
Рис. 5. Влияние плотности тока и концентрации Al2O3 на скорость осаждения хромового покрытия: 1- 0 г/л Al2O3; 2 - 5 г/л Al2O3, 3 - 10 г/л Al2O3
вают, что на скорость осаждения хрома значительное влияние оказывают плотность тока и нанопорошок оксида алюминия. С ростом плотности тока и введением оксида алюминия скорость осаждения увеличивается. Это объясняется тем, что нанопорошок оксида алюминия является дополнительным транспортным средством по доставке анионов хрома к катоду, приводящее к увеличению скорости осаждения хромового покрытия.
При наложении разности потенциалов частица с двойным электрическим слоем приобретает вид, показанный на рис. 6, т.е. приобретает вид диполя и под действием потенциала, она будет перемещаться к катоду или аноду.
Пористость покрытий является одной из основных характеристик, которая оказывает решающее влияние на их защитную способность.
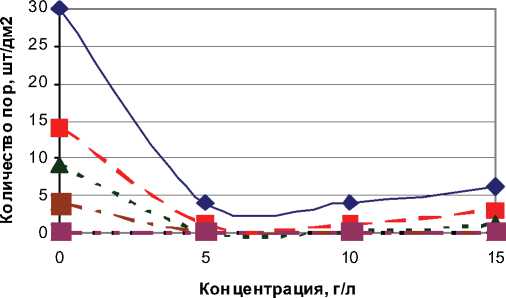
На рис. 7. представлена зависимость изменения количества пор от концентрации нанопорошка оксида алюминия и толщины хромового покрытия.
Из представленных графиков видно, что с ростом толщины покрытия пористость снижается. Присутствие нанопорошка оксида алюминия в электролите резко снижает пористость по сравнению с электролитом без нанопорошка при одинаковой толщине покрытия, причем наибольшее снижение пористости при концентрации Al2O3 5-10 г/л. При толщинах более 45 мкм пористость отсутствует в электролитах как с нанопорошком, так и без нанопорошка.
В связи с тем, что при кластерном хромировании покрытие полностью копирует рельеф покрываемой поверхности и, наночастицы благодаря их высокой физико-химической активности обеспечивают массовую кристаллизацию хрома, образуется сверхвысокодисперсная (мелкокристаллическая) структура покрытия, образование пор в которой затруднено.
Возникающие в процессе хромирования микротрещины, образование которых связано с высо-
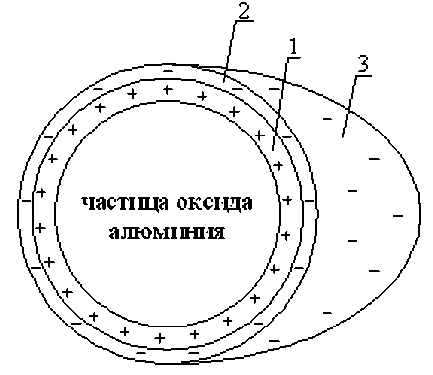
Рис. 6. Наночастица с двойным электрическим слоем, находящаяся в электролите хромирования под током:
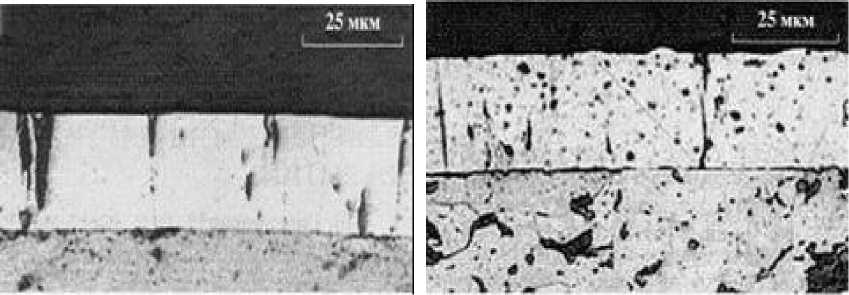
1. Внутренний слой Гельмгольца, который содержит адсорбированные катионы K + , Sr 2+ , H3О + и молекулы воды; 2. Внешний слой Гельмгольца, который содержит адсорбированные анионы хромовой, серной и кремнефтористой кислот, а также молекулы воды; 3. Диффузный слой ориентированный к аноду, в котором находятся анионы хромовой, серной и кремнефтористой кислот, а также молекулы воды кими внутренними напряжениями в хромовом покрытии, во время электроосаждения зарастают. На рис. 8. видно, что в хромовом покрытии, полученном в электролите без нанопорошка (рис. 8а), поры могут доходить до поверхности основы, а в кластерном покрытии (рис. 8б) поры перекрываются и не доходят до поверхности основы.
На рис. 9. представлена зависимость изменения шероховатости от толщины хромового покрытия, полученного из саморегулирующегося электролита хромирования без нанопорошка и содержащего 10 г/л оксида алюминия (температура электролита 62оС, плотность тока 50 А/дм2 ), где ДRa = Ra покр – Ra исх.
Из рисунка видно, что шероховатость хромо-
Кри в ая 1
Кри в ая 2
Кри в ая 3
Кри в ая 4
Кри в ая 5
Рис. 7. Зависимость количества пор от концентрации Al2O3 и толщины покрытия: 1– толщина 7 мкм; 2 – толщина 12 мкм; 3 – толщина 18 мкм; 4 – толщина 30 мкм; 5 – толщина 45 мкм
а) б)
Рис. 8. Микрофотографии шлифов хромовых покрытий: а – без нанопорошка, б – с нанопорошком Al2O3
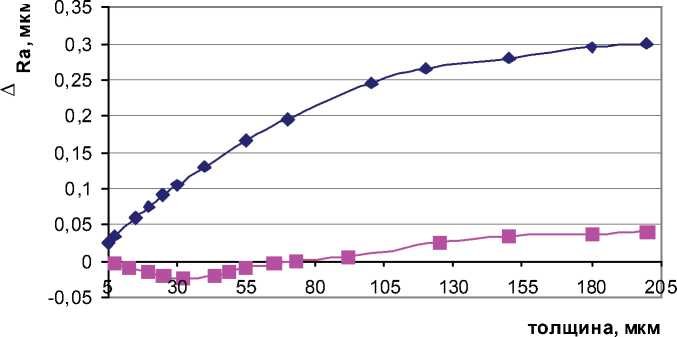
Рис. 9. Изменение шероховатости в зависимости от толщины покрытия и наличия нанопорошка оксида алюминия:
1 – электролит без нанопорошка, 2 – электролит с нанопорошком
-■- 2
вого покрытия, полученного в электролите, содержащим нанопорошок, уменьшается, проходя через минимум при толщине покрытия 30 мкм, с дальнейшим ростом толщины покрытия его шероховатость увеличивается незначительно. При толщине покрытия до 70 мкм шероховатость кластерного хромового покрытия ниже или соответствует шероховатости исходного материала. Шероховатость покрытия, полученного в электролите без нанопорошка, монотонно растет и ухудшается на 1-2 класса в зависимости от толщины покрытия.
Эффект выравнивания и даже уменьшения шероховатости объясняется двумя одновременно происходящими процессами при кластерном хромировании.
Экранирование выступов поверхности катода наночастицами, которое тем больше, чем выше электропроводность наночастиц.
Максимальное изменение шероховатости ДRa с использованием нанопорошка оксида алюминия составляет 0,025 мкм при электропроводности нанопорошка оксида алюминия 10-5 Ом/м.
Максимальное изменение шероховатости ДRa для нанопорошка карбида кремния состав- ляет 0,045 мкм при электропроводности карбида кремния 105 Ом/м.
Это говорит о том, что в углублениях поверхности катода процесс осаждения хромового покрытия идёт интенсивнее, а на выступах скорость осаждения меньше.
Увеличение концентрации нанопорошка над впадинами покрываемой поверхности в результате броуновского движения наночастиц приводит к увеличению количества ударов наночастиц о покрываемую поверхность во впадинах и, соответственно, увеличиваются транспортные функции нанопорошка по доставке к покрываемой поверхности ионов хрома, что также увеличивает скорость осаждения покрытия (рис. 10).
Выводы:
На основании вышеизложенного наночастицы оксидов металлов в электролите хромирования являются дополнительными транспортными средствами по доставке ионов хрома к поверхности катода и влияют на продолжительность переходных процессов, происходящих на границе катод-электоролит. Причем действуют два
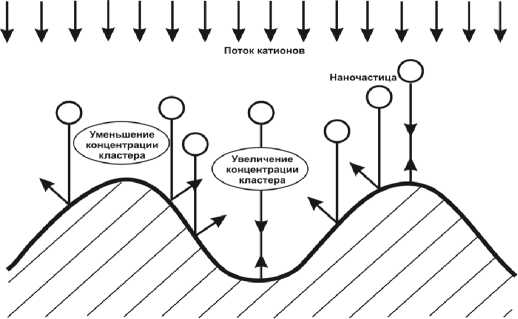
Рис. 10. Схема выравнивания шероховатости поверхности при кластерном хромировании
противоположно направленных фактора:
-
- с одной стороны депассивация поверхности за счет абразивного действия частиц, очищающих поверхности анода и катода от пассивных пленок, оксидов, газов, что активирует их поверхность - увеличивая выход хрома по току и скорость осаждения покрытия;
-
- с другой стороны происходит экранирование поверхности катода, которое тем больше, чем выше электропроводность частиц, приводящая к резкому снижению скорости осаждения покрытия, так например скорость осаждения хромового покрытия из саморегулирующегося электролита, содержащего наночастицы карбида кремния (электропроводность 105Ом/м), в два-три раза меньше, чем из электролита, содержащего наночастицы оксида алюминия (электропроводность 10-5 Ом/м).
Наночастицы оксидов металлов при ударе о катод образуют центры кристаллизации (зародыши), от которых начинается кристаллизация хрома. Вследствие большого количества частиц (~5·109 шт/мм3), участвующих в процессе, кристаллизация носит многозародышевый характер. Образующееся покрытие имеет малые размеры структурных фрагментов с отсутствием дальнего порядка в кристаллической структуре. Совокупность практически безынерционного массопе- реноса частиц дисперсной фазы и массовой кристаллизации хрома обеспечивает равномерное осаждение покрытия на эквипотенциальных поверхностях. Малый размер наночастиц и кристаллитов хрома обеспечивают точное копирование микрорельефа поверхности, что увеличивает общую поверхность сцепления покрытия с основой, исключает «течь» газа и гидрожидкостей под хромовым покрытием при высоких давлениях и обеспечивает повышение микротвердости покрытия до 14000 МПа, а также увеличение износостойкости покрытия по сравнения с покрытиями из стандартных электролитов хромирования..
Покрытия, полученные с использованием электролита, содержащего наночастицы оксида алюминия, имеют повышенную коррозионную стойкость по сравнению с хромовыми покрытиями, полученными в стандартных электролитах хромирования.
Список литературы О роли наноразмерных частиц оксида алюминия в саморегулируещемся электролите хромирования
- Шлугер М.А. Ускорение и усовершенствование хромирования деталей машин. М.: Машгиз, 1961. С. 140.
- Михайлов А.А. Обработка деталей с гальваническими покрытиями. М.: Машиностроение, 1981. С.144.
- Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М., Химия, 1989. С.464.


