О синтезе аналога ресвератрола с остовом транс-стильбазола
Автор: Балакирева О.И., Вакаева С.С., Пяткин И.В., Семенов А.В.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 19 т.4, 2016 года.
Бесплатный доступ
Разработан метод синтеза производного транс-стильбазола - синтетического аналога природного фитоалексина ресвератрола. Синтезированное соединение является потенциальной основой для создания новых высокоэффективных цитопротекторов антиоксидантного типа действия.
Антиоксиданты, синтетические аналоги ресвератрола, транс-стильбазол
Короткий адрес: https://sciup.org/147249191
IDR: 147249191 | УДК: 547.829
Текст научной статьи О синтезе аналога ресвератрола с остовом транс-стильбазола
Настоящая работа посвящена синтезу аналога ресвератрола основанному на известной стратегии биоизостерной замены бензольного кольца пиридиновым фрагментом. В рамках концепции "me too drug" разработки лекарственных препаратов именно процессы замены фрагмента =СН– на =N– или –СН=СН– на –S– в ароматических системах признаны одними из самых успешных вариантов классических изостерных перемещений [2]. Предлагаемая модификация структуры, с одной стороны, за счет возможности образования четвертичных аммонийных солей приведет к увеличению гидрофильности и, как следствие, биодоступность соединения. С другой стороны, введение дополнительного акцептора водородных связей (пиридинового атома азота), безусловно, должно повлиять на изменение характера связывания молекулы с белками-мишенями. В ряду возможных изомерных структур мы ограничились производным, содержащим гидроксильную группу в положении 3 пиридинового фрагмента, поскольку именно такое взаиморасположение, согласно теоретическим расчетам [3], обеспечивает максимальную антиоксидантную активность аналога.
В качестве наиболее вероятной «стратегической» связи в синтезе остова транс-стильбазола следует рассматривать двойную углерод-углеродную связь, создание которой в данном случае может быть осуществлено с использованием достаточно широкого набора известных методов. В частности, анализ литературных данных показал, что для образования данной связи многими авторами предлагается реакция взаимодействия α-пиколина с ароматическими альдегидами в различных условиях [4–6]. Однако проведенные нами исследования показали неэффективность данных подходов при синтезе целевого соединения (1) связанную, по нашему мнению, с невысокой реакционной способностью исходного метилпридина (2) в качестве метиленовой компоненты, обусловленной снижением (по сравнению с незамещенным α-пиколином) кислотности группы СН3 из-за влияния донорного заместителя в положении 5 пиридинового кольца. Альтернативными способами получения соединения (1) могли бы стать процессы, основанные на реакциях Виттига или Виттига-Хорнера, которые с успехом применяется для синтеза ресвератрола и его производных [7]. Однако ключевым субстратом в этих процессах является труднодоступный 5-метоксипиридин-2-карбальдегид. В результате, в качестве наиболее удобного метода синтеза соединения (1) предлагается путь, представленный на схеме 1, включающий промежуточное формирование спирта (3) и его последующую дегидратацию. Процесс получения соединения (3) заключался в металлировании пиколина (2) бутиллитием в ТГФ при температуре ‒20 оС в инертной атмосфере [8] с последующим введением промежуточно образующегося литийорганического соединения в реакцию с анисовым альдегидом. Последующая дегидратация соединения (3) может быть осуществлена посредством стандартных методов, основанных на использовании полифосфорной кислоты, концентрированной соляной кислоты в метаноле, серной кислоты или гидросульфата калия в бензоле. Тем не менее, нами было установлено, что дегидратация спирта (3) при нагревании с полифосфорной и серной кислотой не происходит, а при кипячении с концентрированной соляной кислотой в метаноле происходит образование простого метилового эфира по гидроксильной группе субстрата. Результативным оказался метод дегидратации с использованием системы триметилхлорсилан/ZnC12 в ТГФ, предложенной в работе [9]:
l.BuLi, ТГФ,-20 °C
2. и-СН3ОС6Н4СНО
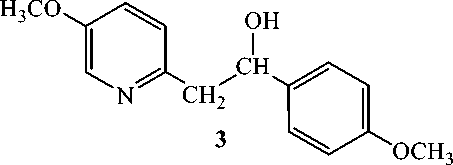
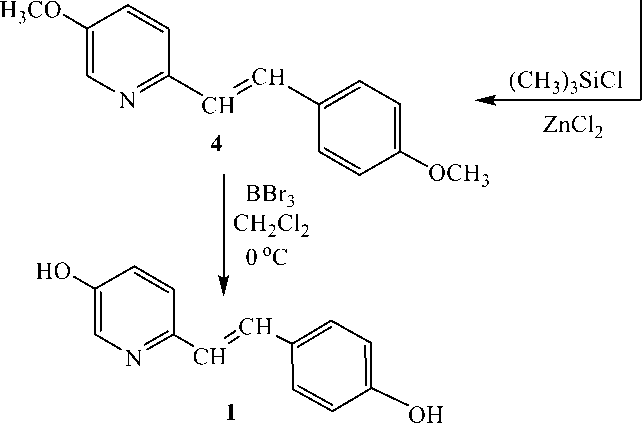
Рис. 1. Схема, отражающая получение 5-гидрокси-2-[( E ) -2-(4-гидроксифинил)винил]пиридина.
Заключительной стадией синтеза аналога ресвератрола - стильбазола ( 1 ) является реакция деметоксилирования соединения ( 4 ) посредством бромида бора в хлористом метилене в инертной атмосфере [10].
Таким образом, в результате проведенного нами исследования разработан удобный способ получения 5-гидрокси-2-[( E )-2-(4-гидроксифинил)винил]пиридина ( 1 ) - аналога ресвератрола, который может служить основой для создания эффективных лекарственных препаратов антиоксидантного типа действия.
Экспериментальная часть. ИК спектры регистрировали на приборе "ИнфраЛЮМ ФТ-02" в таблетках KBr; спектры ЯМР 1 Н и 13С - на приборе "Bruker АМХ 400" (400 МГц) в ДМСО-Й 6 , внутренний стандарт - ГМДС.
Получение 1-(4-метоксифенил)-2-(5-метоксипиридин-2-ил)этанола (3). К раствору 1,5 г 2-метил-5-метоксипиридина (2) в 60 мл сухого ТГФ в инертной атмосфере аргона при перемешивании и охлаждении до –10 оС прибавляли по каплям 20 мл 1 М раствора бутиллития в гексане. Смесь перемешивали при этой температуре в течение 15 мин, затем нагревали до комнатной температуры и перемешивании в течение 2 ч. К реакционной смеси, охлажденной до –10 °С, по каплям добавляли 1,63 мл 4-метокибензальдегида в 3 мл сухого ТГФ. Перемешивали при этой температуре в течение 10 мин, затем нагревали до комнатной температуры и перемешивали еще в течение 2 ч. Реакционную смесь нейтрализовывали до pH 7,0–7,5 постепенным добавлением 10%-го раствора соляной кислоты. Экстрагировали этилацетатом, сушили MgSO4. После удаления растворителя твердый остаток кристаллизовали из водного этанола. Получили соединение (3) в виде бесцветных кристаллов с выходом 68%. Т. пл. 132 – 134 °С. ИК (ν, см-1): 3209, 2955, 2936, 1612, 1512, 1496, 1304, 1269, 1242, 1053, 833. ЯМР 1Н (δ, м.д).: 3,02 д (2Н); 3,78 c (3H); 3,83 c (3H); 5,05 кв (8,7; 3,7 Гц, 1 H); 5,42 c (ОH); 6,86 д (8,2 Гц, 2H); 7,00 д (8,7 Гц, 1H); 7,12 кв (1H); 7,31 д (8,7 Гц, 2H); 8.20 д (2,7 Hz, 1H). ЯМР 13С (δ, м.д.): 44,98; 55,36; 55,73; 73,31; 113,73; 121,83; 124,07); 127,13; 135,95; 136,49; 151,83; 154,44; 158,86.
Получение соединения (4) . Смесь 0,25 г спирта ( 3 ) 0,22 г триметилхлорсилана и 0,2 г безводного ZnCl 2 в 5 мл сухого ТГФ перемешивали при нагревании до 50 оС в инертной атмосфере аргона в течение 8 ч. К охлажденной реакционной смеси прибавляли 20 мл диэтилового эфира и 6 мл насыщенного раствора NH 4 Cl. Нейтрализовали до нейтральной среды аммиаком, и водный слой экстрагировали эфиром. Объединенные органические вытяжки сушили MgSO 4 . Удаляли растворитель, а твердый остаток очищали флеш-хроматографией на силикагеле. Получили соединение (4) в виде бледно-желтых кристаллов с выходом 84 %. Т. пл. 112 – 114 °С. ИК (ν, см-1): 2955, 2932., 1604, 1562, 1512, 1477, 1442, 1396, 1269, 1250, 829. ЯМР 1Н (δ, м.д).: 3,80 с (3Н); 3,84 с (3Н); 6,88 д (8,7 Гц, 2Н); 6,99 д (16,0 Гц, 1Н); 7,15 д (8,5 Гц, 1Н); 7,30 д (8,7 Гц, 1Н); 7,38 д (16,0 Гц, 1Н); 7,47 д (8,7 Гц, 2Н); 8,27 д (3,2 Гц, 1Н). ЯМР 13С (δ, м.д.): 55,41; 55,76; 114,22; 121,06; 122,08; 125,37; 128,17; 129,81; 130,22; 137,34; 148,92; 154,51; 159,60.
Получение 5-гидрокси-2-[(E)-2-(4-гидроксифинил)-винил]-пиридина (1). К раствору 0,12 г соединения (4) в 8 мл сухого хлористого метилена в инертной атмосфере аргона при перемешивании и охлаждении до –20 оС по каплям прибавляли 1,4 мл 1 М раствора BBr3 в хлористом метилене. Перемешивали при этой температуре в течение 15 мин, затем нагревали до комнатной температуры и перемешивали еще 1 ч. После этого выдерживали реакционную смесь в течение 2 ч при температуре 50 оС. Растворитель удаляли, остаток разбавляли водой и нейтрализовывали 10%-м раствором аммиака до нейтральной среды. Экстрагировали этилацетатом и сушили MgSO4. После удаления растворителя получали соединение (1) в виде желтоватого масла с выходом 63%. ЯМР 1Н (δ, м.д): 6,74 д (2 Н); 6,95 д (1 Н); 7,17 кв (1Н); 7,31 д (2Н); 7,37 д (1Н); 7,39 д (2Н); 8,08 д (2Н); 9,61с (1Н); 10,04 с (1Н).
Список литературы О синтезе аналога ресвератрола с остовом транс-стильбазола
- Baur J. A., Sinclair D. A. Therapeutic potential of resveratrol: the in vivo evidence // Nat. Rev. Drug Discov. - 2006. - Vol. 5, Issue 6. - P. 493-506.
- The Practice of Medicinal Chemistry (Third Edition) / Edited by: Camille Georges Wermuth. - Oxford: Elsevier, 2008.
- Семенов А. В., Петров П. С., Вакаева С. С. и др. Теоретическая оценка антиоксидантной активности гидроксипроизводных транс-стильбазола - структурных аналогов ресвератрола // Материалы XVIII Российского национального конгресса «Человек и лекарство», 11-15 апреля 2011 г. - М.: ЗАО РИЦ «Человек и лекарство», 2011. - С. 632. EDN: YVBZHM
- Williams J., Adel R., Carlson J. A Comparison of Methods for the Preparation of 2- and 4-Styrylpyridines // J. Org. Chem. - 1963. - Vol. 28. - P. 387-390.
- Bhowmik P. K., Nedeltchev A. K., Han H. Synthesis optical and thermal properties of conjugated, bispyridyl and tetrapyridyl compounds by Knoevenagel reaction // Tetrahedron Letters - 2007. - Vol. 48. - P. 5383-5387. EDN: KHIKYZ
- Chiang M., Hartung W. H. Synthesis of some Stilbazole Derivatives // J. Org. Chem. - 1945. - Vol. 10, № 1. - P. 21-25.
- Sprouse D. The synthesis of resveratrol [Электронный ресурс] // Nature Proceedings. - 2010. - Режим доступа: http://precedings.nature.com / documents / 4685 / version / 1 / files / npre20104685-1.pdf.
- Ihle N. C., Krause A. E. Preparation of 4-Alkyl-2-[N-(tret-butoxycarbonyl)amino]-pyridines by Alkulation, Nucleophilic Addition, and Acylation of 2-[N-(tret-Buutoxucarbonyl)amino]-4-picoline // J. Org. Chem. - 2006. - Vol. 49. - P. 467-470.
- Peng Z., Ma F., Zhu L., Xie X., Zhang Z. Lewis Acid Promoted Carbon-Carbon Double-Bond Formation via Organozinc Reagents and Carbonyl Compounds // J. Org. Chem. - 2009. - Vol. 74. - P. 6855-6858. EDN: YAUEAB
- Belluta F., Fontana G., Bo L., Carenini N., Ciommarelli Ch., Zunono F. Design, synthesis and anticancer activities of hybrid compounds: Idetification of novel proapoptotic agents // Bioorg. Med. Chem. - 2010. - Vol. 18. - P. 3543-3550.


