О токсичности и прооксидантном эффекте наночастиц CeO2 и SiO2 (на модели Danio rerio)
Автор: Мирошникова Е.П., Косян Д.Б., Аринжанов А.Е., Сизова Е.А., Калашников В.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Наночастицы металлов: биологические эффекты
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Активное использование наноматериалов в различных сферах приводит к их интенсивному поступлению в окружающую среду и вовлечению в процессы ремедиации. В водной среде наноматериалы влияют на фауну аквабиоценоза, включая рыб. Содержание продуктов перекисного окисления липидов (ПОЛ) у гидробионтов как биоиндикаторных организмов традиционно используют в качестве показателя при определении влияния техногенного загрязнения водоема. При анализе показателей ПОЛ следует учитывать, что выявляемое содержание продуктов окисления может быть связано не только с реакцией гидробионтов на антропогенное загрязнение водоема, но и с наличием соответствующих субстратов в тканях рыб. Нами впервые изучен эффект наночастиц диоксидов кремния и церия в условиях водной среды с непосредственной оценкой ферментативной системы тест-объекта. На модели Danio rerio мы определили токсическое действие наночастиц диоксида церия (CeO2 НЧ, 15,8 нм) и диоксида кремния (SiO2 НЧ, 40,9 нм), прооксидантный эффект CeO2 НЧ и SiO2 НЧ, зависимость показателей ПОЛ от дозовой нагрузки, а также наличие у Danio rerio механизмов, обеспечивающих адаптацию к присутствию этих наночастиц в среде обитания. Был установлен факт 100 % гибели тест-объекта к 80-м и 84-м сут под влиянием CeO2 НЧ. Первые признаки токсического эффекта CeO2 НЧ в дозе 10 мг/дм3 корма отмечали на 45-е сут, на 56-е сут численность сокращалась на 33 %, на 65-е сут - уже на 54 %. В случае SiO2 НЧ выживаемость снизилась на 33 %. Наночастицы в дозах 10 и 100 мг/дм3 приводили к уменьшению содержания малонового диальдегида (МДА) у Danio rerio во всех группах по сравнению с контролем: соответственно на 11 и 61 % - в варианте с CeO2 НЧ и на 50,0 и 41,5 % - с SiO2 НЧ, то есть влияние оказалось сходным. Ту же динамику наблюдали в течение первых 2 нед эксперимента. При добавлении CeO2 НЧ в воду аквариума (10 и 100 мг/дм3) активность супероксиддисмутазы (СОД) снизилась соответственно на 75 % и 69 %, на фоне SiO2 НЧ в тех же концентрациях - на 50 и 26 %. Похожий характер изменения активности регистрировали для каталазы (КТ). Таким образом, поступление CeO2 НЧ и SiO2 НЧ в среду обитания сопровождалось депрессией антиоксидантной системы Danio rerio в начале эксперимента, появлением признаков адаптации к концу 2-й нед и значительным увеличением активности КТ и СОД к окончанию срока наблюдения, что указывает на наличие у этих наночастиц токсического действия, требующего дальнейшего изучения.
Выживаемость, каталаза, супероксиддисмутаза, наночастицы диоксида кремния, наночастицы диоксида церия, масс-спектрометрия
Короткий адрес: https://sciup.org/142213997
IDR: 142213997 | УДК: 639.2/.3:574.5:57.084.1:[546.28+546.28]-022.532 | DOI: 10.15389/agrobiology.2016.6.921rus
Текст научной статьи О токсичности и прооксидантном эффекте наночастиц CeO2 и SiO2 (на модели Danio rerio)
По некоторым оценкам, к 2020 году развитие нанотехнологий обеспечит создание отраслей промышленности, в которых будет занято около 6 млн человек с совокупным производством товаров на 3 трлн долларов (1). Закономерно увеличится поступление ультрадисперсных материалов в окружающую среду, где они будут вовлекаться в биологические процессы. В водной среде наноматериалы могут быть включены в различные процессы, например быть компонентами сточных вод или выбросов; они не подвергаются биодеградации и крайне медленно покидают биологический цикл (2). Этим обусловлена необходимость изучить состояние объектов наземных и водных (природных и антропогенных) экосистем при воздействии наноматериалов — в первую очередь, тех форм, которые имеют значительный потенциал применения. К их числу относятся нанопрепараты, содержащие церий и кремний и используемые во многих биотехнологических и медицинских производствах (3). Исследования показали, что токсический эффект CeO2 и SiO2 обнаруживается только при размерах частиц
Работа выполнена при финансовой поддержке Российского научного фонда (проект ¹14-36-00023). Анализ образцов ткани экспериментальных животных на содержание химических элементов проводили в лаборатории АНО «Центр биотической медицины», г. Москва (аттестат аккредитации ГСЭН.RU.ЦАО.311, Регистрационный номер в Государственном реестре РОСС RU. 0001.513118).
до 10 нм, однако точных сведений, подтверждающих их низкую токсичность для человека и животных, нет. Ограниченное число фундаментальных работ по действию наночастиц (НЧ) CeO2 и SiO2, противоречивость полученных данных, а также расширение сфер применения материалов на основе НЧ CeO2 и SiO2 обусловливают необходимость в биологической оценке таких наноматериалов, в том числе в объектах среды (4, 5).
Следует отметить, что сведения об эффектах церий- и кремнийсодержащих наночастиц неоднозначны. На примере пресноводной рыбы Catostomus commersonii показано, что эти наночастицы характеризуются нестабильным проявлением активности (6). Исследования на модели Danio rerio выявили отсутствие токсического и повреждающего влияния (7), продемонстрированы перспективы применения церийсодержащих наночастиц в лечебных целях (8). В то же время получили распространение данные о выраженной токсичности таких материалов, в частности была обнаружена способность НЧ CeO2 вызывать легочные воспаления при тестировании на крысах (9), индуцировать оксидативный стресс и, как следствие, однони-тевые разрывы ДНК (10, 11).
При его оценке в качестве изучаемых параметров выступают продукты перекисного окисления липидов (ПОЛ) в тканях гидробионтов — биоиндикаторов техногенного загрязнения водоема. Однако, анализируя эти результаты, важно учитывать, что фиксируемые показатели могут быть связаны не только с реакцией на антропогенное загрязнение, но и с эндогенными субстратами перекисного окисления в тканях.
Нами впервые изучено действия наночастиц диоксида кремния и церия в условиях водной среды с непосредственной оценкой ферментативной системы биоиндикаторного организма.
Цель работы заключалась в определении биологических эффектов наночастиц CeO2 и SiO2 в водной среде в зависимости от дозы препаратов и способа их поступления.
Методика. Исследования выполнены на модели Danio rerio возрастом 1 мес, отобранных по массе.
Препараты наночастиц SiO2 (d = 40,9 нм) и CeO2 (d = 15,8 нм), использованные в исследованиях, синтезированы газофазным методом в Центре коллективного пользования Казанского национального исследовательского технологического университета им. А.Н. Туполева. Материаловедческая аттестация препаратов включала электронную сканирующую и просвечивающую микроскопию на JSM 7401F и JEM-2000FX («JEOL», Япония), а также рентгенофазовый анализ (дифрактометр ДРОН-7, НПО «Буревестник», Россия). Атомно-силовую микроскопию проводили на микроскопе СММ-2000 (ОАО «ПРОТОН-МИЭТ», Россия). При сканировании использовали кантилеверы MSCT-AUNM («Park Scientific Instru-ments», США) с коэффициентом жесткости k = 0,01 Н/м и радиусом кривизны иглы 15-20 нм. Количественный морфометрический анализ полученных изображений выполняли с помощью штатного программного обеспечения микроскопа.
Аквариумных рыбок Danio rerio (вид пресноводных лучеперых рыб семейства Карповые) возрастом 1 мес ( n = 75) в течение 21 сут содержали в условиях одного аквариумного стенда (V = 300 л). Затем методом параналогов сформировали 5 групп (по n = 15), поместив каждую в отдельный аквариум (V = 10 л, плотность посадки 15 особей), в воду которого добавляли исследуемые наночастицы: в I группе — CeO2 НЧ (10 мг/дм3), во II группе — CeO2 НЧ (100 мг/дм3), в III группе — SiO2 НЧ (10 мг/дм3), в IV группе — SiO2 НЧ (100 мг/дм3); V группа — контроль (без добавления 922
наночастиц). После адаптации модельного объекта в течение 21 сут (предварительный этап эксперимента) наночастицы SiO2 (SiO2 НЧ) и CeO2 (CeO2 НЧ) в форме лиозолей вводили с кормом (личинки комаров Chironomidae ) каждые 7 сут (10 и 100 мг/дм3 корма по группам согласно схеме опыта; в контроле наночастицы не добавляли). Для подготовки лиозолей наночастицы диспергировали в воде и стерилизовали ультразвуком (УЗДН-2Т, «НПП Академприбор», Россия; f-35 кГц, 300 Вт, A-10 мкА, 30 мин). Длительность эксперимента составила 84 сут.
Токсическое действие нанопрепаратов оценивали по выживаемости тест-объекта, рассчитанной как процент живых особей в конце опыта от их исходного числа. Концентрации нанопрепаратов относили к следующим группам токсичности: для выживаемости биоиндикатора 0-39 % — Tox, 50 % — LC 50 , 40-69 % — LOEC и 70-100 % — NOEC.
При определении продуктов перекисного окисления липидов (ПОЛ) и состояния систем антиоксидантной защиты через 7, 14 и 84 сут гомогенизировали по 5 особей Danio rerio (TissueLyser LT, «Qiagen N.V.», Германия). Для приготовления вытяжки к 1 объему гомогената добавляли 9 объемов трис-буферного раствора (Tris-HCl — 50 ммоль/л, дитиотреитол DTT — 1,0 ммоль/л, EDTA — 1,0 ммоль/л, сахароза — 250 ммоль/л, рН 7,5). После центрифугирования (10 мин при 15000 об/мин) отбирали супернатант, в котором измеряли содержание малонового диальдегида (МДА), а также активность ключевых ферментов антиоксидантной защиты — каталазы (КТ, КФ 1.11.1.6) и супероксиддисмутазы (СОД, КФ 1.15.1.1), используя автоматический биохимический анализатор СS-T240 («Dirui Industrial Co., Ltd», Китай) и коммерческие биохимические наборы для ветеринарии («Randox Laboratories, Ltd», Великобритания).
В течение исследования поддерживали средние значения температуры 22±2 ° С, рН 7,3±0,07, концентрацию растворенного кислорода 5±0,2 мг/л; световой режим — 12/12 ч (день/ночь). Рыбок кормили каждые 2 сут. Условия выращивания и содержания объектов соответствовали правилам OECD (Organisation for Economic Co-operation and Development) (12). Эксперименты выполняли в соответствии с протоколами Женевской конвенции и принципами надлежащей лабораторной практики (Национальный стандарт Российской Федерации ГОСТ Р 534342009), а также с инструкциями «The Guide for the Care and Use of Laboratory Animals (National Academy Press Washington, D.C. 1996)». Уход за животными осуществлялся согласно правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.4-96).
Данные представлены в виде среднего ( M ) и стандартной ошибки среднего ( m ). Статистический анализ выполняли с использованием стандартных методик ANOVA (программный пакет Statistica 10.0, «StatSoft Inc.», США) и последующей оценкой надежности по критерию Тьюки (Tukey’s test of additivity») в программе SPSS 17.0 («IBM Corporation», США). Различия считались статистически значимыми при Р < 0,05.
Результаты. В нашем опыте в 1-е сут гибель рыб в присутствии наночастиц обоих элементов не отмечали (данные не приведены). Более длительное воздействие наночастиц повлияло на численность Danio rerio (рис. 1). Первые признаки токсического эффекта CeO2 НЧ в дозе 10 мг/дм3 корма отмечали на 45-е сут, на 56-е сут численность сокращалась на 33 %, на 65-е сут — уже на 54 %, к 84-м сут зафиксировали гибель 100 % тест-объектов. При концентрации CeO2 НЧ 100 мг/дм3 гибель Danio rerio констатировали к 80-м сут.
На 7-е и 28-е сут обе дозы CeO2 НЧ и SiO2 НЧ (10 и 100 мг/дм3)
относились к категории NOEC (выживаемость объекта в пределах 70-100 %). На 56-е сут по CeO2 НЧ обе дозы переходили в группу LOEC (концентрация, сохраняющая 40-69 % выживаемости объекта), тогда как по SiO2 НЧ — оставались в группе NOEC.
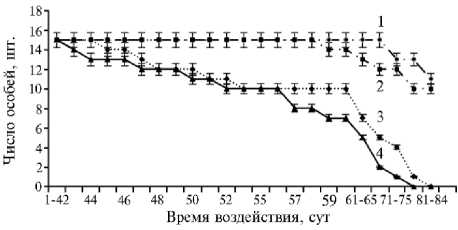
Рис. 1. Динамика численности биоиндикаторного объекта Danio rerio в зависимости от дозы наночастиц SiO 2 (1, 2) и CeO 2 (3, 4) , внесенных с кормом, и срока воздействия: 1, 3 — 10 мг/дм3, 2, 4 — 100 мг/дм3 ( n = 75).
Наконец, на 84-е сут у CeO2 НЧ обе дозы были токсичными (Tox — концентрации, при которых выживаемость объекта составляет 0-39 %), тогда как у SiO2 НЧ эффект дозы 10 мг/дм3 все еще оценивался как NOEC, и только для дозы 100 мг/дм3 категория токсичности изменялась на LOEC.
Отметим, что полученные в этих экспериментах данные о высокой ток- сичности наночастиц церия противоречили нашей рабочей гипотезе, ос-
нованной на цикле работ о способности CeO2 НЧ проявлять антиоксидантные свойства, действуя как аналог супероксиддисмутаз (СОД) и каталаз. Речь шла о нейтрализации свободных радикалов и защите клетки от окислительного повреждения (13). На этом основании авторы предлагали использовать CeO2 НЧ при лечении неврологических расстройств и для защиты клеток от излучения (13, 14). В то же время способность CeO2 провоцировать оксидативный стресс показана на культуре клеток (15, 16) и на модельных объектах — крысах (17, 18) и нематоде Caenor-habditis elegans (19).
Наши данные также демонстрируют необоснованность высказанных предположений (20) о биологической инертности наночастиц диоксида кремния. Так, контакт SiO2 НЧ с тест-объектом проявился снижением выживаемости Danio rerio на 7 %, к концу эксперимента — на 33 %, хотя полной гибели тест-объекта мы не наблюдали. Ранее на фоне применения SiO2 НЧ были выявлены хромосомные аберрации и развитие окислительного стресса (21, 22). На модели Сarassius auratus gibelio (карась) показана способность наночастиц Si/SiO2 вызывать воспалительную реакцию (23). Сходные результаты получены и на других тест-объектах (24-26).
Контакт Danio rerio с CeO2 НЧ и SiO2 НЧ в течение первых 2 нед эксперимента сопровождался снижением со-
держания МДА во всех группах по сравнению с контролем (табл. 1). Так, на 7-е сут содержание МДА снизилось на 11 и 61 % относительно контроля при дозах CeO2 НЧ соответственно 10 и 100 мг/дм3. Для SiO2 НЧ динамика оказалась сходной — уменьшение содержания МДА на 7-е сут на 50,0 и 41,5 % при дозах со-
1. Содержание (мкмоль/л) малонового диальдегида в гомогенатах Danio rerio в зависимости от доз и времени воздействия наночастиц (НЧ) CeO 2 и SiO 2 ( M ± m , n = 75)
|
Нанопрепарат |
10 мг/дм3 |
100 мг/дм3 |
|
Н а 7-е сут |
||
|
CeO 2 НЧ |
0,615±0,011 ∗ |
0,269±0,006 ∗ |
|
SiO 2 НЧ |
0,346±0,008 ∗∗ |
0,404±0,003 ∗∗ |
|
Контроль |
0,691±0,005 |
|
|
Н а 14-е сут |
||
|
CeO 2 НЧ |
0,245±0,003 ∗∗ |
0,251±0,004 ∗ |
|
SiO 2 НЧ |
0,252±0,005 ∗ |
0,269±0,006 ∗ |
|
Контроль |
0,461±0,008 |
|
|
Н а 84-е сут |
||
|
SiO 2 НЧ |
4,100±0,105 ∗ |
4,500±0,095 ∗∗ |
|
Контроль |
0,693±0,001 |
|
|
∗ , ∗∗ Различия с контролем статистически |
значимы соответ- |
|
|
ственно при Р < 0,05 и Р < 0,01. |
||
ответственно 10 и 100 мг/дм3. К 14-м сут эксперимента та же динамика со- хранялась. Увеличение сроков воздействия до 84 сут привело к усилению продукции МДА и, следовательно, к активизации ПОЛ. Так, на фоне SiO2 НЧ концентрация МДА при дозе 10 мг/дм3 превысила контрольные значения в 11 раз, при 100 мг/дм3 — в 12 раз. Аналогичные результаты получены при оценке действия наночастиц кремния на карася (23).
Присутствие наночастиц в корме и в воде повлияло на активность ферментов антиоксидантной защиты (СОД и КТ) у тест-объекта. По СОД у Danio rerio на 7-е сут во всех опытных группах показатель был меньше контроля. Так, в варианте с CeO2 НЧ он снизился на 75 % при дозе нанопрепарата 10 мг/дм3 и на 69 % — при 100 мг/дм3, на фоне SiO2 НЧ — на 50 и 26 % соответственно при дозе 10 и 100 мг/дм3. На 14-е сут активность СОД в присутствии наночастиц различалась в зависимости от их вида. CeO2 НЧ вызывали снижение значений по СОД: для 10 мг/дм3 — на 41 %, для 100 мг/дм3 — на 29 % (табл. 2). При добавлении SiO2 НЧ к корму показатели для СОД превышали таковые в контрольных образцах только на 20-е сут (в 1,96 раза при дозе 10 мг/дм3 и в 1,48 раза — при 100 мг/дм3).
2. Активность каталазы (КТ) и супероксиддисмутазы (СОД) в гомогенатах Danio rerio в зависимости от доз и времени воздействия наночастиц (НЧ) CeO2 и SiO 2 ( M ± m , n = 75)
|
Нанопрепарат |
КТ, мкмоль/л |
СОД, % ингибирования адреналина |
|
доза 10 мг/дм3 доза 100 мг/дм3 |
доза 10 мг/дм3 доза 100 мг/дм3 |
|
|
CeO 2 НЧ SiO 2 НЧ |
Н а 7-е сут 93,1±0,7 ∗ 51,4±0,5 ∗∗ 15,9±0,4 46,9±1,0 ∗ |
17,6±2,8 ∗ 48,5±1,7 ∗ 35,6±1,2 ∗∗ 52,4±2,6 ∗ |
|
Контроль 16,4±0,5 70,6±0,5 Н а 14-е сут CeO 2 НЧ 97,4±2,1 ∗∗ 83,3±2,9 ∗ 28,1±1,5 33,7±1,1 SiO 2 НЧ 77,1±2,8 ∗∗ 29,3±1,4 93,6±3,7 ∗ 70,6±2,1 ∗ Контроль 16,2±0,3 47,6±0,6 Н а 84-е сут SiO 2 НЧ 15,9±0,9 ∗ 20,2±1,1 6,1±0,2 ∗∗ 10,8±1,1 ∗ Контроль 23,1±0,8 59,3±1,8 ∗ , ∗∗ Различия с контролем статистически значимы соответственно при Р < 0,05 и Р < 0,01. |
||
Значительное снижение активности СОД к окончанию экспери- мента вполне ожидаемо и определяется развитием токсических реакций, сходных с описанными ранее в присутствии ксенобиотиков и кадмия (27).
Похожую динамика мы наблюдали и для каталазы (см. табл. 2).
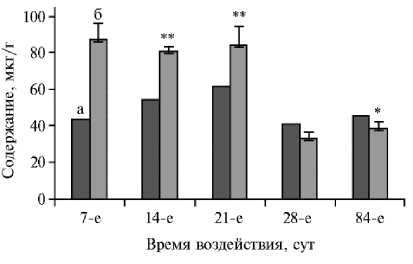
Рис. 2. Содержание кремния в тканых Danio rerio в зависимости от времени воздействия наночастиц SiO2 (100 мг/дм3 воды): а — контроль, б — опыт.
∗ , ∗∗ Различия с контролем статистически значимы соответственно при Р < 0,05 и Р < 0,01.
Таким образом, полученные нами результаты показывают, что на начальных этапах воздействия НЧ на организм происходит заметное снижение функции систем защиты клетки от окислительного стресса. Возможно, это следствие способности НЧ выступать в качестве аналога каталазы и проявлять активность, до некоторой степени сходную с действием СОД (28). Характерно, что активность КТ и СОД, которая изменяется в присутствия CeO2 НЧ и SiO2 НЧ, со временем восстанавливается (29). Поэтому мы полагаем закономерным, что динамика показателей по СОД и КТ у Danio rerio под влиянием наночастиц противоположна описанной ранее для токсических веществ — например, инсектицида имидаклоприда, действие которого выражалось сначала в увеличении активности КТ и СОД, а затем в ее значительном снижении (30).
В этой связи сложно объяснить гибель Danio rerio в эксперименте. Причина могла быть в том, что ультрадисперсная природа частиц оксидов способна привести к их накоплению в тканях у рыб. Это ранее показано в ряде исследований (24, 27, 30). В наших экспериментах подобный факт также имел место, особенно в первые недели, что хорошо видно на примере кремния (рис. 2). Однако в дальнейшем содержание кремния в организме Danio rerio снизилось, вероятно, вследствие работы системы гомеостаза (25). При этом SiO2 НЧ не препятствуют регенерации тканей (23), но способны вызывать как протромботические эффекты, так и увеличения концентрации фибриногена, а также провоспалительных цитокинов в плазме (22, 31). При этом маркеры окислительного стресса (СОД, КТ) остаются не затронутыми (22). Интересное объяснение гибели тестового организма при контакте с НЧ дают S.N. Petrache с соавт. (26), связывая ее с воздействием СеО2 на кишечную палочку, которое сопровождается снижением потребления корма и последующими изменениями в обмене веществ (32). Аналогичные данные приводятся в работе M.C. Arnold с соавт. (33).
Итак, исследованные наночастицы (НЧ) обладают токсическим эффектом, поскольку их поступление в организм Danio rerio (биоиндикатор) сопровождается полной (CeO2 НЧ) или частичной (SiO2 НЧ) гибелью тест-объекта к окончанию эксперимента. В начальный период воздействия отмечается депрессия антиоксидантной системы, но к концу 2-й нед появляются признаки адаптации. Содержание малонового диальдегида при дозе SiO2 НЧ 10 мг/дм3 увеличивается в 11 раз, 100 мг/дм3 — в 12 раз, для CeO2 НЧ отмечены похожие изменения.
Список литературы О токсичности и прооксидантном эффекте наночастиц CeO2 и SiO2 (на модели Danio rerio)
- Roco M.M. The long view of nanotechnology development: the National Nanotechnology Initiative at 10 years. J. Nanopart. Res., 2011, 13: 427-445 ( ) DOI: 10.1007/s11051-010-0192-z
- Keller A.A., McFerran S., Lazareva A., Suh S. Global life cycle releases of engineered nanomaterials. J. Nanopart. Res., 2013, 15: 1692 ( ) DOI: 10.1007/s11051-013-1692-4
- Геращенко И.И. Мембранотропные свойства наноразмерного диоксида кремния. Мед.-биол. аспекты поверхностных явлений, 2009, 1(16): 288-306.
- Jackson P., Raun Jacobsen N., Baun A., Birkedal R., Kühnel D., Alstrup Jensen K., Vogel U., Wallin H. Bioaccumulation and ecotoxicity of carbon nanotubes. Chem. Cent. J., 2013, 7(1): 154.
- Li Y., Li P., Yu H., Bian Y. Recent advances (2010-2015) in studies of cerium oxide nanoparticles’ health effects. Environ. Toxicol. Pharmacol., 2016, 9(44): 25-29 ( ) DOI: 10.1016/j.etap.2016.04.004
- Rundle A., Robertson A.B., Blay A.M., Butler K.M., Callaghan N.I., Dieni C.A., MacCormack T.J. Cerium oxide nanoparticles exhibit minimal cardiac and cytotoxicity in the freshwater fish Catostomus commersonii. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2016, 181-182: 19-26 ( ) DOI: 10.1016/j.cbpc.2015.12.007
- Piccinetti C.C., Montis C., Bonini M., Laurà R., Guerrera M.C., Radaelli G., Vianello F., Santinelli V., Maradonna F., Nozzi V., Miccoli A., Olivotto I. Transfer of silica-coated magnetic (Fe3O4) nanoparticles through food: a molecular and morphological study in Zebrafish. Zebrafish, 2014, 11(6): 567-579 ( ) DOI: 10.1089/zeb.2014.1037
- Ouyang Z., Mainali M.K., Sinha N., Strack G., Altundal Y., Hao Y., Winningham T.A., Sajo E., Celli J., Ngwa W. Potential of using cerium oxide nanoparticles for protecting healthy tissue during accelerated partial breast irradiation (APBI). Phys. Medica, 2016, 32(4): 631-635 ( ) DOI: 10.1016/j.ejmp.2016.03.014
- Morimoto Y., Izumi H., Yoshiura Y., Tomonaga T., Oyabu T., Myojo T., Kawai K., Yatera K., Shimada M., Kubo M., Yamamoto K., Kitajima S., Kuroda E., Kawaguchi K., Sasaki T. Pulmonary toxicity of well-dispersed cerium oxide nanoparticles following intratracheal instillation and inhalation. J. Nanopart. Res., 2015, 17(11): 442 ( ) DOI: 10.1007/s11051-015-3249-1
- Dogra Y., Arkill K.P., Elgy C., Stolpe B., Lead J., Valsami-Jones E., Tyler C.R., Galloway T.S. Cerium oxide nanoparticles induce oxidative stress in the sediment-dwelling amphipod Corophium volutator. Nanotoxicology, 2016, 10(4): 480-487 ( ) DOI: 10.3109/17435390.2015.1088587
- OECD Guideline for Testing of Chemicals. Guideline 203. Fish, Acute Toxicity Test. Organization of Economic Cooperation Development, Paris, France, 1992.
- Ramesh R., Kavitha P., Kanipandian N., Arun S., Thirumurugan R., Subramanian P. Alteration of antioxidant enzymes and impairment of DNA in the SiO2 nanoparticles exposed zebra fish (Danio rerio). Environment Monitoring and Assessment, 2013, 185(7): 5873-5881 ( ) DOI: 10.1007/s10661-012-2991-4
- Tarnuzzer R.W., Colon J., Patil S., Seal S. Vacancy engineered ceria nanostructures for protection from radiation-induced cellular damage. Nano Lett., 2005, 5(12): 2573-2577 ( ) DOI: 10.1021/nl052024f
- Schubert D., Dargusch R., Raitano J., Chan S.W. Cerium and yttrium oxide nanoparticles are neuroprotective. BBRC, 2006, 342(1): 86-91 ( ) DOI: 10.1016/j.bbrc.2006.01.129
- Park E.J., Choi J., Park Y.K., Park K. Oxidative stress induced by cerium oxide nanoparticles in cultured BEAS-2B cells. Toxicology, 2008, 245(1-2): 90-100 ( ) DOI: 10.1016/j.tox.2007.12.022
- Kim I.S., Baek M., Choi S.J. Comparative cytotoxicity of Al2O3, CeO2, TiO2 and ZnO nanoparticles to human lung cells. J. Nanosci. Nanotechnol., 2010, 10(5): 3453-3458 ( ) DOI: 10.1166/jnn.2010.2340
- Das M., Patil S., Patil S., Bhargava N., Kang J.F., Riedel L.M., Seal S., Hickman J.J. Auto-catalytic ceria nanoparticles offer neuroprotection to adult rat spinal cord neurons. Biomaterials, 2007, 28(10): 1918-1925 ( ) DOI: 10.1016/j.biomaterials.2006.11.036
- Srinivas A., Rao P.J., Selvam G., Murthy P.B., Reddy P.N. Acute inhalation toxicity of cerium oxide nanoparticles in rats. Toxicol. Lett., 2011, 205(2): 105-115 ( ) DOI: 10.1016/j.toxlet.2011.05.1027
- Rogers S., Rice K.M., Manne N.D., Shokuhfar T., He K., Selvaraj V., Blough E.R. Cerium oxide nanoparticle aggregates affect stress response and function in Caenorhabditis elegans. SAGE Open Medicine, 2015, 3: 2050312115575387 ( ) DOI: 10.1177/2050312115575387
- Erogbogbo F., Yon K.-T., Roy I., Xu G., Prasad P.N., Swihart M.T. Biocompatible luminescent silicon quantum dots for imaging of cancer cells. ACS Nano, 2008, 2(5): 873-878 ( ) DOI: 10.1021/nn700319z
- Rajiv S., Jerobin J., Saranya V., Nainawat M., Sharma A., Makwana P., Gayathri C., Bharath L., Singh M., Kumar M., Mukherjee A., Chandrasekaran N. Comparative cytotoxicity and genotoxicity of cobalt (II, III) oxide, iron (III) oxide, silicon dioxide, and aluminum oxide nanoparticles on human lymphocytes in vitro. Hum. Exp. Toxicol., 2016, 35(2): 170-183 ( ) DOI: 10.1177/0960327115579208
- Nemmar A., Beegam S., Yuvaraju P., Yasin J., Shahin A., Ali B.H. Interaction of amorphous silica nanoparticles with erythrocytes in vitro: role of oxidative stress. Cell Physiol. Biochem., 2014, 34(2): 255-265 ( ) DOI: 10.1159/000362996
- Stanca L., Petrache S.N., Radu M., Serban A.I., Munteanu M.C., Teodorescu D., Staicu A.C., Sima C., Costache M., Grigoriu C., Zarnescu O., Dinischiotu A. Impact of silicon-based quantum dots on the antioxidative system in white muscle of Carassius auratus gibelio. Fish Physiol. Biochem., 2012, 38: 963-975 ( ) DOI: 10.1007/s10695-011-9582-0
- Serban A.I., Stanca L., Sima C., Staicu A.C., Zarnescu O., Dinischiotu A. Complex responses to Si quantum dots accumulation in carp liver tissue: Beyond oxidative stress. Chem-Biol. Interact., 2015, 239: 56-66 ( ) DOI: 10.1016/j.cbi.2015.06.015
- Nemmar A., Albarwani S., Beegam S., Yuvaraju P., Yasin J., Attoub S., Ali B.H. Amorphous silica nanoparticles impair vascular homeostasis and induce systemic inflammation. Int. J. Nanomed., 2014, 9(1): 2779-2789 ( ) DOI: 10.2147/IJN.S52818
- Petrache S.N., Stanca L., Serban A.I., Sima C., Staicu A.C., Munteanu M.C., Costache M., Burlacu R., Zarnescu O., Dinischiotu A. Structural and oxidative changes in the kidney of crucian carp induced by silicon-based quantum dots. Int. J. Mol. Sci., 2012, 13(8): 10193-10211 ( ) DOI: 10.3390/ijms130810193
- Asagba S.O., Eriyamremu G.E., Igberaese M.E. Bioaccumulation of cadmium and its biochemical effect on selected tissues of the catfish (Clarias gariepinus). Fish Physiol. Biochem., 2008, 34: 61-69 ( ) DOI: 10.1007/s10695-007-9147-4
- Pirmohamed T., Dowding J.M., Singh S., Wasserman B., Heckert E., Karakoti A.S., King J.S., Seal S., Self W.T. Nanoceria exhibit redox state-dependent catalase mimetic activity. Chem. Сommun., 2010, 46: 2736-2738 ( ) DOI: 10.1039/b922024k
- Heckert E.G., Karakoti A.S., Seal S., Self W.T. The role of cerium redox state in the SOD mimetic activity of nanoceria. Biomaterials, 2008, 29: 2705-2709 ( ) DOI: 10.1016/j.biomaterials.2008.03.014
- Ge W., Yan S., Wang J., Zhu L., Chen A., Wang J. Oxidative stress and DNA damage induced by imidacloprid in zebrafish (Danio rerio). J. Agric. Food Chem., 2015, 63(6): 1856-1862 ( ) DOI: 10.1021/jf504895h
- Xie G., Sun J., Zhong G., Shi L., Zhang D. Biodistribution and toxicity of intravenously administered silica nanoparticles in mice. Arch. Toxicol., 2010, 84: 183-190 ( ) DOI: 10.1007/s00204-009-0488-x
- Мирошников С.А., Лебедев С.В. Диапазон концентраций (референтные значения) химических элементов в теле животных. Вестник Оренбургского государственного университета, 2009, 6(112): 241-243.
- Arnold M.C., Badireddy A.R., Wiesner M.R., Di Giulio R.T., Meyer J.N. Cerium oxide nanoparticles are more toxic than equimolar bulk cerium oxide in Caenorhabditis elegans. Arch. Environ. Contam. Toxicol., 2013, 65(2): 224-233 ( ) DOI: 10.1007/s00244-013-9905-5


