О влиянии путресцина и кадаверина на функциональную активность Lactobacillus spp., изолированных из генитального тракта
Автор: Афанасьевская Елизавета Викторовна, Годовалов Анатолий Петрович, Карпунина Тамара Исаковна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Исследовано влияние диаминов бактериального происхождения на функциональную активность клинических штаммов Lactobacillus spp. Установлено дозозависимое действие путресцина на их ростовые характеристики. Кадаверин в концентрации 1 ммоль/л в среде культивирования существенно увеличивал накопление биомассы исследованных культур лактобацилл. Получены экспериментальные данные, подтверждающие дестабилизирующее влияние бактериальных аминов на вагинальные Lactobacillus spp. и, следовательно, их важную непосредственную роль в ослаблении биологической защиты вагинальной микросреды.
Лактобактерии, кадаверин, путресцин, параметры роста
Короткий адрес: https://sciup.org/147239671
IDR: 147239671 | УДК: 616.9:579.864.1:577.112.3 | DOI: 10.17072/1994-9952-2022-3-212-217
Текст научной статьи О влиянии путресцина и кадаверина на функциональную активность Lactobacillus spp., изолированных из генитального тракта
Многочисленные микробиологические исследования последних лет убедительно доказали, что в любом биотопе организма человека существует разнообразная микрофлора, способная в значительной сте-
-
© Афанасьевская Е. В., Годовалов А. П., Карпунина Т. И., 2022
пени влиять на состояние здоровья. В свою очередь, состояние микробных сообществ определяется как микроокружением, так и взаимоотношениями их участников. Среди множества бактериальных метаболитов детектированы разнообразные соединения, «претендующие» на роль межмикробных коммуникаторов. В связи с этим биогенные полиамины (БП) и, прежде всего, кадаверин и путресцин, способные влиять на проявление практически всех функций прокариотических клеток [Нестерова, Цыганов, Ткаченко, 2020; Ткаченко и др., 2020], привлекают внимание исследователей микробиоценоза генитального тракта. Со времен Albert Döderlein (1892) в составе вагинально-цервикальной микробиоты в норме безоговорочно признается доминирующая роль молочнокислых бактерий. Согласно накопленной информации, в микробиоте влагалища может встречаться более десяти видов лактобактерий, состав, количество и функциональное состояние которых постоянно изменяются в зависимости от возраста, гормонального статуса, периода менструального цикла и других факторов. На основе молекулярно-генетических исследований установлено 6 типов вагинальной микробиоты, в 3-4-х из которых лактобактерии составляют более 90% микробного сообщества [Fudaba et al., 2021]. Вместе с тем публикации о влиянии БП микробного происхождения на представителей Lactobacillus , определяющих благополучие в биотопе, в доступной литературе немногочисленны, и преимущественно они посвящены изучению проблемы бактериального вагиноза [Sanderson, White, Balsdon, 1983; Nelson et al., 2015; Borgogna et al., 2021]. В работах J.C. Borgogna et al. показано, что минимальные ингибирующие концентрации путресцина и кадаверина, необходимые для подавления роста вагинальных штаммов Lactobacillus spp., превышают концентрации этих полиаминов, детектируемых при физиологических состояниях у женщин. Авторами установлено, что в максимальных концентрациях, которые были характерны для женщин с типом влагалищной микрофлоры CST IV, путресцин тормозит рост лактобацилл L. crispatus, L. gasseri, L. iners , увеличивая при этом время процесса деления их в среднем на 20–30%. Кадаверин в аналогичных концентрациях также увеличивает время деления и удлиняет лаг-фазу роста бактериальных популяций L. crispatus, L. gasseri, L. jensenii . Более того, даже в физиологических концентрациях кадаверин и путресцин снижают продукцию молочной кислоты штаммами L. iners ( L -изоформа) и L. gasseri ( D - и L -изоформы). Авторами исследования отмечена интересная особенность, которая заключается в том, что вагинальные штаммы L. iners среди представителей других видов лактобактерий оказались менее подвержены негативному влиянию этих диаминов. Установлено, что удлинение лаг-фазы роста вагинальных штаммов лактобактерий под влиянием БП обусловливает переход микробиоты типа CST II в CST IV [Borgogna et al., 2021]. В исследованиях S. Puebla-Barragan et al. [2021] показано, что лактобактерии, предварительно инкубированные в присутствии полиаминов, обладали более выраженной способностью деградировать эти полимеры, а также наибольшей устойчивостью к высоким значениям рН и способностью расти в присутствии полиаминов. Такая ситуация может быть связана с тем, что активность основного фермента метаболизма путресцина и кадаверина – аргининдезиминазы – у лактобактерий зависит от значения рН среды [Rimaux et al., 2011]. Вероятно, лактобактерии при низких значениях рН используют кадаверин и путресцин как источник нутриентов [Puebla-Barragan et al., 2021].
Цель исследования – оценить влияние биогенных полиаминов бактериального происхождения на функциональную активность клинических штаммов Lactobacillus spp.
Материалы и методы исследований
Образцы (15) цервико-вагинального отделяемого женщин репродуктивного возраста были получены при помощи стандартизованных по объему (0.1 мл) ложек Фолькмана. Лактобактерии изолировали на полужидкой молочно-ростовой среде (МРС), в ряде исследований для культивирования использовали Лактобакагар (Оболенск, Россия). Бактерии культивировали при температуре 37ºС в обычных и мик-роаэрофильных условиях при повышенной влажности. Полученные чистые культуры идентифицировали с учетом тинкториальных и культурально-биохимических свойств. Штаммами сравнения служили L. crispatus LMG 9479, L. acidophilus LMG 8151, L. brevis LMG 27275, L. plantarum 8Р-А3. Для изучения кинетики роста бактериальных клеток в питательную среду МРС, разлитую в лунки плоскодонного полистиролового планшета, вносили тест-штаммы и штаммы сравнения. Культивирование осуществляли в течение 72 ч. при 37ºС. Каждый час проводили измерение оптической плотности при длине волны 580 нм на планшетном спектрофотометре PowerWave X (Bio-Tek). Интенсивность накопления бактериальной биомассы оценивали, рассчитывая площадь под кривыми роста с помощью программы Microsoft® Excel® (Microsoft, 2019).
Концентрацию полиаминов определяли с использованием разработанных в лаборатории адаптации микроорганизмов ИЭГМ УрО РАН высокочувствительных флуоресцентных методов, основанных на тонкослойном разделении дансилированных производных этих соединений [Лаврикова, Ахова, Ткаченко, 2020; Шегина, Ахова, Ткаченко, 2020] и методов высокоэффективной жидкостной хроматографии.
Результаты и их обсуждение
При культивировании изолированных клинических штаммов Lactobacillus spp. в более чем в 90% случаев не установлено продукции ими путресцина и кадаверина, в остальных случаях продукцию этих полиаминов регистрировали лишь на следовом уровне.
При оценке влияния путресцина на кинетику роста штаммов Lactobacillus spp. установлено, что для клинических изолятов характерна короткая лаг-фаза, после которой бактериальные клетки переходили в фазу экспоненциального роста. Для штаммов сравнения зарегистрирована более длительная лаг-фаза (рис. 1). По завершении фазы экспоненциального роста уровень накопления биомассы различными штаммами существенно не различался.
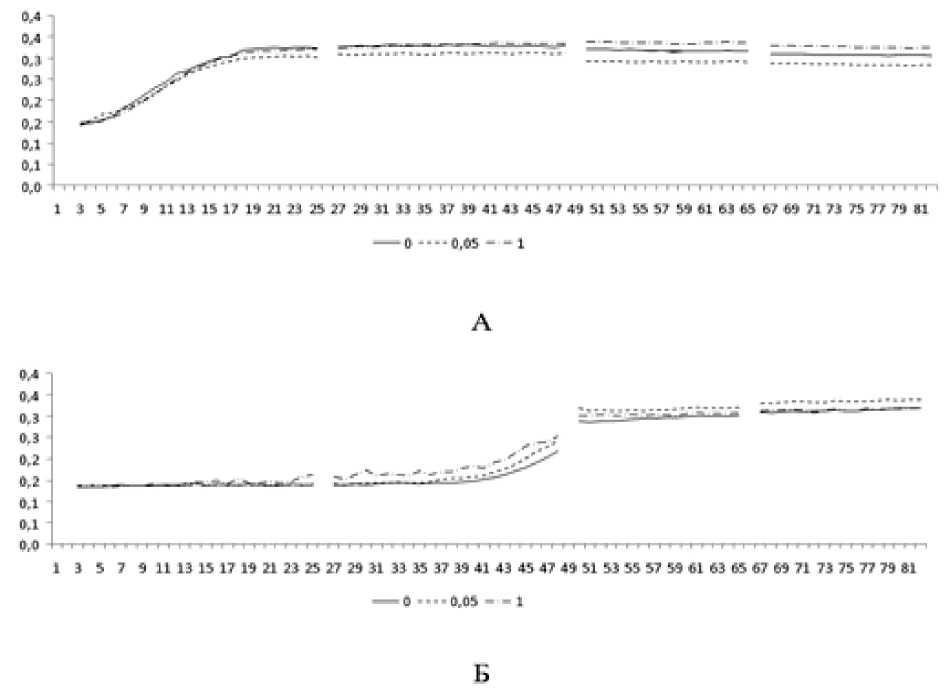
Рис. 1. Влияние путресцина на кинетику роста клинического штамма (А) и штамма сравнения (Б) Lactobacillus spp.
По оси абсцисс – длительность культивирования (час), по оси ординат – объем биомассы (усл. ед. оптической плотности). Линиями обозначены кривые роста при различных концентрациях путресцина (ммоль/л)
[The effect of putrescine on the growth kinetics of clinical strain (A) and comparison strain (Б) Lactobacillus spp. On the abscissa axis – the duration of cultivation (hour), on the ordinate axis – the volume of biomass (conl. units of optical density). The lines indicate the growth curves at different concentrations of putrescine (mmol/l)]
При концентрации путресцина 0.05 ммоль/л в среде культивирования клинических штаммов наблюдали относительно более низкий уровень накопления биомассы, чем у штаммов сравнения. Увеличение концентрации путресцина до 1 ммоль/л повышало биомассу клинических штаммов, а у штаммов сравнения лишь несколько ускоряло фазу экспоненциального роста, не влияя в дальнейшем на накопление биомассы.
Кадаверин в концентрации 1 ммоль/л в среде культивирования существенно увеличивал накопление биомассы как клинических штаммов, так и штаммов сравнения. Однако для штаммов сравнения после завершения фазы экспоненциального роста кривая совпадала с таковой для образцов, культивируемых без кадаверина (рис. 2).
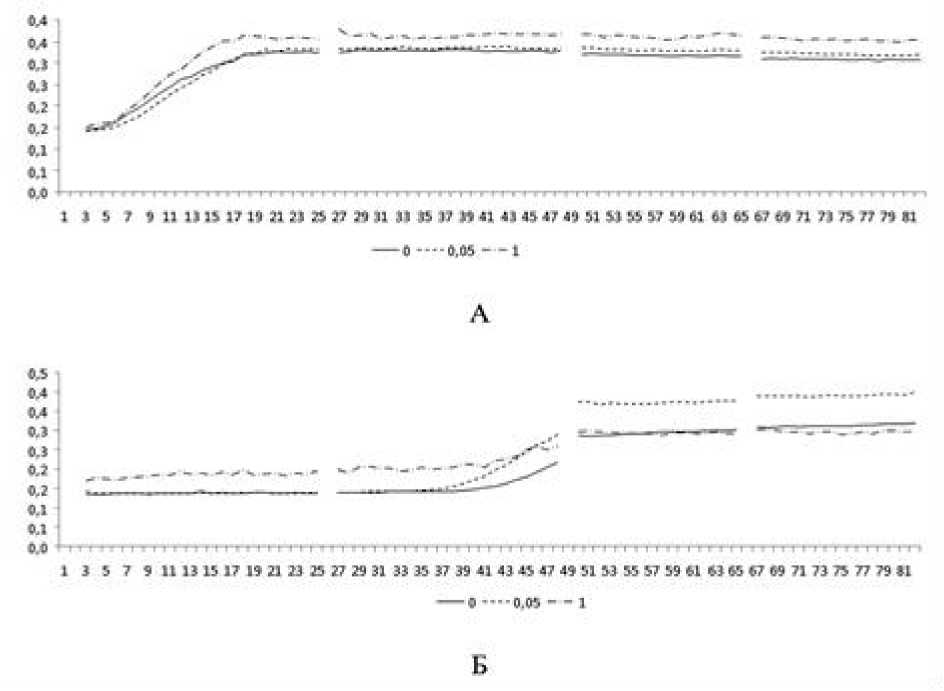
Рис. 1. Влияние кадаверина на кинетику роста клинического штамма (А) и штамма сравнения (Б) Lactobacillus spp.
По оси абсцисс – длительность культивирования (час), по оси ординат – объем биомассы (усл. ед. оптической плотности). Линиями обозначены кривые роста при различных концентрациях кадаверина (ммоль/л)
[The effect of cadaverine on the growth kinetics of clinical strain (A) and comparison strain (Б) Lactobacillus spp. On the abscissa axis – the duration of cultivation (hour), on the ordinate axis – the volume of biomass (conl. units of optical density). The lines indicate the growth curves at different concentrations of cadaverine (mmol/l)]
Заключение
В результате проведенных исследований установлено влияние бактериальных диаминов на ростовые характеристики клинических штаммов лактобактерий, изолированных из цервико-вагинального отделяемого женщин репродуктивного возраста. Ранее в работе [Borgogna et al., 2021] показано, что повышение содержания кадаверина, путресцина и тирамина в отделяемом влагалища было связано с большей вероятностью перехода женщин от вагинальной микробиоты с преобладанием L. crispatus к микробиоте с низким содержанием Lactobacillus spp. Авторы считают, что in vivo увеличение наиболее часто наблюдаемых бактериальных аминов связано с потерей Lactobacillus spp. Более того, БП бактериального происхождения негативно влияют на рост типовых штаммов наиболее распространенных вагинальных лактобацилл и изменяют их продукцию молочной кислоты. Полученные нами результаты подтверждают предположение о том, что бактериальные амины дестабилизируют вагинальные Lactobacillus spp., играя при этом важную и непосредственную роль в ослаблении их защиты вагинальной микросреды. В исследовании E. Kuley с соавт. [2012] показано, что лактобактерии стимулируют продукцию кадаверина и других полиаминов энтеробатериями, которые наиболее часто изолируют из цервико-вагинального биотопа при дисбиотических и неспецифических воспалительных процессах в генитальном тракте. Можно полагать, что при этом формируется «порочный круг»: Lactobacillus spp. стимулируют продукцию полиаминов энтеробактериями, в свою очередь, полиамины укорачивают продолжительность лаг-фазы лактобактерий, сохраняя им жизнеспособность, и способны существенно изменять видовой состав лактобацилл. Такой «порочный круг» можно рассматривать как патогенетическое звено хронизации воспалительного процесса.
Список литературы О влиянии путресцина и кадаверина на функциональную активность Lactobacillus spp., изолированных из генитального тракта
- Лаврикова А.Л., Ахова А.В., Ткаченко А.Г. Продукция кадаверина бактериями в условиях микроаэрации // Химия. Экология. Урбанистика. 2020. Т. 2020-2. С. 122-125.
- Нестерова Л.Ю., Цыганов И.В., Ткаченко А.Г. Влияние биогенных полиаминов на антибиотикочув-ствительность и поверхностные свойства клеток Mycobacterium smegmatis // Прикладная биохимия и микробиология. 2020. Т. 56, № 4. С. 342-351.
- Ткаченко А.Г. и др. Роль полиаминов в регуляции бактериальной персистенции // Вестник Пермского федерального исследовательского центра. 2020. № 2. С. 36-47.
- Шегина Е.С., Ахова А.В., Ткаченко А.Г. Продукция путресцина бактериями в условиях микроаэрации // Химия. Экология. Урбанистика. 2020. Т. 2020-2. С. 216-220.
- Borgogna J.C. et al. Biogenic amines increase the odds of bacterial vaginosis and affect the growth of and lactic acid production by vaginal Lactobacillus spp. // Appl. Environ. Microbiol. 2021. Vol. 87(10). Article e03068-20. DOI: 10.1128/AEM.03068-20.
- Fudaba M. et al. Bioinformatics analysis of oral, vaginal, and rectal microbial profiles during pregnancy: A pilot study on the bacterial co-residence in pregnant women // Microorganisms. 2021. Vol. 9(5). Article 1027. DOI: 10.3390/microorganisms9051027.
- Kuley E. et al. Stimulation of cadaverine production by foodborne pathogens in the presence of Lactobacillus, Lactococcus, and Streptococcus spp. // J. Food Sci. 2012. Vol. 77(12). Article M650-8. DOI: 10.1111/j.1750-3841.2012.02825.x.
- Nelson T.M. et al. Vaginal biogenic amines: biomarkers of bacterial vaginosis or precursors to vaginal dysbiosis? // Front. Physiol. 2015. Vol. 6. Article 253. DOI: 10.3389/fphys.2015.00253.
- Puebla-Barragan S. et al. Interstrain variability of human vaginal Lactobacillus crispatus for metabolism of biogenic amines and antimicrobial activity against urogenital pathogens // Molecules. 2021. Vol. 26(15). Article 4538. DOI: 10.3390/molecules26154538.
- Puebla-Barragan S. et al. The two-way interaction between the molecules that cause vaginal malodour and lactobacilli: An opportunity for probiotics // Int. J. Mol. Sci. 2021. Vol. 22(22). Article 12279. DOI: 10.3390/ijms222212279.
- Rimaux T. et al. The kinetics of the arginine deiminase pathway in the meat starter culture Lactobacillus sakei CTC 494 are pH-dependent // Food Microbiol. 2011. Vol. 28(3). P. 597-604. DOI: 10.1016/j.fm.2010.11.016.
- Sanderson B.E., White E., Balsdon M.J. Amine content of vaginal fluid from patients with trichomoniasis and gardnerella associated nonspecific vaginitis // Br. J. Vener Dis. 1983. Vol. 59. P. 302-305.


