О возможности применения программы Adobe Photoshop для морфометрического анализа цифровых изображений микропрепаратов при проведении иммуногистохимического исследования костного матрикса
Автор: Миханов Василий Александрович, Полякова Валентина Сергеевна, Мхитарян Елена Евгеньевна, Мещеряков Константин Николаевич, Кожанова Татьяна Геннадьевна, Бакаева Назиля Рифкатовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Методы исследования
Статья в выпуске: 4 т.24, 2016 года.
Бесплатный доступ
В статье предложен способ объективной оценки содержания белков костного матрикса (коллаген I, коллаген II и остеокальцин) с использованием программы Adobe Photoshop. Исследование проведено на 70 половозрелых крысах самцах пинии «Вистар», которым формировали открытый поперечный перелом средней трети диафиза большеберцовой кости. В опытной группе (ОГ) животным в область перелома на 1 и 2 сутки вводили по 0,5 мл препарата «Винфар», содержащего метаболиты культуры Bacillus subtillis 804, в контрольной группе (КГ) - 0,5 мл 0,9% NaCl. Для оценки содержания белков костного матрикса на 3, 21, 44 и 61 сутки остеорепаративного процесса применяется анализ цифровых микрофотографий иммуногистохимичєских препаратов при помощи программы Adobe Photoshop Extended с вычислением площадей участков структур, содержащих исследуемые белки, с последующим объективным и точным вычислением их относительного содержания в тканях по формуле: ООП (%) = (Sa / St) x100, где ООП - относительная объемная плотность, Sa - суммарная площадь всех выделенных областей в анализируемом изображении, St - общая площадь цифрового изображения...
Морфометрия, переломы костей
Короткий адрес: https://sciup.org/143177136
IDR: 143177136
Текст научной статьи О возможности применения программы Adobe Photoshop для морфометрического анализа цифровых изображений микропрепаратов при проведении иммуногистохимического исследования костного матрикса
Введение. В настоящее время все проводимые исследования в области как экспериментальной, так и клинической медицины требуют объективной оценки полученных результатов [1]. Не являются исключением и многочисленные работы, посвященные изучению проблем репаративной регенерации клеток, тканей и органов, в том числе и посттравматической регенерации костной ткани [2, 3]. В связи с чем, возникла необходимость в объективной количественной оценке процесса заживления переломов костей в условиях эксперимента. Одной из характеристик, отражающих состояние репаративного процесса костной ткани является оценка содержания белков костного матрикса в гистологических срезах. Все известные в настоящее время методы оценки содержания структур в гистологических срезах основаны на принципах и методах системной морфометрии и стереологии, основополагающими из которых являются способы определения относительной объёмной плотности тканевых микроструктур: 1) метод наложения точечных сеток (метод «полей» А.А. Глаголева) и 2) метод суммирования линий сканирования [4]. Недостатками вышеперечисленных способов является наличие многочисленных, зачастую трудновыполнимых условий для получения объективных данных: необходимость многократных измерений, трудоёмкость применения окулярной точечной сетки, окулярной тестовой линии сканирования или аналогичных измерительных сеток и линий, но адаптированных для микрофотографий, «ручной» подсчёт элементов, большие затраты времени, большая погрешность измерений из-за размытости границ гистохимической окраски структур и субъективной оценки свето- и цветовосприятия, что в совокупности усложняет использование этого метода для решения крупных научных задач. Несмотря на то, что в настоящее время на рынке предлагаются аппаратно-программные комплексы для морфометрии, которые пригодны для объективной оценки содержания биоструктур в гистологических препаратах [5-8], все они не лишены главного их недостатка – дороговизны, что значительно ограничивает их широкое распространение и практическое применение. Для устранения недостатков выше описанных способов при определении относительной объёмной плотности (ООП) белков костного матрикса на разных сроках остеорепа-ративного процесса предлагается метод, основанный на анализе цифровых микрофотографий иммуногистохимических препаратов при помощи программы Adobe Photoshop Extended.
Цель исследования – расширение арсенала способов и повышение точности сравнительной оценки содержания белков костного матрикса на разных сроках остеорепаративного процесса.
Материал и методы исследования. Экспериментальное исследование проведено на 70 половозрелых крысах самцах линии «Вистар». Все исследования на животных были выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приказ Минвуза СССР от 13.11.1984 г. № 724). Животным под ингаляционным наркозом формировали открытый поперечный перелом средней трети диафиза левой большеберцовой кости. В опытной группе (ОГ) животным в область перелома на 1 и 2 сутки эксперимента вводили по 0,5 мл препарата «Винфар», содержащего метаболиты культуры Bacillus subtillis 804 [9], в контрольной группе (КГ) – 0,5 мл физ. раствора. Осуществлена естественная иммобилизация посредством сохранившей целостность малоберцовой кости. Животных выводили из опыта на 3, 21, 44 и 61 сутки. Исследования проводили с использованием иммуногистохимических методов и морфометрии. При проведении иммуногистохимических методов исследования для выявления экспрессии Osteocalcin (маркер созревания костной ткани), collagen II (маркер хондрогенеза) и collagen I (в нашем исследовании – маркер остеогенеза) использовались соответственно антитела anti-Osteocalcine («SPRING Bioscience», США), antiCollagene II Type и anti-Collagene I Type («GeneTex», США). Используемая система детекции - Reveal Polyvalent HRP – DAB Detection System («SPRING Bioscience», США). Далее делали цифровые микрофотографии зоны периостальной и эндостальной костной мозоли, которые загружали в компьютерную программу Adobe Photoshop CS6 Extended с последующим выделением и вычислением в исследуемом цифровом изображении площади участков иммуногистохимически окрашенных структур, содержащих определяемые белки (остеокальцин, коллаген I или коллаген II) в относительных значениях (вычисление относительной объемной плотности - ООП), в пределах исследуемого гистосреза на 1 цифровой микрофотографии (равной 1 полю зрения) при увеличении х300 минимум в 5 полях зрения (микрофотографий) для каждого показателя. Для этого цифровой фотоснимок загружали в программу Adobe Photoshop CS6 Extended (подходят и более ранние CS3, CS4, CS5 версии программы) и в левой колонке панели инструментов выбирали инструмент «Волшебная палочка», после чего кликали по вкладке главного меню «Выделение», и в открывшемся меню выбирали «Цветовой диапазон» – инструмент обеспечивающий выбор области в изображении по тональности или цвету. Далее в открывшемся диалоговом окне инструментом «Пипетка» в области цифровой микрофотографии выбирали участок нужного цвета и тональности, соответствующий цвету и тональности преципитирующего специфического хромогена соответствующей системы детекции применяемой в ходе иммуногистохимического окрашивания гистологического препарата. После выбора «Пипеткой» нужного цвета на всей площади цифровой микрофотографии автоматически выделялись области подобного цвета и тональности. Далее границы выделенных областей расширяли или сокращали в зависимости от избыточности или недостаточности включения в области выделения пикселей тех оттенков и тональностей цвета, что соответствуют цвету шаблона используемой системы детекции. Для этого в правой стороне диалогового окна «Цветовой диапазон» выбирали пипетку со знаком «+» или «-», а также использовали опцию «Разброс» для установки приемлемого диапазона яркости выделяемых пикселей, от настройки параметров которой так же будут зависеть границы выделяемой области. После необходимой коррекции по яркости включаемых в область выделения пикселей формируются окончательные, уточнённые путем настройки выше описанных параметров, границы выделенных областей цифровой микрофотографии, суммарная относительная площадь которой и будет соответствовать относительной объёмной плотности белков внеклеточного матрикса проявивших себя в цифровом изображении окраской соответствующей цвету специфического хромогена (в нашей работе хромоген DAB образует темно-коричневые преципитаты). Для того чтобы при анализе следующего цифрового изображения гистологических препаратов той же ткани, окрашенной теми же иммуногистохимическими реактивами не повторять коррекцию границ областей выделения и нивелировать субъективность (а значит и возможные ошибки) при каждой такой коррекции, мы сохраняли шаблон настроенных параметров инструмента уже откорректированных границ. Далее во вкладке главного меню «Окно» выбирали строку «Журнал измерений» и открывшемся диалоговом окне кликали на опцию «Записать измерения» после чего автоматически формировалась таблица с различными рассчитанными параметрами выделенных областей изображения. Числовое значение первой строки «Измерение 1» в столбце «Площадь» соответствовало суммарной площади всех выде- ленных областей в анализируемом изображении, содержащих исследуемый белок (Sa). Единицей измерения по умолчанию является пиксел. Общая площадь цифрового изображения (St) зависит от разрешения микрофотографии, соответствует произведению значений строки «Измерение 1» в столбцах «Высота» и «Ширина» и всегда одинакова при условии одинакового разрешения всех анализируемых цифровых изображений, что значительно упрощает вычисление ООП по следующей формуле: ООП (%)=(Sa/St)×100. При проведении статистической обработки результатов вычисляли средние значения абсолютных и относительных величин (M), ошибки средних величин (m) и t-критерий Стьюдента. Различия средних величин считали достоверными при уровне значимости р <0,05.
Результаты исследования и их обсуждения. На 3 сутки у животных контрольной группы (КГ) в периостальной зоне перелома синтез остеокальцина незначителен и составляет 0,218±0,009%, тогда как в опытной группе (ОГ) ООП остеокальцина в 2 раза выше – 0,423±0,013% (рис. 1А). Экспрессия коллагена I типа в ОГ (ООП 9,40±0,62%) больше таковой группы контроля (ООП 3,92±0,31%) почти в 3 раза (рис. 2А). У животных контрольной группы ООП коллагена II типа составляет 4,77±0,11%, что незначительно превышает данный показатель в ОГ (ООП коллагена II типа 4,03±0,08%) (рис. 3А). В эндостальной костной мозоли на 3 сутки эксперимента содержание остеокальцина в ОГ вдвое больше КГ и незначительно превышает аналогичные показатели периостальной зоны (ООП остеокальцина КГ 0,293±0,011% и ООП остеокальцина КГ 0,579±0,013%) (рис. 1Б). ООП коллагена I типа в эндостальной мозоли в обеих группах троекратно (рис. 2Б), а ООП коллагена II типа – четырехкратно меньше, чем в периостальной мозоли (рис. 3Б). На 21 сутки у животных КГ в периостальной зоне перелома ООП экспрессия коллагена I типа в ОГ (ООП 20,7±1,01%) на этом сроке возрастает и, по-прежнему, больше таковой группы контроля (ООП 11,25±1,12%). У животных контрольной группы ООП коллагена II типа составляет 19,16±0,98%, в ОГ ООП коллагена II типа – 12,55±0,52%. В эндостальной костной мозоли на 21 сутки эксперимента содержание остеокальцина в КГ (ООП 0,747±0,008%) незначительно превышает ОГ (ООП 0,621±0,013%). На 44 сутки у животных КГ в периостальной зоне перелома ООП остеокальцина составляет 1,156±0,034%, а в ОГ ООП остеокальцина уже на данном сроке достигает значений (ООП 1,582±0,026%) близких с ООП нормальной (около 1,6%) костной ткани [10]. Экспрессия коллагена I типа в ОГ (ООП 42,43±2,21%) на этом сроке двукратно возрастает и, по-прежнему,
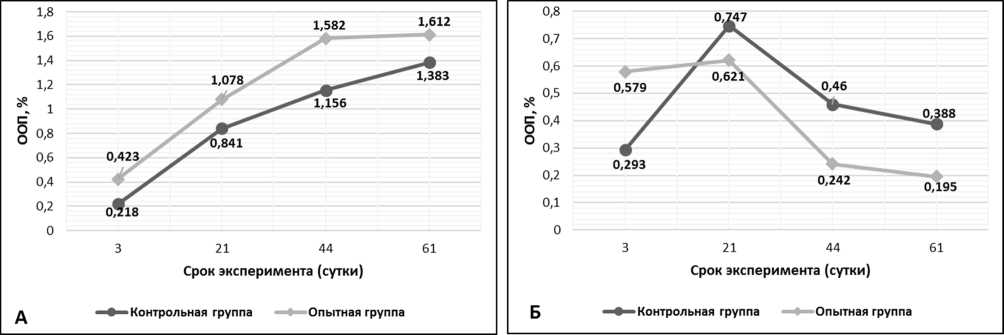
Рис. 1. Относительная объемная плотность (ООП) остеокальцина на разных сроках заживления перелома кости: А) ООП остеокальцина в периостальной мозоли, Б) ООП остеокальцина в эндостальной мозоли.
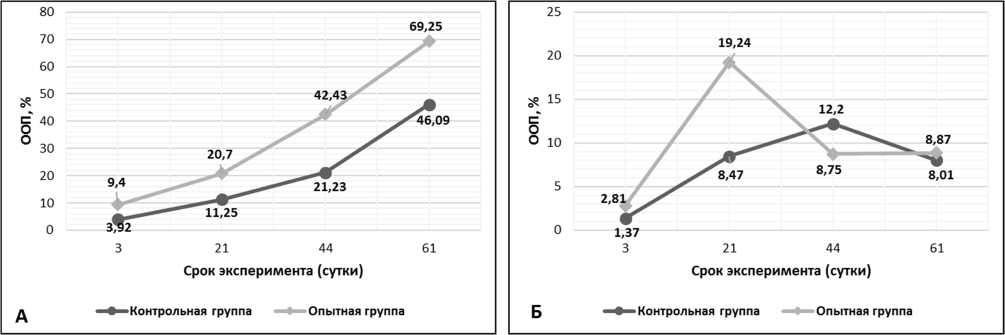
Рис. 2. Относительная объемная плотность (ООП) коллагена I типа на разных сроках заживления перелома кости: А) ООП коллагена I типа в периостальной мозоли, Б) ООП коллагена I типа в эндостальной мозоли.
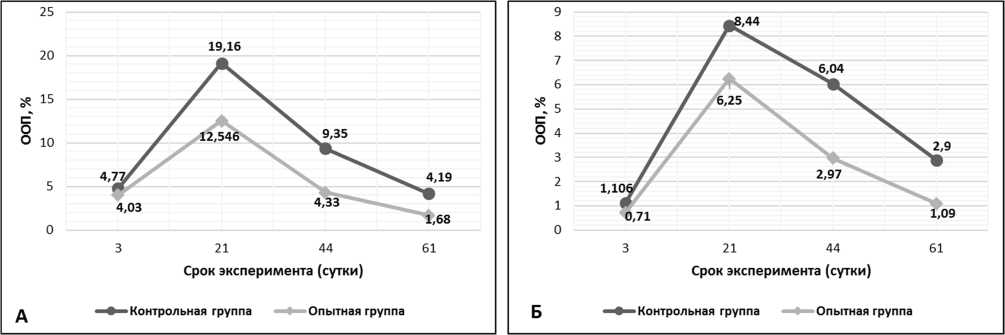
Рис. 3. Относительная объемная плотность (ООП) коллагена II типа на разных сроках заживления перелома кости: А) ООП коллагена II типа в периостальной мозоли, Б) ООП коллагена II типа в эндостальной мозоли.
двукратно больше таковой группы контроля (ООП 21,23±1,94%). У животных контрольной группы ООП коллагена II типа составляет 9,35±0,97%, в ОГ ООП коллагена II типа – 4,33±0,82%, т.е. происходит уменьшение экспрессии коллагена II в обеих группах по сравнению с предыдущим сроком, из-за остеогенной реорганизацией периостальной мозоли, что так же подтверждается увеличением ООП коллагена I типа, см. выше. В эндостальной костной мозоли на 44 сутки эксперимента содержание остеокальцина продолжает уменьшаться в обеих группах животных, и, по-прежнему, в КГ ООП (0,460±0,017%) двукратно превышает ООП остеокальцина ОГ (0,242±0,028%) из-за более выраженной редукции эндостальной мозоли в ОГ по сравнению с контролем. ООП коллагена I типа эндостальной мозоли в КГ все еще увеличивается – 12,2±0,49%, тогда как в ОГ уменьшается – 8,75±0,53%, подтверждая развитие эндостальной мозоли в КГ и продолжение процесса её редукции в ОГ на данном сроке эксперимента. ООП коллагена II типа КГ – 6,04±0,12%, в ОГ – 2,97±0,47%. На 61 сутки экспрессия коллагена I типа в ОГ (ООП 69,25±2,23%) возрастает более чем на треть и на треть больше таковой группы контроля (ООП 46,09±1,74%), на данном сроке достигая значений близких с ООП коллагена I нормальной (около 70,0%) костной ткани [10]. ООП коллагена I типа эндостальной мозоли в КГ начинает уменьшаться только на 61 сутки – 8,87±0,05%, подтверждая начавшийся процесс редукции эндостальной мозоли, тогда как в ОГ ООП коллагена I типа составляет 8,01±0,02%, достигая значений близких с ООП коллагена I нормальной костной ткани (около 7,0-8,0%). ООП коллагена II типа эндостальной мозоли в КГ – 2,9±0,03%, в ОГ – 1,09±0,02%.
Заключение. Таким образом, определение ООП коллагеновых и неколлагеновых белков эндостальной и периостальной мозолей по формуле: ООП (%) = (Sa / St) ×100, при автоматическом выделении и вычислении с помощью программы Adobe Photoshop Extended в цифровых изображениях площадей участков структур, содержащих исследуемые белки, позволяет объективно определить динамику заживления открытого перелома кости в эксперименте, что в примере конкретного использования подтверждается более ранними сроками консолидации перелома диафиза большеберцовой кости в опытной группе животных при применении препарата «Винфар», в результате проявленного ангиогенного воздействия входящего в его состав метаболитов культуры Bacillus subtillis 804, а также влияния на пролиферативную активность клеток хондрогенного и остеогенного дифферонов, ответственных за синтез соответствующих белков костного матрикса.
Список литературы О возможности применения программы Adobe Photoshop для морфометрического анализа цифровых изображений микропрепаратов при проведении иммуногистохимического исследования костного матрикса
- Клюшин, Д.А. Доказательная медицина. Применение статистических методов/Д.А. Клюшин, Ю.И. Петунин. - М.: «Диалектика», 2007. - С. 320
- Попков А. В. Стимуляция репаративной регенерации костной ткани при диафизарных переломах (экспериментальное исследование) /А. В. Попков, Д. А. Попков, Ю. М. Ирьянов и др. // Международный журнал прикладных и фундаментальных исследований. - 2014. - №9. - С. 82-88.
- Chen K., Hao J., Noritake K., et al. Low intensity pulsed ultrasound stimulation (LIPUS) has been clinically applied to promote bone fracture healing in the orthopedic field. Open Journal of Regenerative Medicine. 2013; 2(1): 8-14.
- Автандилов, Г.Г. Компьютерная микротелефотометрия в диагностической гистопатологии / Г.Г. Автандилов. - Москва: РМАПО, 1996. - С 54-57.
- Ирьянов, Ю.М. Переносной аппаратно-программный комплекс и возможности его применения в гистологических исследованиях/ Ю.М. Ирьянов, Т.А. Силантьева, Е.Н. Горбач, Т.Ю. Ирьянова//Гений Ортопедии. - 2004. - №3. - С. 96-98.
- Шереметьева, Т. А. Обработка изображений и морфометрические измерения объектов в микроскопии / Т. А. Шереметьева, А.М. Малов, Г.Н. Филиппов //Известия ВУЗов. Приборостроение. - 2009. - Т.52, №8. - С. 68-73.
- Спиридонов, И.Н. Аппаратно-программный комплекс морфометрии новообразований кожи / И.Н. Спиридонов, К.Г. Кудрин, И.И. Решетов, О.В. Маторин // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. - 2010. - №1. - С.28-33.
- Шереметьева, Т. А. Программный комплекс интерактивной обработки изображений в цифровой микроскопии / Т. А. Шереметьева, В.Г. Шереметьев // Оптический журнал. - 2011. - Т. 78, № 1. - С.74-76.
- Свидетельство на товарный знак (знак обслуживания) № 433087 «Винфар». / Правообладатель Никитенко В.И. Зарегистрировано 23 марта 2011 г.
- Вавилова Т. П. Биохимия тканей и жидкостей полостей рта: учебное пособие. - 2-е изд., испр. и доп. - 2008. - 208 с.


