Об электронной структуре мономеров катионной полимеризации 4, 6-диметилиндена и 5, 7-диметилиндена
Автор: Бабкин Владимир Александрович, Андреев Дмитрий Сергеевич, Петров Владислав Владимирович, Стоянов Олег Владиславович
Журнал: НБИ технологии @nbi-technologies
Рубрика: Технико-технологические инновации
Статья в выпуске: 2 (21), 2016 года.
Бесплатный доступ
В настоящей статье представлены квантово-химические расчеты молекул 4,6-диметилиндена и 5,7-диметилиндена методом PM3 с оптимизацией геометрии по всем параметрам градиентным методом. Получено оптимизированное геометрическое и электронное строение этих соединений. Теоретически оценена их кислотная сила ( р Ка = 23). Установлено, что молекулы 4,6-диметилиндена и 5,7-диметилиндена относятся к классу очень слабых кислот ( p Ka > 14).
Квантово-химический расчет, метод pm3, 6-диметилинден, 7-диметилинден, кислотная сила
Короткий адрес: https://sciup.org/14968426
IDR: 14968426 | УДК: 547.64:544.183.26 | DOI: 10.15688/jvolsu10.2016.2.5
Текст научной статьи Об электронной структуре мономеров катионной полимеризации 4, 6-диметилиндена и 5, 7-диметилиндена
DOI:
Первые исследования по катионной полимеризации мономеров 4,6-диметилиндена и 5,7-диметилиндена были выполнены еще в начале 70-х гг. XX столетия. Например, в работах [10; 11] изучали влияние различных кислот Льюиса (TiCl4, BF8, OR2 и SbCl4, AlBr8, SbCl4) и H2SO4 в металенхлориде при -20 и -72 °С на выход и характеристическую вязкость поли-4,6-диметилиндена. Наибольшую вязкость имели продукты, полученные с BF8 * ОМе2. В присутствии BF8 * OR2 температура не сильно влияет на характеристическую вязкость. Также относительно высокомолекулярные продукты получены и в присутствии TiCl4. С этой кислотой Льюиса наибольшее значение Mn (молекулярная масса полимера) 20 000 при -30 °С и 120 000 при -72 °С. Энтальпия полимеризации составляла 18,5 ± 0,9 ккал/моль. Эти же авторы (Марешаль и сотрудники) [8] первыми синтезировали мономер 5,7-диметилиндена и изучили его катионную полимеризацию. Авторы использовали различные кислоты Льюиса, например TiCl4, SnCl4, AlBr8 и SbCl4, в 1,2-дихлорэтане или метиленхлориде при -30 и -72 °С. В присутствии этих инициаторов были получены продукты сравнительно низкого молекулярного веса, и полимеризация совсем не проходила в присутствии BF8 * ОМе2 и BF8 * OEt2. При -30 °С в присутствии TiCl4 этот мономер сополимеризуется с инденом, константы сополимеризации имеют следующие значения: r5,7-диM... = 3,80 ± 0,04, rln = 0,10 ± 0,05. Очевидно, по отношению к катиону индена 5,7-диметилинден гораздо активнее, чем сам инден. Это весьма неожиданный и трудно объяснимый результат. В публикации [10] Марешаль привел данные по исследованию влияния различных условий на выход и среднечисловой молекулярный вес поли-5,7-диметилиндена. Среди использованных активных инициаторов, например TiCl4, SnCl4, AlBr3, SbCl5..., и H2SO4, продукт с относительно высокой характеристической вязкостью при 100 %-м выходе был получен в присутствии AlBr3 в метиленхло-риде при -30 °С и при -72 °С [4; 8; 10; 11]. Другая информация по полимеризации этих мономеров практически отсутствует. И осо- бенно это касается механизмов элементарных актов этих процессов, и в частности, механизмов инициирования, роста и обрыва материальной цепи на электронном уровне. Первым шагом в решении этого комплекса задач является изучение геометрического и электронного строения этих мономеров, что в дальнейших исследованиях, очевидно, позволит выработать стратегию изучения механизмов элементарных актов. Теоретическими и, в частности, методом квантовой химии MNDO уже предприняты первые попытки изучения геометрического и электронного строения этих соединений [1; 2].
Однако геометрическое и электронное строение мономеров катионной полимеризации 4,6-диметилиндена и 5,7-диметилиндена лучше изучать квантово-химическим методом PM3, специально параметризованным для расчета многовалентных атомов и циклических соединений [6], к которым и относятся исследуемые мономеры.
В связи с этим, целью настоящей работы является квантово-химический расчет изучаемых мономеров 4,6-диметилиндена и 5,7-диметилиндена PM3 с оптимизацией геометрии по всем параметрам градиентным методом, встроенным в программу Firefly [7], который частично основан на исходном коде GAMESS (US) [12], в приближении изолированной молекулы в газовой фазе и теоретической оценки их кислотной силы. Для визуального представления модели молекулы использовалась программа MacMolPlt [9].
Результаты расчетов
Оптимизированное геометрическое и электронное строение и квантово-химические характеристики молекул 4,6-диметилин-дена и 5,7-диметилиндена, полученные методом PM3, показаны на рисунках 1–2 и в таблицах 1–3. Используя формулу р Ка = 42,936 – 165,11 q max H+ , полученную авторами по методике [5] ( q max H+ = +0,12 – максимальный заряд на атомах водорода данных молекул; р Ка – универсальный показатель кислотности, см. табл. 1–3), находим значение кислотной силы, равное р Ка = 23.
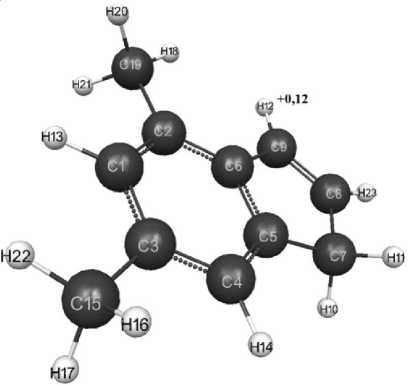
Рис. 1. Геометрическое и электронное строение молекулы 4,6-диметилиндена (метод PM3) ( Е 0 = -143 547 кДж/моль)
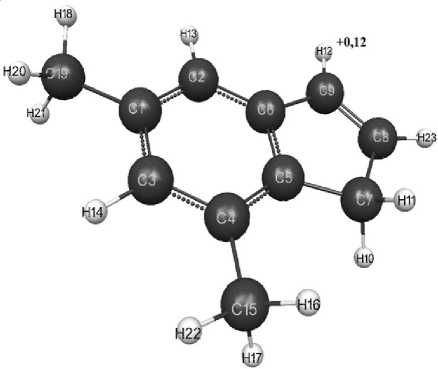
Рис. 2. Геометрическое и электронное строение молекулы 5,7-диметилиндена (метод PM3) ( Е 0 = -143 548 кДж/моль)
Таблица 1
Оптимизированные длины связей, валентные углы и заряды на атомах молекулы 4,6-диметилиндена (метод PM3)
|
Длины связей |
R , Å |
Валентные углы |
Град |
Атом |
Заряды на атомах молекулы |
|
C(2)-C(1) |
1,40 |
С(2)-С(1)-С(3) |
122 |
C(1) |
-0,11 |
|
C(2)-C(19) |
1,48 |
С(1)-С(3)-С(4) |
120 |
C(2) |
-0,04 |
|
C(3)-C(1) |
1,39 |
С(3)-С(4)-С(5) |
118 |
C(3) |
-0,07 |
|
C(3)-C(15) |
1,49 |
С(2)-С(6)-С(5) |
121 |
C(4) |
-0,09 |
|
C(4)-C(3) |
1,40 |
С(1)-С(2)-С(6) |
118 |
C(5) |
-0,08 |
|
C(5)-C(4) |
1,38 |
С(4)-С(5)-С(6) |
121 |
C(6) |
-0,07 |
|
C(6)-C(2) |
1,39 |
С(4)-С(5)-С(7) |
130 |
C(7) |
-0,02 |
|
C(6)-C(5) |
1,42 |
С(6)-С(5)-С(7) |
109 |
C(8) |
-0,16 |
|
C(7)-C(5) |
1,50 |
С(5)-С(7)-С(8) |
103 |
C(9) |
-0,09 |
|
C(8)-C(7) |
1,51 |
С(6)-С(9)-С(8) |
109 |
H(10) |
+0,08 |
|
C(9)-C(8) |
1,35 |
С(2)-С(6)-С(9) |
131 |
H(11) |
+0,08 |
|
C(9)-C(6) |
1,46 |
С(5)-С(6)-С(9) |
108 |
H(12) |
+0,12 |
|
H(10)-C(7) |
1,11 |
С(7)-С(8)-С(9) |
111 |
H(13) |
+0,11 |
|
H(11)-C(7) |
1,11 |
С(5)-С(7)-Н(10) |
112 |
H(14) |
+0,11 |
|
H(12)-C(9) |
1,09 |
С(8)-С(7)-Н(10) |
112 |
C(15) |
-0,07 |
|
H(13)-C(1) |
1,10 |
С(5)-С(7)-Н(11) |
112 |
H(16) |
+0,05 |
|
H(14)-C(4) |
1,09 |
С(8)-С(7)-Н(11) |
112 |
H(17) |
+0,05 |
|
H(16)-C(15) |
1,10 |
Н(10)-С(7)-Н(11) |
107 |
H(18) |
+0,05 |
|
H(17)-C(15) |
1,10 |
С(6)-С(9)-Н(12) |
123 |
C(19) |
-0,06 |
|
H(18)-C(19) |
1,10 |
С(8)-С(9)-Н(12) |
127 |
H(20) |
+0,05 |
|
H(20)-C(19) |
1,10 |
С(2)-С(1)-Н(13) |
119 |
H(21) |
+0,05 |
|
H(21)-C(19) |
1,10 |
С(3)-С(1)-Н(13) |
120 |
H(22) |
+0,04 |
|
H(22)-C(15) |
1,10 |
С(3)-С(4)-Н(14) |
121 |
H(23) |
+0,11 |
|
H(23)-C(8) |
1,09 |
С(5)-С(4)-Н(14) |
121 |
||
|
С(1)-С(3)-С(15) |
120 |
||||
|
С(4)-С(3)-С(15) |
119 |
||||
|
С(3)-С(15)-Н(16) |
111 |
||||
|
С(3)-С(15)-Н(17) |
111 |
||||
|
Н(16)-С(15)-Н(17) |
107 |
||||
|
С(2)-С(19)-Н(18) |
112 |
Окончание таблицы 1
|
Длины связей |
R , Å |
Валентные углы |
Град |
Атом |
Заряды на атомах молекулы |
|
С(1)-С(2)-С(19) |
120 |
||||
|
С(6)-С(2)-С(19) |
122 |
||||
|
С(2)-С(19)-Н(20) |
111 |
||||
|
Н(18)-С(19)-Н(20) |
108 |
||||
|
С(2)-С(19)-Н(21) |
111 |
||||
|
Н(20)-С(19)-Н(21) |
108 |
||||
|
Н(18)-С(19)-(21) |
108 |
||||
|
С(3)-С(15)-Н(22) |
112 |
||||
|
Н(17)-С(15)-Н(22) |
108 |
||||
|
Н(16)-С(15)-Н(22) |
108 |
||||
|
С(7)-С(8)-Н(23) |
122 |
||||
|
С(9)-С(8)-Н(23) |
127 |
Таблица 2
Оптимизированные длины связей, валентные углы и заряды на атомах молекулы 5,7-диметилиндена (метод PM3)
|
Длины связей |
R , Å |
Валентные углы |
Град |
Атом |
Заряды на атомах молекулы |
|
C(1)-C(19) |
1,49 |
С(2)-С(1)-С(3) |
121 |
C(1) |
-0,08 |
|
C(2)-C(1) |
1,40 |
С(1)-С(3)-С(4) |
121 |
C(2) |
-0,08 |
|
C(3)-C(1) |
1,40 |
С(3)-С(4)-С(5) |
118 |
C(3) |
-0,11 |
|
C(4)-C(3) |
1,40 |
С(2)-С(6)-С(5) |
121 |
C(4) |
-0,05 |
|
C(4)-C(15) |
1,48 |
С(1)-С(2)-С(6) |
118 |
C(5) |
-0,10 |
|
C(5)-C(4) |
1,39 |
С(4)-С(5)-С(6) |
121 |
C(6) |
-0,05 |
|
C(6)-C(2) |
1,38 |
С(4)-С(5)-С(7) |
130 |
C(7) |
-0,02 |
|
C(6)-C(5) |
1,41 |
С(6)-С(5)-С(7) |
109 |
C(8) |
-0,15 |
|
C(7)-C(5) |
1,50 |
С(5)-С(7)-С(8) |
103 |
C(9) |
-0,10 |
|
C(8)-C(7) |
1,51 |
С(6)-С(9)-С(8) |
109 |
H(10) |
+0,08 |
|
C(9)-C(8) |
1,35 |
С(2)-С(6)-С(9) |
131 |
H(11) |
+0,08 |
|
C(9)-C(6) |
1,46 |
С(5)-С(6)-С(9) |
108 |
H(12) |
+0,12 |
|
H(10)-C(7) |
1,11 |
С(7)-С(8)-С(9) |
111 |
H(13) |
+0,11 |
|
H(11)-C(7) |
1,11 |
С(5)-С(7)-Н(10) |
112 |
H(14) |
+0,11 |
|
H(12)-C(9) |
1,09 |
С(8)-С(7)-Н(10) |
112 |
C(15) |
-0,06 |
|
H(13)-C(2) |
1,09 |
С(5)-С(7)-Н(11) |
112 |
H(16) |
+0,04 |
|
H(14)-C(3) |
1,10 |
С(8)-С(7)-Н(11) |
112 |
H(17) |
+0,05 |
|
H(16)-C(15) |
1,10 |
Н(10)-С(7)-Н(11) |
107 |
H(18) |
+0,04 |
|
H(17)-C(15) |
1,10 |
С(6)-С(9)-Н(12) |
123 |
C(19) |
-0,06 |
|
H(18)-C(19) |
1,10 |
С(8)-С(9)-Н(12) |
128 |
H(20) |
+0,04 |
|
H(20)-C(19) |
1,10 |
С(1)-С(2)-Н(13) |
121 |
H(21) |
+0,05 |
|
H(21)-C(19) |
1,10 |
С(6)-С(2)-Н(13) |
121 |
H(22) |
+0,04 |
|
H(22)-C(15) |
1,10 |
С(1)-С(3)-Н(14) |
119 |
H(23) |
+0,11 |
|
H(23)-C(8) |
1,09 |
С(4)-С(3)-Н(14) |
119 |
||
|
С(3)-С(4)-С(15) |
121 |
||||
|
С(5)-С(4)-С(15) |
121 |
||||
|
С(4)-С(15)-(16) |
111 |
||||
|
С(4)-С(15)-Н(17) |
111 |
||||
|
Н(16)-С(15)-(17) |
107 |
||||
|
С(1)-С(19)-Н(18) |
112 |
||||
|
С(2)-С(1)-С(19) |
120 |
||||
|
С(3)-С(1)-С(19) |
120 |
||||
|
С(1)-С(19)-Н(20) |
112 |
||||
|
Н(18)-С(19)-Н(20) |
108 |
||||
|
С(1)-С(19)-Н(21) |
110 |
Окончание таблицы 2
|
Длины связей |
R , Å |
Валентные углы |
Град |
Атом |
Заряды на атомах молекулы |
|
Н(20)-С(19)-Н(21) |
108 |
||||
|
Н(18)-С(19)-Н(21) |
108 |
||||
|
С(4)-С(15)-Н(22) |
112 |
||||
|
Н(17)-С(15)-Н(22) |
108 |
||||
|
Н(16)-С(15)-Н(22) |
108 |
||||
|
С(7)-С(8)-Н(23) |
122 |
||||
|
С(9)-С(8)-Н(23) |
127 |
Таблица 3
Общая энергия (Е0, кДж/моль), максимальный заряд на атоме водорода (qmaxH+) и универсальный показатель кислотности (рКа) мономеров
(метод PM3)
|
№ п/п |
Мономер |
Е 0 |
H+ q max |
р Ка |
|
1 |
4,6-диметилиндена |
-143 547 |
+0,12 |
23 |
|
2 |
5,7-диметилиндена |
-143 548 |
+0,12 |
23 |
Заключение
В настоящей работе впервые был выполнен квантово-химический расчет молекул 4,6-диметилиндена и 5,7-диметилиндена квантово-химическим методом PM3. Определено оптимизированное геометрическое и электронное строение этих соединений. Теоретически оценена их кислотная сила ( р Ка = 23). Эти данные качественно находятся в хорошем соответствии с данными, представленными в работе [3], что свидетельствует о более корректном выборе метода PM3 для оценки кислотной силы изучаемых инденов, чем, например, в работах [1–2]. Кроме того, показано, что изучаемые мономеры 4,6-диметилинде-на и 5,7-диметилиндена относятся к классу очень слабых Н-кислот (так как p Ka > 14).
Список литературы Об электронной структуре мономеров катионной полимеризации 4, 6-диметилиндена и 5, 7-диметилиндена
- Бабкин, В. А. Квантово-химический расчет молекулы 4,6-диметилиндена/В. А. Бабкин, К. Н. Садыков//Квантово-химический расчет уникальных молекулярных систем: сб. ст. каф. Ми-ЕНД СФ ВолгГАСУ. -Волгоград: Изд-во ВолГУ, 2010. -Т. 3. -С. 189-192.
- Бабкин, В. А. Квантово-химический расчет молекулы 5,7-диметилиндена/В. А. Бабкин, К. Н. Садыков//Квантово-химический расчет уникальных молекулярных систем: сб. ст. каф. Ми-ЕНД СФ ВолгГАСУ. -Волгоград: Изд-во ВолГУ, 2010. -Т. 3. -С. 184-186.
- Белл, Р. Протон в химии/Р. Белл. -М.: Мир, 1977. -381 с.
- Кеннеди, Дж. Катионная полимеризация олефинов/Дж. Кеннеди. -М., 1978. -431 с.
- О корреляционной зависимости универсального показателя кислотности с максимальным зарядом на атоме водорода Н-кислот. Метод АМ1/В. А. Бабкин, Д. С. Андреев, В. Т. Фомичев, Г. Е. Заиков, Э. Р. Мухамедзянова//Вестник Казанского технологического университет а. -2012. -№ 10. -С. 15-18.
- Цирельсон, В. Г. Квантовая химия. Молекулы, молекулярные системы и твердые тела/В. Г. Цирельсон. -М.: Бином, 2010. -422 с.
- Alex, A. Granovsky, Firefly version 8/A. Alex. -Electronic text data. -Mode of access: http://classic.chem.msu.su/gran/firefly/index.html. -Title from screen.
- Anton, A. Confidence intervals for copolymerization reactivity ratios determined/A. Anton, J. Zwegers, E. Marechal//Bull. Soc. Chim. France. -1970. -Р. 1466.
- Bode, B. M. MacMolPlt: A Graphical User Interface for GAMESS/B. M. Bode, M. S. Gordon//J. Molec. Graphics. -1998. -№ 16. -Р. 133-138.
- Marechal, E. Polymeric Dyes-Synthesis, Properties and Uses/E. Marechal//J. Polymer Sci. -1970. -Vol. A-1. -№ 8. -Р. 2867.
- Marechal, E. Sigwalt Synth esis of Poly(indene-g-isobutylene) by Cationic Techniques/E. Marechal, P. Evard, P.//Bull. Soc. Chim. France. -1981. -Р. 2247-2250.
- Shmidt, M. W. General Atomic and Molecular Electronic Structure System/M. W. Shmidt, K. K. Baldrosge, J. A. Elbert //J. Comput. Chem. -1993. -Vol. 14. -Р. 1347-1363.


