Об особенностях селекции фиолетовозерной пшеницы на основе сортов с антоциановой окраской колеоптиля и стебля
Автор: Гордеева Е.И., Шаманин В.П., Хлесткина Е.К., Шоева О.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Улучшение сортов растений
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
Природные антоцианы, которые накапливаются в вегетативных и генеративных органах растений, выполняя защитные функции при биотических и абиотических стрессах, представляют интерес для производства функциональных продуктов питания с лечебно-профилактическими свойствами. Получение форм зерновых культур с повышенным содержанием антоцианов - одно из быстро развивающихся направлений в современной селекции. Образование антоцианов в перикарпе зерновки мягкой пшеницы контролируется совместно генами Pp-1 и Pp3 . В отличие от уникального доминантного аллеля Pp3 , унаследованного мягкой пшеницей от эндемичного вида Triticum aethiopicum Jakubz., доминантные аллели генов Рр-1 широко распространены среди сортов пшеницы и, помимо окраски зерновки, контролируют биосинтез антоцианов в колеоптиле и стебле. Следовательно, лимитирующим фактором накопления антоцианового пигмента как в вегетативных органах, так и в перикарпе зерновки пшеницы является доминантный аллель гена Рр-D1. Цель исследования заключалась в создании фиолетовозерных гибридов с доминантными аллелями гена Рр-D1, привнесенными из разных сортов, и в сравнительном изучении влияния этих новых аллелей на биосинтез антоцианов в вегетативных и генеративных тканях растений (в колеоптилях и в перикарпе зерновок). Для доказательства наличия у сортов с антоциановой окраской колеоптилей доминантных аллелей гена Pp-D1 , необходимых для создания фиолетовозерных гибридов пшеницы, мы провели скрещивания сортов Сибирская 21, Терция, Эритроспермум 4-16, имеющих данный признак окраски колеоптилей, с почти-изогенными линиями С29 Рр3 P и С29 Рр3 PF, созданными ранее на основе сорта Саратовская 29, не имеющими антоциановой окраски зерновки, но несущими доминантные аллели гена Pp3 . Отбор проводился с использованием внутригенного ДНК-маркера Pp3-diagnostic и сцепленных с геном Pp-D1 SSR-маркеров Xgwm0044 и Xgwm0111. Прошедшие отбор фиолетовозерные гибридные растения с доминантными аллелями целевых генов в гомозиготном состоянии характеризовались наличием антоциановых пигментов в колеоптиле и в зерновке, содержание которых при выращивании в теплице варьировало в пределах соответственно 35,4-69,0 и 34,1- 84,2 мкг/г и не отличалось от показателя у контрольных фиолетовозерных линий фС29Р и фС29PF, несущих оба гена Pp . Коэффициент корреляции между суммарным содержанием антоцианов в зерне и в колеоптиле составил rs = 0,83 (p = 0,0003). Новые фиолетовозерные гибриды с наибольшим содержанием антоцианов в зерновках, полученные в комбинациях скрещивания Терция × 29 Рр3 P и Эритроспермум 4-16 × С29 Рр3 P, были протестированы в полевых условиях по признакам урожайности и содержанию антоцианов в зерновках. Обе линии не отличались от сорта Саратовская 29 по числу и массе зерен с растения и превосходили этот контрольный сорт по числу колосков в главном колосе (13,8 и 13,0 против 12,3), а линия на основе сорта Терция имела статистически достоверно большую массу 1000 зерен (41,6 против 37,5). Содержание антоцианов в зерновках у этой линии составило 244,3 мкг/г и практически не отличалось от такового у ранее полученной темно-фиолетовозерной линии фBW49880P (221,4 мкг/г), наследующей доминантный ген Pp-D1 от сорта Purple. Полученные нами темно-фиолетовозерные линии являются перспективными предсортами и донорами для дальнейшей селекции богатых антоцианами сортов мягкой пшеницы. Кроме того, имеется возможность использовать упрощенную схему моногенного наследования гена Pp3 в скрещиваниях фиолетовозерных растений пшеницы с широко распространенными сортами пшеницы с окрашенным колеоптилем и стеблем, уже содержащими в геноме доминантные аллели генов Pp-1 (Pp-B1 или Pp-D1), для получения новых гибридов и сортов с повышенным содержанием антоцианов в перикарпе зерновки. Разработанный нами полиморфный внутригенный диагностический маркер гена Pp3-diagnostic позволяет уже на ранних стадиях развития выявить гомозиготные растения поколения F2 и повышает точность отбора.
Внутригенный днк маркер, генотипирование, маркер-ориентируемая селекция, микросателлитные маркеры, purple pericarp
Короткий адрес: https://sciup.org/142242469
IDR: 142242469 | УДК: 622.111.1:631.522/.524 | DOI: 10.15389/agrobiology.2024.3.507rus
Текст научной статьи Об особенностях селекции фиолетовозерной пшеницы на основе сортов с антоциановой окраской колеоптиля и стебля
Антоцианы — водорастворимые растительные пигменты, которые положительно влияют на здоровье человека благодаря антиоксидантным, противовоспалительным, гипогликемическим, антимутагенным, антидиабе-
∗ Выращивание растений в тепличном комплексе ЦКП «Ливр» было поддержано бюджетным проектом ИЦиГ СО РАН ¹ FWNR-2022-0017. Исследование выполнено при поддержке Российского научного фонда, грант ¹ 21-66-00012.
тическим, противораковым и нейропротекторным свойствам (1-4). Природные антоцианы представляют интерес для производства функциональных продуктов питания, пищевых красителей, так называемой умной упаковки (5). В зависимости от структуры молекулы и рН среды цвет этих пигментов может варьироваться от красного и пурпурного до синего. Антоцианы накапливаются в вегетативных и генеративных органах растений, выполняя защитные функции при биотических и абиотических стрессах (6, 7). Адаптационные свойства этих природных соединений связаны в первую очередь с их высокой антиоксидантной активностью благодаря наличию реакционноактивных гидроксильных групп и способности участвовать в метилировании, метаксилировании, алкилировании, гликозилировании и хелатировании металлов переменной валентности (Fe, Zn, Mn, Cu) (8).
У пшеницы и других злаков антоцианы накапливаются в оболочках зерна, что делает его перспективным сырьем с повышенными потребительскими качествами (9-11). Богатая антоцианами фиолетовозерная пшеница обещает стать функциональным пищевым продуктом — источником простых и сложных фенольных соединений, белков, углеводов, пищевых волокон, витаминов группы В и макро- и микроэлементов (12, 13). Зерно такой пшеницы имеет сложный антоциановый профиль, содержащий около 22 различных соединений (10). Доминирующий антоциановый пигмент — ци-анидин-3-глюкозид (Сy-3-glu), на его долю приходится 19,3-30,5 % от общего количества антоцианов в зерне (14). Кроме антоцианов, у фиолетовозерных сортов пшеницы достоверно повышено содержание фенольных кислот и флавонола кверцетина, обладающих выраженными антиоксидантными свойствами и противовоспалительным действием (12, 15, 16). Уже проводится технологическая оценка потенциала фиолетовозерной пшеницы для производства таких функциональных продуктов питания, как цельнозерновой хлеб, печенье с отрубями (10, 13, 17).
Получение форм зерновых культур с измененным содержанием антоцианов — одно из быстро развивающихся направлений в современной селекции, что требует эффективных протоколов, основанных на знаниях о генетическом контроле биосинтеза этих соединений. Ключевые гены Рр ( Purple pericarp, Pp-1 / Myb и Рр3 / TaMyc1 ), регулирующие биосинтез антоцианов в перикарпе зерновки мягкой пшеницы ( Triticum aestivum L., 2 n = 42, BBAADD ) , были картированы в геноме соответственно в коротких плечах хромосом 7-й гомеологической группы (гены Pp-А1 , Pp-В1 , Pp-D1 ) и в длинном плече хромосомы 2A (18, 19). Гомеологичные гены Pp-1 (= Rc-1 , Red coleoptile ) кодируют регуляторный фактор R2R3-Myb типа, активируют биосинтез антоцианов не только в перикарпе зерновки, но также в колеоптиле и в стебле (20). Наличие трех гомеологичных генов Pp-1 в рецессивном состоянии определяет неокрашенный фенотип растения. Если хотя бы один из этих генов находится в доминантном состоянии, в вегетативных органах пшеницы будут синтезироваться антоциановые пигменты, а при наличии доминантного аллеля гена Pp3 антоцианы будут синтезироваться и в зерне (21). Доминантный аллель гена Рр3 , определяющий синтез антоцианов в перикарпе зерновки, является уникальным. Он имеет эндемичное происхождение от тетраплоидного вида пшеницы — T. aethiopicum [синоним T. turgidum subsp . durum (Desf.) Husn . ] и перенесен в геном мягкой пшеницы методом классической гибридизации и отбора (22). В отличие от гена Рр3 доминантные аллели генов Pp-1 широко представлены у диплоидных, тет-раплоидных и гексаплоидных видов пшениц (20, 23, 24). Между образцами пшеницы имеются существенные различия в содержании антоцианов в колеоптиле, что может быть обусловлено различными аллелями генов Pp-1 508
(18). Ранее были созданы почти-изогенные фиолетовозерные линии мягкой пшеницы на основе скрещивания и многократных беккроссов сорта Саратовская 29 и беккроссные фиолетовозерные гибридные линии, наследующие доминантные аллели генов Pp-D1 и Рр3 от сортов Purple и Purple Feed (25, 26).
Цель работы заключалась в создании фиолетовозерных гибридов с новыми доминантными аллелями гена Рр-D1, привнесенными из разных сортов, и в сравнительном изучении влияния этих новых аллелей на биосинтез антоцианов в вегетативных и генеративных тканях растений (в колеоптилях и в перикарпе зерновок). Для доказательства наличия у сортов с антоциановой окраской колеоптилей доминантных аллелей гена Pp-D1 , необходимого для создания фиолетовозерных гибридов пшеницы, мы скрестили растения этих сортов с неокрашенными почти-изогенными линиями пшеницы в качестве доноров доминантного аллеля гена Pp3, провели отбор и оценку полученных гибридов.
Методика . Растительный материал. В качестве материнских форм при создании гибридов с новыми аллелями гена Рр-1 отобрали три образца мягкой пшеницы ( Triticum aestivum L.) с фиолетовой окраской колеоптиля и верхнего междоузлия стебля: сорт Сибирская 21, сорт Терция, линия Эритроспермум 4-16 (зарегистрирована в 2024 году как сорт Агрономическая 5, код 7953809) и образцы с зелеными стеблями: линия Лютесценс 5315, сорт Столыпинская 2, сорт Силантий (коллекция ОмГАУ, г. Омск). В качестве отцовских форм использовали почти-изогенные линии i:S29 Рр3 P pp-A1 YP (= С29 Рр3 P) и i:S29 Рр3 PF pp-A1 YP (= С29 Рр3 PF), созданные на основе сорта Саратовская 29 (коллекция ИЦиГ СО РАН, г. Новосибирск). Эти линии не имеют антоциановой окраски вегетативных органов и зерна, но несут доминантный аллель гена Pp3 в составе небольших рекомбинантных участков хромосом 2А соответственно от сортов Purple (k-46990, Австралия) и Purple Feed (k-49426, Канада) (коллекция ВИР). Отсутствие окраски вегетативных органов у этих линий обусловлено присутствием рецессивных аллелей генов Pp-B1 и Pp-D1 сорта Саратовская 29 и замещением слабого доминантного аллеля гена Pp-A1 этого сорта рецессивным аллелем гена от сорта Yanezkis Probat (YP) (25) .
В сравнительных исследованиях в качестве контрольных использовали ранее созданные почти-изогенные фиолетовозерные линии i:S29 Рр3Pp-D1 P (=фC29P) и i:S29 Рр3Pp-D1 PF (=фC29PF), i:S29 Pp3 P Pp-D1 PF (=фC29PPF), бек-кроссные гибридные линии BC 1 F 4 (Эл 22*2/i:S29 Pp3Pp-D1 PF) (=фЭл 22PF), BC 1 F 4 (STRU*2/i:S29 Pp3Pp-D1 PF) (=фSTRUPF), BC 1 F 4 (BW49880*2/i:S29 Pp3Pp-D1 P) (=фBW49880P) и их родительские линии и сорта (20, 26).
Схема скрещивания. Для получения фиолетовозерных гибридов растения выращивали в гидропонной теплице в грунте из керамзита при 2-разовом поливе питательным раствором Кнопа Центра искусственного выращивания растений ИЦиГ СО РАН (г. Новосибирск) при 16-часовом освещении лампами дневного света и дневной/ночной температуре воздуха от 18/20 ° С до 22/24 ° С. Незрелые пыльники у реципиентных сортов удаляли и проводили опыление пыльцой, собранной с цветков донорных растений. Гибридные растения поколения F 1 самоопылялись, в результате чего были получены семена F 2.
В поколении F2 (40 растений каждой гибридной комбинации) проводили двухступенчатый отбор гомозиготных растений по целевым генам с помощью молекулярного анализа: 1) с использованием внутригенного маркера Pp3-diagnostic (27) — по наличию продуктов ПЦР-амплификации внутригенной последовательности ДНК, соответствующих по длине доминантному аллелю гена Pp3, 2) по наличию ПЦР-продуктов, подтверждающих присутствие SSR-локусов Xgwm0044 и Xgwm0111, сцепленных с геном Pp-D1. Отобранные нами фиолетовозерные растения послужили источником новых линий пшеницы. Зерна с отдельных растений фиолетовозерных гибридов F2 были высажены и самоопылялись для получения линий F3. Методом индивидуального отбора семена двух линий поколения F4 высевали для оценки их продуктивности в полевых условиях.
Выделение ДНК . ДНК экстрагировали из листьев каждого растения поколения F 2 от каждого скрещивания и из растений родительских линий в соответствии с процедурой модифицированного протокола J. Plaschke с соавт. (28). Около 100 мг свежей зеленой массы (листья 2-3-недельных проростков) помещали в пробирку объемом 1,5 мл, добавляли 200 мкл буфера для экстракции (100 мМ Трис-HCl, рН 7,5; 500 мМ NaCl, 50 мМ EDTA, 1,25 % SDS, 3,8 % Na 2 S 2 O 5 ) и измельчали с помощью гомогенизатора. Добавляли ещe 500 мкл буфера для экстракции, инкубировали на водяной бане при 60 ° С 30 мин. Добавляли 700 мкл смеси хлороформ:изоами-ловый спирт (24:1), перемешивали и центрифугировали в течение 15 мин при 12000 об/мин. ДНК осаждали, добавляя к водной фазе 1,4 мл 96 % охлажденного этанола ( - 20 ° С), центрифугировали 10 мин при 12000 об/мин. Осадок высушивали на воздухе и растворяли в 50 мкл буфера ТЕ (10 мМ Трис-НСl, рН 8,0; 1 мМ EDTA). Для оценки качества и количества экстрагированной ДНК применяли аналитический электрофорез, после чего для стандартизации количества ДНК до 100 мкг/мкл пробы разводили стерильной бидистиллированной водой.
Молекулярные маркеры. Для точного молекулярного анализа ДНК изучаемых растений использовали сконструированный нами внутри-генный полиморфный маркер Рр3-diagnostic, позволяющий отличать доминантные аллели гена Рр3 от рецессивных (27). В работе также использовали микросателлитные маркеры GWM (Gatersleben Wheat Marker) (29), фланкирующие локус гена Pp-1D на хромосоме 7D (Xgwm0044 и Xgwm0111).
Полимеразная цепная реакция. ПЦР проводили в реакционной смеси объемом 20 мкл. На 100 нг ДНК-матрицы — выделенной из листьев ДНК (1 мкл) приходилось 67 мM Трис-НСl (рН 8,8), 1,8 мM МgCl2, 0,01 % Tween 20, 18 мM (NH4)2SO4, по 0,2 мM каждого дНТФ, по 0,3 мкМ прямого и обратного специфичных праймеров (ООО «Биоссет», г. Новосибирск, , 1 ед. Taq-ДНК-полимеразы TAQ-02 (ООО «Биоспецифика», г. Новосибирск, . Амплификацию проводили в T100 Thermal Cycler («Bio-Rad», США) по общепринятой методике: преденатурация — 2 мин при 94 °С; 45 циклов: денатурация — 1 мин при 94 °С, отжиг матрицы с праймерами — 1 мин при соответствующих праймерам температурах, полимеризация — 2 мин при 72 °С; достраивание ПЦР-фрагментов — 5 мин при 72 °С. В режиме TOCHDOWN проводили преденатурацию в течение 2 мин при 94 °С; далее 13 циклов: денатурация — 15 с при 94 °С, отжиг матрицы с праймерами — 30 с при 65 °С с понижением на 0,7 °С/цикл, полимеризация — 45 с при 72 °С), затем 24 цикла: денатурация — 15 с при 94 °С, отжиг матрицы с праймерами — 30 с при 56 °С, полимеризация — 30 с при 72 °С; стандартная финальная элонгация — 5 мин при 72 °С.
Продукты ПЦР разделяли в 2 % агарозном геле (LE Agarose, «Lonza Rockland, Inc.», США) и 5 % агарозном геле высокого разрешения (HR, high resolution) HyAgarose™ HR Agarose («ACTGene, Inc.», США), приготовленных на ТАЕ-буфере (40 мМ Трис-НСl, pH 8,0, 20 мМ ацетат натрия, 1 мМ EDTA) с добавлением бромистого этидия. В карманы геля наносили по 10510
20 мкл реакционной смеси с продуктами ПЦР с добавлением 5 % глицерина, 0,05 % бромфенолового синего и 0,05 % ксиленцианола. Использовали маркер длины фрагментов ДНК 100 bp (ООО «Биолабмикс», г. Новосибирск, . Электрофорез проводили в горизонтальной камере в течение 1-5 ч при напряжении 7 B/см. Для получения изображений гелей в УФ-свете, их документирования и анализа использовали систему Molecular Imager® Gel DocTM XR+ System («Bio-Rad Laboratories, Inc.», США).
Выделение и оценка суммарного содержания антоцианов (ССА). Из зрелых зерновок антоцианы экстрагировали после измельчения образцов в мельнице ЛЗМ-1 (ООО «СовЛаТ», Россия). Для выделения антоцианов из колеоптилей семена проращивали на влажной фильтровальной бумаге в климатической камере RUMED® («RUBARTH APPARATE GmbH», Германия) при 20 ° С и 12-часовом фотопериоде, колеоптили растирали. Антоцианы экстрагировали 1 % HCl в метаноле согласно описанию (30) в 3 биологических повторностях для каждой линии. Для каждой повторности отбирали по 0,2 г растертой ткани и добавляли по 1 мл 1 % раствора HCl в метаноле. Суспензии оставляли на ночь при +4 ° С, после чего центрифугировали (30 мин, 12000 об/мин, +4 ° С). Количество антоцианов в супернатанте оценивали по поглощению при длине волны 530 и 700 нм (спектрофотометр SmartSpecTM Plus («Bio-Rad Laboratories, Inc.», США). Скорректированное значение А 530 - А 700 использовали для расчета массовой концентрации по эквиваленту самого распространенного в зерновке антоцианидина цианидин-3-глюкозида (Cy-3-Glu) (мкг/г сухой массы образца) в соответствии с описанием (31).
Полевая оценка продуктивности растений. Для учета показателей продуктивности растений гибридные линии выращивали рядами длиной 1 м на опытном участке селекционно-генетического комплекса ИЦиГ СО РАН (г. Новосибирск, 54.847102N, 83.127422Е, 2021 год). У 10 растений каждого генотипа измеряли высоту, длину главного колоса, определяли продуктивную кустистость (число продуктивных колосьев на растении), учитывали число колосков в главном колосе, число и массу зерен с главного колоса, число и массу зерен с растения, массу 1000 зерен.
Методы статистического и компьютерного анализа. Значения ССА и показатели урожайности представлены в работе в виде среднего ( М ) и стандартного отклонения (±SD). Статистический анализ проводили в программе Statistica v. 6.1 («StatSoft, Inc.», США). Статистическую достоверность различий между средними значениями оценивали с помощью критериев Манна-Уитни и Стьюдента-Ньюмена-Кейлса для попарных множественных сравнений независимых групп (32). При p < 0,05 различия считали статистически значимыми. Взаимосвязь между ССА в колеоптиле и в зерне оценивали с помощью коэффициентов ранговой корреляции Спирмена.
Результаты . Фенотипическая и генетическая характеристика донорных, реципиентных и контрольных линий и сортов, использованных в работе, представлена в таблице 1.
1. Линии и сорта пшеницы ( Triticum aestivum L.), использованные в работе
Линия/сорт
|
Сокращенное обозначение |
Pp3 |
Окраска |
|
колеоптиля/ Pp-1 зерна |
Оригинатор (ссылка)
Реципиенты
Лютесценс 53-15
Силантий
Столыпинская 2
с р ец е с с ив ны м и алл елям и ге но в Pp-1
|
Лют 53-15 |
- |
- |
- |
ОмГАУ |
|
Силантий |
- |
- |
- |
ОмГАУ |
|
Стол 2 |
- |
- |
- |
ОмГАУ |
Продолжение таблицы 1
|
Реципиенты |
с доминатными |
аллелями генов |
Pp-1 |
||
|
Сибирская 21 |
Сиб 21 |
- |
+/ Pp-D1 |
- |
СибНИИРС, 2019 |
|
Терция |
Терция |
- |
+/ Pp-D1 |
- |
Курганский НИИСХ, ОмГАУ, ИЦиГ СО РАН |
|
Эритроспермум 4-16 (Агронимическая 5) Эр 4-16 |
- |
+/ Pp-D1 |
- |
ОмГАУ |
|
|
Доноры |
доминантных |
ал |
л ел е й г е н ов Pp3 |
||
|
i:S29 Рр3 P pp-A1 YP |
С29 Рр3 P |
+ |
- |
- |
ИЦиГ СО РАН (21) |
|
i:S29 Рр3 PF pp-A1 YP |
С29 Рр3 PF Контрольные |
+ об |
разцы |
- |
ИЦиГ СО РАН (21) |
|
i:S29 Рр3Pp-D1 P |
фС29 P |
+ |
+/ Pp-A1 , Pp-D1 |
+ |
ИЦиГ СО РАН (21) |
|
i:S29 Рр3Pp-D1 PF |
фС29PF |
+ |
+/ Pp-A1 , Pp-D1 |
+ |
ИЦиГ СО РАН (21) |
|
i:S29 Pp3 P Pp-D1 PF |
фС29РPF |
+ |
+ / Pp-A1 , Pp-D1 |
+ |
ИЦиГ СО РАН (30) |
|
Саратовская 29 |
С 29 |
- |
+/ Pp-A1 |
- |
НИИСХ Юго-Востока |
|
Элемент 22 |
Эл 22 |
- |
- |
- |
ОмГАУ |
|
STRU 0732-84k 071 |
STRU |
- |
- |
- |
Strube D&S GmbH, Германия |
|
BW49880 |
BW |
- |
- |
- |
CIMMYT, INT, Мексика |
|
BC 1 F 4 (Эл 22*2/i:S29 Pp3Pp-D1 PF) |
фЭл 22 PF |
+ |
+/ Pp-D1 |
+ |
ИЦиГ СО РАН (26) |
|
BC 1 F 4 (STRU*2/i:S29 Pp3Pp-D1 PF) |
фSTRUPF |
+ |
+/ Pp-D1 |
+ |
ИЦиГ СО РАН (26) |
|
BC 1 F 4 (BW49880*2/i:S29 Pp3Pp-D1 P) |
фBW49880 P |
+ |
+/ Pp-D1 |
+ |
ИЦиГ СО РАН (26) |
|
Пр и м еч ани е. Наличие/отсутствие гена или признака — |
соответственно +/ - . |
Оригинаторы: ОмГАУ — |
|||
|
Омский государственный аграрный университет, СибНИИРС — Сибирский НИИ растениеводства, филиал |
|||||
ИЦиГ СО РАН, г. Новосибирск, Курганский НИИСХ — Курганский НИИ сельского хозяйства, ИЦиГ СО РАН — Институт цитологии и генетики СО РАН, г. Новосибирск, НИИСХ Юго-Востока — Федеральный аграрный научный центр Юго-Востока, г. Саратов.
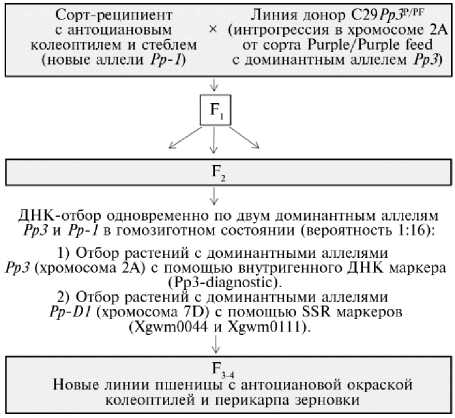
Рис. 1. Схема скрещивания и молекулярного отбора для получения фиолетовозерных гибридов пшениц с новыми доминантными аллелями гена Рр-Dl , регулирующего биосинтез антоцианов в колеоптиле и перикарпе зерновки.
Создание фиолетовозерных линий мягкой пшеницы. Схема скрещивания и молекулярного отбора для получения фиолетовозерных гибридов пшениц от сортов-реципиентов с антоциановой окраской колеоптилей и верхнего междоузлия стебля, несущих новые доминантные аллели гена Рр-D1 , с изогенными линиями — донорами доминантных аллелей гена Pp3 P и Pp3 PF от сортов Purple и Purple Feed представлена на рисунке 1.
Для получения фиолетовозерных линий на основе сортов Сиб 21, Терция и линии Эр 4-16, характеризующихся антоциановой ок- раской колеоптиля и стебля и, следовательно, несущих доминантные аллели генa Рр-1, эти образцы опылялись изогенными линиями С29Рр3P и С29Рр3PF — донорами доминантных аллелей Pp3, но не доминантных аллелей Pp-1. Полученные в результате скрещивания гибриды F1 были размножены до поколения F2.
Фиолетовозерные гибриды F 2 с доминантными аллелями сразу двух генов — Pp3 и Pp-D1 в гомозиготном состоянии выявляли с помощью ПЦР-детектирования. Для точного молекулярного анализа ДНК изучаемых растений использовали ДНК-маркеры, связанные с фиолетовозерно-стью (табл. 2).
2. ДНК-маркеры генов Pp3 и Pp-D1 , связанные с фиолетовозерностью, и режимы их ПЦР-амплификации
|
Маркер |
Т, ° C |
Размер ПЦР-продукта, п.н. |
Маркируемая хромосома и ген |
Пара праймеров 5 '^ 3 ' (ссылка) |
|
Pp3-diagnostic TOCHDOWN |
398/429 |
2A, Pp3 |
F: TAGTGCCGTCTAACTGGTGA R: ACGACGCCTAAGGAAACAC (27) |
|
Xgwm0044 60 |
~ 175/173 |
7D, Pp-D1 |
F: GTTGAGCTTTTCAGTTCGGC R: ACTGGCATCCACTGAGCTG (29) |
|
Xgwm0111 55 |
198 |
7D, Pp-D1 |
F: TCTGTAGGCTCTCTCCGACTG |
R: ACCTGATCAGATCCCACTCG (29)
Используя внутригенный ДНК-маркер Pp3-diagnostic, позволяющий по длине ПЦР-продукта отличить доминантные аллели гена Рр3 от рецессивных (28), мы отобрали растения с доминантными аллелями гена Pp3 в гомозиготном состоянии, а с помощью SSR-маркеров Xgwm0044 и Xgwm0111 (29), сцепленных с геном Pp-D1 , — гомозиготные образцы по доминантному аллелю этого гена.
A
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
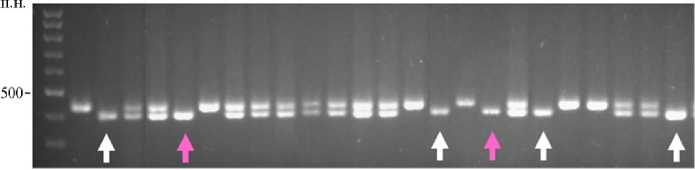
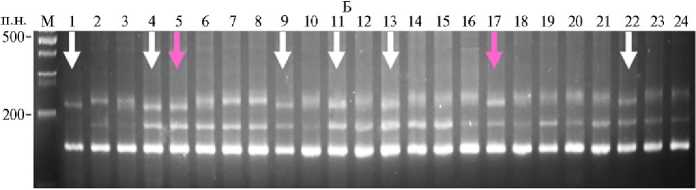
Рис. 2. Электрофореграммы продуктов ПЦР, полученных с использованием внутригенного маркера Pp3-diagnostic (А) и SSR-маркера Xgwm0111 (Б) , на ДНК родительских растений пшеницы линий Эритроспермум 4-16 (1), С29 Рр3 P (2) ( Triticum aestivum L.) и их гибридов поколения F 2 (324). Белыми стрелками отмечены гибриды, несущие в гомозиготном состоянии доминантный аллель гена Pp3 и аллель сцепленного с геном Рр-D1 маркера Xgwm0111, соответствующий реципиентному сорту. Розовыми стрелками отмечены двойные гомозиготы по этим маркерам. М — маркер молекулярных масс 100 bp (ООО «Биолабмикс», г. Новосибирск).
В качестве примера (рис. 2) приведены электрофореграммы ПЦР-продуктов после амплификации геномной ДНК родительских растений Эр 4-16, С29Рр3P и полученных в результате их скрещивания гибридов поколения F2. Среди проанализированных 22 гибридов (см. рис. 2) были выявлены два растения, несущих в гомозиготном состоянии доминантные аллели гена Pp3 от растения-донора и ПЦР-продукты SSR-маркера Xgwm0111, сцепленного с доминантным аллелем Pp-D1, унаследованные от реципиент-ного сорта. Из 40 гибридных растений таких образцов было только три. Аналогичным образом отобрали растения из комбинаций Эр 4-16 ½ С29Рр3PF, Терция ½ С29Рр3P, Терция ½ С29Рр3PF и Сиб 21 ½ С29Рр3P. У отобранных растений зерновки при созревании приобретали интенсивную фиолетовую окраску. В комбинациях скрещивания донорных линий С29Рр3P и С29Рр3PF с реципиентными сортами Лют 53-15, Стол 2 и Силантий, не накапливающими антоциановые пигменты в колеоптиле и стебле, мы отобрали растения, несущие в геноме доминантные аллели генов Pp3 от донорных линий совместно с аллелями SSR-маркеров, сцепленных с геном Pр-D1, соответствующих сортам-реципиентам. Несмотря на наличие доминантного аллеля гена Pp3, ни у одного из отобранных гибридных растений, которые получили от сортов с неокрашенными колеоптилями, зерновка не имела фиолетовой окраски.
Следовательно, для получения фиолетовозерных сортов пшениц с повышенным содержанием антоцианов в перикарпе зерновки достаточно при скрещивании растений пшеницы с антоциановой окраской колеоптиля и стебля, несущих доминантные аллели Рр-D1 ( Rc-D1 ), перенести в их геном только доминантные аллели Pp3 .
Суммарное содержание антоцианов в колеоптиле и зерне. ССА было оценено в колеоптиле 4-суточных проростков и в зрелом зерне в трех группах образцов (рис. 3). В первую группу отнесли гибриды, несущие доминантные аллели гена Pp3 доноров и рецессивные аллели гена Pp-D1 реципиентов, во вторую — отобранные окрашенные гибриды с доминантными аллелями гена Pp3 доноров и Pp-D1 реципиентов, в третью группу вошли контрольные образцы, содержащие доминантные аллели генов Pp3 и Pp-D1 , унаследованные либо от сорта Purple, либо от Purple Feed.
H 19.4s
»19,0“
№ 17,lbs
В 16,81'
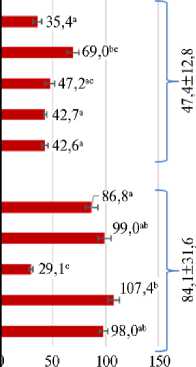
Суммарное содержание антоцианов в колеоптила в пересчете на Cy-3-Glu, мкг/г
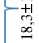
Рис. 3. Сравнение суммарного содержания антоцианов в колеоптилях 4-суточных проростков (слева) и в зрелых зерновках (справа) у гибридов F 2 , отобранных с помощью молекулярных маркеров, и у фиолетовозерных линий пшеницы, полученных ранее (в пересчете на цианидин-3-глюкозид, Су-3-glu) ( Triticum aestivum L., для каждого образца n = 3, M ±SD; гидропонная теплица, весенняя вегетация 2021 года, описание условий см. в разделе «Методика»). Одинаковыми буквами отмечены образцы, между которыми не выявили статистически значимых различий внутри групп, отмеченных фигурными скобками. Звездочками зеленого цвета отмечены образцы, у которых суммарное содержание антоцианов (ССА) в колеоптиле достоверно выше, чем в зерне, звездочками черного цвета — образцы, у которых ССА в зерне выше, чем в колеоптиле (при p < 0,05, U -test Манна-Уитни). Обозначения образцов см. в таблице 1.
В первой группе зерновки с отобранных гибридов F 2 , содержащих в геноме доминантные аллели Pp3 совместно с рецессивными аллелями pp-D1 от реципиентных сортов, не отличались друг от друга по содержанию соединений, поглощающих при длине волны λ = 530 нм, которая характерна для антоцианов. ССА в зерновках варьировало в пределах 2,1-2,8 мкг/г со средним значением 2,6 мкг/г и было достоверно ниже (p < 0,05, критерий Манна-Уитни), чем у сорта Саратовская 29 (3,9 мкг/г), несущего полудоминант-ный аллель Рp-A1 (см. рис. 3). ССА в колеоптиле у проростков из зерен с отобранных гибридов F 2 в этой группе варьировало в диапазоне 16,819,0 мкг/г со средним значением 18,3 мкг/г. За исключением гибрида из комбинации скрещивания Стол 2 ½ С29 Рр3 PF, ССА в зерне было достоверно ниже (p < 0,05), чем в колеоптиле у растений сорта Саратовская 29.
Во второй группе ССА в колеоптиле у проростков из зерен отобранных гибридных растений F 2 , несущих доминантные аллели Pp3 совместно с доминантными аллелями Pp-D1 от реципиентных образцов, варьировало от 35,4 мкг/г (Сиб 21 ½ С29 Рр3 P) до 69,0 мкг/г (Терция ½ С29 Рр3 P) (см. рис. 3). Среднее значение ССА в колеоптиле составило 47,4 мкг/г. ССА в колеоптилях гибридных проростков комбинаций Терция ½ С29 Рр3 PF и Терция ½ С29 Рр3 P было самым высоким в указанной группе гибридов и в проростках комбинации Терция ½ С29 Рр3 P достоверно (p < 0,05) отличалось от такового у гибридов с сортом Сибирская 21 и линией Эритроспермум 4-16. ССА в зерновках с отобранных гибридов поколения F 2 в этой группе варьировало от 34,1 мкг/г в комбинации Эр 4-16 ½ С29 Рр3 PF до 84,2 мкг/г в комбинации Эр 4-16 ½ С29 Рр3 P (см. рис. 3). Все гибриды из этой группы по ССА в зерне достоверно (p < 0,05) отличались от гибридов с наименьшим и наибольшим значениями ССА. Также достоверные различия по ССА в зерне были выявлены между отобранными гибридами из комбинаций скрещивания Сиб 21 ½ С29 Рр3 P и Терция ½ С29 Рр3 PF.
В третьей группе ССА в колеоптиле у проростков из зерен ранее полученных нами фиолетовозерных контрольных образцов пшеницы с доминантными аллелями генов Pp3 и Pp-D1 , унаследованными либо от сорта Purple, либо от Purple Feed, варьировало от 29,1 мкг/г у линии фSTRUPF до 107,4 мкг/г у линии фЭл 22PF (см. рис. 3). ССА в колеоптиле у всех образцов из этой группы достоверно (p < 0,05) превышало показатель линии фSTRUPF с наименьшим значением ССА в колеоптиле. ССА в колеоптиле у линии фC29P было достоверно (p < 0,05) ниже, чем у фЭл 22PF.
Суммарное содержание антоцианов в зрелом зерне фиолетовозерных контрольных образов в этой группе варьировало от 40,1 мкг/г у линии фSTRUPF до 213,2 мкг/г у линии фBW49880P (см. рис. 3). Линия фSTRUPF имела наименьшее значение ССА (p < 0,05), линия фBW49880P — наибольшее значение этого показателя (p < 0,05). Кроме того, ССА в зернах почти-изогенной линии фC29P было выше (p < 0,05), чем у сестринской линии фC29PF и у линии фЭл 22PF.
При сравнении трех анализируемых групп по ССА было установлено, что количество антоцианов в колеоптиле и в зрелом зерне у неокрашенных образцов F 2 ниже (p < 0,05), чем у окрашенных гибридов F 2 , несущих доминантные аллели генов Pp-D1 от реципиентных сортов, и ниже, чем у полученных ранее фиолетовозерных линий. Достоверных различий между последними двумя группами фиолетовозерных образцов мы не выявили.
Мы также сравнили ССА в разных тканях растения — в колеоптиле и в зерне. У всех образцов из группы неокрашенных гибридов F 2 ССА в колеоптиле было выше (p < 0,05), чем в зерне. В группе гибридов
F 2 с антоциановой окраской зерна от скрещиваний Сиб 21 ½ С29 Рр3 P, Терция ½ С29 Рр3 PF и Эр 4-16 ½ С29 Рр3 P количество антоцианов в зерне превышало этот показатель в колеоптилях у проростков. У гибридов из комбинаций Терция ½ С29 Рр3 P и Эр 4-16 ½ С29 Рр3 PF не было различий по ССА между колеоптилем и зерном. В группе фиолетовозерных контрольных образцов у линий фSTRUPF и фBW49880P ССА в зерне было выше, чем в колеоптиле, тогда как у изогенной линии фC29PF и линии фЭл 22PF ССА в колеоптиле было выше, чем в зерне. В то же время у изогенной линии фC29P ССА в зерне и колеоптиле не различалось.
Коэффициент корреляции между суммарным содержанием антоцианов в зерне и в колеоптиле составил r s = 0,83 (p = 0,0003, корреляция Спирмена).
Сравнительное изучение созданных фиолетовозерных линий. Два гибридных растения с наибольшим суммарным содержанием антоцианов в зерне (фТерция Рр3 P и фЭр4-16 Рр3 P), отобранных в комбинациях скрещивания Терция ½ С29 Рр3 P и Эр 4-16 ½ С29 Рр3 P, размножили до поколения F 4 , и полученные линии были протестированы по признакам продуктивности в полевых условиях 2021 года совместно с краснозерным сортом Саратовская 29, почти-изогенной линией фC29PРF, белозерной селекционной линией BW49880 и созданной на ее основе фиолетовозерной линией фBW49880P поколения BC 1 F 5 (табл. 3).
По всем изученным параметрам контрольная почти-изогенная линия фC29PРF не отличалась от сорта Саратовская 29, на основе которого она была получена. Обе отобранные линии — F 4 Терция ½ С29 Рр3 P и F 4 Эр 4-16 ½ С29 Рр3 P не отличались от них по массе зерен с растения (соответственно 2,8 и 3,1 г). Гибридная линия F 4 от сорта Терция имела сниженное число зерен с растения, достоверно меньшее (p < 0,05), чем гибрид F 4 от линии Эритроспермум 4-16. По числу колосков в главном колосе (13,8 и 13,0) обе линии достоверно (p < 0,05) превосходили контрольные. Высота растения и масса 1000 зерен у линии F 4 от сорта Терция (110,2 см и 41,6 г) были больше (p < 0,05), чем у контрольных линий, а линия F 4 от линии Эритроспермум 4-16 (99,2 см и 39,9 г) не отличалась от контрольных линий. Длина главного колоса и число зерен в главном колосе у гибридной линии F 4 от Эритроспермум 4-16 (8,2 см и 39,2 шт.) были больше (p < 0,05), чем у контрольных линий, у гибридной линии F 4 от сорта Терция (7,7 см и 34,2 шт.) — не отличались от показателей у контрольных линий. Продуктивная кустистость (у линий F 4 от сорта Терция и F 4 от линии Эритроспермум 416 соответственно 2,5 и 2,4 колосьев на растение) была ниже (p < 0,05), чем у контрольных образцов.
Фиолетовозерная линия фBW49880P и ее родительская форма BW49880 имели наименьшую высоту растений, которая отличалась от таковой (p < 0,05) как у контрольных линий на основе сорта Саратовская 29, так и у отобранных линий. Продуктивная кустистость у этих линий была ниже, чем у контрольных линий на основе сорта Саратовская 29, но не отличалась от показателя у отобранных фиолетовозерных линий. Число колосков и зерен в главном колосе у сорта BW49880 были выше (p < 0,05), чем у контрольных линий на основе сорта Cаратовская 29 и фиолетовозерных линий, тогда как у линии фBW49880P эти показатели не отличались от таковых у контрольных линий. Обе линии имели статистически значимо большую массу 1000 зерен по сравнению с контрольными линиями и не отличались по этому параметру от сравниваемых отобранных фиолетовозерных линий.
-
3. Развитие растений и структура урожая у образцов пшеницы ( Triticum aestivum L.) c различной окраской зерновок ( n = 12, M ±SD, опытное поле ИЦиГ СО РАН, г. Новосибирск, 2021 год)
Показатель
Саратовская 29 (С29)
фC29PРF
F 4
BW49880
фBW49880P
Терция ½ С29 Pp3 P \
Эр 4-16 ½ С29 Pp3 P
Цвет зерновок
Красный
Фиолетовый
Фиолетовый
Фиолетовый
Белый
Фиолетовый
Высота растения, см
102,75±7,6b
101,1±6,2b
110,2±7,6с
99,2±5,9b
69,6±3,5а
66,2±4,4а
Продуктивная кустистость, шт/раст.
3,3±1,2b
3,8±0,8b
2,5±0,5a
2,4±0,5a
2,2±0,6a
2,4±0,7a
Длина главного колоса, см
7,1±0,5a
7,4±0,6a
7,7±0,8a
8,2±0,8b
8,9±0,9b
7,4±0,7a
Число колосков в главном колосе, шт.
12,3±0,7a
12,6±0,8a
13,8±0,9b
13,0±3,4b
14,9±1,2c
11,5±0,8a
Число зерен в главном колосе, шт.
31,8±1,5a
32,2±3,6a
34,2±4,8a
39,2±6,9b
44,8±6,2c
32,1±3,6a
Число зерен с растения, шт.
75,8±23,8ab
93,8±24,6b
66,2±14,9a
78,3±14,3ab
85,7±26,4ab
57,1±12,3a
Масса зерен с растения, г
2,9±0,9ab
3,3±0,9ab
2,8±0,7ab
3,1±0,7ab
3,7±1,2b
2,4±0,5a
Масса 1000 зерен, г
37,5±3,8a
35,0±2,6a
41,6±2,1b
39,9±4,5ab
43,2±4,3b
42,0±4,2b
a, b, с Различия между линиями статистически значимые при p < 0,05 (тест множественных сравнений Стьюдента-Ньюмена-Кеулса).
Зерна с растений F 4 полученных гибридных линий имели насыщенную антоциановую окраску. Мы определили ССА в цельнозерновой муке из созревших зерновок полевого материала (рис. 4).
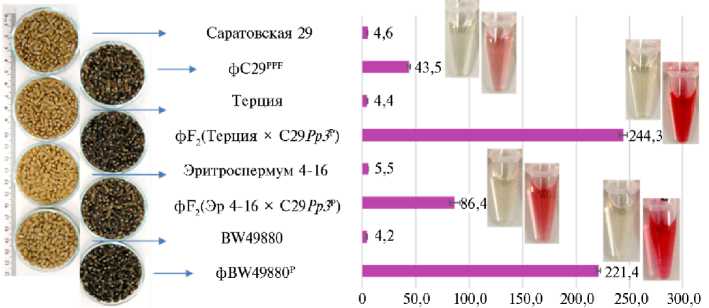
Рис. 4. Суммарное содержание антоцианов ( n = 3, M ±SD ) в цельнозерновой муке у сортов и линий пшеницы ( Triticum aestivum L.). Слева — зерно фиолетовозерных линий и их родительских сортов (получено в условиях опытного поля ИЦиГ СО РАН, г. Новосибирск, 2021 год). Справа — пробирки с суспензиями выделенных из цельнозерновой муки антоцианов в растворе 1 % HCl в метаноле
Наивысший показатель ССА (244,3 мкг/г) выявлен в темно-фиолетовых зернах гибридной линии от скрещивания сорта Терция с неокрашенной линией С29 Рр3 P. Высокий показатель ССА (221,4 мкг/г) также имели темно-фиолетовые зерна гибридной линии фBW49880P. Наименьшее значение ССА среди фиолетовозерных образцов (43,5 мкг/г) выявили в цельнозерновой муке почти-изогенной линии фC29PРF.
Анализируя полученные результаты, отметим следующее. Для биосинтеза антоцианов в перикарпе зерновки пшеницы необходимо комплементарное взаимодействие двух генов Pp-1 и Pp3 (18). В отличие от доминантного аллеля гена Pp3 , который унаследован мягкой пшеницей от эндемичного вида пшеницы эфиопской и является редким, доминантные аллели гена Pp-1 , контролирующие синтез антоцианов не только в зерновке, но и в вегетативных органах, распространены среди различных видов пшеницы и культивируемых в настоящее время современных сортов. Поскольку содержание антоцианов в колеоптиле у сортов варьирует в широких пределах, что может быть обусловлено различными аллелями гена Pp-1 (24), вопрос о том, как эти аллели влияют на биосинтез антоцианов в зерне при их комбинировании с доминантными аллелями гена Pp3 , оставался открытым.
Для решения этого вопроса в проведенном нами исследовании были получены линии пшеницы с фиолетовой окраской зерновки на основе сортов и линий, не имеющих антоциановых пигментов в зерне, но несущих доминантные аллели либо гена Pp3 (С29Рр3P и С29Рр3PF), либо гена Pp-D1 (Сибирская 21, Терция, Эритроспермум 4-16). Используя внутригенный ДНК-маркер Pp3-diagnostic и SSR-маркеры Xgwm0044 и Xgwm0111, тесно сцепленные с геном Pp-D1, мы отобрали гибридные растения, несущие совместно доминантные аллели генов Pp-D1 и Pp3 в гомозиготном состоянии. Зерно со всех отобранных гибридов F2, выращенных в осеннюю вегетацию в гидропонной теплице, имело антоциановую окраску перикарпа с ССА в диапазоне от 34,1 до 84,2 мкг/г и не отличалось от контрольных образцов, содержащих в зерновке от 40,1 до 84,8 мкг/г антоцианов, за исключением контрольного образца фBW49880P с темно-фиолетовым зерном и ССА 213,2 мкг/г. Эти значения ССА согласуются с данными, полученными дру- гими авторами, которые оценили содержание антоцианов в зерновке пшеницы в пределах от 16,0 до 477 мкг/г (10, 14, 33, 34). Таким образом, имеется возможность использовать моногенное наследование гена Pp3 в скрещиваниях фиолетовозерной пшеницы с широко распространенными сортами мягкой пшеницы с окрашенным колеоптилем и стеблем, уже содержащими в геноме доминантные аллели генов Pp-1 (Pp-B1 или Pp-D1), для получения новых гибридов и сортов с фиолетовой окраской зерновки (27).
Среди гибридов F 2 , полученных в результате скрещивания с сортами, несущими доминантные аллели гена Pp-D1 , в двух комбинациях Терция ½ С29 Рр3 P и Эр 4-16 ½ С29 Рр3 P мы отобрали по одному растению с наибольшим содержанием антоцианов в зерне и размножили их до поколения F 4 . Полученные гибридные линии были протестированы в полевых условиях 2021 года. По результатам измерения ССА в цельнозерновой муке из зерен полевого материала гибридные линии F 4 Терция ½ С29 Рр3 P показали самое высокое значение (244,3 мкг/г), что практически в 3 раза превышало показатель в зернах от линии F 4 Эр 4-16 ½ С29 Рр3 P (86,4 мкг/г) и было сравнимо с ССА в темно-фиолетовых зернах ранее созданного гибрида фBW49880P от селекционной линии, биообогащенной цинком (35). Интересно, что у полученной гибридной линии F 4 Терция ½ С29 Рр3 P, выращенной в полевых условиях, ССА в зерне было выше, чем в среднем у отобранных фиолетовозерных гибридных растений поколения F 2 , несущих в геноме доминантные аллели Pp3 и Pp-D1 . Это предполагает воздействие других, еще не изученных нами генов на биосинтез и сохранение антоцианов в перикарпе зерна.
Как было показано в ряде работ, на содержание антоцианов в зерне существенное влияние оказывают условия выращивания и агротехника (14, 36, 37). Наибольшее содержание антоцианов в перикарпе зерновок было выявлено в фазу восковой спелости (36, 37), в связи с чем ранняя уборка урожая фиолетовозерной пшеницы, богатой антоцианами, давала на 39 % больше антоцианов, чем более поздняя уборка (38). Показано, что применение удобрений с азотом, цинком, магнием повышало урожайность зерна и содержание антоцианов в фиолетовозерном рисе (39). Обработка магнием также увеличивала содержание антоцианов (36). Фиолетовозерные пшеницы накапливали значительно большее количество антоцианов при низком азотном стрессе (40). Несмотря на влияние среды на биосинтез антоцианов в тканях растений и варьирование их содержания у одного и того же сорта в различных агроэкологических условиях, генотип растения имеет решающее значение в проявлении признака (40).
Некоторые авторы предполагают, что накопление антоцианов может иметь отрицательную связь с урожайностью из-за дисбаланса энергии, необходимой для наполнения зерна, частично направленной на биосинтез пигментов (41). По данным структурного анализа полевого материала, отобранные фиолетовозерные гибридные линии F 4 Терция ½ С29 Рр3 P и F 4 Эр 4-16 ½ С29 Рр3 P не отличались от краснозерного сорта Саратовская 29 и ранее созданной на его основе фиолетовозерной почти-изогенной линии фC29PРF (см. табл. 3). Отдельно надо отметить, что у фиолетовозерной гибридной линии фBW49880P, несущей в геноме доминантные аллели генов Pp3 и Pp-D1 от сорта Purple, как и у ее белозерной родительской линии, растения были ниже (66,4 см и 69,5 см) в сравнении с сортом Саратовская 29 и остальными линиями, что не отразилось на их урожайности в ЗападноСибирском регионе.
Показавшие наибольшее ССА в зерне, выращенном в полевых условиях, линии F4 Терция ½ С29Рр3P и фBW49880P представляют собой перспективные селекционные образцы и ценные доноры не только генов окраски, но и комплекса генов, определяющих адаптивность к условиям Западной Сибири. Так, сорт Терция, полученный из гибридной популяции от ступенчатого скрещивания между собой изогенных линий на основе сорта Новосибирская 67 (АНК-2/АНК-3//АНК-1/3/АНК-7А), отнесен к высокоурожайному среднеспелому типу и включен в список особо ценных по качеству сортов Государственного реестра селекционных достижений, допущенных к использованию по Западно-Сибирскому региону (код сорта 9300473). Этот сорт характеризуется толерантностью к возбудителям некоторых рас бурой ржавчины и мучнистой росы, засухоустойчив, устойчивость к полеганию составляет 4,0-5,0 баллов. В поздних посевах возможно поражение стеблевой ржавчиной.
Линия BW49880 обладает комплексной устойчивостью к стеблевой и листовой ржавчине благодаря сочетанию генов Sr2 + Yr30 + Lr27 + Pbc , локализованных на хромосоме 3BS (42, 43). Кроме того, у линии снижена высота растений, которые имеют плотный неполегающий стебель, и она рассматривается как перспективный источник генов карликовости Rht . Фиолетовозерная гибридная линия, полученная на основе этой линии, — фBW49880P в настоящее время используется в качестве донорного родителя в скрещиваниях с новыми коммерческими сортами Столыпинская 2 и Си-лантий, имеющими зеленые стебли.
Итак, в представленной работе показано, что сорта пшеницы с антоциановой окраской колеоптиля, стебля, подколосового междоузлия содержат доминантные аллели генов Pp-D1 , которые можно использовать в селекции фиолетовозерных линий. При скрещивании таких сортов с фиолетовозерными донорами доминантных аллелей генов Pp-D1 и Pp3 , полученными ранее селекционными методами, наследование признака окраски зерновки у гибридов будет определяться единственным геном Pp3 , уникальный аллель которого, контролирующий фиолетовую окраску перикарпа, был перенесен в геном мягкой пшеницы от тетраплоидного вида Triricum aethiopicum . Разработанный нами диагностический маркер этого гена Pp3-diagnostic позволяет уже на ранних стадиях развития выявить гомозиготные растения поколения F 2 , которые сформируют при созревании фиолетовое зерно, что повышает точность отбора и снижает трудоемкость селекционной работы. Созданные на основе сортов с окрашенными колеоптилями и стеблями линии не отличались по содержанию антоцианов от ранее полученных нами фиолетовозерных линий, несущих доминантные аллели генов Pp-D1 от доноров фиолетовой окраски зерна, а в некоторых случаях превосходили их по суммарному содержанию антоцианов в зерновке. Одна из темно-фиолетовозерных линий — фТерция Рр3 P, отобранная из гибридной комбинации с сортом Терция, и контрольная темно-фиолетовозерная линия фBW49880P, созданная на основе белозерного синтетика BW49880, показали наибольшее накопление антоцианов в полевых условиях — соответственно 244,3 и 221,4 мкг/г. Эти линии были выбраны в качестве перспективных доноров для селекции новых сортов мягкой пшеницы. Коэффициент корреляции между суммарным содержанием антоцианов в зерне и в колеоптиле изучаемых линий составил r s = 0,83 (p = 0,0003). Полученные результаты важны не только для понимания особенностей накопления антоцианового пигмента в вегетативных органах мягкой пшеницы и в перикарпе зерновки, а также для селекции богатых антоцианами культурных сортов мягкой пшеницы.
Авторы благодарят Галину Владимировну Генералову и Ольгу Викторовну
Захарову за техническую помощь в работе.
Список литературы Об особенностях селекции фиолетовозерной пшеницы на основе сортов с антоциановой окраской колеоптиля и стебля
- Salehi B., Sharifi-Rad J., Cappellini F., Reiner., Zorzan D., Imran M., Maroyi A. The therapeutic potential of anthocyanins: current approaches based on their molecular mechanism of action. Front. Pharmacology, 2020, 11: 1300 (doi: 10.3389/fphar.2020.01300).
- Гончарова Ю.К., Гончаров С.В., Харитонов Е.М., Фотев Ю.В., Симонова В.В., Очкас Н.А. Антиоксиданты растительного происхождения и их нетрадиционные источники (обзор). Сельскохозяйственная биология, 2024, 59(1): 39-53 (doi: 10.15389/agrobiology.2024.1.39rus).
- Шанина Е.П., Оберюхтин Д.А., Черницкий А.Е. Картофель: новый взгляд на традиционный пищевой продукт и его употребление в виде сока (обзор). Сельскохозяйственная биология, 2024, 59(1): 22-38 (doi: 10.15389/agrobiology.2024.1.22rus).
- Dwivedi S.L., Mattoo A.K., Garg M., Dutt S., Singh B., Ortiz Rios R.O. Developing germplasm and promoting consumption of anthocyanin-rich grains for health benefits. Front. Sust. Food Sys-tems, 2022, 6: 867897 (doi: 10.3389/fsufs.2022.867897).
- Oladzadabbasabadi N., Nafchi A.M., Ghasemlou M., Ariffin F., Singh Z., Al-Hassan A. A. Nat-ural anthocyanins: sources, extraction, characterization, and suitability for smart packaging. Food Pack. Shelf Life, 2022, 33: 100872 (doi: 10.1016/j.fpsl.2022.100872).
- Landi M., Tattini M., Gould K.S. Multiple functional roles of anthocyanins in plant-environ-ment interactions. Environ. Exp. Botany, 2015, 119: 4-17 (doi: 10.1016/j.envexpbot.2015.05.012).
- Shen N., Wang T., Gan Q., Liu S., Wang L., Jin B. Plant flavonoids: classification, distribution, biosynthesis, and antioxidant activity. Food Chemistry, 2022, 383: 132531 (doi: 10.1016/j.food-chem.2022.132531).
- Запрометов М.Н. Основы биохимии фенольных соединений. М., 1974.
- Zhu F. Anthocyanins in cereals: Composition and health effects. Food Research International, 2018, 109: 232-249 (doi: 10.1016/j.foodres.2018.04.015).
- Garg M., Kaur S., Sharma A., Kumari A., Tiwari V., Sharma S., Krishania M. Rising demand for healthy foods-anthocyanin biofortified colored wheat is a new research trend. Front. Nutr., 2022, 9: 878221 (doi: 10.3389/fnut.2022.878221).
- Padhy A.K., Kaur P., Singh S., Kashyap L., Sharma A. Colored wheat and derived products: key to global nutritional security. Critic. Rev. Food Sci. Nutrition, 2024, 64(7): 1894-1910 (doi: 10.1080/10408398.2022.2119366).
- Wang X., Zhang X., Hou H., Ma X., Sun S., Wang H., Kong L. Metabolomics and gene expres-sion analysis reveal the accumulation patterns of phenylpropanoids and flavonoids in different colored-grain wheats (Triticum aestivum L.). Food Res. Int., 2020, 138: 109711 (doi: 10.1016/j.foodres.2020.109711).
- Koksel H., Cetiner B., Shamanin V.P., Tekin-Cakmak Z.H., Pototskaya I.V., Kahraman K., Morgounov A.I. Quality, nutritional properties, and glycemic index of colored whole wheat breads. Foods, 2023, 12(18): 3376 (doi: 10.3390/foods12183376).
- Abdel‐Aal E.S.M., Hucl P., Shipp J., Rabalski I. Compositional differences in anthocyanins from blue‐and purple‐grained spring wheat grown in four environments in Central Saskatchewan. Cereal Chem., 2016, 93(1): 32-38 (doi: 10.1094/CCHEM-03-15-0058-R).
- Sytar O., Bośko P., Živčák M., Brestic M., Smetanska I. Bioactive phytochemicals and antioxidant properties of the grains and sprouts of colored wheat genotypes, Molecules, 2018, 23(9): 2282 (doi: 10.3390/molecules23092282).
- Zhang J., Ding Y., Dong H., Hou H., & Zhang X. Distribution of phenolic acids and antioxidant activities of different bran fractions from three pigmented wheat varieties. J. Chem., 2018; 1-9 (doi: 10.1155/2018/6459243).
- Gamel T.H., Saeed S.M.G., Ali R., Abdel-Aal E.-S.M. Purple wheat: food development, anthocy-anin stability, and potential health benefits. Foods, 2023, 12: 1358. (doi: 10.3390/foods12071358).
- Хлесткина Е. К. Гены, детерминирующие окраску различных органов пшеницы. Вавилов-ский журнал генетики и селекции, 2014, 16(1): 202-216.
- Shoeva O.Y., Gordeeva E.I., Khlestkina E.K. The regulation of anthocyanin synthesis in the wheat pericarp. Molecules, 2014, 19(12): 20266-20279 (doi: 10.3390/molecules191220266).
- Himi E, Taketa S. Isolation of candidate genes for the barley Ant1 and wheat Rc genes control-ling anthocyanin pigmentation in different vegetative tissues. Mol. Gen. Genomics, 2015, 290(4): 1287-1298 (doi: 10.1007/s00438-015-0991-0).
- Gordeeva E.I., Shoeva O.Y., Khlestkina E.K. Marker-assisted development of bread wheat near-isogenic lines carrying various combinations of purple pericarp (Pp) alleles. Euphytica, 2015, 203: 469-476 (doi: 10.1007/s10681-014-1317-8).
- Zeven A.C. Wheats with purple and blue grains: a review. Euphytica, 1991, 56: 243-258 (doi: 10.1007/BF00042371).
- Ye G.J., Wei L., Chen W.J., Zhang B., Liu B.L., Zhang H.G. Frame-shift mutation causes the function loss of TaMYB-A1 regulating anthocyanin biosynthesis in Triticum aestivum. Cereal Res. Commun., 2017, 45(1): 35-46 (doi: 10.1556/0806.44.2016.042).
- Cao D., Fan J., Xi X., Zong Y., Wang D., Zhang H., Liu B. Transcriptome analysis identifies key genes responsible for red coleoptiles in Triticum monococcum. Molecules, 2019, 24: 932 (doi: 10.3390/molecules24050932).
- Arbuzova V.S., Maystrenko O.I., Popova O.M. Development of near-isogenic lines of the common wheat cultivar Saratovskaya 29. Cereal Res. Commun., 1998, 26(1): 39-46 (doi: 10.1007/BF03543466).
- Gordeeva E., Shamanin V., Shoeva O., Kukoeva T., Morgounov A., Khlestkina E. The strategy for marker-assisted breeding of anthocyanin-rich spring bread wheat (Triticum aestivum L.) culti-vars in Western Siberia. Agronomy, 2020, 10: 1603 (doi: 10.3390/agronomy10101603).
- Шоева О.Ю., Гордеева Е.И., Хлесткина Е.К. Патент RU2774444C1, 2022 г. по МПК C12Q1/68 от 29 ноября 2021 г. Внутригенный ДНК-маркер для отбора пшеницы с повышенным содержанием антоцианов в перикарпе зерновки. Режим доступа: https://paten-ton.ru/patent/RU2774444C1). Без даты.
- Plaschke J., Ganal M.W., Röder M.S. Detection of genetic diversity in closely related bread wheat using microsatellite markers. Theor. Appl. Genet., 1995, 91: 1001-1007 (doi: 10.1007/BF00223912).
- Röder M.S., Korzun V., Wendehake K., Plaschke J., Tixier M.H., Leroy P., Ganal M.W. A mi-crosatellite map of wheat. Genetics, 1998, 149(4): 2007-2023 (doi: 10.1093/genetics/149.4.2007).
- Гордеева Е.И., Шоева О.Ю., Шаманин В.П., Хлесткина Е.К. Использование молекуляр-ных маркеров в селекции мягкой пшеницы (Triticum aestivum L.) с различной антоциано-вой окраской зерновок. Письма в Вавиловский журнал генетики и селекции, 2023, 9(2): 86-99 (doi: 10.18699/LettersVJ-2023-9-11).
- Abdel-Aal E.S.M., Hucl, P. A rapid method for quantifying total anthocyanins in blue aleurone and purple pericarp wheats. Cereal Chemistry, 1999, 76: 350-354 (doi: 10.1094/CCHEM.1999.76.3.350).
- Трухачева Н.В. Математическая статистика в медико-биологических исследованиях с применением пакета Statistica. М., 2012.
- Žofajová A., Pšenáková I., Havrlentov, M., & Piliarová M. Accumulation of total anthocyanins in wheat grain. Agr./Pol’nohospodarstvo, 2012, 58(2): 50-56 (doi: 10.2478/v10207-012-0006-7).
- Sharma S., Chunduri V., Kumar A., Kumar R., Khare P., Kondepudi K.K., Garg M. Anthocy-anin bio-fortified colored wheat: nutritional and functional characterization. PLoS ONE, 2018, 13(4): e0194367 (doi: 10.1371/journal.pone.0194367).
- Ghimire S., Thapa D.B., Paudel A., Adhikari N.R. Variability study of biofortified bread wheat genotypes for grain zinc and iron concentration, yield and yield associated traits at Khumaltar, Lalitpur, Nepal. Int. J. Appl. Sci. Biotechnol., 2019, 7: 184-194 (doi: 10.3126/ijasbt.v7i2.23433).
- Bustos D.V., Riegel R., Calderini D.F. Anthocyanin content of grains in purple wheat is affected by grain position, assimilate availability and agronomic management. J. Cereal Sci., 2012, 55(3), 257-264 (doi: 10.1016/j.jcs.2011.12.001).
- Knievel D.C., Abdel-Aal E.S., Rabalski I., Nakamura T., Hucl P. Grain color development and the inheritance of high anthocyanin blue aleurone and purple pericarp in spring wheat (Triticum aestivum L.). J. Cereal Sci., 2009, 50(1): 113-120 (doi: 10.1016/j.jcs.2009.03.007).
- Li X., Qian X., Lǚ X., Wang X., Ji N., Zhang M., Ren M. Upregulated structural and regulatory genes involved in anthocyanin biosynthesis for coloration of purple grains during the middle and late grain-filling stages. Plant Physiol. Biochem., 2018, 130: 235-247 (doi: 10.1016/j.plaphy.2018.07.011).
- Fongfon S., Prom-U-Thai C., Pusadee T., & Jamjod S. Responses of purple rice genotypes to nitrogen and zinc fertilizer application on grain yield, nitrogen, zinc, and anthocyanin concen-tration. Plants, 2021, 10(8): 1717 (doi: 10.3390/plants10081717).
- Fan X., Xu Z., Wang F., Feng B., Zhou Q., Cao J., Wang T. Identification of colored wheat genotypes with suitable quality and yield traits in response to low nitrogen input. PloS ONE, 2020, 15(4), e0229535 (doi: 10.1371/journal.pone.0229535).
- Rahman M. M., Lee K. E., & Kang S. G. Studies on the effects of pericarp pigmentation on grain development and yield of black rice. Indian J. Genet.Plant Breed., 2015, 75(4), 426-433 (doi: 10.5958/0975-6906.2015.00069.3).
- Spielmeyer W., Sharp P.J., Lagudah E.S. Identification and validation of markers linked to broad-spectrum stem rust resistance gene Sr2 in wheat (Triticum aestivum L.). Crop. Sci., 2003, 43: 333-336 (doi: 10.2135/cropsci2003.3330).
- Aktar-Uz-Zaman M., Tuhina-Khatun M., Hanafi M.M., Sahebi M. Genetic analysis of rust resistance genes in global wheat cultivars: an overview. Biotech. Biotech. Equipment, 2017, 31: 431-445 (doi: 10.1080/13102818.2017.1304180).


