Об участии гетеротрофных микроорганизмов в начальном почвообразовании на отходах агломерации железных руд
Автор: Артамонова В.С., Булавина М.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2021 года.
Бесплатный доступ
Представлены результаты исследований развития гетеротрофных микроорганизмов в эмбриозёмах, формирующихся на песчаных отходах агломерации железных руд в Западной Сибири. На начальном этапе почвообразования - в инициальных эмбриозёмах обнаружены низкие значения актуальной кислотности и очень низкие показатели гумуса. Установлено, что такие среды обитания фитотоксичны, что подтверждают данные о всхожести семян и роста проростков: овса посевного, редьки масличной и горчицы белой. Доказано, что гетеротрофные микроорганизмы адаптированы к жизни в эмбриозёмах. Азотобактерии сохраняют жизнедеятельность, благодаря токсино- и слизеобразованию, и активно размножаются. Микромицеты проявляют диморфизм - дрожжевой и мицелиальный типы роста, что расширяет возможности их вегетативного размножения и сохранения популяции. Выявлено, что органо-аккумулятивные эмбриозёмы наиболее жизнепригодны для растений и микроорганизмов. Впервые зарегистрировано свечение плесневых грибов и азотобактера под злаковыми растениями и сосновыми насаждениями. Высказано предположение, что выброс световой энергии, присутствие оксидаз микроорганизмов и лигнина растений способствует гумификации в олиготрофной среде.
Бактерии, плесневые грибы, адаптация, почвообразование, техногенные отходы
Короткий адрес: https://sciup.org/147235444
IDR: 147235444 | УДК: 504.75+631.4 | DOI: 10.17072/1994-9952-2021-1-61-69
Текст научной статьи Об участии гетеротрофных микроорганизмов в начальном почвообразовании на отходах агломерации железных руд
ганизмов, преимущественно местного происхождения, способных к детоксикации [Водолеев, Анд-роханов, Клековкин, 2007; Liste, 2009; Evaluation…, 2011]. Такие приёмы могут ускорить минерализационную и гумификационную активность в корнеобитаемом слое, улучшить минеральное питание растений, но доказательств о выживании и участии гетеротрофных микроорганизмов в этих процессах на песчаных токсичных железорудных отходах, недостаточно.
Любая почва возникает, функционирует и эволюционирует при участии и под частичным контролем биоты и в большой мере адаптирована к её нуждам [Макаров, 2007]. В зрелых почвах свыше 90% растительных остатков подвергается биодеградации с участием гетеротрофных микромицетов и бактерий [Кузнецов, Градова, 2006]. Они же участвуют в детоксикации металлов и гетеротрофном «гумусовом» цикле углерода. Показано, что микроорганизмы прижизненно метабилизируют органические остатки до низкомолекулярных соединений, а по мере гибели клеток внутри цитоплазмы происходят изменения, которые сопровождаются привлечением разрушающихся соединений в сборку первичных частиц гумусовых веществ (размером несколько нанометров) и затем – фрактальных кластеров или основных элементов организации гумусовой матрицы [Федотов, Лысак, Шалаев, 2013]. Источником гумусоподобных веществ могут быть меланины (прогуминовые или парагуминовые соединения) темноокрашенных микромицетов и азотобактерий, например род Azotobacter [Завгородняя, 2000; Попов, Зеленков, Теплякова, 2016]. Установлено, что азотобактер осуществляет продуцирование меланина лишь в присутствии бензойной кислоты [Gospodaryov, Lushchak, 2011] – продукта распада лигнина, который участвует в гумификации. Меланины грибного происхождения после деградации наиболее близки по элементному составу, молекулярным массам и оптическим свойствам с таковыми гуминовых веществ. Сообщается [Гесслер, Егорова, Белозерская, 2014], что в экстремальных условиях роста содержание меланинов у микромицетов может увеличиваться, обеспечивая им выживание в неблагоприятных условиях. Меланины выполняют адаптивную функцию, защищают микроорганизмы от повышенной радиации, УФ- и γ-излучения, тяжёлых металлов и активных форм кислорода, литического действия энзимов биоконкурентов за источники питания и энергии [Gospodaryov, Lushchak, 2011]. Меланизированные штаммы азотобактера выявлены ранее в антропогенно преобразованных почвах сибирского мегаполиса [Артамонова, 2002]. Информация о развитии неспорообразующих бактерий и несовершенных микро-мицетов в техногенных отходах железной руды на этапе инициирования в них почвообразования скудна. Имеются единичные сведения об адаптации гетеротрофных бактерий к условиям обитания на песчаных железорудных отходах [Артамонова и др., 2011].
Цель данной работы – изучить жизнедеятельность несовершенных микромицетов и неспорообразующих бактерий углеродной гетеротрофии в эмбриозёмах на песчаных отходах агломерации железной руды в условиях их самозарастания и лесной рекультивации.
Материалы и методы исследования
Объекты исследований представлены эмбри-озёмами инициальными и органо-аккумулятивными, формирующимися на отходах агломерации обогащения (обогащения) железосодержащей руды и её концентратов. Это хвосты магнитной сепарации рудных пород, которые представляют собой смесь измельчённой железосодержащей руды и технологических реагентов после обогатительного передела минерального сырья. Отходы гидротранспортом доставляются на полигоны – хвосто-хранилища, пребывают десятилетиями на открытом воздухе, представляя собой угрозу окружающей среде. В Кузбассе источником загрязнения окружающей среды являются отходы агломерации преимущественно магнетитовых руд (Fе 3 O 4 ), запасы которых составляют в регионе более 1.5 млрд т. Кроме железа они содержат сульфиды цинка, меди, а также кобальт, бор, золото. Они присутствуют в отвалах рудников и в отстойниках аглофабрик, одна из которых (Абагурская) находится в черте г. Новокузнецка. Её хвостохранилища являются причиной многолетнего загрязнения атмосферы города.
Хвостохранилище Абагурской обогатительной фабрики, с которого были отобраны пробы для почвенно-микробиологического анализа, действует с 1954 г., занимает к настоящему времени площадь около 35 га, где скопилось более 50 млн м3 отходов [Панова и др., 2017]. Хвосты – это мелкозернистые или пылеватые пески, зачастую очень токсичные и радиоактивные [Панова и др., 2017]. В их составе преобладают кислотные оксиды железа и остаточное магнитное железо, которое сосредоточено преимущественно в мелких фракциях. В процентном отношении лидируют SiO 2 , Fe 2 O 3 , CaO, Al 2 O 3 , FeO [Горбачёва, 2020]. Оксиды железа вместе с оксидами кремния и алюминия формируют кислые дренажи, загрязняющие почвы и водотоки прилегающих территорий. Из минералов присутствуют: Fe 3 O 4 ∙Fe 2 O 3 ∙FeO, каолинит, хлорид, вермикулит, полевые шпаты, биотит, кальцит, магнетит и карбонатные включения [Панова и др., 2017].
По истечении 30‒40 лет на поверхности мине- ральных отходов регистрируются локальные педо-подобные образования – эмбриозёмы. В них определялись: содержание углерода по Тюрину; актуальная кислотность традиционным в почвоведении методом; фитотоксичность – по угнетению растений, рекомендованных нормативными документами для тестирования токсичности. При проращивании семян овса, редьки и горчицы использовали 5-кратную повторность вместо 3-кратной, обеспечивающей снижение погрешности, обусловленной разбросом результатов. Микробиологические анализы – традиционные. Рост азотобактера и микро-мицетов учитывали на «голодном» агаре, для уточнения таксономической принадлежности мик-ромицетов использовали кислую среду Чапека. Антагонизм микроорганизмов выявлялся по регистрации литического действия, люминесценцию фиксировали с помощью инновационного продукта – ручки Invisible Ink en fnd Black Light. Данные статистически обрабатывали в программе Statistica.
Результаты и их обсуждение
Анализ содержания углерода в эмбриозёмах свидетельствует о дефиците органогена (таблица). Пересчёт углерода на гумус показал, что значения последнего соответствуют по общепринятой в почвоведении шкале Д.С. Орлова и Л.А. Гришиной очень низкому уровню (менее 2%).
|
Пул С (%) и кислотность в эмбриозёмах |
||||||
|
Проба |
Показатель |
M |
σ |
υ, % |
Доверительный интервал |
|
|
-95% |
+95% |
|||||
|
1 |
рН |
3.8 |
0.01 |
0 |
3.7 |
3.8 |
|
С, % |
0.3 |
0.01 |
4 |
0.3 |
0.3 |
|
|
2 |
рН |
3.8 |
0.02 |
1 |
3.7 |
3.8 |
|
С, % |
0.3 |
0.02 |
6 |
0.2 |
0.3 |
|
|
3 |
рН |
6.3 |
0.02 |
0 |
6.2 |
6.3 |
|
С, % |
1.0 |
0.02 |
2 |
1.0 |
1.0 |
|
|
4 |
рН |
5.7 |
0.02 |
0 |
5.7 |
5.8 |
|
С, % |
0.7 |
0.04 |
5 |
0.7 |
0.8 |
|
|
5 |
рН |
8.1 |
0.02 |
0 |
8.0 |
8.1 |
|
С, % |
1.2 |
0.11 |
9 |
0.9 |
1.5 |
|
|
6 |
рН |
8.0 |
0.03 |
0 |
8.0 |
8.1 |
|
С, % |
1.1 |
0.11 |
10 |
0.8 |
1.3 |
|
Примечание. 1, 2 – Э. инициальный; 3, 4 – Э. органо-акк. под злаками; 5, 6 – Э. органо-акк. под сосновыми насаждениями.
Минимальные значения гумуса обнаружены в инициальных эмбриозёмах без растений, чуть выше они оказались в органо-аккумулятивных молодых почвах, под злаками, донником и под сосновыми насаждениями. Актуальная кислотность эм-бриозёмов инициальных (рН < 4.5) соответствовала сильной кислотности, в органо-аккумулятивных – значения рН водного раствора (5.5‒6.0) приблизились к нейтральной степени. Сильная кислот- ность способствовала подвижности тяжёлых металлов и высокой фитотоксичности (рис. 1).
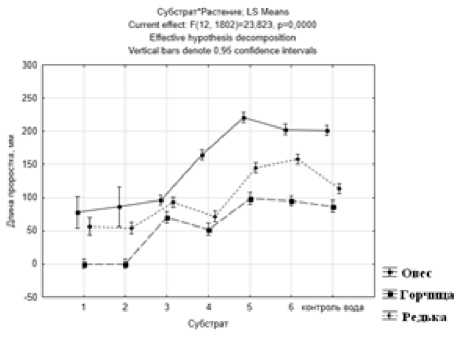
Рис. 1 . Длина проростков фитотестов:
1, 2 – Э. инициальный; 3, 4 – Э. органо-акк. под злаками; 5, 6 – Э. органо-акк. под сосновыми насаждениями
Наиболее устойчивым к таким условиям обитания оказался овёс. Для горчицы среда оказалась губительной. Следовательно, эмбриозёмы представляют собой олиготрофные среды обитания. Негативное влияние на накопление углерода мог оказывать песок в эмбриозёмах, поскольку в зрелых песчаных почвах гумус быстро минерализуется. Анализ гетеротрофных микробных ассоциаций показал, что в метаболически активном состоянии пребывают плесневые грибы р. Fusarium, Trichoderma, Penicillium и неспорообразующие грамотрицательные бактерии р. Azotobacter . Встречаемость азотобактерий (по степени обрастания мелкозёма) в инициальном эмбриозёме составляла 62–85%, в органо-акумулятивном – 100%, но меньшинство встречаемых бактерий в инициальном эмбриозёме оказались наиболее активными в процессе размножения. Их скорость роста в пересчёте на сутки на 30% была выше. В этом же типе эмбриозёма азотобактер продуцировал литические экзометаболиты против микро-мицетов (рис. 2). В органо-аккумулятивном эм-бриозёме они не наблюдались.
Мы полагаем, что углеродная гетеротрофия у азотобактера и плесневых грибов могла дополняться в условиях дефицита органической пищи древнейшим автотрофным путём усвоения углекислоты [Виноградский, 1952]. Хемосинтез органического вещества может проходить с участием углекислого газа, окиси углерода, муравьиной и уксусной кислот, метанола, карбонатов (в присутствии воды). Он обеспечивается за счёт энергии окисления неорганических соединений водорода, марганца, железа, серы, аммиака, а не энергии света. Среди хемосинтетиков присутствуют и азотобактерии, которые синтезируют энергию в виде молекулы АТФ. Такой метаболизм в эмбриозёмах исключать нельзя, но в нашем исследовании рост азотобактера обеспечивался на «голодной» питательной среде (Эшби), в рецептуре приготовления которой есть глюкоза (в небольших количествах); в её присутствии хемосинтез не происходит, поэтому корректнее говорить в нашем случае о гете-ротрофии.
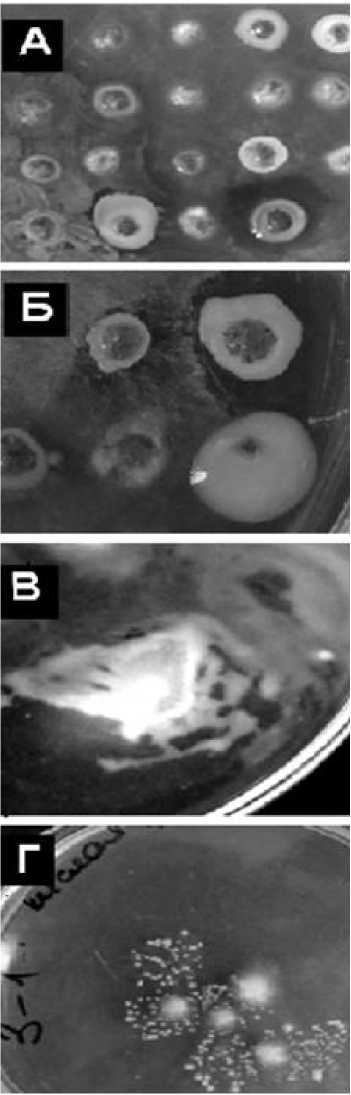
Рис. 2. Физиологические особенности микроорганизмов:
А – литические зоны азотобактера, Б – слизе-образование азотобактера, В – люминесценция азотобактера, Г -деморфизм микромицетов
Что касается проявления литической (антибиотической) активности Azotobacter chroococcum, то антифунгальный эффект был обнаружен ранее, в 60-е гг. прошлого века [Мишустин, Наумова, Хохлова, 1969]. Угнетать развитие микромицетов могли анисомицин группы азалидов [Придатчина и др., 1982], а также антибиотик фенольной группы – 5-алкил резорцин [Придатчина, 1984], способный подавлять рост Penicillium chrysogenum, Fusarium culmorum и простейших [Stasiuk, Kozubek, 2010]. Нужно отметить, что микромице-ты в такой обстановке проявляли диморфизм – наличие двух морфологических типов роста: дрожжевого и плесневого (гифального, мицелиального). Дрожжевой рост сопровождался почкованием, что наряду с фрагментами гиф, отдельных клеток, а также спор и конидий расширило возможности вегетативного размножения несовершенных грибов. Через плеоморфизм – фазовые изменения роста повышалась их численность бесполым путём. В органо-аккумулятивном эмбри-озёме такой адаптивной стратегии роста не наблюдалось.
Активной жизнедеятельности азотобактера способствовал не только синтез токсинов, но и слизеобразование. Слизью называют вещество, окружающее клетку, имеющее аморфный, бесструктурный вид и легко отделяющееся от поверхности клетки, по толщине зачастую превосходящее её диаметр. Поэтому основная масса находящихся в почвах органических полимеров микробного происхождения представлена внеклеточными полисахаридами и полиуронидами бактерий, или, иначе говоря, слизями и их остатками. Слизи азотобактера по химической природе являются полисахаридами, в составе которых доминирует ангидрид уроновой кислоты (до 75%).
Имеющиеся в составе полисахаридов карбоксильные и фенольные группы ответственны за распад кристаллических решеток минералов. Реагируя с определенными химическими элементами, они образуют комплексные связи, способствующие переходу элементов в раствор. Поэтому в эмбри-озёмах, где преобладают минеральные частицы, слизи – это важное биогенное средство извлечения элементов зольного питания. Одновременно слизи защищают клетки азотобактера от механических повреждений, иссушения, выедания простейшими, биодеградации другими микроорганизмами.
Слизи выступают также в роли резерва питательных веществ в ситуациях их дефицита, обезвреживания от экотоксикантов, в том числе путём хелатирования. В процессе жизнедеятельности азотобактер осуществляет сцепление песчаных частиц слизью, способствующих образованию педо-агрегатов. Следовательно, слизи – это мульти-функциональный адаптер сохранения жизнедеятельного состояния азотобактера в эмбриозёмах, биогенный фактор формирования водоудержива- ющей способности молодых почв на техногенных песчаных отходах. Проявлением другой адаптивной способности у азотобактера и плесневых грибов оказалась люминесценция их живых клеток голубым светом.
Люминесцентный путь превращения химической энергии в световую в условиях аэробиоза у грамотрицательных бактерий обязан окислительному метаболизму. Выброс энергии – это результат неутилизированной энергии и нейтрализации ферментами активных форм кислорода, токсичных (но необходимых) для процесса окисления глюкозы. Интересно, что голубое свечение микроорганизмов обусловлено возбуждением флавина, в результате окисления альдегида и восстановления молекулы рибофлавинфосфата. Провоцируют свечение активные формы кислорода, прежде всего, его реактивные соединения: синглетный (высокореактивный) кислород – радикал супероксид– аниона, водородный пероксид, гидроксильный анион. В настоящее время считается, что образование свободных радикалов является одним из патогенетических механизмов повреждения митохондрий, липидов, ДНК клетки [Коровина, Захарова, Обыночная, 2003]. Процесс перекисного окисления липидов в мембранах осуществляется по свободно радикальному механизму, подобно тому, как по цепному механизму происходит деление ядер урана [Коровина, Захарова, Обыночная, 2003]. Разрушаются жирорастворимые соединения, такие как убихинон – коэнзим СоQ8 у грамотрица-тельных бактерий, СоQ6 – дрожжей, поскольку они более уязвимы для процессов перекисного окисления. Кроме убихинона у Azotobacter chroococcum , могут поражаться, и другие липиды – их у бактерии не менее 16 [Алексеева, 2005]. Окислительным атакам могут подвергаться ферредоксины – белковые железосерные кластеры и флаводоксины – белковые структуры, идентичные ферредоксинам. Они участвуют в азотфиксации и их поражение может негативно отразиться на фиксации молекулярного азота азотобактером [Готтшалк, 1982]. Тем не менее, у представителей рода Azotobacter выработался особый механизм защиты от негативного действия кислорода — так называемая дыхательная защита. Она осуществляется путём значительной интенсификации дыхания, снижающего концентрацию кислорода в клетках [Берцова, Демин, Богачев, 2005]. Также имеется особый белок Shethna, защищающий нитрогеназу от кислорода [Maier, Moshiri, 2000]. Вероятно, такая защита способствовала выживанию и размножению азотобактера в эмбриозёмах.
Свободные радикалы, ведущие цепь окисления (обычно это перекисные радикалы), могут вступать в реакцию взаимодействия (рекомбинация или диспропорционирование) и в реакцию с молекула- ми клеточной мембраны, превращая их в свободные радикалы (самоподдерживающаяся лавинообразная реакция). Инициаторами таких взаимодействий являются химические реакции, связанные с изменением валентности иона металла (Cu2+, Fe2+). Особенно опасно для клетки одновременное присутствие О2- и Н2О2, причиной которого является нарушение эволюционно сформированных механизмов защиты микроорганизмов против токсичных форм кислорода – ферментов, способны предохранять клетки от «самозагрязнения» потоками активного кислорода и перекиси водорода путём каталитического расщепления [Хочачка, Сомеро, 1988]. Они имеют определенную специализацию как по отношению к конкретным видам радикалов и перекисей, так и по локусам возникновения активных форм кислорода. Активное ферментативное звено включает супероксиддисму-тазу, пероксидазу и каталазу. В этих ферментах важную роль имеет геминный компонент – протеиды с геминовой группой. Не исключено, что в эм-бриозёмах возникают ситуации, когда в микробных клетках возрастает не только пул свободных радикалов, но и повреждаются железосодержащие белки, их белковые комплексы с железом и серой под воздействием реакционных соединений азота – окиси азота и пероксинитрата. Известно, что окись азота производится практически всеми типами живых организмов, в том числе бактериями и микро-мицетами [Röszer, 2012]. Окись азота является высокореактивным свободным радикалом со временем жизни порядка нескольких секунд, но при этом обладает высокой способностью к проникновению сквозь биологические мембраны. Эндогенный оксид азота проявляет своё действие на клетки путём S-нитрозилирования тиоловых соединений (включая тиоловые группы серосодержащих аминокислот, таких, как цистеин) и нитрозилирования ионов переходных металлов, которых в эмбриозё-мах достаточно. Установлено [Park, 2003; Imlay, Korshunov, Imlay, 2015], что цистеин вследствие его высокой реакционной способности может восстанавливать внутриклеточное железо, способствуя протеканию реакции окисления пероксида водорода – H2O2 с ионами железа (реакция Фентона), которая сопровождается образованием токсичных гидроксильных радикалов и индукцией хемолюминесценции. Интенсивность свечения, возникающего при рекомбинации свободных радикалов, пропорциональна квадрату их концентрации в системе. В экспериментах с биологическими субстратами и органическими веществами показатель светосуммы люминесценции, индуцированной реакцией Фентона, стабилен при концентрации компонентов [Fe2+] = 10-3 моль/л, [H2O2] = 10-3 моль/л, pH = 2 [Иванова, Трофимова, Пискарёв, 2014]. Такие условия реальны в инициальных эм- бриозёмах. Не исключено также связывание окиси азота не только с Fe, но и с Cu, Zn, Cr, Co, Mn, ионами переходных металлов в составе простети-ческих групп и активных каталитических центров металлоферментов, дефицита которых в эмбри-озёмах тоже нет, они наследуются от отходов железной руды. Интересно другое – выявленное нами свечение регистрировалось у микроорганизмов, обитающих преимущественно под злаками и сосновыми посадками. Эти растения являются основными продуцентами лигнина в растительном мире. Продукт его разложения – бензойная кислота – является важнейшим компонентом гумификации растительного опада хвойных и лиственных растительных сообществ [Анохина и др., 2018]. Окисление остатков лигнина и его связь с белками микроорганизмов в слабощелочной среде обычно сопровождаются образованием гуминовых кислот. В окислении лигнина участвуют лигнолитические микромицеты, благодаря присутствию ферментов – оксидаз, таких как марганецпероксидаза и лиг-нинпероксидаза. В качестве кофакторов окисления органических остатков у них выступают гемы Fe, Cu, Mn, обеспечивающие разрушение перекиси водорода до молекулярного кислорода и воды [Дармов, Горшунова, Тарасова, 2017]. Присутствие металлов в таких местообитаниях не оспаривается, поскольку стратегия растений поглощать тяжёлые металлы связана с выделением корнями производных мугеиновых кислот, действующих как внешние фитосидерофоры, мобилизующие нерастворимые ионы металлов [Murakami et al., 1989; Takagi, 1993]. Следовательно, молекулярный кислород – продукт каталитического расщепления геминными ферментами быстро вовлекается в окисление железа, и процесс образования свободных радикалов в микробных клетках продолжается. Свечение способствует освобождению невостребованной энергии микробной клеткой и частичной нейтрализации радикалов, тем самым предохраняет микроорганизмы от развития митохондриальной дисфункции, пероксидации липидов, нарушения ДНК и нитрогеназы. Жизнедеятельные клетки являются источником микробной биомассы и участником гумификации, поскольку выброс энергии, синтез оксидаз в присутствии лигнина способствует образованию гуминовых кислот.
Заключение
Эмбриозёмы, формирующиеся на отходах обогащения железной руды, жизнепригодны для гетеротрофных неспорообразующих бактерий и несовершенных микромицетов. На инициальном этапе педогенеза среда обитания микроорганизмов характеризуется сильной кислотностью, олиготроф-ностью, токсичностью, присутствием оксидного и магнитного железа. Жизнедеятельные микроорга- низмы обнаружили к ним различные способы адаптации: азотобактерии выживают, благодаря токсино- и слизеобразованию, микромицеты – благодаря диморфизму – дрожжевому и мицелиальному росту, что расширяет возможности их вегетативного размножения и сохранения популяции. В нейтральной среде обитания – эмбриозёмах органо-аккумулятивных разнообразие типов роста у микромицетов отсутствовало. Специфическим способом адаптации микромицетов и азотобактера к нарушению окислительных реакций, обусловленных присутствием железа и других металлов, оказалась люминисценция. Освобождение клетками неиспользованной энергии в форме света, предохраняло их от гиперкоагуляции белков, перекисного окисления липидов, гипергликемии, которые вызываются перекисными радикалами и активными формами кислорода. Обычно освобождение химической энергии, не вовлекаемой в процессы метаболизма, наблюдается у микромицетов и бактерий при термодинамически полном окислении, но за пределы клетки энергия освобождается в форме тепла, но не в форме света. В таком случае бактерии теряют около половины продуцируемой энергии, плесневые грибы – значительно больше, поскольку используют для синтетических целей лишь около 10% энергии. В патологическом состоянии – при интенсивном окислении кислорода в присутствии избытка свободных радикалов, энергия выбрасывается фотонами с максимумом излучения бактериями 470‒500 нм, что достаточно для возбуждения свечения в видимой части спектра. Испускаемая энергия – 70 ккал/1 эйнштейн значительно превышает энергию большинства биохимических реакций, например, при распаде высокоэнергетической молекулы АТФ (7 ккал) [Биолюминесценция, 2020]. Такой энергетический приток в олиготрофную среду способствует, на наш взгляд, протеканию химических и автокаталитических процессов окислительного характера вокруг клетки для её же блага. Освобождённая энергия, оксидазы погибших микроорганизмов и присутствие лигнина, очевидно, способствуют гумификации в олиготрофной песчаной молодой почве, что при необходимости микроорганизмы могут использовать в качестве углеродного ресурса. Полученная информация о жизнедеятельных гетеротрофных микроорганизмах в эмбриозёмах, формирующихся на песчаных полигонах железорудных отходов, расширяет знания об экологии микроорганизмов и их участии в современном педогенезе.
Работа выполнена в рамках государственного задания ИПА СО РАН по бюджетному финансированию Министерства науки и образования Российской Федерации.
Список литературы Об участии гетеротрофных микроорганизмов в начальном почвообразовании на отходах агломерации железных руд
- Алексеева А.Е. Физиолого-биохимическая активность и разнообразие штаммов Azotobacter chroococcum, выделенных из почв Нижегородской области: дис. ... канд. биол. наук. Н. Новгород, 2005. 141 с.
- Анохина Н.А. и др. Динамика содержания ароматических кислот в биогеоценозах стационарных почвенных лизиметров // Вестник Московского университета. Сер. 17. Почвоведение. 2018. №4. С. 3-10.
- Артамонова В.С. Микробиологические особенности антропогенно преобразованных почв Западной Сибири. Новосибирск: Изд-во СО РАН, 2002. 225 с.
- Артамонова В.С. и др. Эколого- микробиологическое разнообразие микробных сообществ в техногенно-нарушенных ландшафтах Сибири // Сибирский экологический журнал. 2011. Вып. 5. С. 735-746.
- Берцова Ю.В., Демин О.В., Богачев А.В. Дыхательная защита нитрогеназного комплекса у Azotobacter vinelandii // Успехи биологической химии. 2005. Т. 45. С. 205-234.
- Биолюминесценция. 2020. [Электронный ресурс]. URL: https://www.bibliofond.ru/ view.aspx?id= 56452 (дата обращения: 19.12.2020)
- Виноградский С.Н. Микробиология почвы. Проблемы и методы. М.: Изд-во АН СССР, 1952. 792 с.
- Водолеев А.С., Андроханов В.А., Клековкин С.Ю. Почвоулучшители: рекультивационный аспект. Новосибирск: Наука, 2007. 148 с.
- Гесслер Н.Н., Егорова А.С., Белозерская Т.А. Экстремальных условиях существования (обзор) // Прикладная биохимия и микробиология. 2014. Т. 50, № 2. С. 125-134.
- Горбачёва К. Стратегия переработки отходов обогащения железных руд Мундыбашской обогатительной и Абагурской агломерационно-обогатительных фабрик. [Электронный ресурс]. URL: https://pandia.ru/text/77/194/28780/php (дата обращения: 26.10.2020).
- Готтшалк Г. Метаболизм бактерий. М.: Мир, 1982. 310 с.
- Дармов И.В., Горшунова Е.И., Тарасова Т.С. Исследование природных изолятов микромицетов Fusarium spp. - продуцентов лигнолитических ферментов // Учёные записки Казанского университета. Сер. Естественные науки. 2017. Т. 159, кн. 1. С. 72-84.
- Завгородняя Ю.А. Сравнительная характеристика гуминовых кислот и грибных меланинов: дис. ... канд. биол. наук. М., 2000. 109 с.
- Иванова Л.П., Трофимова С.В., Пискарёв И.М. Хемилюминесценция, индуцированная реакцией Фентона, - математическое моделирование процесса; особенности, параметры и условия применения для биомедицинских исследований // Современные технологии в медицине. 2014. Т. 6, № 4. С. 14-25.
- Коровина Н.А., Захарова И.Н., Обыночная Е.Г. Применение антиоксидантов в педиатрической практике // Сonsilium-medicum. 2003. Т. 5, № 9. С. 47-52.
- Кузнецов А.Е., Градова Н.Б. Научные основы эко-биотехнологии. М.: Мир, 2006. 504 с.
- Макаров И.Б. Плодородие и продуктивность почв: соотношение понятий // Плодородие. 2007. № 3. С. 33-35.
- Мишустин Е.Н., Наумова А.Н., Хохлова Ю.М. Ан-тифунгальный антибиотик из культуры Azotobacter chroococcum // Микробиология. 1969. Т. 39, вып. 1. С. 87-90.
- Панова В.Ф. и др. Переработка отходов обогащения железной руды // Вестник Сибирского государственного индустриального университета. 2017. № 3 (21). С. 56-62.
- Попов А.И., Зеленков В.Н., Теплякова Т.В. Биологическая активность и биохимия гуминовых веществ. Ч. 1. Биохимический аспект (обзор литературы) // Вестник Российской Академии естественных наук. 2016. № 1. С. 11-18.
- Придатчина Н.Н. Биологически активные вещества из клеточных липидов азотфиксирующей бактерии Azotobacter chroococcum: дис. ... канд. биол. наук. М., 1984. 144 с.
- Придатчина Н.Н. и др. Azotobacter chroococcum -продуцент нового противогрибкового антибиотика // Антибиотики. 1982. № 1. С. 3-5.
- Федотов Г.Н., Лысак Л.В., Шалаев В.С. Микроорганизмы и образование гумусовых веществ в почвах // Лесной вестник. 2013. № 7. С. 111-115.
- Хочачка П., Сомеро Дж. Биохимическая адаптация. М.: Мир. 1988. 568 с.
- Benabdellah K. et al. GintPDXl encodes a protein in volved in vitamin B6 biosynthesis that is up-regulated by oxidative stress in the arbuscular my-corrhizal fungus Glomus intraradices // New Phy-tol. 2009. Vol. 184. P. 682-693.
- Evaluation of Urban Soils: Suitability for green infrastructure or urban infrastructure. 2011. EPA Publication. 20 p. [Электронный ресурс]. URL: https://www. epa. gov/sites/production/files/2015-10/documents/evaluation-of-urban-soils.pdf (дата обращения: 18.12.2020).
- Gospodaryov D., Lushchak V. Some properties of melanin produced by Azotobacter chroococcum and its possible application in biotechnology // Бютехнолопя. 2011. Т. 4, № 2. C. 61-69.
- Imlay K.R.C., Korshunov S., Imlay J.A. Physiological roles and adverse effects of the two cystine importers of Escherichia coli // J. Bacteriol. 2015. Vol. 197 (23). P. 3629-3644.
- Liste H.-H. Auswahl und Konditionierung alternativer Pflansubstrate zur Rekultivverung von Deponien und Altablagerungen // Обеспечение безопасности закрытых полигонов твёрдых бытовых отходов экологическими методами: материалы междунар. семинара (7-13 сент. 2009 г. Пермь, ПГУ). Пермь; Берлин; М., 2009. С.69-78.
- Maier R.J., Moshiri F. Role of the Azotobacter vine-landii Nitrogenase-Protective Shethna Protein in Preventing Oxygen-Mediated Cell Death // J. Bac-teriol. 2000. Vol. 182, № 13. Р. 3854-3857.
- Murakami T. et al. Stabilities of metal complexes of mugeinic acids and their specific affinities for iron (III) // Chem. Lett. 1989. P. 2137-2140.
- Park S. High levels of intracellular cysteine promote oxidative DNA damage by driving the Fenton reaction // J. Bacteriol. 2003. Vol. 185(6). P. 19421950.
- Roszer T. Nitric Oxide is a Bioproduct in Prokaryotes // The Biology of Subcellular Nitric Oxide. Springer Science+Business Media. 2012. Vol 10, № 2. P. 19-46.
- StasiukM., KozubekA. Biological activity of phenolic lipids // Cell. Mol. Life Sci. 2010. Vol. 67. P. 841-860.
- Takagi S. Production of phytosiderophores // Iron Chelation in Plants and Soil Microorganisms. New York: Academic Press, 1993. P. 111-131.


