Обмен веществ и репродуктивная функция в послеродовой период у коров-первотелок при введении им экстракта плаценты
Автор: Митяшова О.С., Гусев И.В., Лебедева И.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология и патофизиология репродукции
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Большинство репродуктивных нарушений у коров молочных пород связано с состоянием обмена веществ после отела. Одним из подходов к нормализации воспроизводительной функции служит использование биостимуляторов, которые оказывают модулирующее действие на иммунную, метаболическую и эндокринную системы. Целью представленной работы было изучение влияния экстракта плаценты крупного рогатого скота на метаболическую адаптацию и функционирование репродуктивной системы в послеродовой период у коров-первотелок. Мы впервые провели мониторинг показателей обмена веществ и стероидогенной активности яичников у коров-первотелок, обработанных экстрактом плаценты, в течение транзитного периода и через 2 мес после отела, а также оценили показатели воспроизводства. Сырьем для изготовления препарата служил послед, отделившийся в течение 4-6 ч после отела. Экстракт из плаценты выделяли в соответствии с методикой, описанной ранее (М.В. Вареников с соавт., 2010), с модификациями. Влияние экстракта оценивали на коровах-первотелках черно-пестрой породы (Bos taurus taurus) на базе ЗАО ПЗ «Барыбино» (Домодедовский р-н, Московская обл.) в 2015-2016 годах. За 7-14 сут до отела и на дату отела животным I группы (контроль, n = 8) вводили физиологический раствор, коровам II группы (опыт, n = 11) - 20 мл экстракта плаценты. Перед обработкой, на 3-и-5-е, 20-25-е и 50-60-е сут после отела у животных брали кровь для биохимического и иммуноферментного анализов. В пробах сыворотки крови измеряли концентрацию общего белка и его фракций, мочевины, билирубина, холестерина, кальция, фосфора, активность ферментов аспартатаминотрансферазы (АсАТ, ЕC 2.6.1.1) и аланинаминотрансферазы (АлАТ, ЕC 2.6.1.2), содержание эстрадиола-1β и прогестерона. Через 12 мес после отела, проанализировав данные зоотехнического и племенного учета, определяли показатели воспроизводства в обеих группах коров (доля стельных животных, сервис-период, индекс осеменения) и удой за 305 сут лактации. Повышение (p
Коровы-первотелки, экстракт плаценты, обмен веществ, овариальные стероидные гормоны, репродуктивная способность
Короткий адрес: https://sciup.org/142214031
IDR: 142214031 | УДК: 636.2:591.16 | DOI: 10.15389/agrobiology.2017.2.323rus
Текст научной статьи Обмен веществ и репродуктивная функция в послеродовой период у коров-первотелок при введении им экстракта плаценты
Низкая интенсивность воспроизводства стада — одна из основных проблем современного молочного скотоводства как в России, так и за рубежом (1, 2). Пониженная репродуктивная способность коров молочного направления обусловлена пролонгированным послеродовым анэструсом, дисфункцией яичников, низкой оплодотворяемостью, высокой эмбриональной смертностью, повышением частоты инфекционных заболеваний матки вследствие ослабленного иммунитета и другими нарушениями (1, 3). Как следствие, до 20 % коров в хозяйствах подвергается выбраковке уже в первую лактацию, а межотельный интервал составляет более 400 сут (4, 5).
Установлено, что большинство нарушений у высокопродуктивных
Работа выполнена при финансовой поддержке ФАНО (темы 0600-2014-0014, 0600-2016-0005).
молочных коров связано с состоянием обмена веществ после отела (1, 6, 7). Для поддержания лактации в ранний послеродовой период животным не хватает питательных веществ, поступающих с кормом, что приводит к отрицательному энергетическому балансу, который компенсируется посредством мобилизации собственных ресурсов. В этих условиях вследствие ограниченной обеспеченности организма глюкозой основным источником энергии служат жировые депо (8). Катаболический характер обмена веществ в период ранней лактации приводит к изменению содержания метаболитов и метаболических гормонов в крови, которые влияют на фертильность животных (1, 7, 9). Кроме того, перенаправление основных метаболических потоков на нужды лактации вызывает недостаток энергетических и пластических ресурсов для поддержания других функций, в первую очередь воспроизводительной. В наиболее сложной ситуации оказываются коровы-первотелки, поскольку их рост требует дополнительных ресурсов (10).
Для ускоренного восстановления репродуктивной функции коров после отела широко практикуются гормональные препараты (11, 12). Альтернативным подходом к решению этой проблемы представляется использование биостимуляторов, которые оказывают модулирующее действие на иммунную, метаболическую и эндокринную системы животных (13-15). Такими биостимуляторами могут служить экстракты или тканевые препараты плаценты, которые оказывают лечебное и профилактическое влияние на воспалительные, окислительные и дегенеративные процессы, рассасывание экссудатов и рубцов, эндокринные расстройства, процессы роста (1620). Введение гомологичного экстракта плаценты овцам до и после окота стимулирует развитие молочной железы и увеличивает выход молока (21). Получены данные о снижении количества послеотельных осложнений и акушерско-гинекологических заболеваний у коров после применения препаратов на основе плаценты человека (22, 23). Сотрудниками Всероссийского НИИ животноводства продемонстрировано положительное влияние экстракта плаценты крупного рогатого скота (КРС) на репродуктивное здоровье и репродуктивную функцию коров (24, 25). Установлено, что максимальное сокращение сервис-периода достигается после введения экстракта плаценты животным с более высокой молочной продуктивностью (свыше 5000 кг молока), то есть с более выраженными послеродовыми нарушениями метаболизма. Эти данные позволяют предположить, что компоненты препарата на основе плаценты КРС оказывают нормализующее действие на обмен веществ у коров после отела, что обусловливает модуляцию их последующей репродуктивной способности.
В представленной работе мы впервые исследовали обмен веществ и стероидогенную активность яичников у коров-первотелок, которым вводили экстракт плаценты, в течение транзитного периода и через 2 мес после отела, а также проанализировали их показатели воспроизводства. У подопытных коров были выявлены более высокое содержание холестерина в крови и укороченный сервис-период по сравнению с контрольными животными. Кроме того, наблюдалось выраженное повышение сывороточной концентрации прогестерона через 2 мес после отела, что указывает на более быстрое восстановление полового цикла у коров при введении им экстракта плаценты.
Нашей целью было изучение влияния экстракта плаценты крупного рогатого скота на метаболическую адаптацию и функционирование репродуктивной системы в послеродовой период у коров-первотелок с молочной продуктивностью свыше 6000 кг молока.
Методика. Сырьем для изготовления препарата служил послед, от- делившийся в течение 4-6 ч после отела. Чистую плаценту без видимых патологических изменений тканей отбирали у здоровых коров черно-пестрой голштинской породы 2-4-го отелов, содержащихся в ОАО «Румянцевское» (Нижегородская обл.). Экстракт из плаценты выделяли в соответствии с методикой, описанной ранее (24), с применением модификаций. После микроволнового воздействия на сырье полученный экстракт смешивали с дистиллированной водой (1:3) и кипятили в СВЧ-печи R-2471J («Sharp Cor-poration», Таиланд) в течение 5 мин. После остывания полученную взвесь центрифугировали 20 мин при 1000 g на центрифуге GR 412 («Jouan», Франция), затем супернатант пропускали через бумажный фильтр. Для антибактериальной обработки препарата к полученному фильтрату добавляли 0,5 % спиртовой раствор фенола (в объеме 0,6 % от общего объема жидкости) и фильтровали через стерильный фильтр с размером пор 0,45 мкм.
Цитотоксичность готового экстракта плаценты оценивали на инфантильных самках лабораторных крыс линии Wistar. После подкожной инъекции 0,5 мл экстракта за крысами наблюдали в течение 1 нед.
Влияние экстракта плаценты на обмен веществ и репродуктивную функцию коров-первотелок черно-пестрой породы ( Bos taurus taurus ) исследовали на базе ЗАО ПЗ «Барыбино» (Домодедовский р-н, Московская обл.) в 2015-2016 годах. Животные находились в условиях беспривязного содержания. Рацион кормления соответствовал зоотехническим нормам. Все эксперименты проводили в соответствии с Хельсинской декларацией (World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects, 1964-2013) и требованиями надлежащей лабораторной практики (Национальный стандарт Российской Федерации ГОСТ Р 53434-2009). За 1-2 нед до предполагаемого отела по принципу аналогов были отобраны 19 коров-первотелок, которых разделили на две группы. Животных I группы (контроль, n = 8) обрабатывали физиологическим раствором. Животным II группы (опыт, n = 11) 2-кратно (за 7-14 сут до предполагаемого отела и на дату фактического отела) вводили подкожно в область шеи 20 мл экстракта плаценты.
Кровь брали перед (за 7-14 сут до отела) и после введения экстракта (на 3-и-5-е, 20-25-е и 50-60-е сут после фактического отела) из хвостовой вены с помощью вакуумной системы Apexlab («Hebei Xinle Sci&Tech Co., Ltd», Китай). После получения сыворотки образцы замораживали и хранили при - 20 ° С для последующего определения биохимических показателей и концентрации овариальных стероидных гормонов.
В пробах сыворотки крови измеряли концентрацию общего белка и его фракций, мочевины, билирубина, холестерина, кальция, фосфора, а также активность ферментов аспартатаминотрансферазы (АсАТ, ЕC 2.6.1.1) и аланинаминотрансферазы (АлАТ, ЕC 2.6.1.2) на автоматическом биохимическом анализаторе ChemWell («Awareness Technology», США) с реагентами фирмы «Analyticon Biotechnology AG» (Германия). Методом иммуно-ферментного анализа в сыворотке крови определяли содержание эстра-диола-17 β и прогестерона. Тесты проводили с использованием планшетного спектрофотометра Униплан («Пикон», Россия) и коммерческих наборов реагентов «НВО Иммунотех» (Россия) согласно инструкции фирмы-производителя. Чувствительность метода составляла 30 пмоль/л (эстрадиол-17 β ) и 0,4 нмоль/л (прогестерон). Все анализы выполняли в двух повторностях, коэффициент вариации в анализе не превышал 15 %.
Через 12 мес после отела, проанализировав данные зоотехнического и племенного учета, определяли показатели воспроизводства в обеих группах коров (доля стельных животных, сервис-период, индекс осемене- ния) и удой за 305 сут лактации.
Данные обрабатывали методом однофакторного (one-way ANOVA) и двухфакторного (two-way ANOVA) дисперсионного анализа при помощи программы SigmaStat («Systat Software, Inc.», США). Результаты представлены в виде средних значений ( X ) и стандартной ошибки (SEM). Достоверность различия сравниваемых средних значений оценивали с использованием критерия Тьюки (Tukey’s test).
Результаты . Подкожная инъекция крысам 0,5 мл экстракта плаценты КРС в течение 1 нед не вызывала воспалительного процесса в месте введения. Общее состояние животных было удовлетворительным.
Перед введением экстракта плаценты коровам (за 1-2 нед до отела) биохимические показатели крови и содержание половых стероидных гормонов в сравниваемых группах достоверно не различались.
А
Б
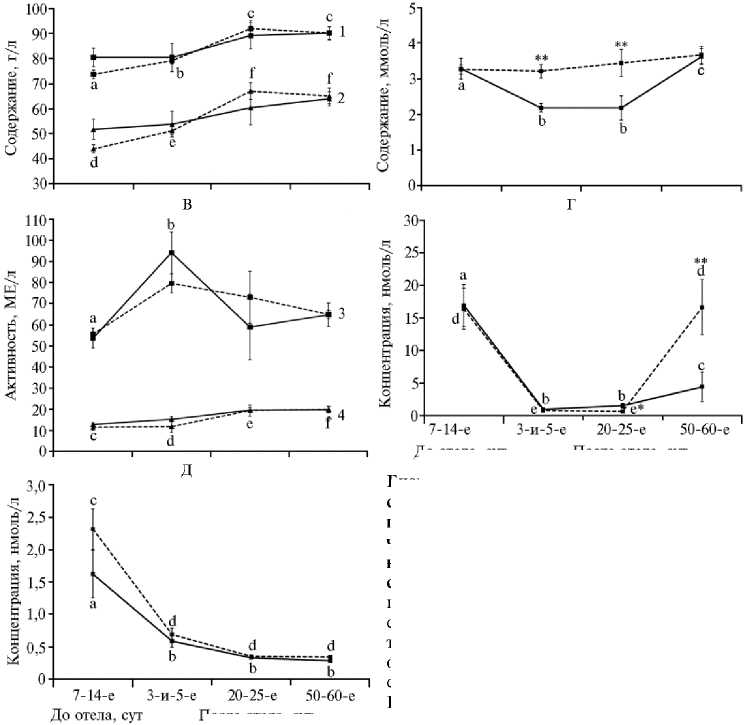
После отела, сут активность аспартатамино-
—
После отела, сут гормональные показатели в у коров-первотелок черно- пестрой породы во время транзитного периода и через 2 мес после отела при введении животным экстракта плаценты крупного рогатого скота: А — содержание общего белка (1) и глобулинов (2), Б — содержание общего холе- стерина, В
До отела, сут
Биохимические и сыворотке крови
А: a, cp < 0,001, b, cp < 0,05 (общий белок); d, fp
трансферазы (АсАТ, 3) и аланинаминотрансферазы (АлАТ, 4), Г — концентрация прогестерона, Д — концентрация эстрадиола-17 β . Вертикальные отрезки — стандартные ошибки средних (SEM). Сплошная линия — I группа (контроль, n = 8), пунктирная линия — II группа (опыт, n = 11).
-
< 0,001, e, fp < 0,01 (глобулины). Б: a, bp < 0,05,
-
b, cp < 0,01 (общий холестерин); **p < 0,01 (между контрольной и подопытной группами). В: а, bp < 0,05 (АсАТ); c, ep < 0,001, с, fp < 0,001, d, ep < 0,01; d, fp < 0,001 (АлАТ). Г: a, bp < 0,001, a, сp < 0,01, d, ep < 0,001 (прогестерон); *p < 0,05, **p < 0,01 (между контрольной и подопытной группами). Д: a, bp < 0,001, c, dp < 0,001 (эстрадиол-17 β ) .
Согласно общепризнанному мнению, критически значимым отрезком времени, определяющим здоровье, молочную продуктивность и репродуктивный потенциал высокоудойных коров, служит транзитный период, который охватывает 2-3 нед до отела и 3 нед после него (26). Этот 326
период характеризуется наиболее выраженными изменениями обмена веществ, которые к концу первого триместра лактации постепенно исчезают.
Введение коровам экстракта плаценты модифицировало изменение ряда биохимических показателей в течение транзитного периода. В крови у животных II группы между 7-14-ми сут до отела и 20-25-ми сут после отела было выявлено значительное повышение (p < 0,001) концентрации общего белка (на 24,9 %) и его глобулиновой фракции (на 51,8 %), чего не наблюдалось в контрольной группе (рис., А).
Содержание холестерина в крови у контрольных животных снижалось на 33 % (p < 0,05) к 3-5-м сут после отела и сохранялось таким до 2025-х сут, а затем возрастало (p < 0,01) до предотельного значения к 5060-м сут (см. рис., Б). У получавших препарат животных показатель не изменялся в течение всего периода исследований. При этом в середине и в конце транзитного периода концентрация холестерина в крови у коров в подопытной группе была в 1,5-1,6 раза выше, чем в контрольной (p < 0,01).
На 3-и-5-е сут после отела наблюдалось резкое повышение активности АсАТ в контроле (на 75,2 %, p < 0,05), тогда как в опыте оно было гораздо менее выраженным (см. рис., В). Активность АлАТ в сыворотке крови у коров II группы не изменялась до середины транзитного периода, но повышалась на 68,8 % (p < 0,001) к его концу (см. рис., В). В контрольной группе активность АлАТ в крови возрастала несущественно и постепенно. В то же время мы не выявили влияния экстракта плаценты на концентрацию альбуминов, мочевины, билирубина, кальция и фосфора или на их изменения в послеродовой период.
Введение экстракта плаценты КРС коровам-первотелкам также оказало долговременное действие на их гормональный статус. В обеих группах концентрация прогестерона в крови уменьшалась почти в 20 раз на 3-и-5-е сут после отела и сохранялась невысокой до конца транзитного периода (см. рис., Г). При этом на 20-25-е сут после отела этот показатель у животных из II группы был на 57,7 % ниже (p < 0,05), чем в контроле. Через 50-60 сут после отела содержание прогестерона у подопытных коров резко возрастало (в 26 раз, p < 0,001), что свидетельствовало о начале лютеальной активности яичников. У контрольных животных содержание прогестерона повышалось менее значительно, оставаясь почти в 4 раза ниже, чем у животных II группы (p < 0,01). В то же время концентрация эстра-диола-17 β и характер ее снижения в крови у коров-первотелок в послеродовой период оказались сходными у животных обеих групп (см. рис., Д).
Показатели воспроизводства и молочной продуктивности у коров-первотелок черно-пестрой породы при подкожном введении перед и во время отела экстракта плаценты крупного рогатого скота ( X ±SEM, ЗАО ПЗ «Барыбино», Домодедовский р-н, Московская обл., 2015-2016 годы)
|
Показатель |
Группа |
|
|
I, контроль ( n = 8) 1 |
II, опыт ( n = 11) |
|
|
Доля стельных животных, % |
75,0±15,3 |
90,9±8,7 |
|
Сервис-период, сут |
123,5±10,5 |
95,1±5,8* |
|
Индекс осеменения |
1,5±0,3 |
1,5±0,2 |
|
Удой за 305 сут лактации, кг |
7209±546 |
7256±251 |
|
П р и м е ч а н и е. Описание групп см. в разделе «Методика». * Различия между контрольной и подопытной группами статистически значимы при p < 0,05. |
||
Введение животным экстракта плаценты приводило к значительному сокращению продолжительности сервис-периода (на 28,4 сут, p < 0,05), а также к некоторому повышению результативности искусственного осеменения (на 15,9 %), но не влияло на индекс осеменения (табл.). Молочная продуктивность за 305 сут лактации в подопытной и контрольной группах была практически одинаковой.
Следовательно, наиболее существенные метаболические изменения, обусловленные введением экстракта плаценты КРС коровам-первотелкам, связаны с липидным обменом, а именно с поддержанием более высокого содержания холестерина в крови в транзитный период. При этом концентрация холестерина оставалась в пределах нормальных значений для этого показателя. Сходная тенденция к повышению содержания холестерина в послеродовой период наблюдалась после введения многотельным коровам красно-пестрой породы препарата из плаценты человека (22). Ранее было показано, что концентрация холестерина в крови у высокоудойных коров в послеотельный период положительно связана с восстановлением половой цикличности и снижением продолжительности сервис-периода (27, 28). Эти данные согласуются с полученными нами результатами.
Как известно, мобилизация жировых депо в период ранней лактации приводит к повышению концентрации в крови свободных жирных кислот, а β -окисление последних — к избытку ацетил-КоА и усилению синтеза кетоновых тел в печени (7, 8). Кетоновые тела, в свою очередь, оказывают негативное влияние на репродуктивную функцию коров (29). Поэтому положительная связь между содержанием холестерина и воспроизводительной способностью коров может быть обусловлена частичным использованием избытка ацетил-КоА на его образование и соответствующим снижением синтеза кетоновых тел. Кроме того, холестерин способен уменьшать скорость метаболического клиренса прогестерона, необходимого для адекватного поддержания стельности (6, 30).
Таким образом, введение коровам-первотелкам экстракта плаценты крупного рогатого скота до и во время отела оказывает модулирующее влияние на обменные процессы (в первую очередь, на липидный обмен) в послеродовой период. Введение экстракта плаценты также вызывает повышение лютеальной активности яичников через 2 мес после отела, что свидетельствует о стимуляции выхода животных из состояния послеродового анэструса. Нормализация метаболического и гормонального статуса коров, очевидно, связана с повышением репродуктивной способности животных и приводит к сокращению последующего сервис-периода.
Список литературы Обмен веществ и репродуктивная функция в послеродовой период у коров-первотелок при введении им экстракта плаценты
- Chagas L.M., Bass J.J., Blache D., Burke C.R., Kay J.K., Lindsay D.R., Lucy M.C., Martin G.B., Meier S., Rhodes F.M., Roche J.R., Thatcher W.W., Webb R. Invited review: New perspectives on the roles of nutrition and metabolic priorities in the subfertility of high-producing dairy cows. J. Dairy Sci., 2007, 90(9): 4022-4032 ( ) DOI: 10.3168/jds.2006-852
- Лягин Ф.Ф. Особенности воспроизводительных качеств высокопродуктивных коров. Зоотехния, 2003, 5: 25-27. Режим доступа: http://elibrary.ru/item.asp?id=9125091. Без даты.
- Dobson H., Smith R.F., Royal M.D., Knight Ch., Sheldon I. The high producing dairy cow and its reproductive performance. Reprod. Domest. Anim., 2007, 42(2): 17-23 ( ) DOI: 10.1111/j.1439-0531.2007.00906.x
- Brickell J.S., Wathes D.C. A descriptive study of the survival of Holstein-Friesian heifers through to third calving on English dairy farms. J. Dairy Sci., 2011, 94(4): 1831-1838 ( ) DOI: 10.3168/JDS.2010-3710
- Wu J.J., Wathes D.C., Brickell J.S., Yang L.G., Cheng Z., Zhao H.Q., Xu Y.J., Zhang S.J. Reproductive performances and survival of Chinese Holstein dairy cows in central China. Anim. Prod. Sci., 2012, 52(1): 11-19 ( ) DOI: 10.1071/AN11146
- Wathes D.C. Mechanisms linking metabolic status and disease with reproductive outcome in the dairy cow. Reprod. Domest. Anim., 2012, 47(4): 304-312 ( ) DOI: 10.1111/j.1439-0531.2012.02090.x
- Wathes D.C., Clempson A.M., Pollott G.E. Associations between lipid metabolism and fertility in the dairy cow. Reprod. Fertil. Dev., 2012, 25: 48-61 ( ) DOI: 10.1071/RD12272
- Van Knegsel A.T.M., van den Brand H., Dijkstra J., Tamminga S., Kemp B. Effect of dietary energy source on energy balance, production, metabolic disorders and reproduction in lactating dairy cattle. Reprod. Nutr. Dev., 2005, 45(6): 665-688 ( ) DOI: 10.1051/rnd:2005059
- Лебедев В.А., Лебедева И.Ю., Кузьмина Т.И., Шапиев И.Ш. Роль метаболических гормонов в регуляции функции яичников у коров. Сельскохозяйственная биология, 2005, 2: 14-22.
- Ettema J.F., Santos J.E. Impact of age at calving on lactation, reproduction, health, and income in first-parity Holsteins on commercial farms. J. Dairy Sci., 2004, 87: 2730-2742 ( ) DOI: 10.3168/jds.S0022-0302(04)73400-1
- Xu Z.Z., Burton L.J., McDougall S., Jolly P.D. Treatment of noncyclic lactating dairy cows with progesterone and estradiol or with progesterone, GnRH, prostaglandin F2 alpha, and estradiol. J. Dairy Sci., 2000, 83(3): 464-470 ( ) DOI: 10.3168/jds.S0022-0302(00)74904-6
- Bhoraniya H.L., Dhami A.J., Naikoo M., Parmar B.C., Sarvaiya N.P. Effect of estrus synchronization protocols on plasma progesterone profile and fertility in postpartum anestrous Kankrej cows. Trop. Anim. Health Prod., 2012, 44(6): 1191-1197 ( ) DOI: 10.1007/s11250-011-0057-1
- Пальчиков М.Ю. Бионормализующее действие препаратов из плаценты человека при ранней стимуляции половой цикличности у коров. Канд. дис. Белгород, 2005.
- Гизатуллин P.P. Гигиеническое обоснование коррекции естественной резистентности организма телят биологическим стимулятором «Биостим». Канд. дис. Уфа, 2001.
- Лободин К.А., Нежданов А.Г., Бузлама В.С. Лигфол для коррекции воспроизводительной функции коров. Ветеринария, 2006, 3: 39-44. Режим доступа: http://elibrary.ru/item.asp?id=9242703. Без даты.
- Blank M.S., Friesen H.G. Effects of placentophagy on serum prolactin and progesterone concentrations in rats after parturition or superovulation. J. Reprod. Fertil., 1980, 60(2): 273-278 ( ) DOI: 10.1530/jrf.0.0600273
- Wu C.H., Chang G.Y., Chang W.C., Hsu C.T., Chen R.S. Wound healing effects of porcine placental extracts on rats with thermal injury. Br. J. Dermatol., 2003, 148(2): 236-245 ( ) DOI: 10.1046/j.1365-2133.2003.05164.x
- Hong J.W., Lee W.J., Hahn S.B., Kim B.J., Lew D.H. The effect of human placenta extract in a wound healing model. Ann. Plast. Surg., 2010, 65(1): 96-100 ( ) DOI: 10.1097/SAP.0b013e3181b0bb67
- Park S.Y., Phark S., Lee M., Lim J.Y., Sul D. Anti-oxidative and anti inflammatory activities of Placental extracts in benzo pyrene-exposed rats. Placenta, 2010, 31(10): 873-879 ( ) DOI: 10.1016/j.placenta.2010.07.010
- Митяшова О.С. Стимулирующее действие экстракта плаценты коров на рост и развитие репродуктивных органов у самок лабораторных крыс. В сб.: Биология -наука XXI века. Пущино, 2015: 353-354. Режим доступа: http://www.psn.ru/biology21/Page354.pdf. Без даты.
- Cotor G., Pop А., Ghita М. The effect of ovine placenta extract on mammogenesis, lactogenesis, and galactopoiesis in sheep. Turk. J. Vet. Anim. Sci., 2011, 35: 137-142.
- Лободин К.А. Плацента активное начало -препарат для коррекции воспроизводительной функции коров. Ветеринария, 2006, 7: 38-42. Режим доступа: http://elibra-ry.ru/item.asp?id=9242726. Без даты.
- Корниенко В.С. Лекарственный препарат бан. А.с. 2140275 (РФ) МКИ3 А61К35/12, А61К35/50. Филиал N 5 ГНЦ-Институт биофизики ФУ «Медбиоэкстрем» при МЗ России. ¹ 98110825/13. Заявл. 04.06.98. Опубл. 27.10.99.
- Вареников М.В., Чомаев А.М., Артюх В.М., Прытков Ю.А., Лиэпа В.Л. Способ получения биостимулятора из плаценты коров. А.С. 2377999 (РФ) МКИ3 А61К35/50. Всероссийский государственный научно-исследовательский институт животноводства (ВИЖ). № 2007143944/13. Заявл. 29.11.07. Опубл. 10.01.10.
- Лиэпа В.Л. Влияние применения Плацентина-А в сочетании с биологически активными веществами на сроки инволюции матки у коров. Автореф. канд. дис. Дубровицы, 2011.
- Zebeli Q., Ghareeb K., Humer E., Metzler-Zebeli B.U., Besenfelder U. Nutrition, rumen health and inflammation in the transition period and their role on overall health and fertility in dairy cows. Res. Vet. Sci., 2015, 103: 126-136 ( ) DOI: 10.1016/j.rvsc.2015.09.020
- Dhami A.J., Nakrani B.B., Hadiya K.K., Patel J.A., Shah R.G. Comparative efficacy of different estrus synchronization protocols on estrus induction response, fertility and plasma progesterone and biochemical profile in crossbred anestrus cows. Vet. World, 2015, 8(11): 1310-1316 ( ) DOI: 10.14202/vetworld.2015.1310-1316
- Reist M., Erdin D.K., von Euw D., Tschümperlin K.M., Leuenberger H., Hammon H.M., Morel C., Philipona C., Zbinden Y., Künzi N., Blum J.W. Postpartum reproductive function: association with energy, metabolic and endocrine status in high yielding dairy cows. Theriogenology, 2003, 59(8): 1707-1723 ( ) DOI: 10.1016/S0093-691X(02)01238-4
- Shin E.K., Jeong J.K., Choi I.S., Kang H.G., Hur T.Y., Jung Y.H., Kim I.H. Relationships among ketosis, serum metabolites, body condition, and reproductive outcomes in dairy cows. Theriogenology, 2015, 84: 252-260 ( ) DOI: 10.1016/j.theriogenology.2015.03.014
- Hawkins D.E., Niswender K.D., Oss G.M., Moeller C.L., Odde K.G., Sawyer H.R., Niswender G.D. An increase in serum lipids increases luteal lipid content and alters the disappearance rate of progesterone in cows. J. Anim. Sci., 1995, 73(2): 541-545 ( ) DOI: 10.2527/1995.732541x


