Обоснование чувствительности иммунохроматографического анализа в зависимости от локализации детектируемого антигена
Автор: Смирнова Дарья Николаевна, Богачева Наталья Викторовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Цель работы - определение влияния локализации детектируемого антигена на чувствительность иммунохроматографического метода. Оценивали чувствительность иммунохроматографической тест-системы «РЭД Helicobacter pylori», предназначенной для детекции фермента H. pylori - уреазы. В качестве исследуемого материала использовали чистую культуру H. pylori, а также коммерческий антиген AGHPY-0100 («Arista Biologicals», США), в состав которого входят внутриклеточные белки H. pylori, ассоциированные с генами cagA (120 kd), vacA (87 kd) и уреазой. При тестировании с коммерческим антигеном AGHPY-0100 порог чувствительности тест-системы «РЭД Helicobacter pylori» составил не менее 20 нг/мл, что свидетельствует о ее высокой чувствительности. При тестировании с цельной корпускулярной культурой H. pylori чувствительность оказалась значительно ниже и составила 1.1×1010 м.к.×см-3. Экспериментальные данные подтверждают гипотезу о том, что если иммунохроматографическая тест-система направлена на выявление внутриклеточного антигена, то высокой чувствительности можно добиться только при тестировании предварительно выделенного и очищенного антигена микроорганизма. При разработке подобных тестсистем можно ожидать, что они будут преимущественно качественными, а не количественными.
Детектируемый антиген, caga и vaca, фермент уреаза, иммунохроматографическая тест-система, чувствительность иммунохромато-графического анализа
Короткий адрес: https://sciup.org/147227093
IDR: 147227093 | УДК: 579.6 | DOI: 10.17072/1994-9952-2019-3-309-313
Текст научной статьи Обоснование чувствительности иммунохроматографического анализа в зависимости от локализации детектируемого антигена
Хеликобактериоз – инфекционное заболевание, дочно-кишечного тракта человека и животных вызываемое бактерией Helicobacter pylori, которая [Госманов, Нургалиев, Нургалиев, 2012].
имеет выраженную тропность к эпителию желу- Основными антигенами H. pylori , играющими значительную роль в патогенезе H. pylori -
ассоциированных заболеваний и представляющими интерес для разработки различных тест-систем и вакцинных препаратов, являются VacA-цитотоксин, CagA-протеин и другие высокомолекулярные белки, уреаза, липополисахарид клеточной стенки, специфический водорастворимый протеин [Гордина, Богачева, Дармов, 2017].
Вакуолизирующий цитотоксин VacА вызывает образование вакуолей в эпителиоцитах и их гибель. В гене vacA, ответственном за синтез цитокина, выделяют сигнальный регион – s и серединный – m, в каждом из которых – по два аллельных варианта – s1 и s2, m1 и m2 [Макаренко. Воропаева, 2004]. Штаммы с генотипом vac As1m1 продуцируют увеличенное количество цитотоксина по сравнению со штаммами vac As2m2, и поэтому чаще ассоциированы с гастродуоденальными язвами [Макаренко, Воропаева, Матвеенко, 2009].
Достаточно высока значимость в патогенезе хеликобактериоза фермента уреазы, защищающего микроорганизм от агрессивного воздействия соляной кислоты желудочного сока путем разрушения мочевины с образованием углекислого газа и аммиака. Уреаза имеет белковую природу и состоит из двух субъединиц UreA (29,5 кДа) и UreB (66 кДа). Уреаза вырабатывается в процессе жизнедеятельности внутри клетки и выделяется в окружающую среду. Определение уреазы или антител к ней является основой диагностических тестов на косвенное обнаружение в организме данного патогена [Гордина, Богачева, Дармов, 2017].
Диагностика большинства инфекционных заболеваний, в том числе и хеликобактериоза, направлена на детекцию антигенов возбудителя заболевания. Большинство используемых в настоящее время диагностических тест-систем направлено на определение поверхностных антигенов. Не являет- ся исключением это и для пользующихся в настоящее время популярностью иммунохромато-графических тест-систем. В качестве примеров можно привести иммунохроматографические тест-системы для диагностики легионеллеза [Ярков и др., 2009], бруцеллеза [Бызова и др., 2012], псевдотуберкулеза [Богачева, Елагин, Печенкин, 2016], сапа и мелиоидоза [Федюкина, Ветчинин, Баранова, 2015].
Основные же антигены патогенности H. pylori расположены внутриклеточно.
Цель работы – определение влияния локализации целевого антигена на чувствительность имму-нохроматографического метода анализа.
Материал и методы исследования
Материал
В качестве культур для тестирования были выбраны H. pylori, хранящиеся в музейной коллекции кафедры микробиологии «Вятского государственного университета». Данные культуры были получены от лиц, имеющих в анамнезе заболевания желудочно-кишечного тракта. Использовали чистую культуру микроорганизма, принадлежность которой к H. pylori была подтверждена молекулярно-генетическим, биохимическим и бактериологическим методом, а также коммерческим антигеном AGHPY-0100 («Arista Biologicals», США), в состав которого входят внутриклеточные белки H. pylori , ассоциированные с генами cagA (120 kd) и vac A (87 kd) и уреазой .
Методы исследования
Культуры H. pylori выращивали на селективной питательной среде – колумбийском кровяном агаре с антибиотиками амфотерицином и ванкомицином в анаэростате при температуре 37°С в течение 3 - 5 сут.
Принадлежность культур к H. pylori подтверждалась бактериологическими и биохимическим методами, к числу которых относятся оксидазный тест «Oxi-тест» («Микро-Ла-Тест», Россия), уреазный тест и каталазный тест, методом ПЦР при использовании коммерческих тест-систем «Хелико-пол VA», «Хеликопол CA», «Хеликопол IA», «Хе-ликопол BA» (Россия), «ДНК-технологии» (Россия), методом иммунохроматографии при использовании коммерческой тест-системы «РЭД Helicobacter pylori » (Россия). Иммунохроматографиче-ский анализ проводили с использованием коммерческой тест-системы «РЭД Helicobacter pylori » (Россия), предназначенной для индикации фермента уреазы H. pylori.
Результаты и их обсуждение
Принцип иммунохроматографического анализа заключается в специфическом взаимодействии клеток H. pylori с моноклональными антителами, конъюгированными с окрашенной меткой. В аналитической зоне образовавшийся комплекс взаимодействует с моноклональными антителами, иммобилизированными на поверхности мембраны. В контрольной зоне тест-полоски окрашенный иммунокомплекс образуется вне зависимости от наличия в тестируемом биологическом материале клеток H. pylori.
Если в анализируемом образце присутствуют клетки H. pylori , то на тест-полоске образуются две параллельные окрашенные линии (красная аналитическая, обозначенная буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа. В том случае, если в анализируемом образце нет клеток H. pylori, то на тест-полоске образуется одна зеленая контрольная линия (С), что свидетельствует об отрицательном результате анализа.
На первом этапе провели тестирование имму-нохроматографической тест-системы «РЭД Helicobacter pylori » с использованием антигена AGHPY-0100 с исходной концентрацией 2.5 мг/мл, который предварительно развели до концентрации 20 мкг/мл буфером для растворения образца, входящего в состав набора. Далее сделали ряд последовательных разведений антигена с шагом 10 и получили концентрации антигена 20 000, 200, 20, 2 нг/мл.
В круглое окошко кассеты (S) вносили 100 мкл раствора антигена AGHPY-0100 с определенной концентрацией и через 10 мин. визуально оценивали результаты анализа (рис. 1).
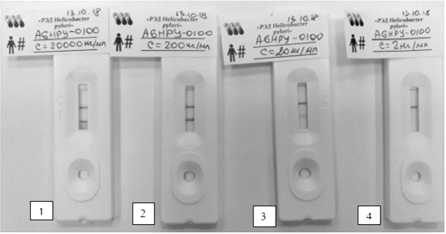
Рис. 1 . Проверка чувствительности иммуно-хроматографической тест-системы «РЭД Helicobacter pylori» с антигеном AGHPY-100.
Концентрация антигена, нг/мл: 1 – 20 000 2 – 200, 3 – 20, 4 – 2
По результатам тестирования с коммерческим антигеном AGHPY-0100 порог чувствительности тест-системы «РЭД Helicobacter pylori » составил не менее 20 нг/мл, что свидетельствует о высокой чувствительности тест-системы.
На следующем этапе работы провели тестирование иммунохроматографической тест-системы с инактивированной культурой H. pylori , концентрация которой с использованием отраслевого стандарта мутности ФГБУ «НЦЭСМП» МЗ РФ (ОСО 42-28-85П) была определена как 1×1010 м.к.×см-3.(цельная культура, смытая с чашки Петри). С цельной культурой результат тестирования оказался положительным. Далее сделали следующий шаг – проверили чувствительность тест-системы, используя миллиардную культуру H. pylori. Результат оказался отрицательным.
На рис. 2 представлен результат тестирования иммунохроматографической тест-системы «РЭД Helicobacter pylori » со штаммом 11б H. pylori .
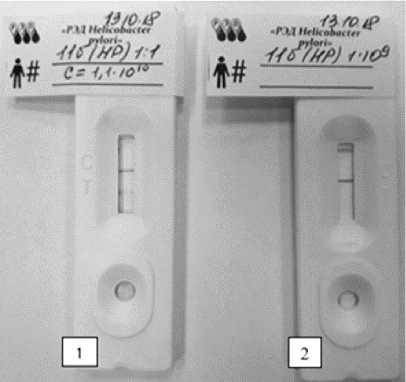
Рис. 2. Результат тестирования иммунохро-матографической тест-системы «РЭД Helicobacter pylori » со штаммом 11б H. pylori
В предыдущих работах [Смирнова, Богачева, Дармов, 2018] мы уже говорили о том, что порог чувствительности иммунохроматографических тест-систем, определенный по биологической концентрации клеток в сравнении с таковой, определенной по оптической концентрации, может быть выше, и это может быть связано с тем, что антиген CagA H. pylori имеет внутриклеточную локализацию. В данной работе мы подтвердили наше утверждение, что если целевые антигены (белок CagA, уреаза и др.) расположены внутриклеточно, а не являются поверхностными антигенами целого корпускулярного микроорганизма, то о высокой чувствительности тест-системы можно говорить только при тестировании ее с коммерческим антигеном или с антигеном, предварительно выделенным из биологического материала, полученного от пациента.
При разработке тест-систем на поверхностные антигены бактерий трудностей с тестируемым материалом не возникает. Для тестирования подходят как чистая культура микроорганизма, так и биоматериал, полученный непосредственно от пациента (кал, мокрота, кровь). Чувствительность подобных тест-систем, например, для выявления Legionella pneumophila составляет 1×105 м.к.×см-3 [Ярков и др., 2009], Yersinia pseudotuberculosis – от 5×105 м.к.×см-3 [Богачева, Елагин, Печенкин, 2016].
В связи с этим при разработке иммунохромато-графических тест-систем, направленных на детекцию внутриклеточных патогенов, порог их чувствительности нельзя сравнивать с порогом чувствительности тест-систем, разработка которых направлена на детекцию поверхностных антигенов. Это обосновывает и тот факт, что большинство подобных тест-систем являются качественными, а не количественными.
Выводы
-
1. Чувствительность иммунохроматографиче-ской тест-системы «РЭД Helicobacter pylori » («РЭД», Россия) при тестировании с коммерческим антигеном AGHPY-0100 («Arista Biologicals», США), в состав которого входят внутриклеточные белки H. pylori , ассоциированные с генами cagA, vac A, уреазой, оказалась высокой и составила не менее 20 нг/мл.
-
2. Чувствительность иммунохроматографиче-ской тест-системы «РЭД Helicobacter pylori » («РЭД», Россия), предназначенной для выявления уреазы H.pylori , с целым инактивированным корпускулярным микроорганизмом, оказалась низкой, и составила 1.1×1010 м.к.×см-3.
-
3. На примере оценки иммунохроматографиче-ской тест-системы, предназначенной для выявления H. pylori , обоснована особенность чувствительности иммунохроматографического анализа в зависимости от локализации детектируемого антигена: у иммунохроматографических тест-систем, направленных на детекцию внутриклеточных патогенов, порог их чувствительности нельзя сравнивать с порогом чувствительности тест-систем, разработка которых направлена на детекцию поверхностных антигенов. В первом случае – это в большей степени качественные, а, во втором – количественные иммунохроматографические тест-системы.
Авторы выражают глубокую благодарность фирме ООО «Российская экспресс диагностика» за предоставление тест-систем «РЭД Helicobacter pylori » для проведения исследований.
Список литературы Обоснование чувствительности иммунохроматографического анализа в зависимости от локализации детектируемого антигена
- Богачева Н.В., Елагин Г.Д., Печенкин Д.В. Разработка иммунохроматографической моноклональной тест-системы для выявления Yersinia рseudotuberculosis серогруппы I // Проблемы особо опасных инфекций. 2016. № 2. С. 6568.
- Бызова Н.А. и др. Разработка иммунохроматографической тест-системы для экспрессной детекции липополисахаридгного антигена и клеток возбудителя бруцеллеза крупного рогатого скота // Прикладная биохимия и микробиология. 2012. Т. 48, № 6. С. 653-661.
- Гордина А.В., Богачева Н.В., Дармов И.В. Обоснование перспективных методов выделения антигенов // Общество, наука, инновации. НПК - 2017: сб. статей. Киров, 2017. С. 9-16.
- Госманов Р.Г., Нургалиев Ф.М., Нургалиев Р.М. Хеликобактериоз // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2012. С. 68-74.
- Макаренко Е.В, Воропаева А.В. Гены vacA cagA babA Helicobacter pylori у больных дуоденальной язвой и хроническим гастритом // Вестник ВГМУ. 2004. Т. 3, № 1. С. 74-77.
- Макаренко Е.В, Воропаева А.В., Матвеенко М.Е. Влияние генотипов Helicobacter pylori на морфологические показатели слизистой оболочки желудка у больных дуоденальной язвой и хроническим гастритом // Вестник ВГМУ. 2009. Т. 8, № 3. С. 1-15.
- Смирнова Д.Н., Богачева Н.В., Дармов И.В. Разработка экспериментального образца иммунохроматографической тест-системы для выявления белка патогенности CagA Helicobacter pylori // Клиническая лабораторная диагностика. 2018. № 4. С. 242-246.
- Федюкина Г.Н., Ветчинин С.С., Баранова Е.В. Получение компонентов иммунохроматографического теста для выявления возбудителей сапа и мелиоидоза // Биотехнология. 2015. № 1. С. 85-92.
- Ярков С.П. и др. Выявление возбудителя легионеллеза иммунохроматографией с визуальной и видеоцифровой детекцией // Проблемы особо опасных инфекций. 2009. № 2. С. 61-64.
- Cittely D.M. et al. Helicobacter pylori genotypes in non atrophic gastritis are different of the found in peptic ulcer, premalignant lesions and gastric cancer in Colombia // Rev. Med. Chil. 2002. Vol. 130 (2). Р. 143-151.


