Образование биопленок штаммами стафилококка, выделенными из различного биологического материала при инфекционных осложнениях тотального эндопротезирования коленного сустава
Автор: Бабушкина И.В., Бондаренко А.С., Мамонова И.А., Ульянов В.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: исследовать способность к биопленкообразованию в условиях in vitro штаммов Staphylococcus spp. - возбудителей имплантат-ассоциированной инфекции у пациентов после эндопротезирования коленного сустава в зависимости от исследуемого биологического материала. Материал и методы. Изучена способность к био-пленкообразованию в условиях in vitro 275 штаммов Staphylococcus spp. Формирование биопленок проводили статическим способом в полистироловых 96-луночных планшетах по модифицированному методу G. D. Chris- tensen. Результаты. Способность к биопленкообразованию выявлена у 51,2 % исследуемых штаммов, причем среди коагулазоположительных стафилококков она была достоверно выше, чем у коагулазонегативных (p
Биопленки, имплантат-ассоциированная инфекция, патогенез, стафилококки
Короткий адрес: https://sciup.org/149135285
IDR: 149135285 | УДК: 617.58-77
Текст научной статьи Образование биопленок штаммами стафилококка, выделенными из различного биологического материала при инфекционных осложнениях тотального эндопротезирования коленного сустава
1Введение. Имплантат-ассоциированная инфекция остается актуальной проблемой в травматологии и ортопедии, что связано с постоянным ростом числа эндопротезирований крупных суставов, большими материальными затратами на лечение инфекционных осложнений, высокой инвалидизацией пациентов [1, 2]. По данным регистра эндопротезирования коленного сустава РНИИТО им. Р. Р. Вредена, в 2011–2014 гг. доля ревизионного эндопротезирования коленного сустава на фоне развития глубокой имплантат-ассоции-рованной инфекции составила более 59% [1].
Длительное время основными возбудителями инфекционных осложнений после эндопротезирования крупных суставов считали коагулазоположительные стафилококки, особенно S. aureus , обладающие большим количеством известных факторов патогенности и вирулентности [3–5]. В последнее десятилетие пересмотрены представления о патогенезе имплантат-ассоциированной инфекции, и главная роль отводится способности возбудителя инфекции, как высокопатогенного, так и низкопатогенного, формировать биопленки, что рассматривается как основной фактор вирулентности [4–6]. Отдельное внимание уделяется взаимосвязи способности микроорганизмов к формированию биопленок и их резистентности к метициллину; многими авторами проводится активное изучение штаммов S. epidermidis , относящихся к клональному комплексу CC2 и являющихся носителями кассет SCCmec, детерминирующих устойчивость к метициллину и способных активно формировать биопленки [6].
Накопление бактериальной массы в виде биопленки на поверхности имплантатов и дальнейшая диссеминация микроорганизмов приводят к формированию хронического инфекционного процесса и необходимости удаления эндопротеза. Рядом исследователей доказано, что до 90% нозокомиальных инфекций связано с образованием биопленок и L-форм бактерий, устойчивых к антибиотикам, факторам иммунитета, неблагоприятным факторам внешней среды [4, 6]. В состав биопленок входят бактерии с замедленным метаболизмом, которые при недостатке питательных веществ переходят в некультивируемое состояние, что существенно затрудняет микробиологическую диагностику.
Для раннего выявления инфекционно-воспалительных осложнений после эндопротезирования и дифференциальной диагностики имплантат-ассо-циированной инфекции и асептического воспаления необходима обоснованная система микробиологической диагностики, учитывающая патогенетические особенности процесса, что требует пересмотра методологического подхода к микробиологической диагностике, применения информативных методов микробиологической диагностики, способных обнаруживать возбудителя в сессильной форме.
Цель: исследовать способность к биопленкообра-зованию в условиях in vitro штаммов Staphylococcus spp . — возбудителей имплантат-ассоциированной инфекции у пациентов после эндопротезирования коленного сустава в зависимости от исследуемого биологического материала.
Материал и методы . Проведен анализ результатов изучения способности к биопленкообразованию клинических штаммов стафилоколокка, выделенных из различных видов биологического материала, полученного от пациентов с перипротезной инфекцией после тотального эндопротезирования коленного сустава . В исследование включены 156 пациентов, проходивших лечение в НИИТОН СГМУ им. В. И. Разумовского в 2016–2018 гг. Исследованию подлежали: отделяемое ран и свищей, аспираты коленного сустава, гомогенизированные биоптаты мягких тканей перипротезной области, удаленные компоненты эндопротезов. Всего выделено 275 штаммов стафилококка (видовой состав и чувствительность к метициллину исследуемых штаммов см. в табл. 1).
Группу сравнения составили референс-штаммы S. epidermidis (АТСС 12228) и S. aureus (АТСС 25923, MRSA 43300).
Таблица 1
Эпидемиологическая характеристика исследуемых штаммов
|
Биологический материал |
Штаммы Staphylococcus spp ., включенные в исследование |
||||
|
S. aureus , n=121 |
S. epidermidis , n=154 |
Всего |
|||
|
MSSA |
MRSA |
MSSE |
MRSE |
||
|
Отделяемое ран и свищей |
14 |
16 |
26 |
19 |
75 |
|
Аспират |
11 |
18 |
19 |
11 |
59 |
|
Биоптаты мягких тканей |
12 |
21 |
21 |
20 |
74 |
|
Соникационная жидкость |
12 |
17 |
19 |
19 |
67 |
|
Всего |
49 |
72 |
85 |
69 |
275 |
П р и м еч а н и е : MSSA — метициллинчувствительные штаммы S. aureus; MRSA –метициллинрезистентные штаммы S. aureus; MSSE — метициллинчувствительные штаммы S. epidermidis; MRSE — метициллинрезистентные штаммы S. epidermidis.
На этапе дооперационной диагностики осуществляли взятие материала из поверхностных ран и свищей с помощью стерильных тампонов Transportswab (Citoswab) и пункцию коленного сустава для получения аспирата, что входит в стандартный протокол предоперационного обследования.
Интраоперационно проводили взятие тканевых биоптатов, не менее 3–5 точек для каждого пациента, общим объемом около 1 см3 в стерильные контейнеры. Биоптаты взвешивали, гомогенизировали, готовили разведение биоматериала изотоническим раствором NaCl, мерно высевали на плотные питательные среды.
Для деструкции биопленки при исследовании компонентов удаленных эндопротезов проводили их ультразвуковую обработку с целью получения взвеси сессильных бактериальных клеток для дальнейшего культурального исследования. Бактериологическое исследование фрагментов эндопротеза осуществляли следующим образом: удаленные фрагменты в операционной помещали в стерильный пакет и доставляли в лабораторию. В пакет добавляли 50–100 мл стерильного изотонического раствора, затем помещали в ванну ультразвуковой установки «УЗУМИ-2», заполненную водой. Обработку ультразвуком проводили в течение 10 минут при частоте 37 кГЦ. Затем соникационную жидкость мерно высевали на жидкие и плотные питательные среды для культурального исследования.
Микробиологическое исследование проводили по стандартным методикам с использованием дифференциально-диагностических и селективных сред. Для идентификации до вида использовали бактериологический анализатор Crystal Autoreader (Becton Dickinson).
Определение чувствительности к антибиотикам проводили диско-диффузионным методом согласно МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» с использованием Mueller-Hinton-Agar (Becton Dickinson) и сенси-дисков (Becton Dickinson). Детекцию метициллинорезистентности осуществляли с использованием набора «MeReSa Agar Base, MRSA Alert» (Hi Media).
Биопленки моделировали статическим способом в полистироловых 96-луночных планшетах по методу G. D. Christensen [7]. Суточную агаровую культуру штаммов Staphylococcus spp . разводили 0,9%-м раствором NaCl до оптической плотности 0,5 McFarland с помощью денситометра Densi-La-Meter (Pliva-Lachema Diagnostika), затем разбавляли в 20 раз изотоническим раствором. Микробную взвесь в конечной концентрации 5^10 6 КОЕ/мл вносили по 100 мкл в лунки стерильных 96-луночных микропланшетов, добавляли 100 мкл ГРМ-бульона с глюкозой.
Во все серии экспериментов включали референтные штаммы S. aureus АТСС 25923 и S. epidermidis АТСС 12228 для оценки воспроизводимости результатов. Лунки с жидкой питательной средой без добавления микробной взвеси использовали в качестве отрицательного контроля. Для всех контрольных и опытных лунок соблюдали 4-кратные повторности.
Планшеты закрывали крышками и инкубировали при 37°С в течение 24 часов. В часть лунок добавляли только 200 мкл бульона без добавления бактериальной взвеси. Дальнейшие этапы для контрольных лунок были аналогичными опытным.
Питательную среду с планктонной формой бактерий удаляли, трехкратно промывали лунки 0,9%-м раствором NaCl. Для окрашивания образовавшейся биопленки в каждую лунку добавляли 100 мкл 0,1%-го водного раствора генцианвиолета на 20 минут при комнатной температуре. Краситель, который не связался с биопленкой, удаляли трехкратной промывкой планшета изотоническим раствором. Затем в каждую лунку вносили по 200 мкл 95%-го этанола для элюации связавшегося с образовавшейся биопленкой генцианвиолета. Оптическую плотность элюатов, которая отражала интенсивность образования биомассы биопленки, определяли на спектрофотометре Anthos 2020 при длине волны 540 нм.
Статистическую обработку полученных результатов проводили с использованием программы Statistica 10.0. Проверку вариационных рядов на нормальность распределения выполняли по критерию Шапиро — Уилка. При статистическом анализе использовали непараметрические методы исследования с вычислением средней (M), стандартного отклонения средней (±SD), медианы (Me), 25-го и 75-го квартилей (Q). Для сравнения четырех выборок (отделяемое ран, аспираты, биоптаты, соникационная жидкость) использовали непараметрический дисперсионный анализ Краскела — Уоллиса. Для сравнения двух независимых выборок использовали тест Колмогорова — Смирнова. Различия считали значимыми при p<0,05.
Результаты . Проведено эпидемиологическое исследование клинических штаммов в зависимости от источника их выделения. Из отделяемого ран и свищей выделено 75 штаммов Staphylococcus spp . (27,3% от общего количества выделенных штаммов); из аспирата — 59 штаммов стафилококка (21,4%), из биоптатов мягких тканей — 74 штамма (26,9%); из соникационной жидкости — 67 штаммов Staphylococcus spp . (24,3%). Резистентность к метициллину выявлена у 51,2% всех штаммов, причем среди коагулазоположительных стафилококков она была достоверно (p<0,05) выше (60,5%), чем у коагулазонегативных (44,8%). Данные по видовому составу и метициллинрезистентности штаммов, выделенных из различных видов биологического материала, представлены в табл. 1.
Проводили оценку способности формирования биопленок штаммами стафилококка статическим методом культивирования, который предполагает измерение оптической мутности элюатов генцианвиолета в 96-луночном планшете.
Для референс-штаммов S. aureus АТСС 25923 и S. epidermidis АТСС 12228 значения оптической плотности экстрактов генцианвиолета составили 0,211 (0,189; 0,234) и 0,189 (0,152; 0,214) соответственно.
Проведено исследование оптической плотности экстрактов генцианвиолета, полученных из клинических штаммов Staphylococcus spp ., отличающихся по виду, резистентности к метициллину и источнику выделения; результаты представлены в табл. 2.
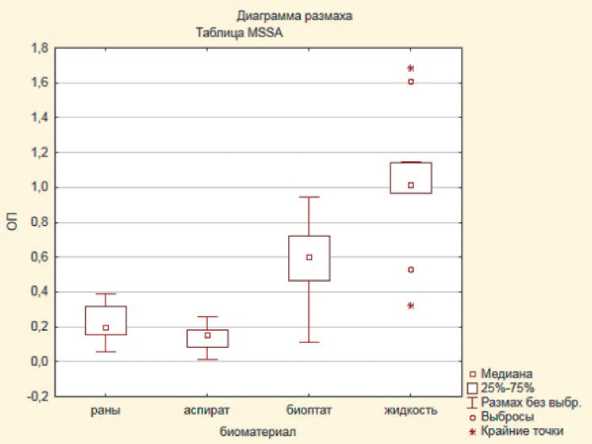
Выявлено, что у элюатов из штаммов стафилококка, выделенных из поверхностных ран и свищей, значения оптической плотности экстрактов красителя достоверно (p<0,05) ниже, чем у штаммов, выделенных из биоптатов мягких тканей и из сони-кационной жидкости, что отражает слабую способность к пленкообразованию данной группы штаммов. У штаммов, выделенных из аспиратов, отмечали самые низкие значения оптической плотности экстрактов, достоверно не отличающиеся от значений референсных штаммов, что также свидетельствует
Таблица 2
Оптическая плотность экстрактов генцианвиолета, полученных из клинических штаммов Staphylococcus spp. и референс-штаммов
|
Биологический материал |
Оптическая плотность экстрактов генцианвиолета для различных групп Staphylococcus spp . |
|||
|
S. aureus |
S. epidermidis |
|||
|
MSSA, n=49 |
MRSA, n=72 |
MSSE, n=85 |
MRSE, n=69 |
|
|
Отделяемое ран и свищей |
0,199 (0,156; 0,318) |
0,332 (0,232; 0,398) |
0,185 (0,162; 0,298) |
0,309 (0,175; 0,432) |
|
Аспират |
0,156 (0,085; 0,179) |
0,202 (0,178; 0,269) |
0,195 (0,155; 0,256) |
0,117 (0,092; 0,258) |
|
Биоптаты мягких тканей |
0,601 (0,465; 0,723) P3-1=0,027 P3-2=0,002 |
0,562 (0,511; 0,624) P3-1=0,027 P3-2<0,001 |
0,893 (0,742; 0,950) P3-1=0,014 P3-2<0,001 |
1,103 (0,969; 1,331) P3-1=0,002 P3-2<0,001 |
|
Соникационная жидкость |
1,016 (0,966; 1,141) P4-1<0,001 P4-2<0,001 |
1,267 (1,178; 1,431) P4-1<0,001 P4-2<0,001 P4-3<0,001 |
1,388 (1,104; 1,616) P4-1<0,001 P4-2<0,001 P4-3<0,001 |
1,563 (1,056; 1,892) P4-1<0,001 P4-2<0,001 |
Примечание: в таблице приведены значения медианы и квартилей (25%; 75%); Р3-1 — статистически различия между штаммами, выделенными из биоптатов, и штаммами, полученными из отделяемого ран; P3–2 — статистические различия между штаммами из биоптатов и штаммами, полученными из аспиратов; P4–1 — статистические различия между штаммами из соникационной жидкости и штаммами из отделяемого ран; P4–2 — статистические различия между штаммами, полученными из соникационной жидкости, и штаммами из аспирата; P4–3 — статистические различия между штаммами из соникационной жидкости и из биоптатов.
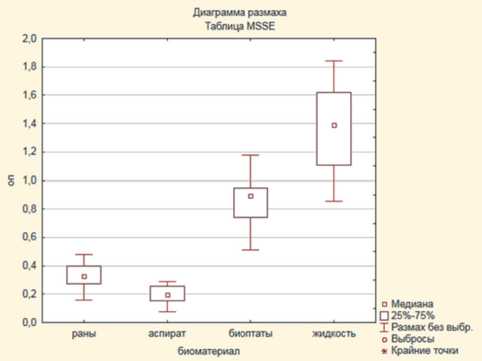
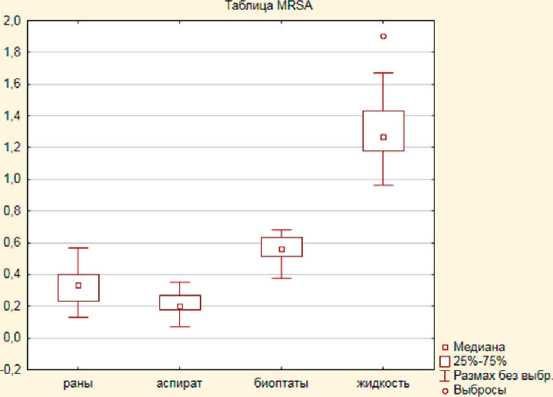
о слабой пленкообразущей способности этой группы изолятов (рис. 1, 2).
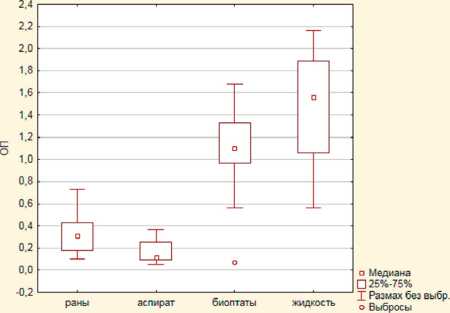
Штаммы стафилококка, выделенные из биопта-тов мягких тканей, характеризовались высокими значениями оптической плотности элюатов красителя, достоверно (p<0,05) превышающими показатели штаммов 1-й группы (отделяемое ран), 2-й группы (аспираты) и референс-штаммов, что позволяет говорить о склонности данных штаммов формировать биопленки. Максимальные значения оптической плотности экстрактов генцианвиолета, достоверно (p<0,05) отличающиеся от 1-й и 2-й групп, отмечены среди штаммов, выделенных из соникационной жидкости (см. рис. 1, 2).
Cравнительный межвидовой анализ способности S. epidermidis и S. aureus формировать биопленки не выявил статистически достоверных различий способности к пленкообразованию при анализе штаммов, полученных из отделяемого ран, аспиратов, из соникационной жидкости (рис. 3).
Межвидовые различия отмечены только у группы штаммов, выделенных из биоптатов: оптическая плотность экстрактов штаммов S. epidermidis была достоверно (p<0,05) выше, чем у штаммов S. aureus (см. рис. 3).
Обсуждение. Проведено исследование способности штаммов Staphyloccus spp., выделенных у пациентов с имплантат-ассоциированной инфекцией после эндопротезирования коленного сустава, к формированию биопленок в зависимости от вида исследуемого биологического материала, которое выявило достоверные различия способности к плен-кообразованию у различных групп стафилококка.
Штаммы, выделенные из соникационной жидкости, полученной после ультразвуковой обработки удаленных компонентов эндопротезов, и из биопта-тов мягких тканей, характеризовались высокой способностью к формированию биопленок, достоверно (p<0,05) отличающейся от штаммов, выделенных из поверхностных ран и аспирата. По данным неко-
А)
Рис. 1. Статистические различия оптической плотности экстрактов красителей штаммов S. epidermidis, выделенных из различного биологического материала:
А ) MSSE; Б ) MRSE
Диаграмма размаха MRSE
материал * Крайние точки
Б)
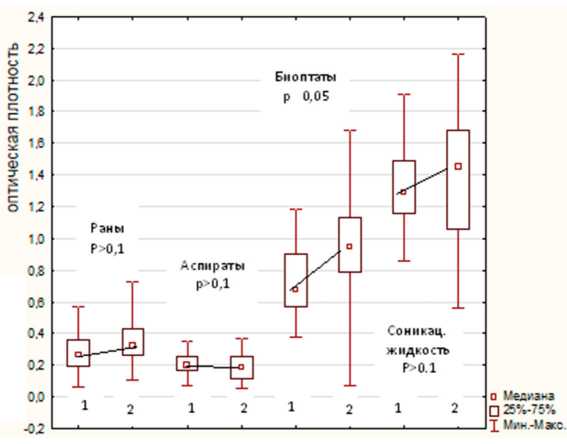
Рис. 3. Межвидовые различия способности S. aureus ( 1 ) и S. epidermidis ( 2 ) к пленкообразованию
Диаграмма размаха
биоматериал * Крайние точки
А)
Б)
Рис. 2. Статистические различия оптической плотности экстрактов красителей штаммов S. aureus , выделенных из различного биологического материала:
А ) MRSA; Б ) MSSA
торых исследователей, более интенсивное биоплен-кообразование у этих групп штаммов обусловлено неблагоприятными условиями внешней среды, недостатком кислорода, наличием абиогенных поверхностей компонетов эндопротеза. Все это приводит к активации биопленкообразования как защитного механизма, позволяющего микроорганизмам сохранить жизнеспособность. Рядом авторов показано, что существует избирательная адгезия микробов к имплантату: у штаммов S. epidermidis она активнее происходит к полимерным частям эндопротеза, у штаммов S. aureus — к металлическим [6, 8], однако наши исследования не обнаружили подобной тенденции. Следует учитывать, что и коагулазоположительные, и коагулазоотрицательные виды стафилококка могут активно взаимодействовать с белками организма (фибронектин, фибриноген, коллаген), которые покрывают конструкции эндопротеза немедленно после их имплантации [9], поэтому различия в тропности разных видов стафилококка к различным абиотическим материалам могут отсутствовать.
Штаммы стафилококка, выделенные из поверхностных ран и аспирата, характеризовались достоверно (p<0,001) меньшей способностью в био-пленкообразованию, чем штаммы, выделенные из биоптатов мягких тканей и из соникационной жидкости. Данная закономерность может быть объяснена преобладанием планктонных форм бактерий в минимальном количестве в аспиратах и отделяемом поверхностных ран, с чем связана низкая информативность дооперационной бактериологической диагностики имплантат-ассоциированной инфекции. Биопленка, сформированная на поверхности эндопротеза с прочно фиксированными микроорганизмами, является основным патогенетическим фактором инфекционного процесса и может быть выявлена при исследовании других видов биологического материала — соникационной жидкости и гомогенизированных биоптатов мягких тканей.
Некоторые авторы указывают на более активное биопленкообразование у штаммов эпидермального стафилококка, особенно выделенных из соникаци-онной жидкости и мягких тканей [10], однако достоверные (p<0,05) межвидовые различия между интенсивностью пленкообразования между штаммами S. aureus и штаммами S. epidermidis выявлены только у штаммов, выделенных из биоптатов. При изучении всех других типов биологического материала видовые различия в способности формировать биопленки не обнаружены.
Заключение. Способность к формированию биопленок выявлена у 51,2% исследуемых штаммов, причем среди коагулазоположительных стафилококков она была достоверно (p<0,05) выше, чем у коагулазонегативных.
Штаммы стафилококка, выделенные из соника-ционной жидкости, полученной после ультразвуковой обработки удаленных компонентов эндопротезов, и из биоптатов мягких тканей, характеризовались высокой способностью к формированию биопленок, достоверно (p<0,05) превышающей значения штаммов, выделенных из поверхностных ран и аспирата.
Межвидовые различия отмечены только у группы штаммов, выделенных из биоптатов: оптическая плотность экстрактов штаммов S. epidermidis была достоверно (p<0,05) выше, чем у штаммов S. aureus .
Таким образом, способность к биопленкообразо-ванию у штаммов стафилококка, выделенных от пациентов с имплантат-ассоциированной инфекцией, зависит от исследуемого биологического материала, что определяет наиболее информативные методы микробиологического исследования, позволяющие выявить инфекционные осложнения эндопротезирования крупных суставов и идентифицировать их этиологический фактор.
Список литературы Образование биопленок штаммами стафилококка, выделенными из различного биологического материала при инфекционных осложнениях тотального эндопротезирования коленного сустава
- Преображенский П. М., Каземирский А. В., Гончаров М. Ю. Современные взгляды на диагностику и лечение пациентов с перипротезной инфекцией после эндопротезирования коленного сустава. Гений ортопедии 2016; 3: 94-104
- Тихилов P. M., Шубняков И. И., Коваленко А. Н. и др. Данные регистра эндопротезирования тазобедренного сустава РНИИТО им. P. P. Вредена за 2007- 2012 годы. Травматология и ортопедия России 2013; 3: 167- 90
- Божкова С. А., Полякова Е. М., Борисов А. М., Рукина А. Н. MRSA при инфекции протезированного сустава: мишень для антибактериальной терапии. Фарматека 2015; 4: 65-9
- Ярец Ю. И., Шевченко Н. И., Рубанов Л. Н. Динамика микробного состава хронической раны с учетом особенностей предоперационной подготовки. Проблемы здоровья и экологии 2012; 32 (2):108-14
- Oliveira A. Comparison of methods for the detection of bioflm production in coagulase-negative staphylococci. BMC Research Notes 2010; 260 (3): 1-8
- Ильина Т. С. Романова Ю. М., Гинцбург А. Л. Биопленки как способ существования бактерий в окружающей среде и организме хозяина: феномен, генетический контроль и системы регуляции их развития. Генетика 2004; 40 (11): 1189-98
- Christensen DG, et al. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of Staphylococci to medical devices. Journal of clinical microbiology 1985; 22 (6): 996-1006
- Афиногенова А. Г. Даровская Е. Н. Микробные биопленки ран: состояние вопроса. Травматология и ортопедия России 2011; 3 (61): 119-25
- Маянский А. Н., Чеботарь И. В. Стафилококковые биопленки: структура, регуляция, отторжение. Микробиология 2011; 1: 101-8
- Смирнова Т. А. и др. Структурно-функциональная характеристика бактериальных биопленок. Микробиология 2010; 79 (4): 413-23
- Божкова С. А., Краснова М. В., Полякова Е. М. и др. Способность к формированию биопленок у клинических штаммов S. aureus и S. epidermidis - ведущих возбудителей ортопедической имплантат-ассоциированной инфекции. Клиническая микробиология и антимикробная химиотерапия 2014; 2 (16): 149-56).


