Образования титана никеля в мелкодисперсной системе оксидов TiO2 (анатаз) -NiO
Автор: Сериков Александр Сергеевич, Гладков Владимир Евгеньевич, Жеребцов Дмитрий Анатольевич, Колмогорцев Алексей Михайлович, Викторов Валерий Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия конденсированного состояния
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Физико-химическими методами (РСА, ДТА, масс-спектрометрия, маг-нетохимический анализ) исследован фазовый переход анатаз- рутил в мелкодисперсных порошках ТiO2, отличающихся способом получения. Установлено, что температура фазового перехода зависит от предыстории получения анатаза. При прокаливании эквимолярной смеси TiO2 (анатаз) -Ni(N03)2 и ТiO2 (анатаз)-(NiOH)2CO3 образуется только титанат никеля, других оксидных соединений с Ti (IV) и Ni (II) не обнаружено. Установлено, что фазовый переход анатаз-рутил препятствует образованию титаната никеля в интервале температур 700-850 °С.
Диоксид титана, анатаз, рутил, фазовый переход, титанат никеля
Короткий адрес: https://sciup.org/147160180
IDR: 147160180 | УДК: 548.3
Текст обзорной статьи Образования титана никеля в мелкодисперсной системе оксидов TiO2 (анатаз) -NiO
Титанат никеля NiTiO3 широко применяется в качестве полупроводников, оптических материалов, катализаторов, пигментов и др. [1-5]. Известно, что NiTiO3 имеет структуру ильменита, где атомы Ni и Ti находятся в октаэдрической координации. Установлено [6], что это соединение имеет антиферромагнитную структуру с температурой Нееля -250 °C. Измерения, проводившиеся в интервале температур -269.. .30 °C, показали, что титанат никеля обладает слабой магнитной анизотропией при низких температурах. Синтез титаната никеля осуществляется множеством способов с использованием органических производных титана, например, его оксалатных комплексов или тетрабутоксититана (IV) [7-10]. Синтез NiTiO3 твердофазным взаимодействием осложняется тем, что при низких температурах (Т <1000 °C) наряду с образующимся титанатом в системе остается TiO2 рутильной и анатазной модификации и NiO. Высокие температуры приводят к неконтролируемому увеличению размера частиц с различной морфологией. Вместе с тем, влияние фазового перехода анатаз -» рутил на особенности синтеза NiTiO3 при взаимодействии в мелкодисперсной системе TiO2-NiO изучено недостаточно.
Цель работы - изучение влияния фазового перехода анатаза в рутил на особенности образования титаната никеля в мелкодисперсной системе TiO2-NiO.
Экспериментальная часть
Исходные реакционные смеси готовили тщательным смешением оксидов титана и солей никеля квалификации «х.ч.» или «ос.ч.» в агатовой ступке до получения порошков однородного цвета.
Оксид титана (IV) анатазной и рутильной модификации получали прокаливанием гидролизного диоксида титана (ГДТ) при 600 °C и 1200 °C, соответственно, в течение 1,5-2 ч и термолизом TiCl4. ГДТ получали способом, детально описанным в [11].
Исходные механические смеси готовили по следующим вариантам: смесь I - ТЮ2 (анатаз из ГДТ)-Ni(NO3)2-6H2O; смесь II - TiO2 (анатаз из TiCl4)-Ni(NO3)2-6H2O; смесь III - ТЮ2 (анатаз из ГДТ) - (NiOH)2CO3; смесь IV - ТЮ2 (анатаз из TiCl4) - (NiOH)2CO3; смесь V - ТЮ2 (рутил из ГДТ) -Ni(NO3)2-6H2O и смесь VI - TiO2 (рутил из ГДТ) - (NiOH)2CO3 путем смешения в спирте эквимолярных отношений (в пересчете на NiO). Оксиды титана и смеси I-VI прокаливали при температурах 700-1200 °C с интервалом 50 °C.
Химическую чистоту образцов контролировали спектральными методами на приборе PGS-2. Прокаленные смеси исследовали рентгенографически на дифрактометре ДРОН-ЗМ с К„-излуче-нием меди. Спектры дифференциально-термического и масс-спектрометрического анализов получали на приборе Netzch Jupiter. Анализ проводили со скоростью нагрева 20 °C в минуту, в кисло-родно-аргоновой смеси от комнатной температуры до 1100 °C.
Химия конденсированного состояния
Количественный рентгеновский анализ рутила и анатаза, а также титаната никеля проводили по калибровочному графику, полученному из рентгеновских данных механических смесей.
Магнетохимический анализ смесей после прокаливания проводили методом Фарадея при комнатной температуре.
Результаты и обсуждение
Размер частиц исходного анатаза, оцененный по ширине рентгеновских дифракционных максимумов, составлял величину ~20 нм. В зависимости от температуры прокаливания смеси I-VI имели различную окраску от темно-коричневой до ярко-желтой.
РСА полученных образцов показал, что температура и скорость фазового перехода анатаз-рутил для Т1О2 (ГДТ) и TiO2 (Т1С14) различна. Методом ДТА (рис. 1, а) установили, что для Т1О2 (ГДТ) при температурах 700-710 °C идет активная десульфатизация, достигающая максимума при температуре 780 °C. Масс-спектрометрические исследования показали, что при 780 °C наблюдали максимум выделения оксидов серы (m/е = 64 и т/е = 48). Слабый экзоэффект при температуре =850 °C относится к фазовому переходу ТЮ2 (анатаз) -» ТЮ2 (рутил) (АН перехода = = 1,8 кДж/моль).
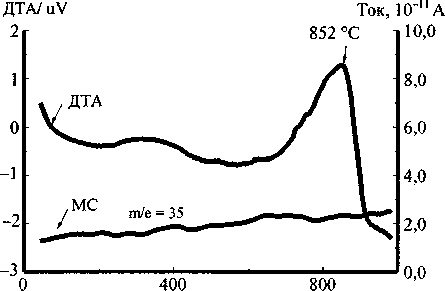
Отметим, что кривые ДТА TiO2 (TiCl4) не содержат эффектов, связанных с десорбцией каких-либо соединений. При этом потерь массы этим образцом при нагревании не обнаружили. Экзоэффект в области 852 °C связан с фазовым переходом анатаз-рутил. Выделения хлора при этом не обнаружили (рис. 1, б).
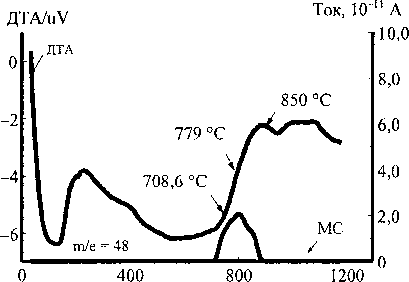
Рис. 1. Дифференциально-термический и масс-спектрометрический анализ: а - анатаз из ГДТ; б - анатаз из TiCI4
На рис. 2 представлены зависимости концентрации рутила от времени и температуры изотермической выдержки. При этом полный переход в рутил для Т1О2 (ГДТ) при 950 и 900 °C в течение 1 и 3 ч соответственно, тогда как фазовый переход анатаз-рутил TiO2(TiCl4) заканчивается при температуре на 100 °C выше.
На основании рутильной модификации ТЮ2 при прокаливании смесей V и VI в интервале температур 700-850 °C титаната никеля не обнаружили. Тогда как в прокаленных смесях I-IV с анатазом в этом температурном интервале образуется титанат никеля, количество которого зависит от времени изотермической выдержки и температуры прокаливания смесей.
Степень превращения Т1О2 в титанат никеля представлена на рис. 3. При этом реакция заканчивается фактически в течение 1 ч. Увеличение концентрации титаната никеля при изменении времени прокаливания с 1 до 3 ч незначительно (всего на 3-5 %).
Количественные данные о фазовом составе смесей после изотермической выдержки представлены в таблице. Анализ представленных данных показывает, что в прокаленных смесях I, III и IV одновременно с фазовым переходом анатаз-рутил образуется титанат никеля. Полного превращения диоксида титана в титанат никеля не происходит. При прокаливании в температурном интервале 800-850 °C оксид титана находится как в рутильной, так и в анатазной модификации. При термообработке смеси II механизм образования титаната никеля совершенно иной. В последнем случае происходит постепенное увеличение количества титаната никеля от времени и температуры изотермической выдержки. Фазового перехода анатаз-рутил в данном температур-
Сериков А.С., Гпадкое В.Е., Жеребцов Д. А., Колмогорцев А.М., Викторов В.В.
ном интервале не наблюдали. Полное превращение анатаза в титанат никеля в смеси II происходит в течение 3 ч при температуре 850 °C. Тогда как при температурах 800-850 °C в смеси I и IV образуется рутильная модификация, которая не взаимодействует с NiO.
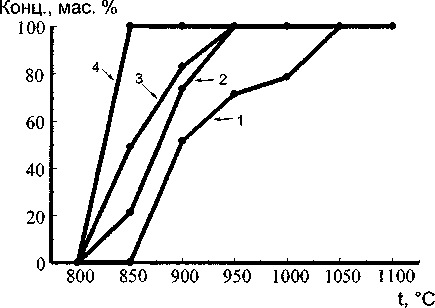
Рис. 2. Концентрация рутила, образующегося при изотермической выдержке из исходных оксидов: 1 - анатаз (ТЮЦ) после 1 ч прокаливания; 2 - анатаз (ГДТ) после 1 ч прокаливания; 3 - анатаз (TICI4) после 3 ч прокаливания; 4- анатаз (ГДТ) после 3 ч прокаливания
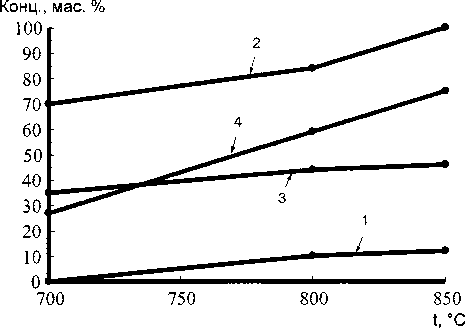
Рис. 3. Содержание титаната никеля в смесях после 3-часовой изотермической выдержки: 1 - смесь I;
2 - смесь II; 3 - смесь III; 4 - смесь IV
Количественный фазовый состав смесей I—IV после изотермической выдержки в течение 3 ч
|
Смеси |
тпр, °с |
Температура, °C |
|||
|
TiO2 (ан), мае. % |
ТЮ2 (рут), мае. % |
NiO, мае. % |
NiTiO3, мае. % |
||
|
I |
700 |
34 |
0 |
31 |
35 |
|
800 |
0 |
39 |
27 |
44 |
|
|
850 |
0 |
28 |
26 |
46 |
|
|
II |
700 |
16 |
0 |
15 |
70 |
|
800 |
8 |
0 |
8 |
84 |
|
|
850 |
0 |
0 |
0 |
100 |
|
|
III |
700 |
52 |
0 |
48 |
Следы |
|
800 |
31 |
16 |
41 |
10 |
|
|
850 |
0 |
46 |
42 |
12 ■ |
|
|
IV |
700 |
38 |
0 |
35 |
27 |
|
800 |
9 |
12 |
20 |
59 |
|
|
850 |
0 |
13 |
12 |
75 |
|
Магнитная восприичивость образцов смесей I и II увеличивается с увеличением температуры прокаливания, что указывает на возрастание парамагнитной фазы титаната никеля в смесях. Так для образца из смеси ТЮ2 (анатаз из ГДТ)-Ni(NO3)2-6H2O, полученного изотермической выдержкой при 700 и 800 °C, х = 13,ОТО-6 см3/г (содержание NiTiO3 - 3 5 %) и у = 14,5-10"6 см3/г (содержание NiTiO3 - 44 %), а для образца из смеси ТЮ2 (анатаз) TiCl4 -Ni(NO3)2-6H2O, прокаленного в тех же условиях, х = 20,9 10 6 см3/г (содержание NiTiO3 -70 %) и у =25,0-1 О*6 см3/г (содержание NiTiO3- 84 %) соответственно.
Выводы
Методами PC А, ДТА, масс-спектрометрического анализа исследован фазовый переход анатаз-рутил. Установлено, что температура фазового перехода зависит от предыстории получения оксида титана. Фазовый переход анатаз-рутил для TiO2, полученный из ГДТ, наблюдали на 100 °C ниже, чем анатаза, полученного из TiCl4. Исследовано образование титаната никеля из анатазной и рутильной модификации при взаимодействии с Ni(NO3)2 и (NiOH)2CO3 (в пересчете на NiO - эквимолярная смесь). Механизм взаимодействия существенно различен. При взаимодействии TiO2 (ГДТ) с нитратом никеля одновременно с фазовым переходом анатаз-рутил на-
Химия конденсированного состояния
блюдается образование титаната никеля. При этом полного превращения титаната никеля не происходит в температурном интервале 700-850 °C. Взаимодействие TiO2 (TiCl4) с нитратом никеля происходит без фазового перехода анатаз—рутил и образование титаната никеля заканчивается при 850 °C в течение 1 ч.
Список литературы Образования титана никеля в мелкодисперсной системе оксидов TiO2 (анатаз) -NiO
- Random fields and random anisotropics in the mixed ising-XY magnet FexCot-xTiO3/Q.J. Harris, Q. Feng, Y.S. Lee et al.//Phys. Rev. Lett. -1997. -Vol. 78, № 2. -P. 346-349.
- Fisch, R. Critical behavior of randomly pinned spin-density waves/R. Fisch//Physical Review -1995-Vol. 51-P. 11507-11514.
- Dharmaraj, N. Nickel titanate nanofibers by electrospinning/N. Dharmaraj, H.C. Park, C.K. Kim et al.//Materials Chemistry and Physics. -2004. -Vol. 87. -1. 1. -P. 5-9.
- Shimizu, Y./Y. Shimizu, K. Uemura, N. Miura et al.//Chem. Lett. -1988 -Vol. 67 -P. 1979.
- Phani, A.R. Structural characterization of nickel tantalum oxide synthesized by sol-gel spin coating technique/A.R. Phani, S. Santucci//Materials Letters. -2001. -Vol. 47. -1. 1-2. -P. 20-24.
- Newnhan, R.E. Crystal structure and magnetic properties of СоТiO3/R.E. Newnhan, J.H. Fang, R.P. Santoro//Acta Crystallogr. -1964. -Vol. 17. -P. 240-242.
- Ni, Y. Nickel titanate microtubes constructed by nearly spherical nanoparticles: Preparation, characterization and properties/Y. Ni, X. Wang, J. Hong//Materials Research Bulletin. -2009. -Vol. 44.-P. 1797-1801.
- Synthesis and characterization of titanates of the formula MTiO3 (M = Mn, Fe, Co, Ni and Cd) by co-precipitation of mixed metal oxalates/Y. M Sharma, M. Kharkwal, S. Uma, R. Nagarajan//Polyhedron. -2009. -Vol. 28. -P. 579-585.
- Structural characterization of NiTi03 nanopowders prepared by stearic acid gel method/M.S. Sadjadi, K. Zare, S. Khanahmadzadeh, M. Enhessari//Materials Letters. -2008. -Vol. 62. -P. 3679-3681.
- Low-temperature synthesis and characterization of (Zn,Ni)TiO3 ceramics by a modified sol-gel route/J. Luoa, X. Xing, R. Yu et al.//Journal of Alloys and Compounds. -2006. -Vol. 420. -P. 317-321.
- Беленький, Е.Ф. Химия и технология пигментов/Е.Ф Беленький, И.В Рискин. -Л.: Химия, 1974.-656 с.


