Общая выживаемость больных раком ободочной кишки с различным уровнем циркулирующих опухолевых клеток и возможности повышения его прогностической значимости
Автор: Кит О.И., Златник Е.Ю., Новикова И.А., Ульянова Е.П., Демидова А.А., Колесников Е.Н., Геворкян Ю.А., Солдаткина Н.В., Снежко А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Разработка персонализированных подходов к диагностике, лечению и прогнозированию рака ободочной кишки является актуальной проблемой современной онкологии. Уровни циркулирующих опухолевых клеток (ЦОК) и опухолевых стволовых клеток (ОСК) рассматриваются как многообещающие неинвазивные прогностические факторы. Цель исследования - оценка общей выживаемости (ОВ) больных раком ободочной кишки ii-iV стадий с различным уровнем ЦОК и изучение возможности повышения его прогностической значимости путем дополнительного определения уровня ОСК cd44+ в опухоли. Материал и методы. В исследование включено 299 больных раком ободочной кишки ii-iV стадий. Выполнялось хирургическое лечение, после чего больные ii-iii стадий получали адъювантную химиотерапию (FolFoX). Больным iV стадии с резектабельными метастазами в печень одновременно с удалением первичной опухоли выполнялась операция на печени, затем - химиотерапия (FolFoX). До операции у больных определяли ЦОК методом Veridex cellsearch™, в удаленной опухоли - экспрессию маркера ОСК cd44+ иммуногистохимическим методом. Изучали ОВ больных с различным уровнем ЦОК, кумулятивную ОВ определяли методом Каплана-Мейера. Для построения прогностической модели использовали метод логистического регрессионного анализа, для оценки влияния изучаемых параметров на ОВ больных - регрессионный анализ Кокса. Результаты. Наблюдается более низкая ОВ при более высоких уровнях ЦОК, разделенных на ранги: 0, 1-3, 4-9, ≥10; (χ2=11,59, p=0,009), что позволяет использовать данный тест как фактор прогноза. Его прогностическую значимость можно повысить при определении в ткани опухоли процента cd44+ опухолевых клеток. Выявлено статистически значимое сопряжение рангов ЦОК и cd44+ с ОВ больных. Повышение концентрации ЦОК в крови на один ранг сопровождалось повышением риска развития летального исхода в 1,58 раза (р=0,002); при дополнительном увеличении экспрессии cd44+ ≥10 % - в 7,2 раза (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Циркулирующие опухолевые клетки, опухолевые стволовые клетки, рак ободочной кишки, выживаемость, прогноз, логистическая регрессия
Короткий адрес: https://sciup.org/140295749
IDR: 140295749 | УДК: 616.348-006.6-037:576 | DOI: 10.21294/1814-4861-2022-21-4-32-39
Текст научной статьи Общая выживаемость больных раком ободочной кишки с различным уровнем циркулирующих опухолевых клеток и возможности повышения его прогностической значимости
Разработка и изучение эффективности новых методов диагностики и лечения рака ободочной кишки, который является одной из ведущих причин заболеваемости и смертности онкологических больных, представляют собой актуальную проблему современной онкологии. Особое место занимает прогнозирование течения этого заболевания, для чего следует учитывать его гетерогенность. Известны его молекулярно-генетические подтипы, отличающиеся по клиническому течению, лабораторным характеристикам, чувствительности к химио- и иммунотерапии и прогнозу [1–4]. Как показано в последние годы, эти опухоли неоднородны даже в пределах одной стадии по такому показателю, как уровень циркулирующих опухолевых клеток (ЦОК) [5]. Количество ЦОК при раке ободочной кишки имеет прямую связь с риском метастазирования и продолжительностью жизни больных [6, 7]. Другие исследования, напротив, характеризуют диссеминацию опухолевых клеток как их транзиторное выделение [8, 9].
Методы определения ЦОК разнообразны, и количественный результат не в последнюю очередь зависит от их выбора. Для наиболее распространенного метода определения уровня ЦОК CellSearch критическим значением при раке ободочной кишки считается уровень ЦОК выше 3 в 7,5 мл, при превышении которого прогнозируются метастазирование опухоли и низкая общая и бессобытийная продолжительность жизни больных. При этом в литературе описано, что частота метастазирования после операции оказалась в 8 раз выше у больных с уровнем ЦОК≥5 [10]. В некоторых работах при распространенном раке ободочной кишки в качестве прогностически значимого предлагается уровень ЦОК≥10 [11], а по данным авторов, изучавших уровни ЦОК у больных II–III стадий, в большинстве случаев их не удалось определить [12]. Таким образом, данные литературы противоречивы в плане определения нижней прогностически неблагоприятной границы ЦОК.
По оптимальному сроку определения ЦОК также высказываются разные мнения. Если одни авторы считают ЦОК достаточно эффективным независимым фактором прогноза при предоперационном обследовании больных [13], то, по мнению других, уровень ЦОК имеет прогностическое значение только при определении на послеоперационном этапе [14]. В некоторых работах уровень ЦОК рассматривается как вспомогательный прогностический фактор [15] и указывается на то, что выявление новых маркеров ЦОК является важной, но не решенной проблемой [16]. Итак, во многих работах подчеркивается недостаточность исследования только уровня ЦОК, тем более, что роль низких показателей остается неясной, вследствие чего следует применять комплексную оценку этого фактора.
Целью исследования явились оценка общей выживаемости больных раком ободочной кишки II–IV стадий с различным уровнем ЦОК и изучение возможности повышения его прогностической значимости путем дополнительного определения уровня ОСК CD44+ в опухоли.
Материал и методы
Дизайн исследования был одобрен этическим комитетом ФГБУ «НМИЦ онкологии». Обязательным условием включения в исследование являлось наличие подписанного добровольного информированного согласия всех больных. В исследование включены 299 больных раком ободочной кишки в возрасте от 42 до 86 лет (средний возраст – 64,2 года), находившихся на лечении в ФГБУ НМИЦ онкологии с 2012 по 2016 г. Распределение больных по стадиям заболевания проводили в соответствии с Международной классификацией злокачественных опухолей по системе TNM (AJCC/UICC 8th ed., 2017). Распределение больных по полу, стадии заболевания, гистологическому строению и степени дифференцировки опухоли представлено в табл. 1; распределение по этим показателям внутри стадий заболевания было сопоставимым. Наиболее часто опухоль располагалась в левой половине ободочной кишки – у 139 (46,5 %) больных, в поперечно-ободочной кишке – у 93 (31,1 %), в правой половине ободочной кишки – у 67 (22,4 %) пациентов.
Всем больным первым этапом выполнялось хирургическое лечение, после чего больные II–III стадий получали адъювантную химиотерапию по схеме FOLFOX. Больным IV стадии с резекта-бельными метастазами в печень одновременно с удалением первичной опухоли выполнялась операция на печени, с адъювантной химиотерапией по схеме FOLFOX. Больных наблюдали в течение 5–7,5 лет после операции. При прогрессировании лечение проводили по общепринятым стандартам. Для оценки общей кумулятивной выживаемо- сти фиксировали факт и сроки летального исхода, связанного с прогрессированием основного заболевания.
Детекцию ЦОК проводили до операции с использованием системы Veridex CellSearch™ (JanssenDiagnostics, LLC) с антителами к маркерам адгезии эпителиальных клеток EpCAM, CD45 и цитокератинам 8,18,19. К ЦОК относили клетки, положительно меченные по EpCAM, цитокера-тинам и отрицательные по CD45. Общее число выявленных опухолевых клеток в 7,5 мл крови являлось конечным результатом.
Уровень опухолевых клеток, экспрессирующих CD44, определяли в ткани удаленной опухоли ИГХ-методом с антителами к CD44 (Termo scientific, клон 156-3С11, разведение 1:2500), подсчитывали процент окрашенных клеток под микроскопом «AxioLab.A1» (Германия) при ×100, ×200, ×400. Для проведения регрессионного анализа Кокса выделяли четыре ранга уровней ЦОК: 0 (ранг 0), 1–3 (ранг 1), 4–9 (ранг 2), ≥10 клеток (ранг 3) в 7,5 мл крови, и два ранга экспрессии CD44+ в опухолевой ткани: ниже 10 % (ранг 0) и ≥10 % (ранг 1).
Статистический анализ проведен с использованием программы Statistica 13,0 (StatSoft, США). Анализ кумулятивной общей выживаемости, связанной с основным заболеванием, проводили с использованием метода множительной оценки Каплана–Мeйера. Множественное сравнение динамики кумулятивной выживаемости пациентов в четырех подгруппах в зависимости от ранга ЦОК осуществлено по критерию Пирсона χ 2. Для построения модели использовали логистический регрессионный анализ. Оценку прогностической значимости коэффициента разработанной модели осуществляли путем ROC-анализа, расчета разделительной точки cut-off и соответствующей ей диагностической чувствительности и специфичности. С помощью регрессионного анализа Кокса проведена оценка влияния изменений изучаемых параметров на выживаемость больных.
Результаты
Общая выживаемость (ОВ) больных оказалась ниже у больных с более высоким предоперационным уровнем ЦОК. Медиана ОВ при ЦОК 0 составляла 53,5 мес (LQ 44,7 UQ 62,8), при ЦОК 1–3 – 46,0 мес (LQ 35,9 UQ 55,6), при ЦОК 4–9 – 32,2 мес (LQ 27,4 UQ 39,1), при ЦОК ≥10 – 12,4 мес. (LQ 9,3 UQ 15,7). За пятилетний срок наблюдения кумулятивная выживаемость среди пациентов, у которых ЦОК в крови отсутствовали, составила 63,3 %, при ЦОК 1–3 – 56,5 %, при ЦОК 4–9 – 50 % и при ЦОК 10 и выше – 16,4 % (табл. 2). Различие показателей выживаемости пациентов четырех подгрупп в зависимости от числа ЦОК было статистически значимым ( χ 2=11,59, p=0,009).
Усилить прогностическую значимость уровня ЦОК оказалось возможным при одновременном
Таблица 1/Table 1
|
Показатели/ Indices |
Количество больных/ Number of patients |
|
|
Пол/Sex |
Мужчины/Men |
155 (51,8 %) |
|
Женщины/Women |
144 (48,2 %) |
|
|
II |
110 (36,8 %) |
|
|
Стадия/Stage |
III |
88 (29,4 %) |
|
IV |
101 (33,8 %) |
|
|
Гистологическое строение/ Histology |
Аденокарцинома/Adenocarcinoma |
242 (80,9 %) |
|
Муцинозная аденокарцинома/ Mucinous adenocarcinoma |
45 (15,1 %) |
|
|
Перстневидно-клеточный рак/ Signet cell carcinoma |
12 (4,0 %) |
|
|
Степень |
G1 |
46 (15,4 %) |
|
дифференцировки/ |
G2 |
165 (53,2 %) |
|
Grade |
G3 |
88 (29,4 %) |
|
Всего/Total |
299 (100 %) |
|
Таблица 2/Table 2
Динамика послеоперацонной кумулятивной выживаемости больных с различным уровнем ЦОК dynamics of postsurgical cumulative survival rate of the patients with different CTC levels
|
Период, мес/ Period, months |
Уровни ЦОК/CTC levels |
|||
|
0 |
1–3 |
4–9 |
10 и выше >10 |
|
|
0,9 |
100,0 % |
100,0 % |
100,0 % |
100,0 % |
|
10,2 |
100,0 % |
90,1 % |
71,4 % |
63,6 % |
|
19,5 |
88,9 % |
80,1 % |
57,1 % |
45,5 % |
|
28,8 |
77,8 % |
67,6 % |
50,0 % |
36,4 % |
|
38,2 |
69,4 % |
62,6 % |
50,0 % |
27,3 % |
|
47,5 |
66,6 % |
59,9 % |
50,0 % |
27,3 % |
|
56,8 |
63,3 % |
56,5 % |
50,0 % |
16,4 % |
|
66,1 |
63,3 % |
56,5 % |
50,0 % |
16,4 % |
|
75,4 |
63,3 % |
56,5 % |
50,0 % |
16,4 % |
|
84,8 |
63,3 % |
56,5 % |
50,0 % |
16,4 % |
|
χ2=11,59, р=0,009 |
||||
Таблица 3/Table 3
Параметры регрессионного анализа Кокса по оценке изолированного и совместного с экспрессией Cd44+ влияния ЦОК на ОВ больных parameters of Cox regression analysis for the assessment of single and mutual with Cd44+ expression impact of CTC on patients` overall survival
|
Показатель/ Index |
β-стандартный коэффициент регрессии/ β-standard regression coefficient |
Стандартная ошибка β/ Standard error β |
Критерий Вальда/ Wald criterion |
p |
Отношение шансов/ ОR |
|
ЦОК/CTC |
0,454 |
0,146 |
9,729 |
0,002 |
1,575 |
|
ЦОК и CD44+/ CTC and CD44+ |
2,795 |
0,364 |
18,758 |
0,0001 |
7,213 |
Клинико-патологическая характеристика больных
Clinical and pathologic characteristics of the patients
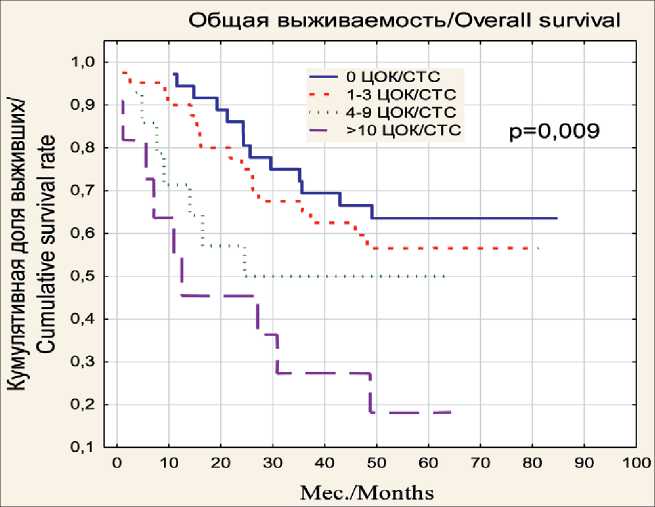
Рис.1. Общая выживаемость после операции больных раком ободочной кишки с различным уровнем ЦОК
Fig. 1. Postsurgical overall survival of the patients with different CTC levels
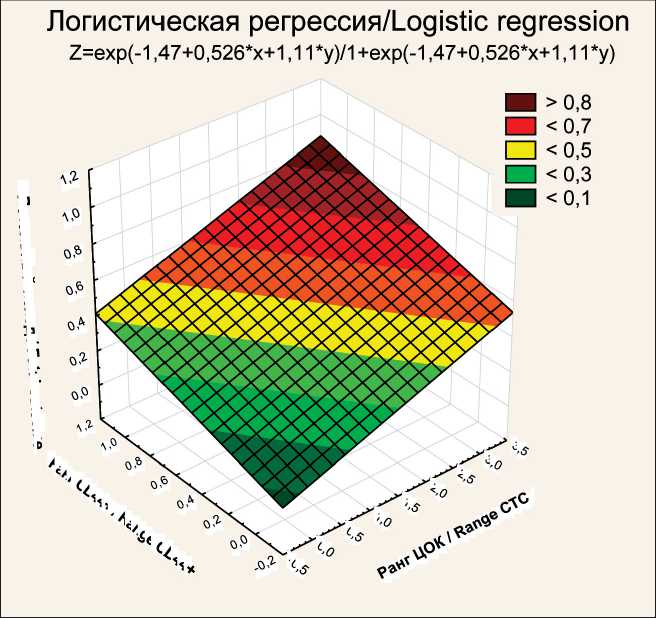
Рис.2. Графическая зависимость величины К от ранга ЦОК и ранга экспрессии CD44
Fig. 2. Plotting K value versus CTC range and CD44 expression range определении в ткани удаленной опухоли доли опухолевых клеток, экспрессирующих маркер ОСК CD44. Применение регрессионного анализа Кокса позволило доказать значимое сопряжение ранга ЦОК совместно с рангом экспрессии CD44+ на опухолевых клетках с ОВ больных (табл. 3). При этом как один показатель изолированно (ЦОК), так и два показателя (ЦОК и CD44+) независимо от стадии значимо влияли на общую выживаемость. Поправка на стадию заболевания у 299 больных нашей выборки при регрессионном анализе Кокса позволила доказать независимость использования двух предикторов.
С более высокой концентрацией ЦОК в крови больных была ассоциирована более низкая вы- живаемость в послеоперационном периоде, о чем свидетельствовали высокие значения β-стандарти-зированного коэффициента регрессии, критерия Вальда и соответствующий р=0,002. Повышение концентрации ЦОК в крови на один ранг сопровождалось повышением риска развития летального исхода в 1,58 раза (р=0,002). Одновременный учет экспрессии маркера ОСК CD44+ и концентрации ЦОК в крови расширил прогностические возможности использования такого сочетания: при повышении концентрации ЦОК в крови на один ранг и увеличении экспрессии CD44+ ≥10 % риск развития летального исхода возрастал в 7,2 раза (p<0,001).
Для индивидуальной оценки риска неблагоприятного исхода заболевания была разработана модель расчета прогностического коэффициента К, учитывающая ранжирование ЦОК и CD44+.
Математическое выражение модели:
К=exp(z)/(1+exp(z)),
Z=0,526 × ранг ЦОК + 1,11 ×
× ранг CD44+ – 1,46.
Методом ROC-анализа была найдена дифференциальная разделительная точка для вынесения заключения о риске летального исхода. По его результатам при K≥0,411 можно сформировать заключение о высоком риске с чувствительностью 81,2 % и специфичностью 80,8 %, а при K<0,411 – о низком риске неблагоприятного (летального) исхода. Статистическую значимость модели оценивали по критерию Пирсона: χ 2=12,5, соответствующая доверительная вероятность р=0,0019, т.е. модель статистически значима. На рис. 2 представлена графическая зависимость величины K от ранга ЦОК и ранга экспрессии CD44. При этом коэффициент K может оказаться ниже критического значения и при высоком ранге ЦОК, если экспрессия CD44+ ниже 10 % (ранг 0), что подтверждает прогностическую значимость уровня СD44+.
Обсуждение
Определение уровня ЦОК при раке ободочной кишки считается многообещающим методом прогноза течения заболевания, однако данные о ценности этого теста разноречивы. Авторы, использовавшие различные методы, признают, что установление нижней границы уровня ЦОК для клинически значимого прогноза является нерешенной задачей [18] и полагают, что этот тест должен оцениваться в комплексе с другими.
Нами по данным исследования 299 больных раком ободочной кишки проведено изучение уровней ЦОК и ОСК и их прогностической значимости с разделением полученных значений на ранги. Отмечены более низкие значения ОВ больных при более высоких уровнях ЦОК в области от 0 до 10. Хотя различие выживаемости больных четырех подгрупп, разделенных на основании уровня ЦОК, было статистически значимым (χ2=11,59, p=0,009), тест, по-видимому, имеет ряд ограничений. Например, отсутствие ЦОК не говорит об отсутствии возможности метастазирования, т.к. у 36,7 % больных, первоначально отрицательных по этому показателю и радикально прооперированных, за период наблюдения наступил летальный исход, связанный с прогрессированием основного заболевания. Вероятно, у них метастазирование происходило преимущественно лимфогенным путем или ограничение чувствительности метода CellSearch не позволило выявить ЦОК на предоперационном этапе. То же можно сказать и о больных с уровнем ЦОК 1–3, который, согласно примененному методу, приравнивается к отрицательному: у них летальный исход отмечен в 43,5 % случаев.
Дополнительная оценка уровня клеток, экспрессирующих маркер ОСК СD44, была обоснована тем, что в ряде исследований прослеживаются связь уровня ЦОК в крови и ОСК в ткани опухоли и, кроме того, общие характеристики этих клеток [17]. О частичной принадлежности ЦОК к опухолевым стволовым клеткам говорят данные литературы [18], подчеркивающие наличие генетических маркеров ОСК у ЦОК при раке ободочной
Список литературы Общая выживаемость больных раком ободочной кишки с различным уровнем циркулирующих опухолевых клеток и возможности повышения его прогностической значимости
- McGranahan N., Swanton C. Clonal Heterogeneity and Tumor Evolution: Past, Present, and the Future. Cell. 2017; 168(4): 613-28. doi: 10.1016/j.cell.2017.01.018.
- De SmedtL., Palmans S., SagaertX. Tumour budding in colorectal cancer: what do we know and what can we do? Virchows Arch. 2016; 468(4): 397-408. doi: 10.1007/s00428-015-1886-5.
- Синянский Л.Е., Вторушин С.В., Паталяк С.В., Афанасьев С.Г. Прогностическая роль молекулярных подтипов рака толстой кишки. Современный взгляд на проблему. Сибирский онкологический журнал. 2021; 20(3): 107-114. [For citation: Sinyansky L.E., Vtorushin S.V., Patalyak S.V., Afanasyev S.G. Prognostic role of molecular subtypes of colon cancer. A current view on the problem. Siberian Journal of Oncology. 2021; 20(3): 107-114. (in Russian)]. doi: 10.21294/1814-4861-2021-203-107-114.
- Сагакянц А.Б. Объединенный иммунологический форум: современные направления развития фундаментальной и прикладной онкоиммунологии (Новосибирск, 2019). Южно-Российский онкологический журнал. 2020; 1(2): 36-45. [SagakyancA.B. United immunological forum: current trends in the development of fundamental and applied oncoimmunology (Novosibirsk, 2019). South Russian Journal of Cancer. 2020; 1(2): 36-45. (in Russian)]. doi:10.37748/2687-0533-2020-1-2-5.
- Tan Y., Wu H. The significant prognostic value of circulating tumor cells in colorectal cancer: A systematic review and meta-analysis. Curr Probl Cancer. 2018; 42(1): 95-106. doi: 10.1016/j. currproblcancer.2017.11.002.
- НепомнящаяЕ.М., Кит О.И., Нистратова О.В., НовиковаИ.А., Никипелова Е.А., Бахтин А.В., Ульянова Е.П., Вострикова Ж.И., Селютина О.Н. Циркулирующие опухолевые клетки и некоторые морфо-иммуногистохимические показатели при колоректальном раке. Современные проблемы науки и образования. 2016; 2: 140. [Nepomnyashchaya E.M., Kit O.I., Nistratova O.V., Novikova I.A., Niki-pelova E.A., Bahtin A.V., Ul'yanova E.P., Vostrikova Zh.I., Selyutina O.N. Circulating tumor cells and some morpho-immunohistochemical parameters in colorectal cancer. Modern Problems of Science and Education. 2016; 2: 140. (in Russian)].
- Veyrune L., Naumann D.N., Christou N. Circulating Tumour Cells as Prognostic Biomarkers in Colorectal Cancer: A Systematic Review. Int J Mol Sci. 2021; 22(8): 3437. doi: 10.3390/ijms22083437.
- NanduriL.K., HissaB., Weitz J., Schölch S., Bork U. The prognostic role of circulating tumor cells in colorectal cancer. Expert Rev Anticancer Ther. 2019; 19(12): 1077-88. doi: 10.1080/14737140.2019.1699065.
- Hinz S., Hendricks A., Wittig A., Schafmayer C., Tepel J., Kalthoff H., Becker T., Röder C. Detection of circulating tumor cells with CK20 RT-PCR is an independent negative prognostic marker in colon cancer patients - a prospective study. BMC Cancer. 2017; 17(1): 53. doi: 10.1186/s12885-016-3035-1.
- Tsai W.S., Chen J.S., Shao H.J., Wu J.C., Lai J.M., Lu S.H., Hung T.F., Chiu Y.C., You J.F., HsiehP.S., Yeh C.Y., HungH.Y., Chiang S.F., Lin G.P., Tang R., Chang Y.C. Circulating Tumor Cell Count Correlates with Colorectal Neoplasm Progression and Is a Prognostic Marker for Distant Metastasis in Non-Metastatic Patients. Sci Rep. 2016; 6: 24517. doi: 10.1038/srep24517.
- Кит О.И., Геворкян Ю.А., Солдаткина Н.В., Новикова И.А., Водолажский Д.И., Шуликов П.Б. Способ прогнозирования метастазирования при раке ободочной кишки. Патент РФ № 2613142. Опубл. 15.03.2017. [Kit O.I., Gevorkyan YU.A., Soldatkina N.V., Novikova I.A., VodolazhskijD.I., ShulikovP.B. Method for predicting metastasis in colon cancer. The patent of the Russian Federation № 2613142. 15.03.2017. (in Russian)].
- Rothe F., MaetensM., Rouas G., PaesmansM., Van den EyndeM., Van Laethem J.L., Vergauwe P., Deboever G., Bareche Y., Vandeputte C., Ignatiadis M., Hendlisz A. CTCs as a prognostic and predictive biomarker for stage II/III Colon Cancer: a companion study to the PePiTA trial. BMC Cancer. 2019; 19(1): 304. doi: 10.1186/s12885-019-5528-1.
- Abdalla T.S.A., Meiners J., Riethdorf S., König A., Melling N., Gorges T., Karstens K.F., Izbicki J.R., Pantel K., Reeh M. Prognostic value of preoperative circulating tumor cells counts in patients with UICC stage I-IV colorectal cancer. PLoS One. 2021; 16(6). doi: 10.1371/journal. pone.0252897.
- Yang C., Shi D., Wang S., Wei C., Zhang C., Xiong B. Prognostic value of pre- and post-operative circulating tumor cells detection in col-orectal cancer patients treated with curative resection: a prospective cohort study based on ISET device. Cancer Manag Res. 2018; 10: 4135-44.doi:10.2147/CMAR.S176575.
- Pan R.J., Hong H.J., Sun J., Yu C.R., Liu H.S., Li P.Y., Zheng M.H. Detection and Clinical Value of Circulating Tumor Cells as an Assisted Prognostic Marker in Colorectal Cancer Patients. Cancer Manag Res. 2021; 13: 4567-78. doi: 10.2147/CMAR.S300554.
- BaekD.H., Kim G.H., Song G.A., Han I.S., ParkE.Y., Kim H.S., Jo H.J., Ko S.H., Park D.Y., Cho Y.K. Clinical Potential of Circulating Tumor Cells in Colorectal Cancer: A Prospective Study. Clin Transl Gastroenterol. 2019; 10(7): e00055. doi: 10.14309/ctg.0000000000000055.
- Grillet F., BayetE., Villeronce O., ZappiaL., LagerqvistE.L., Lunke S., Charafe-JauffretE., Pham K., Molck C., RollandN., Bourgaux J.F., Prud-homme M., Philippe C., Bravo S., Boyer J.C., Canterel-Thouennon L., Taylor G.R., Hsu A., Pascussi J.M., Hollande F., Pannequin J. Circulating tumour cells from patients with colorectal cancer have cancer stem cell hallmarks in ex vivo culture. Gut. 2017; 66(10): 1802-10. doi: 10.1136/ gutjnl-2016-311447.
- Agnoletto C., Corra F., Minotti L., Baldassari F., Crudele F., Cook W.J.J., DiLeva G., d'Adamo A.P., GaspariniP., Volinia S. Heterogeneity in Circulating Tumor Cells: The Relevance of the Stem-Cell Subset. Cancers (Basel). 2019; 11(4): 483. doi: 10.3390/cancers11040483.
- Katoh S., Goi T., Naru.se T., Ueda Y., Kurebayashi H., Nakaza-wa T., Kimura Y., Hirono Y., Yamaguchi A. Cancer stem cell marker in circulating tumor cells: expression of CD44 variant exon 9 is strongly correlated to treatment refractoriness, recurrence and prognosis of human colorectal cancer. Anticancer Res. 2015; 35(1): 239-44.
- Hensler M., VancurovaI., BechtE., Palata O., Strnad P., TesarovaP., Cabihakova M., Svec D., Kubista M., Bartuhkova J., SpisekR., Sojka L.


