Обзор биологической активности флавоноида апигенина: противовоспалительная, противоопухолевая, нейропротекторная и противовирусная
Автор: Биджиева А.Э., Шальнев И.О., Чиряпкин А.С., Кодониди И.П., Глушко А.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 10 т.9, 2023 года.
Бесплатный доступ
Флавоноиды являются обширным классом органических соединений, которые представляют собой вторичные метаболиты растений и высших грибов. С химической точки зрения флавоноиды представляют собой гидроксипроизводные флавона, 2,3-дигидрофлавона изофлавона и 4-фенилкумарина. С давних времен различные части растений рассматривались в качестве источников биологически активных веществ для лечения разнообразных заболеваний и улучшения самочувствия. К одним из наиболее часто встречающихся флавоноидов можно отнести апигенин - 4’,5,7-тригидроксифлавон. Апигенин присутствует главным образом в виде значительного количества гликозилированных веществ в овощах (петрушка, сельдерей, лук), фруктах (апельсины), травах (ромашка, тимьян, орегано, базилик) и напитках на растительной основе (чай, пиво и вино). В данной статье рассмотрены современные результаты исследований противовоспалительной, противоопухолевой, нейропротекторной и противовирусной активности апигенина. Из имеющихся данных следует, что апигенин является перспективной структурой, проявляющей разнообразие виды биологической активности, что позволяет её рассматривать в качестве интересного кандидата для создания на его основе новых лекарственных средств или же для включения этого полифенольного соединения в протоколы комплексного лечения как биологически активной добавки.
Апигенин, флавоноид, фармакологическая мишень, противовоспалительная активность, противоопухолевая активность, нейропротекторная активность, противовирусная активность
Короткий адрес: https://sciup.org/14128638
IDR: 14128638 | УДК: 615.32: | DOI: 10.33619/2414-2948/95/11
Текст обзорной статьи Обзор биологической активности флавоноида апигенина: противовоспалительная, противоопухолевая, нейропротекторная и противовирусная
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 615.32: 547.9
Флавоноиды являются обширным классом полифенольных соединений, которые представляют собой вторичные метаболиты растений и грибов. Эти органические соединения проявляют разнообразные виды биологического действия, что делает их перспективными веществами для разработки на их основе новых лекарственных средств [1, 2]. На данный момент идентифицировано свыше 7000 флавоноидов, и этот список открытых представителей продолжает расти. К одним из наиболее часто встречающихся флавоноидов можно отнести апигенин — 4',5,7-тригидроксифлавон (Рисунок). Апигенин присутствует главным образом в виде значительного количества гликозилированных веществ в овощах (петрушка, сельдерей, лук), фруктах (апельсины), травах (ромашка, тимьян, орегано, базилик) и напитках на растительной основе (чай, пиво и вино) [3]. В связи с его широким представлением в растительном мире и комплексным механизмом реализации спектра биологической активности данный флавоноид можно рассматривать в качестве перспективного соединения для терапии различных заболеваний.
Противовоспалительная активность
Результаты исследования влияния апигенина на воспалительный ответ, индуцированный липополисахаридами, свидетельствуют, что флавоноид значительно ингибирует продукцию провоспалительных цитокинов, таких как интерлейкин-6 (IL-6), интерлейкин-1-бета (IL-1β) и фактор некроза опухоли ‑ альфа (TNF-α), модулируя множественные внутриклеточные сигнальные пути в макрофагах. Апигенин снижает продукцию IL-1β путем ингибирования активации каспазы-1 посредством нарушения сборки инфламмасомы NLRP3. Полифенольное соединение предотвращает продукцию интерлейкина-6 (IL-6) и IL-1β путем снижения стабильности мРНК посредством ингибирования активации сигнального пути ERK1/2. Кроме того, фиксируется выраженное ингибирование TNF-α и IL-1β-индуцированной активации транскрипционного фактора каппа В (NF-κB) [4].
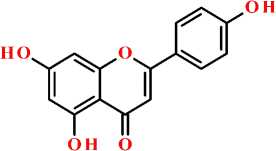
апигенин
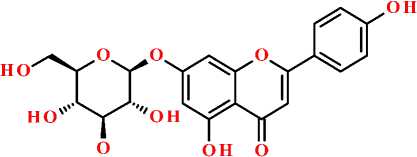
апигенин-7-O-β-D-глюкопиранозид
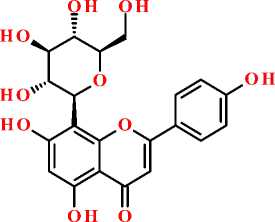
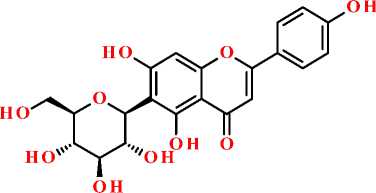
апигенин-8-С-глюкозид (витексин) апигенин-6-С-глюкозид (изовитексин)
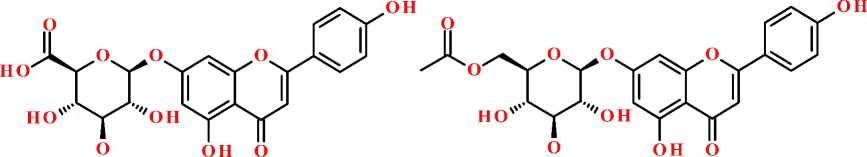
апигенин-7-O-в-D-глюкоронид апигенин-7-O-(6'-O-ацетил-в-D-глюкопиранозид)
Рисунок. Структурная формула апигенина и некоторых его гликозидов
Предварительная обработка апигенином индуцированного полисахаридами воспаления легких значительно индуцирует снижение соотношения влажной массы легких к сухой массе легких у мышей. Наблюдается падение уровня общего количества лейкоцитов и процента нейтрофилов в жидкости бронхоальвеолярного лаважа и IL-6, IL-1β и TNF-α, а также происходит ингибирование экспрессии гена циклооксигеназы-2 (ЦОГ-2) [5]. Апигенин выраженно ингибирует транскрипцию NF-kB, вызванную TNF-α и активностью NF-kB p65. При этом подавление активации NF-kB этими флавоноидом обусловлено ингибированием транскрипционной активации NF-kB [6].
Противоопухолевое действие
Изучалось влияние апигенина на клетки achn786-0 и Caki-1 почечно-клеточной карциномы Установлено, что воздействие флавоноидом вызывает повреждение ДНК, остановку клеточного цикла в фазе G 2 /M, накопление р53 и апоптоз, которые в совокупности подавляют пролиферацию раковых клеток как in vitro , так и in vivo [9].
Апигенин также обладает противоопухолевой активностью против клеток гепатоцеллюлярной карциномы. Он ингибирует рост и индуцирует гибель раковых клеток HepG2. Обработка апигенином увеличивает экспрессию LC3-II и GFP-LC3. Кроме того, флавоноид индуцирует апоптоз и аутофагию посредством ингибирования пути PI3K/Akt/mTOR [10]. Изучался потенциальный химио-сенсибилизирующий эффект апигенина у резистентных к доксорубицину линии клеток гепатоцеллюлярной карциномы BEL-7402/ADM. Флавоноид значительно повышает чувствительность к доксорубицину, индуцирует экспрессию miR-520b и ингибирует ATG7-зависимую аутофагию в этих раковых клетках [11].
При терапии апигенином клеток гепатомы человека HepG2 демонстрировалось снижение жизнеспособности клеток в зависимости от дозы и времени, а также некоторые морфологические изменения. Кроме того, применение апигенина индуцирует генерацию АФК и значительно снижает уровни мРНК и активность каталазы, а также уровни внутриклеточного глутатиона [12]. Апигенин ингибирует рост клеток гепатоцеллюлярной карциномы, влияя на экспрессию транскриптома микроРНК и связанных с ними генов-мишеней [13]. Рассматриваемое полифенольное соединение дозозависимым способом ингибирует пролиферацию, миграцию и инвазию клетками PLC и Bel-7402 гепатоцеллюлярной карциномы человека. Оно снижает экспрессию Snai1 и NF-kB, обращает вспять повышение уровней маркеров эпителиально-мезенхимального перехода (EMT), стимулирует клеточную адгезию, регулирует полимеризацию актина и миграцию клеток [14].
Апигенин индуцирует апоптоз лейкозных клетках человека U937 путем инактивации Akt с сопутствующей активацией JNK, подавлением Mcl-1 и Bcl-2, высвобождением цитохрома c из митохондрий и активацией каспаз. Прерывание пути JNK показало заметное снижение индуцируемой апигенином активации каспазы и апоптоза в лейкозных клетках [15].
Флавоноид в зависимости от дозы и времени подавляет пролиферацию и клоногенную выживаемость клеточных линий рака молочной железы человека T47D и MDA-MB-231. Гибель клеток T47D и MDA-MB-231 была вызвана апоптозом, связанным с повышенным уровнем каспазы-3, расщеплением поли(АДФ-рибоза)полимеразы (PARP) и соотношениями Bax/Bcl-2 [16]. Противоопухолевое и противоинвазивное действие апигенина на карциному MDA-MB-231 молочной железы человека реализуется также через подавление экспрессии IL-6. Блокада экспрессии IL-6 снижала уровни фосфорилированного преобразователя сигнала и активатора транскрипции 3 (pSTAT3), фосфатидилинозитол-4,5-бисфосфат-3-киназы (PI3K), фосфорилированной протеинкиназы B (pAkt) и молекул, связанных с клеточным циклом, включая циклинзависимые киназы (CDK) [17]. Апигенин индуцирует апоптоз по внешнему пути, индуцирует р53 и ингибирует передачу сигналов STAT3 и NFkB в HER2-сверхэкспрессирующих клетках рака молочной железы [18]. Флавоноид индуцирует апоптоз, повреждение ДНК и окислительный стресс в клетках рака молочной железы человека MCF-7 и MDA-MB-231 [19].
Апигенин эффективно подавляет пролиферацию клеток меланомы человека in vitro . Он ингибирует миграцию и инвазию клеток, индуцирует остановку фазы G 2 /M и апоптоз клеток.
Кроме того, апигенин способствует активации расщепленной каспазы-3 и расщепленных белков PARP и снижает экспрессию фосфорилированных (p)-ERK1/2 белков, p-AKT и p-mTOR [20]. Апигенин ограничивает рост меланомы с помощью множества механизмов, среди которых подавление экспрессии PD-L1, что оказывает двойной эффект посредством регуляции как опухолевых, так и антигенпредставляющих клеток [21].
Результаты показывают, что апигенин ингибирует жизнеспособность клеток папиллярного рака щитовидной железы BCPAP путем стимуляции выработки АФК, индукции повреждения ДНК, что приводит к остановке клеточного цикла G 2 /M через понижающую регуляцию экспрессии Cdc25C с последующей гибелью аутофагических клеток [22].
Исследования на мышиной модели ксенотрансплантата показывают, что питание апигенином подавляет рост опухоли предстательной железы, снижает пролиферацию и усиливает апоптоз. Эти эффекты коррелировали дозозависимым образом с ингибированием p-IKKa, NF-ĸB/p65, ядерными антиген пролиферирующими клетками и увеличением экспрессии расщепленной каспазы-3 [23]. Апигенин повышает чувствительность человеческих стволовых клеток рака предстательной железы CD44+ к терапии цисплатином [24]. Флавоноид ингибирует канцерогенез в клетках рака предстательной железы человека PC3-M и LNCaP C4-2B путем модуляции TGF-β-активируемых путей, связанных с прогрессированием рака и его метастазированием, в частности путей Smad2/3 и Src/ FAK /Akt [25].
Апигенин вызывает апоптоз и аутофагию в клетках рака толстой кишки HCT116. Он подавляет экспрессию как циклина B 1 , так и его активирующих структур Cdc2 и Cdc25c. Происходит экспрессия ингибиторов клеточного цикла, таких как p53 и p53-зависимого пути p21Cip1/WAF1. При этом индуцируется расщепление поли(АДФ-рибоза)полимеразы и снижение уровни прокаспазы-3, -8 и -9 [26]. Флавоноид значительно подавляет пролиферацию, миграцию, инвазию клеток колоректального рака и рост органоидов путем ингибирования сигнального пути Wnt/β-катенин [27]. Терапия апигенином приводит к остановке клеточного цикла через активацию каскада каспаз и стимуляцию апоптоза в клетках HT29 рака толстого кишечника. При этом применение флавоноида усиливает терапевтический эффект 5-фторурацила [28]. Апигенин может ингибировать эпителиальномезенхимальный переход, миграцию и инвазию клеток рака толстой кишки человека in vitro и in vivo по пути NF-kB /Snail [29]. Было обнаружено, что противоопухолевая активность апигенина в отношении клеток рака толстой кишки HT-29 обусловлена индукцией аутофагии и апоптоза через ингибирование сигнального пути m-TOR/PI3K/AKT в резистентных к цисплатину клетках рака толстой кишки [30].
Флавоноид снижает выживаемость и миграцию CD44+ стволовых клеток рака предстательной железы посредством передачи сигналов PI3K/Akt/NF-kB [31]. Апигенин можно рассматривать в качестве ингибитора белков апоптоза и ответственных за взаимодействие с Ku70–Bax, что сопровождается индукцией апоптоза в клетках рака предстательной железы и в модели ксенотрансплантата athymic nude на мышах [32]. Апигенин обладает потенциалом ингибирования IKK-β-опосредованной активации NF-kB и является в связи с этим ценным средством для лечения рака поджелудочной железы [33].
Нейропротекторная активность
Использование апигенина на крысах с моделью повреждения спинного мозга способствует значительному увеличению показателей по локомоторной рейтинговой шкалы
Бассо Битти Бреснахана. Обращалось вспять снижение активности супероксиддисмутазы и глутатионпероксидазы и фиксировалось повышение уровня малонового диальдегида, что указывает на его антиоксидантную роль в ответ на травму. Кроме того, лечение апигенином снижает высвобождение сывороточного IL-1β, TNF-α и молекулы межклеточной адгезии-1. Изменяется уровень экспрессии связанных с апоптозом генов Bax, Bcl-2 и каспазы-3. Данный комплекс механизмов опосредует восстановление функций нейронов крыс, что обуславливает нейропротекторный эффект [34].
Апигенин способен защищать нейроны при болезни Альцгеймера, индуцированной плюрипотентными стволовыми клетками человека, несколькими способами: уменьшая частоту спонтанных сигналов Ca2+ и снижая апоптоз, опосредованный каспазой-3 и -7. Эти данные демонстрируют широкое нейропротекторное действие апигенина против патогенеза болезни Альцгеймера на модели заболевания человека [35]. Данный флавоноид помимо снижения воспалительных агентов способен индуцировать увеличение экспрессии нейротрофического фактора головного мозга (BDNF), эффект которого может быть связан с противовоспалительным и нейропротекторным эффектами [36].
Апигенин оказывает нейропротекторное действие против дегенерации периферических нервов в соответствии с четырьмя ключевыми проявлениями: деградацией аксонов, фрагментацией миелина, трансдедифференцировкой и пролиферацией шванновских клеток посредством Krox20 и внеклеточных сигнально-регулируемых киназно-независимых процессов [37]. Флавоноид ослабляет повреждение нейронов, вызванное кислородной и глюкозной депривацией/реперфузией в дифференцированных клетках PC12, главным образом, благодаря своим антиапоптозным и антиоксидантным свойствам, влияя на экспрессию Nrf2 и P53 и транскрипцию их нижестоящих генов-мишеней [38].
Введение апигенина может значительно облегчить протекание черепно-мозговой травмы (включая неврологический дефицит, отек мозга, проницаемость гематоэнцефалического барьера и апоптоз клеток коры головного мозга) после субарахноидального кровоизлияния у крыс. Между тем, лечение флавоноидом снижало уровень АФК и концентрацию малонового диальдегида и миелопероксидазы, повышало соотношение глутатиона и окисленного глутатиона, а также увеличивало количество супероксиддисмутазы и перекиси водорода в коре головного мозга через 24 часа после субарахноидального кровоизлияния. Более того, применение данного полифенольного соединения ингибировало экспрессию Bax и каспазы-3, что выраженно снижает апоптоз нейронов [39]. Апигенин защищает гематоэнцефалический барьер и улучшает раннее повреждение головного мозга путем ингибирования TLR4-опосредованного воспалительного пути у крыс с субарахноидальным кровоизлиянием, а также за счет ингибирования NF-κB и их нижестоящих провоспалительных цитокинов в коре головного мозга и путем усиления регуляции экспрессии белков плотного соединения гематоэнцефалического барьера [40].
Длительное лечение апигенином уменьшает количество микроглии Iba-1+ в гиппокампе мышей GFAP-IL6 и изменяет морфологию микроглии, что полезно при возрастном нейродегенеративном заболевании [41]. Улучшающий эффект апигенина при когнитивных нарушениях после церебральной ишемии и реперфузионного повреждения может включать множество механизмов, таких как ингибирование гистондеацетилазы, индукция экспрессии BDNF и Syn-I и регуляция ацетилирования гистонов [42]. Введение апигенина ослабляет гистопатологические изменения в тканях мозга, индуцированные 1-метил-4-фенил-1,2,3,6-тетрагидропиридином. Кроме того, апигенин способен обращать вспять изменения в экспрессии и концентрации TNF-α, IL-1β, IL-6, IL-10 и TGF-β. Это исследование предполагает, что апигенин может быть использован в качестве нейропротекторного средства для ослабления нейровоспаления при болезни Паркинсона [43].
Противовирусная активность
Апигенин, ингибируя формирование подмножества микроРНК, подавляет репликацию вируса гепатита С in vitro . Он снижает уровни экспрессии зрелой miR122, существенно не влияя на рост клеток. Ингибирующее действие апигенина на репликацию вируса гепатита С зависит от снижения уровней экспрессии зрелой miR122 посредством ингибирования фосфорилирования TRBP [44]. Флавоноид обладает противовирусной активностью против вирус африканской чумы свиней. Ингибирует синтез специфического белка вируса и формирование вирусной частицы, что наиболее выраженно на ранней стадии заражения [45].
Апигенин ингибирует энтеровирусную инфекцию 71 (EV71) путем нарушения ассоциации вирусной РНК с транс-действующими факторами. Он предотвращает ассоциацию РНК EV71 с белками hnRNP A 1 и A 2 . Соответственно, подавление экспрессии hnRNP A 1 и A 2 заметно снижет активность инфекции EV71 [46]. Также апигенин ингибирует репликацию энтеровируса 71, подавляя вирусную активность IRES и модулируя клеточный путь JNK [47].
Флавоноид ингибирует реактивацию вируса Эпштейна-Барр путем подавления промоторной активности двух вирусных генов Zta и Rta, что позволяет предположить, что апигенин является потенциальным соединением для предотвращения реактивации вируса [48]. Апигенин ингибирует синтез вирусной ДНК, мРНК и белков вируса буйволиной оспы, не влияя на другие этапы ж изненного цикла вируса, такие как прикрепление, проникновение и отпочкование [49]. Полифенольное соединение может служить многообещающим веществом для комплексного лечению гриппа A, поскольку оно защищает клетки от гибели и ингибирует активность вирусной нейраминидазы, что важно для подавления репликации вируса [50].
Таким образом, апигенин является перспективным флавоноидом, который способен оказывать разнообразие виды биологической активности, например, противовоспалительную, противоопухолевую, нейропротекторную и противовирусную, что позволяет его рассматривать в качестве интересного кандидата для создания на его основе новых лекарственных средств или же для включения этого полифенольного соединения в протоколы комплексного лечения различных заболеваний как биологически активной добавки.
Список литературы Обзор биологической активности флавоноида апигенина: противовоспалительная, противоопухолевая, нейропротекторная и противовирусная
- Чиряпкин А. С., Золотых Д. С., Поздняков Д. И. Обзор биологической активности флавоноидов: кверцетина и кемпферола // Juvenis scientia. 2023. Т. 9. №2. С. 5-20. https://doi.org/10.32415/jscientia_2023_9_2_5-20
- Биджиева А. Э., Чиряпкин А. С. Обзор биологической активности рутина: противодиабетическая, антиоксидантная, противовоспалительная и противоопухолевая // Бюллетень науки и практики. 2023. Т. 9. №8. С. 48-57. https://doi.org/10.33619/2414-2948/93/05
- Sung B., Chung H. Y., Kim N. D. Role of Apigenin in Cancer Prevention via the Induction of Apoptosis and Autophagy // J Cancer Prev. 2016. V. 21. P. 216-226. https://doi.org/10.15430/JCP.2016.21.4.216
- Zhang X., Wang G., Gurley E. C., Zhou H. Flavonoid Apigenin Inhibits Lipopolysaccharide-Induced Inflammatory Response through Multiple Mechanisms in Macrophages // PLoS ONE. 2014. V. 9. №9. P. e107072. https://doi.org/10.1371/journal.pone.0107072
- Wang J., Liu Y. T., Xiao L., Zhu L., Wang Q., Yan T. Anti-Inflammatory Effects of Apigenin in Lipopolysaccharide-Induced Inflammatory in Acute Lung Injury by Suppressing COX-2 and NF-kB Pathway // Inflammation. 2014. V. 37. P. 2085-2090. https://doi.org/10.1007/s10753-014-9942-x
- Funakoshi-Tago M., Nakamura K., Tago K., Mashino T., Kasahara T. Anti-inflammatory activity of structurally related flavonoids, Apigenin, Luteolin and Fisetin // International Immunopharmacology. 2011. V. 11. №9. P. 1150-1159 https://doi.org/10.1016/j.intimp.2011.03.012
- Wang Y.-C., Huang K.-M. In vitro anti-inflammatory effect of apigenin in the Helicobacter pylori-infected gastric adenocarcinoma cells // Food and Chemical Toxicology. 2013. V. 53. P. 376-383. https://doi.org/10.1016/j.fct.2012.12.018
- Patil R. H., Babu R. L., Naveen Kumar M., Kiran Kumar K. M., Hegde S. M., Nagesh R., Ramesh G. T., Sharma S. C. Anti-Inflammatory Effect of Apigenin on LPS-Induced Pro- Inflammatory Mediators and AP-1 Factors in Human Lung Epithelial Cells // Inflammation. 2015. V. 39. №1. P. 138-147. https://doi.org/10.1007/s10753-015-0232-z
- Men S., Zhu Y., Li J. F., Wang X., Liang Z., Li S. Q., Xu X., Chen H., Liu B., Zheng X. Y., Xie L P. Apigenin inhibits renal cell carcinoma cell proliferation // Oncotarget. 2017. V. 8. №12. P. 19834-19842. https://doi.org/10.18632/oncotarget.15771
- Yang J., Pi C., Wang G. Inhibition of PI3K/Akt/mTOR pathway by apigenin induces apoptosis and autophagy in hepatocellular carcinoma cells // Biomedicine & Pharmacotherapy. 2018. V. 103. P. 699-707. https://doi.org/10.1016/j.biopha.2018.04.072
- Gao A.-M., Zhang X.-Y., Hu J.-N., Ke Z.-P. Apigenin sensitizes hepatocellular carcinoma cells to doxorubicin through regulating miR-520b/ATG7 axis // Chemico-Biological Interactions. 2018. V. 280. P. 45-50. https://doi.org/10.1016/j.cbi.2017.11.020
- Zhang W., Gao J., Lu L., Bold T., Li X., Wang S., Chang Z., Chen J., Kong X., Zheng Y., Zhang M., Tang J. Intracellular GSH/GST antioxidants system change as an earlier biomarker for toxicity evaluation of iron oxide nanoparticles // NanoImpact. 2021. V. 23. P. 100338. https://doi.org/10.1016/j.impact.2021.100338
- Wang S.-M., Yang P.-W., Feng X.-J., Zhu Y.-W., Qiu F.-J., Hu X.-D., Zhang S.-H. Apigenin Inhibits the Growth of Hepatocellular Carcinoma Cells by Affecting the Expression of microRNA Transcriptome // Front. Oncol. 2021. V. 11. P. 657665. https://doi.org/10.3389/fonc.2021.657665
- Qin Y., Zhao D., Zhou H., Wang X., Zhong W., Chen S., Gu W., Wang W., Zhang C., Liu Y., Liu H., Zhang Q., Guo T., Sun T., Yang C. Apigenin inhibits NF-κB and Snail signaling, EMT and metastasis in human hepatocellular carcinoma // Oncotarget. 2016. V. 7. №27. https://doi.org/10.18632/oncotarget.9404
- Budhraja A., Gao N., Zhang Z., Song Y.-O., Cheng S., Wang X., Ding S., Hitron A., Chen G. Luo J., Shi X. Apigenin Induces Apoptosis in Human Leukemia Cells and Exhibits Anti- Leukemic Activity In Vivo // Molecular Cancer Therapeutics. 2011. V. 11. №1. P. 132-142. https://doi.org/10.1158/1535-7163.mct-11-0343
- Cao X., Liu B., Cao W., Zhang W., Zhang F., Zhao H., Meng R., Zhang L., Niu R., Hao X., Zhang B. Autophagy inhibition enhances apigenin-induced apoptosis in human breast cancer cells // Chin J Cancer Res. 2013. V. 25. №2. P. 212-222. https://doi.org/10.3978/j.issn.1000-9604.2013.04.01
- Lee H. H., Jung J., Moon A., Kang H., Cho H. Antitumor and Anti-Invasive Effect of Apigenin on Human Breast Carcinoma through Suppression of IL-6 Expression // International Journal of Molecular Sciences. 2019. V. 20. №13. P. 3143. https://doi.org/10.3390/ijms20133143
- Seo H.-S., Choi H.-S., Kim S.-R., Choi Y. K., Woo S.-M., Shin I., Woo J.-K., Park S.-Y., Shin Y. C., Ko S.-K. Apigenin induces apoptosis via extrinsic pathway, inducing p53 and inhibiting STAT3 and NFκB signaling in HER2-overexpressing breast cancer cells // Molecular and Cellular Biochemistry. 2012. V. 366. №1-2. P. 319-334. https://doi.org/10.1007/s11010-012-1310-2
- Vrhovac Madunić I., Madunić J., Antunović M., Paradžik M., Garaj-Vrhovac V., Breljak D., Marijanović I., Gajski G. Apigenin, a dietary flavonoid, induces apoptosis, DNA damage, and oxidative stress in human breast cancer MCF-7 and MDA MB-231 cells // Naunyn-Schmiedeberg’s Archives of Pharmacology. 2018. V. 391. №5. P. 537-550. https://doi.org/10.1007/s00210-018-1486-4
- Zhao G., Han X., Cheng W., Ni J., Zhang Y., Lin J., Song Z. Apigenin inhibits proliferation and invasion, and induces apoptosis and cell cycle arrest in human melanoma cells // Oncology Reports. 2017. V. 37. №4. P. 2277-2285. https://doi.org/10.3892/or.2017.5450
- Xu L., Zhang Y., Tian K., Chen X., Zhang R., Mu X., Wu Y., Wang D., Wang S., Liu F., Wang T., Zhang J., Liu S., Zhang Y., Tu C., Liu H. Apigenin suppresses PD-L1 expression in melanoma and host dendritic cells to elicit synergistic therapeutic effects // Journal of Experimental & Clinical Cancer Research. 2018. V. 37. №1. https://doi.org/10.1186/s13046-018-0929-6
- Zhang L., Cheng X., Gao Y., Zheng J., Xu Q., Sun Y., Guan H., Yu H., Sun Z. Apigenin induces autophagic cell death in human papillary thyroid carcinoma BCPAP cells // Food & Function. 2015. V. 6. №11. P. 3464-3472. https://doi.org/10.1039/c5fo00671f
- Shukla S., Kanwal R., Shankar E., Datt M., Chance M. R., Fu P., MacLennan G. T., Gupta S. Apigenin blocks IKKα activation and suppresses prostate cancer progression // Oncotarget. 2015. V. 6. P. 31216-31232. https://doi.org/10.18632/oncotarget.5157
- Erdogan S., Turkekul K., Serttas R., Erdogan Z. The natural flavonoid apigenin sensitizes human CD44 + prostate cancer stem cells to cisplatin therapy // Biomedicine & Pharmacotherapy. 2017. V. 88. P. 210-217. https://doi.org/10.1016/j.biopha.2017.01.056
- Mirzoeva S., Franzen C. A., Pelling J. C. Apigenin inhibits TGF-β-induced VEGF expression in human prostate carcinoma cells via a Smad2/3- and Src-dependent mechanism //Molecular Carcinogenesis. 2014. V. 53. №8. P. 598-609. https://doi.org/10.1002/mc.22005
- Lee Y., Sung B., Kang Y. J., Kim D. H., Jung J. Y., Hwang S. Y., Kim M., Kim H. S., Yoon J. H., Chung H. Y., Kim N. D. Apigenin-induced apoptosis is enhanced by inhibition of autophagy formation in HCT116 human colon cancer cells // Int J Oncol. 2014. V. 44. №5. P. 1599-606. https://doi.org/1010.3892/ijo.2014.2339
- Xu M., Wang S., Song Y., Yao J., Huang K., Zhu X. Apigenin suppresses colorectal cancer cell proliferation, migration and invasion via inhibition of the Wnt/β-catenin signaling pathway // Oncology Letters. 2016. V. 11. P. 3075-3080. https://doi.org/10.3892/ol.2016.4331
- Turktekin M., Konac E., One H. I., Alpha E., Yilmaz A., Menevse S. Evaluation of the Effects of the Flavonoid Apigenin on Apoptotic Pathway Gene Expression on the Colon Cancer Cell Line (HT29) // Journal of Medicinal Food. 2011. V. 14. №10. P. 1107-1117. https://doi.org/10.1089/jmf.2010.0208
- Tong J., Shen Y., Zhang Z., Hu Y., Zhang X., Han L. Apigenin inhibits epithelialmesenchymal transition of human colon cancer cells through NF-κB/Snail signaling pathway // Bioscience Reports. 2019. V. 39. №5. P. BSR20190452. https://doi.org/10.1042/bsr20190452
- Chen X., Xu H., Yu X., Wang X., Zhu X., Xu X. Apigenin inhibits in vitro and in vivo tumorigenesis in cisplatin-resistant colon cancer cells by inducing autophagy, programmed cell death and targeting m-TOR/PI3K/Akt signalling pathway // J BUON. 2019. V. 24. №2. P. 488-493
- Erdogan S., Doganlar O., Doganlar Z. B., Serttas R., Turkekul K., Dibirdik I., Bilir A. The flavonoid apigenin reduces prostate cancer CD44 + stem cell survival and migration through PI3K/Akt/NF-κB signaling // Life Sciences. 2016. V. 162. P. 77-86. https://doi.org/10.1016/j.lfs.2016.08.019
- Shukla S., Fu P., Gupta S. Apigenin induces apoptosis by targeting inhibitor of apoptosis proteins and Ku70–Bax interaction in prostate cancer // Apoptosis. 2014. V. 19. №5. P. 883–894. https://doi.org/10.1007/s10495-014-0971-6
- Wu D. G., Yu P., Li J. W., Jiang P., Sun J., Wang H. Z., Zhang L. D., Wen M. B., Bie P. Apigenin potentiates the growth inhibitory effects by IKK-β-mediated NF-κB activation in pancreatic cancer cells // Toxicol Lett. 2014. V. 224. №1. P. 157-64. https://doi.org/10.1016/j.toxlet.2013.10.007
- Zhang F., Li F., Chen G. Neuroprotective effect of apigenin in rats after contusive spinal cord injury // Neurological Sciences. 2013. V. 35. №4. P. 583-588. https://doi.org/10.1007/s10072-013-1566-7
- Balez R., Steiner N., Engel M., Sanz Munoz S., Lum J. S., Wu Y., Wang D., Vallotton P., Sachdev P., O'Connor M., Sidhu K., Münch G., Ooi L. Neuroprotective effects of apigenin against inflammation, neuronal excitability and apoptosis in an induced pluripotent stem cell model of Alzheimer’s disease // Scientific Reports. 2016. V. 6. №4. P. 31450-1–31450-11. https://doi.org/10.1038/srep31450
- Dourado N. S., Souza C. D. S., de Almeida M. M. A., Bispo da Silva A., Dos Santos B. L., Silva V. D. A., De Assis A. M., da Silva J. S., Souza D. O., Costa M. F. D., Butt A. M., Costa S. L. Neuroimmunomodulatory and Neuroprotective Effects of the Flavonoid Apigenin in in vitro Models of Neuroinflammation Associated With Alzheimer's Disease // Front Aging Neurosci. 2020. V. 15. №12. P. 119. https://doi.org/10.3389/fnagi.2020.00119
- Kim M., Jung J., Jeong N. Y., Chung H.-J. The natural plant flavonoid apigenin is a strong antioxidant that effectively delays peripheral neurodegenerative processes // Anatomical Science International. 2019. V. 94. P. 285-294. https://doi.org/10.1007/s12565-019-00486-2
- Guo H., Kong S., Chen W., Dai Z., Lin T., Su J., Li S., Xie Q., Su Z., Xu Y., Lai X. Apigenin mediated protection of OGD-evoked neuron-like injury in differentiated PC12 cells // Neurochem Res. 2014. V. 39. №11. P. 2197-210. https://doi.org/10.1007/s11064-014-1421-0
- Han Y., Zhang T., Su J., Zhao Y., Chenchen, Wang, Li X. Apigenin attenuates oxidative stress and neuronal apoptosis in early brain injury following subarachnoid hemorrhage // Journal of Clinical Neuroscience. 2017. V. 40. P. 157-162. https://doi.org/10.1016/j.jocn.2017.03.003
- Zhang T., Su J., Guo B., Wang K., Li X., Liang G. Apigenin protects blood–brain barrier and ameliorates early brain injury by inhibiting TLR4-mediated inflammatory pathway in subarachnoid hemorrhage rats // International Immunopharmacology. 2015. V. 28. №1. P. 79-87. https://doi.org/10.1016/j.intimp.2015.05.024
- Chesworth R., Gamage R., Ullah F., Sonego S., Millington C., Fernandez A., Liang H., Karl T., Münch G., Niedermayer G., Gyengesi E. Spatial Memory and Microglia Activation in a Mouse Model of Chronic Neuroinflammation and the Anti-inflammatory Effects of Apigenin // Front Neurosci. 2021. V. 30. №15. P. 699329. https://doi.org/10.3389/fnins.2021.699329
- Tu F., Pang Q., Huang T., Zhao Y., Liu M., Chen X. Apigenin Ameliorates Post-Stroke Cognitive Deficits in Rats Through Histone Acetylation-Mediated Neurochemical Alterations // Medical Science Monitor. 2017. V. 23. P. 4004-4013. https://doi.org/10.12659/msm.902770
- Yarim G. F., Kazak F., Yarim M., Sozmen M., Genc B., Ertekin A., Gokceoglu A. Apigenin alleviates neuroinflammation in a mouse model of Parkinson's disease // Int J Neurosci. 2022. V. 26. P. 1-10. https://doi.org/10.1080/00207454.2022.2089136
- Shibata C., Ohno M., Otsuka M., Kishikawa T., Goto K., Muroyama R., Kato N., Yoshikawa T., Takata A., Koike K. The flavonoid apigenin inhibits hepatitis C virus replication by decreasing mature microRNA 122 levels // Virology. 2014. V. 462-463. P. 42-48. https://doi.org/10.1016/j.virol.2014.05.024
- Hakobyan A., Arabyan E., Avetisyan A., Abroyan L., Hakobyan L., Zakaryan H. Apigenin inhibits African swine fever virus infection in vitro // Archives of Virology. 2016. V. 161. №12. P. 3445–3453. https://doi.org/10.1007/s00705-016-3061-y
- Zhang W., Qiao H., Lv Y., Wang J., Chen X., Hou Y., Tan R., Li E. Apigenin inhibits enterovirus-71 infection by disrupting viral RNA association with trans-acting factors // PLoS One. 2014. V.16. №9(10). P. e110429. https://doi.org/10.1371/journal.pone.0110429
- Lv X., Qiu M., Chen D., Zheng N., Jin Y., Wu Z. Apigenin inhibits enterovirus 71 replication through suppressing viral IRES activity and modulating cellular JNK pathway // Antiviral Research. 2014. V. 109. P. 30-41. https://doi.org/10.1016/j.antiviral.2014.06.004
- Wu C., Fang C., Cheng Y., Hsu H., Chou S. P., Huang S., Tsai C., Chen J. Inhibition of Epstein-Barr virus reactivation by the flavonoid apigenin // Journal of Biomedical Science. 2017. V. 24. https://doi.org/10.1186/s12929-016-0313-9
- Khandelwal N., Chander Y., Kumar R., Riyesh T., Dedar R. K., Kumar M., Gulati B. R., Sharma S., Tripathi B. N., Barua S., Kumar N. Antiviral activity of Apigenin against buffalopox: Novel mechanistic insights and drug-resistance considerations // Antiviral Res. 2020. V. 181. P. 104870. https://doi.org/10.1016/j.antiviral.2020.104870
- Xu X., Miao J., Shao Q., Gao Y., Hong L. Apigenin suppresses influenza A virus&induced RIG&I activation and viral replication // Journal of Medical Virology. 2020. V. 92. №12. P. 3057-3066. https://doi.org/10.1002/jmv.26403


