Обзор биологической активности рутина: противодиабетическая, антиоксидантная, противовоспалительная и противоопухолевая
Автор: Биджиева А.Э., Чиряпкин А.С.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 8 т.9, 2023 года.
Бесплатный доступ
Различные части растений с давних времен находят широкое применение для терапии и профилактики заболеваний. Они являются ценным источником биологически активных соединений, особенно они богаты полифенольными структурами. Рутин относится к группе одних из наиболее встречающихся флавоноидов в растительных объектах. Животные организмы не имеют ферментных систем для его синтеза, поэтому он поступает в организм человека только с растительной пищей. Рутин широко используется в качестве компонента в растительных лекарственных средствах, поливитаминных препаратах, в косметологической, пищевой и химической промышленности. В данной статье рассматривается биологическая активность рутина, а именно противодиабетическая, антиоксидантная, противовоспалительная и противоопухолевая активность. В статье обобщены современные данные об указанных выше видах биологической активности. Из представленных результатов исследований следует, что рутин является многообещающим соединением с мультитаргетной активностью для лечения различных заболеваний. Он может послужить основой для создания на его базе новых высокоэффективных фармакологических молекул.
Рутин, флавоноид, противодиабетическая активность, антиоксидантная активность, противовоспалительная активность, противоопухолевая активность
Короткий адрес: https://sciup.org/14128691
IDR: 14128691 | УДК: 615.32: | DOI: 10.33619/2414-2948/93/05
Текст обзорной статьи Обзор биологической активности рутина: противодиабетическая, антиоксидантная, противовоспалительная и противоопухолевая
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 615.32: 547.9
Рутин (рутозид, кверцетин-3-О-рутинозид) является флавоноидом, который представляет собой гликозид кверцетина и относится к витаминам группы Р. Данное полифенольное соединение (рисунок 1) встречается во многих растениях и попадает в организм человека только с растительными продуктами питания, так как живые организмы не имеют ферментных систем для его синтеза [1]. Полифенольные соединения обладают широким спектром биологической активности, что обуславливает высокую их перспективность в качестве лекарственных средств или же биологически активных добавок для комплексного лечения различных заболеваний [2].
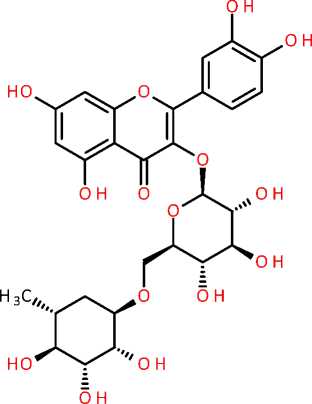
Рисунок. Структурная формула рутина
Противодиабетическая активность. Оценивалось влияние рутина на биохимические параметры стрептозотоцин-индуцированного диабета у крыс самцов линии Wistar. В ходе исследования установлено, что рутин предотвращает изменения активности аспартатаминотрансферазы, аспартатаминотрансферазы и аланинамино-трансферазы в сыворотке крови, а также в сыворотке печени и сердца. Фиксировалось значительное снижение уровня триацилглицеринов в печени и сердце и повышение уровня гликогена. Эти результаты свидетельствуют о том, что рутин может снижать гипергликемию и дислипидемию при одновременном замедлении прогрессирования дисфункции печени и сердца у крыс с диабетом [3].
Также у индуцированных стрептозотоцином крыс с диабетом линии Wistar при пероральном введение рутина наблюдается статистически достоверное снижение уровня глюкозы натощак в плазме крови, гликозилированного гемоглобина и повышение уровня инсулина, С-пептида, гемоглобина и белка [4].
В механизмах реализации флавоноидом антигипергликемического действия лежат различные ферментные и рецепторные пути [5].
Так, установлено, что рутин способствует снижению всасывания глюкозы из тонкого кишечника за счет ингибирования α-глюкозидазы и α-амилазы, которые участвуют в процессах расщепления углеводов [6].
При введении рутина помимо снижения уровня глюкозы в крови и повышения концентрации инсулина наблюдается расширение островков Лангерганса поджелудочной железы и уменьшение их жировой инфильтрации, что важно для защиты и восстановления органа, участвующего в углеводном обмене [7]. Применение рутина способствует снижению уровня провоспалительных цитокинов (IL-6 и TNF-α), что благотворно сказывается на углеводном обмене в тканях и присущих при диабете воспалительных процессах [8]. Рутин значительно снижает уровни помимо глюкозы в крови, креатин, азот мочевину крови, белок мочи, интенсивность окислительного стресса и p-Smad 7. Фиксируется снижение концентрации конечных продуктов повышенного гликозилирования. Ингибируется экспрессия коллагена IV и ламинина, фактора роста соединительной ткани и трансформирующего фактора роста-β1 [9].
Имеются данные, что рутин улучшает концентрацию общего холестерина в сыворотке крови, липопротеинов низкой и высокой плотности, триглицеридов, фактора некроза опухоли α, интерлейкина-6 и сывороточного инсулина у мышей с диабетом. Помимо этого, он оказывает противодиабетическое действие за счет возможного регулирования дисбиоз кишечной микрофлоры [10].
Имеются данные, которые свидетельствуют о способности рутина улучшать диабетическую нефропатию в результате снижения уровня глюкозы в плазме и уменьшения окислительного стресса через сигнальный путь Nrf2 у крыс. Также в ходе эксперимента фиксировалось восстановление скорости нервной проводимости. Эти данные позволяют рассматривать данное полифенольное соединение для комплексного лечения диабетической нейропатии [11].
Антиоксидантная активность. Jianxiong Yang с соавторами проводили комплексное исследование антиоксидантной активности рутина: общую антиоксидантную активность и восстанавливающую способность, анализ на удаление гидроксильных радикалов, анализ на удаление супероксидных радикалов, анализ на удаление радикалов 1,1-дифенил-2-пикрилгидразила и анализ на перекисное окисление липидов, в котором в качестве источника богатого липидами используется яичный желток. В результате была установлена выраженная антиоксидантная активность в отношении различных антиоксидантных систем in vitro, которая зависела от концентрации флавоноида [12].
Установлено, что рутин может стимулировать ферментную активность миелопероксидазы и глутатионпероксидазы, что помимо антирадикального эффекта оказывает еще и гастропротекторный эффект [13]. Флавоноид ингибирует индуцируемую синтазу оксида азота и перекисное окисление липидов в дорсальном роге спинного мозга [14].
Рутин может ингибировать как NADPH-, так и CCl 4 -зависимое микросомальное перекисное окисление липидов, при этом флавоноид являются более эффективным поглотителем анион-радикалов кислорода, чем аскорбиновая кислота [15].
Осуществлялись исследования антиоксидантной активности рутина и кверцетина на многоклеточном модельном организме Caenorhabditis elegans. Полученные данные свидетельствуют о том, что оба флавоноида снижали накопление активных форм кислорода при тепловом стрессе и степень индуцированного окислительного стресса [16].
Установлен защитный эффект рутина на экспрессию генов антиоксидантов у гиперхолэстролемических самцов крысы Westar. Его применение значительно снижало уровень трансфераз, пероксидаз и других ферментов, участвующих в путях окислительного стресса [17].
Противовоспалительная активность. Приводятся результаты исследования, согласно которым рутин выраженно ингибирует высвобождение HMGB1 (high-mobility group protein B1, является цитокиновым медиатором воспаления), снижает HMGB1-зависимые воспалительные реакции в эндотелиальных клетках человека и ингибирует HMGB1-опосредованную гиперпроницаемость и миграцию лейкоцитов у мышей. Также флавоноид подавляет выработку фактора некроза опухоли-α, интерлейкина 6, активацию ядерного фактора-kB и внеклеточно регулируемых киназ 1/2 HMGB1 [18].
Установлено на крысах, что рутин может ингибировать циклооксигеназы-1 и 2 и 15-липоксигеназы-липоксигеназы [19].
Рутин снижает воспалительные процессы в индуцированном отеке лапы крысы с использованием 1%-ного λ-каррагинана и подавляет хемотаксис полиморфноядерных нейтрофилов к fMet-Leu-Phe, что свидетельствует о его противовоспалительном эффекте [20]. Данное полифенольное соединение снижает продукцию NO и TNF-α нейтрофилами периферической крови человека по сравнению с клетками, контролируемыми форболом 12-миристат-13-ацетатом, а также ингибирует активность миелопероксидазы [21].
Флавоноид способен снижать вызванное бусульфаном увеличение концентрации оксида азота, активность миелопероксидазы и 3β-гидроксистероиддегидрогеназы [22].
При введении рутина было зафиксировано снижение выработки цитокинов в макрофагах, что благотворно влияет на течение аутовоспаления и аутоиммунных заболеваний [23] . В ходе исследования влияния рутина на повреждение печени, вызванного обструкцией желчевыводящих путей у крыс, установлено, что флавоноид снижает экспрессию трансформирующего фактора роста β1 (TGF-β1), интерлейкина-1β и фактора роста соединительной ткани [24].
Исследования на макрофагов, предварительно обработанных бисфенол А-глицидилметакрилатом, показало, что рутин снижает выработку провоспалительных цитокинов, включая фактор некроза опухоли (TNF)-α, интерлейкинов (IL-1β, IL-6) и простагландина-2 в макрофагах. Рутин также подавляет индуцируемую BisGMA секрецию NO и экспрессию индуцируемой синтазы оксида азота (iNOS), снижает фосфорилирование митоген-активируемой протеинкиназы (MAPK). Данный комплексный механизм действия флавоноида полезен для лечения воспалительных процессов различной этиологии [25].
Осуществлялось изучение противоопухолевых свойств рутина в отношении клеток рака толстой кишки человека (HCT116), в ходе которого было установлено, что флавоноид способствовал апоптозу в клетках HCT116, в частности, за счет ингибирования клеточного цикла в фазе G 0 -G 1 и активацией белка каспазы [26].
Согласно анализу противоопухолевой активности флавоноида на моделей рака молочной железы (EAC in vivo и MCF7 in vitro) и линии клеток рака поджелудочной железы (PANC-1) следует, что применение рутина приводит к уменьшение объема опухоли, уровня карциноэмбрионального антигена, содержания холестерина, жирных кислот и способствуют апоптозу этих раковых клеток [27].
Флавоноид повышает уровни белков, связанных с апоптотической гибелью клеток рака толстой кишки человека Caco-2 (фосфобад, расщепленная каспаза-3 и поли(АДФ-рибоза)- полимеразы). К тому же комбинированное лечение рака рутином и противоопухолевыми препаратами (5-фторурацил и оксалиплатин) более эффективно, чем отдельные виды лечения лекарственными средствами [28].
Рутин индуцирует аутофагию в клеточных линиях лейкемии (THP-1), полости рта (CA9-22) и легких (A549) и снижает выработку TNF-α, который является важным фактором воспаления [29]. Наногибрид MgO-NH-PBA-рутина оказывает выраженную противораковую активность в отношении клеток рака молочной железы (MDA-MB-231) посредством внутриклеточной генерации активных форм кислорода, ингибирования миграции раковых клеток и их дальнейшего апоптоза [30].
Рассматриваемое полифенольное соединение ингибирует рост опухоли леток лейкоза человека HL-60 на модели ксенотрансплантата на животных, а также индуцирует остановку клеточного цикла и апоптоз в мышиных клетках лейкоза WEHI-3 in vitro и in vivo [31].
Рутин обладает противораковой активностью против клеток рака шейки матки HPV-C33A через остановку клеточного цикла G 0 /G 1 и индукцию апоптоза [32].
Рутин является многообещающим полифенольным соединением, которое обладает, в частности, противодиабетической, антиоксидантной, противовоспалительной и противоопухолевой активностью. Это позволяет его рассматривать в качестве перспективного мультитаргетного лекарственного средства или же биологически активной добавки для комплексного лечения различных заболеваний.
Список литературы Обзор биологической активности рутина: противодиабетическая, антиоксидантная, противовоспалительная и противоопухолевая
- Ковальский И. В., Краснюк И. И., Никулина О. И., Беляцкая А. В., Харитонов Ю. Я., Фельдман Н. Б., Луценко С. В. Механизмы фармакологического действия рутина (обзор) // Химико-фармацевтический журнал. 2014. Т. 48. №2. С. 3-6. https://doi.org/10.30906/0023-1134- 2014-48-2-3-6
- Чиряпкин А. С., Золотых Д. С., Поздняков Д. И. Обзор биологической активности флавоноидов: кверцетина и кемпферола // Juvenis scientia. 2023. Т. 9. №2. С. 5-20. https://doi.org/10.32415/jscientia_2023_9_2_5-20
- Fernandes A. A. H., Novelli E. L. B., Okoshi K., Okoshi M. P., Di Muzio B. P., Guimarães J. F. C., Junior A. F. Influence of rutin treatment on biochemical alterations in experimental diabetes // Biomedicine & Pharmacotherapy. 2010. V. 64. №3. P. 214-219. https://doi.org/10.1016/j.biopha.2009.08.007
- Kamalakkannan N., Prince P. S. M. Antihyperglycaemic and antioxidant effect of rutin, a polyphenolic flavonoid, in streptozotocin‐induced diabetic wistar rats // Basic & clinical pharmacology & toxicology. 2006. V. 98. №. 1. P. 97-103. https://doi.org/10.1111/j.1742- 7843.2006.pto_241.x
- Vasta J. D., Corona C. R., Wilkinson J., Zimprich C. A., Hartnett J. R., Ingold M. R., Robers M. B. Quantitative, wide-spectrum kinase profiling in live cells for assessing the effect of cellular ATP on target engagement // Cell chemical biology. 2018. V. 25. № 2. P. 206-214. https://doi.org/10.1016/j.chembiol.2017.10.010
- Dubey S., Ganeshpurkar A., Ganeshpurkar A., Bansal D., Dubey N. Glycolytic enzyme inhibitory and antiglycation potential of rutin // Future Journal of Pharmaceutical Sciences. 2017. V. 3. №. 2. P. 158-162. https://doi.org/10.1016/j.fjps.2017.05.005
- Prince P. S. M., Kamalakkannan N. Rutin improves glucose homeostasis in streptozotocin diabetic tissues by altering glycolytic and gluconeogenic enzymes // Journal of biochemical and molecular toxicology. 2006. V. 20. №2. P. 96-102. https://doi.org/10.1002/jbt.20117
- Niture N. T., Ansari A. A., Naik S. R. Anti-hyperglycemic activity of rutin in streptozotocin-induced diabetic rats: an effect mediated through cytokines, antioxidants and lipid biomarkers // IJEB. 2014. V. 52. №7. http://nopr.niscpr.res.in/handle/123456789/29045
- Hao H. H., Shao Z. M., Tang D. Q., Lu Q., Chen X., Yin X. X., Chen H. Preventive effects of rutin on the development of experimental diabetic nephropathy in rats // Life sciences. 2012. V. 91. №19-20. P. 959-967. https://doi.org/10.1016/j.lfs.2012.09.003
- Cai C., Cheng W., Shi T., Liao Y., Zhou M., Liao Z. Rutin alleviates colon lesions and regulates gut microbiota in diabetic mice // Scientific Reports. 2023. V. 13. №1. P. 4897. https://doi.org/10.1038/s41598-023-31647-z
- Tian R., Yang W., Xue Q., Gao L., Huo J., Ren D., Chen X. Rutin ameliorates diabetic neuropathy by lowering plasma glucose and decreasing oxidative stress via Nrf2 signaling pathway in rats // European journal of pharmacology. 2016. V. 771. P. 84-92. https://doi.org/10.1016/j.ejphar.2015.12.021
- Yang J., Guo J., Yuan J. In vitro antioxidant properties of rutin // LWT-Food Science and Technology. 2008. V. 41. № 6. P. 1060-1066. https://doi.org/10.1016/j.lwt.2007.06.010
- La Casa C., Villegas I., De La Lastra C. A., Motilva V., Calero M. M. Evidence for protective and antioxidant properties of rutin, a natural flavone, against ethanol induced gastric lesions // Journal of ethnopharmacology. 2000. V. 71. №1-2. P. 45-53. https://doi.org/10.1016/S0378-8741(99)00174-9
- Azevedo M. I., Pereira A. F., Nogueira R. B., Rolim F. E., Brito G. A., Wong D. V. T., Vale M. L. The antioxidant effects of the flavonoids rutin and quercetin inhibit oxaliplatin-induced chronic painful peripheral neuropathy // Molecular pain. 2013. V. 9. P. 1744-8069-9-53. https://doi.org/10.1186/1744-8069-9-53
- Potapovich A. I., Kostyuk V. A. Comparative study of antioxidant properties and cytoprotective activity of flavonoids // Biochemistry (Moscow). 2003. V. 68. P. 514-519. https://doi.org/10.1023/A:1023947424341
- Kampkötter A., Nkwonkam C. G., Zurawski R. F., Timpel C., Chovolou Y., Wätjen W., Kahl R. Investigations of protective effects of the flavonoids quercetin and rutin on stress resistance in the model organism Caenorhabditis elegans // Toxicology. 2007. V. 234. №. 1-2. P. 113-123. https://doi.org/10.1016/j.tox.2007.02.006
- Al-Rejaie S. S., Aleisa A. M., Sayed-Ahmed M. M., Al-Shabanah O. A., Abuohashish H. M., Ahmed M. M., Hafez M. M. Protective effect of rutin on the antioxidant genes expression in hypercholestrolemic male Westar rat // BMC complementary and alternative medicine. 2013. V. 13. №. 1. P. 1-9. https://doi.org/10.1186/1472-6882-13-136
- Yoo H., Ku S. K., Baek Y. D., Bae J. S. Anti-inflammatory effects of rutin on HMGB1- induced inflammatory responses in vitro and in vivo // Inflammation Research. 2014. V. 63. P. 197- 206. https://doi.org/10.1007/s00011-013-0689-x
- Gautam R., Singh M., Gautam S., Rawat J. K., Saraf S. A., Kaithwas G. Rutin attenuates intestinal toxicity induced by Methotrexate linked with anti-oxidative and anti-inflammatory effects // BMC complementary and alternative medicine. 2016. V. 16. №. 1. P. 1-6. https://doi.org/10.1186/s12906-016-1069-1
- Selloum L., Bouriche H., Tigrine C., Boudoukha C. Anti-inflammatory effect of rutin on rat paw oedema, and on neutrophils chemotaxis and degranulation // Experimental and Toxicologic Pathology. 2003. V. 54. №. 4. P. 313-318. https://doi.org/10.1078/0940-2993-00260
- Nikfarjam B.A., Adineh M., Hajiali F., Nassiri-Asl M. Treatment with Rutin – A Therapeutic Strategy for Neutrophil-Mediated Inflammatory and Autoimmune Diseases // Journal of Pharmacopuncture. 2017. V. 20. P. 52-56. https://doi.org/10.3831/KPI.2017.20.003
- Abarikwu S. O., Njoku R. C. C., John I. G., Amadi B. A., Mgbudom-Okah C. J., Onuah C. L. Antioxidant and anti-inflammatory protective effects of rutin and kolaviron against busulfaninduced testicular injuries in rats // Systems Biology in Reproductive Medicine. 2022. V. 68. №2. P. 151-161. https://doi.org/10.1080/19396368.2021.1989727
- Ganeshpurkar A., Saluja A. Immunomodulatory effect of rutin, catechin, and hesperidin on macrophage function // Indian Journal of Biochemistry and Biophysics (IJBB). 2020. V. 57. №1. P. 58-63. https://doi.org/10.56042/ijbb.v57i1.31775
- Pan P. H., Lin S. Y., Wang Y. Y., Chen W. Y., Chuang Y. H., Wu C. C., Chen C. J. Protective effects of rutin on liver injury induced by biliary obstruction in rats // Free Radical Biology and Medicine. 2014. V. 73. P. 106-116. https://doi.org/10.1016/j.freeradbiomed.2014.05.001
- Huang F. M., Chang Y. C., Lee M. W., Su N. Y., Yang L. C., Kuan Y. H. Rutin alleviates bisphenol Aglycidyl methacrylate‐induced generation of proinflammatory mediators through the MAPK and NF‐κB pathways in macrophages // Environmental Toxicology. 2023. V. 38. №3. P. 628-634. https://doi.org/10.1002/tox.23711
- Jayameena P., Sivakumari K., Ashok K., Rajesh S. Rutin: A potential anticancer drug against human colon cancer (HCT116) cells // Int. J. Biol. Pharm. Allied Sci. 2018. V. 7. №9. P. 1731-1745. https://doi.org/10.31032/IJBPAS/2018/7.9.4532
- Saleh A., ElFayoumi H. M., Youns M., Barakat W. Rutin and orlistat produce antitumor effects via antioxidant and apoptotic actions // Naunyn-Schmiedeberg's archives of pharmacology. 2019. V. 392. P. 165-175. https://doi.org/10.1007/s00210-018-1579-0
- Nasiri F., Kismali G., Alpay M., Kosova F., Cakir D. U., Sel T. Rutin enhances the antiproliferative effect of 5-FU and oxaliplatin in colon cancer cells // Cancer Research. 2016. V. 76. №14. P. 2177-2177. https://doi.org/10.1158/1538-7445.AM2016-2177
- Park M. H., Kim S., Song Y. R., Kim S., Kim H. J., Na H. S., Chung J. Rutin induces autophagy in cancer cells // International Journal of Oral Biology. 2016. V. 41. №1. P. 45-51. https://doi.org/10.11620/IJOB.2016.41.1.045
- Singh T. A., Sadhukhan P., Ghosh N., Thakur N., Sharma A., Tejwan N., Sil P. C. Targeted delivery of rutin into breast cancer cells via using phenylboronic acid functionalized MgO nanoparticles // Materials Science and Engineering: B. 2023. V. 296. P. 116623. https://doi.org/10.1016/j.mseb.2023.116623
- Lin J. P., Yang,J. S., Lin J. J., Lai K. C., Lu H. F., Ma C. Y., Chung J. G. Rutin inhibits human leukemia tumor growth in a murine xenograft model in vivo // Environmental toxicology. 2012. V. 27. №8. P. 480-484. https://doi.org/10.1002/tox.20662
- Khan F., Pandey P., Upadhyay T. K., Jafri A., Jha N. K., Mishra R., Singh V. Anticancerous effect of rutin against HPV-C33A cervical cancer cells via G0/G1 cell cycle arrest and apoptotic induction // Endocrine, Metabolic & Immune Disorders-Drug Targets (Formerly Current Drug Targets-Immune, Endocrine & Metabolic Disorders). 2020. V. 20. №3. P. 409-418. https://doi.org/10.2174/1871530319666190806122257


