Оценка активности антиоксидантных ферментов у представителей разных популяций Lymnaea stagnalis различается по степени заражения при температурном стрессе
Автор: Аксенов-грибанов Д.В., Хомич А.С., Бодиловская О.А., Кондратьева Е.С., Лубяга Ю.А., Шатилина З.М., Емшанова В.А., Голубев А.П.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 3 т.12, 2016 года.
Бесплатный доступ
Целью данного исследования было оценить влияние эффектов термического стресса и паразитарной инвазии на активность антиоксидантных ферментов (пероксидаза, каталаза и глутатион S-трансфераза) в разных популяциях широко распространенных видов легочного моллюска Lymnaea stagnalis из водных объектов с различными уровнями антропогенного загрязнения в Беларуси - незагрязненное озеро Нарах и загрязненное Чижовское водохранилище. В экспозиции теплового стресса (35 ° С) обнаружено несколько отличий. В не инфицированных моллюсках обеих популяций активность пероксидазы снижалась, а активность каталазы возрастала. Активность глутатион-S-трансферазы увеличилась у не зараженных моллюсков, обитающих в загрязненном Чижовском водохранилище.
Короткий адрес: https://sciup.org/14323998
IDR: 14323998
Текст научной статьи Оценка активности антиоксидантных ферментов у представителей разных популяций Lymnaea stagnalis различается по степени заражения при температурном стрессе
Загрязнение водоемов, происходящее на фоне глобальных климатических изменений и повышенной антропогенной нагрузки, ведет к серьезным нарушениям в функционировании экосистем (Rogelj, 2013; IPCC, 2014). Возрастающая на пресные водоемы антропогенная нагрузка оказывает негативное воздействие на состояние их биоты, в том числе и на сообщества пресноводных легочных моллюсков – одной из доминантных групп макрозообентоса. При рассмотрении адаптационных механизмов загрязнение ведет к развитию стрессовых реакций у организмов, а на популяционном уровне - к снижению численности популяций многих видов, вплоть до их полного исчезновения (Fordham et al. , 2013; Golubev et al. , 2005, 2013).
Согласно определению Воробьевой Л.И. (2004), стресс – это любые изменения в геноме, протеоме или в окружающей среде, которые приводят к снижению скорости роста или способности к выживанию. Потому, на биохимическом уровне постоянное обитание гастропод в загрязнённых условиях ведет к локальным адаптациям и активации ряда как специфических, так и неспецифических механизмов стресс-резистентности (Lorenzo et al. , 2016).
Пресноводные легочные моллюски часто используются в качестве модельных объектов при проведении экологических и физиологических экспериментов (Jackson et al., 2016). Одним из наиболее распространенных и удобных объектов выступает вид Lymnaea stagnalis (Linnaeus, 1758). Данный вид широко распространен на территории Евразии и приспособлен к обитанию в водоемах с высокой степенью загрязнения и при различных температурных режимах.
Несмотря на то, что данный вид выступает модельным для изучения ряда экофизиологических механизмов стресс-адаптации (Axenov-Gribanov et al , 2015), вопросы влияния паразитических инвазий на биохимический статус гастропод и их механизмы стресс-адаптации остаются зачастую неизученными. В связи с этим целью настоящего исследования являлась оценка влияния острого температурного стрессового воздействия и и инвазированности личинками трематод на активность ферментов антиоксидантной системы (пероксидазы, каталазы и глутатион S-трансферазы) у некоторых популяций легочного моллюска L. stagnalis респ. Беларусь.
MATERIALS AND METHODS
В качестве объекта исследования были выбраны легочные моллюски Lymnaea stagnalis (Linnaeus, 1758). Моллюск встречается преимущественно в прибрежной полосе на илисто-песчаных грунтах и зарослях полупогруженной растительности (Maximova et al. , 2012).
Моллюски были собраны в двух водоёмах: в чистом озере Нарочь и в загрязненном Чижовском водохранилище р. Свислочь. В ходе экспериментального исследования проведена экспозиция гастропод в условиях острой гипертермии при температуре +35°С. Пробоотборы мышечной ткани особей проводились через каждые 4 часа экспозиции. Длительность экспериментов составила 24 часа. Как для контрольный, так и для экспериментальной выборки был проведён паразитологический анализ пищеварительной железы моллюсков на наличие трематод (Kiatsopit et al., 2016), а так же определена активность некоторых ферментов антиоксидантной системы (пероксидазы, глутатион S-трансферазы и каталазы).
Оценку активности ферментов антиоксидантной системы (пероксидазы, каталазы и глутатион S-трансферазы) проводили согласно модифицированным (Timofeyev et al. , 2006., Bedulina et al. , 2010) спектрофотометрическим методикам Drotar (1985), Aebi (1984) и Habig (1974). Измерения проводили на спектрофотометре Cary 50 (Varian, США) при λ=436 нм для пероксидазы, при λ=240 нм для каталазы и при λ=340 нм для глутатион S-трансферазы. Все эксперименты проведены в 5 биологических параллелях. Биохимический анализ каждой пробы проведен в 3-х аналитических измерениях. Оценку достоверности проводили, используя U-критерий Манна - Уитни. Статистический анализ проводили с использованием программы Past 3.12.
RESULTS AND DISCUSSION
Результаты оценки влияния паразитарной инвазии на активность механизмов неспецифической стресс-резистентности при температурно-индуцированном стрессовом воздействии представлены на рисунках 12.
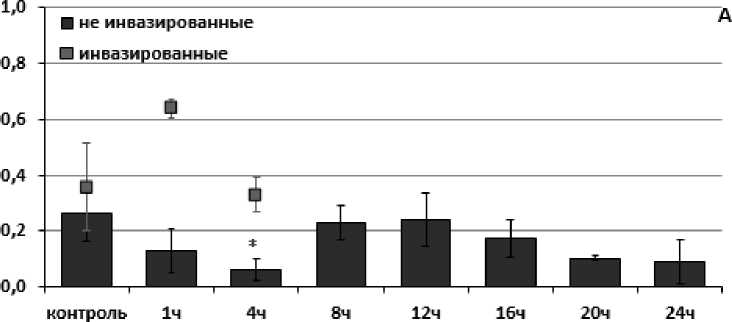
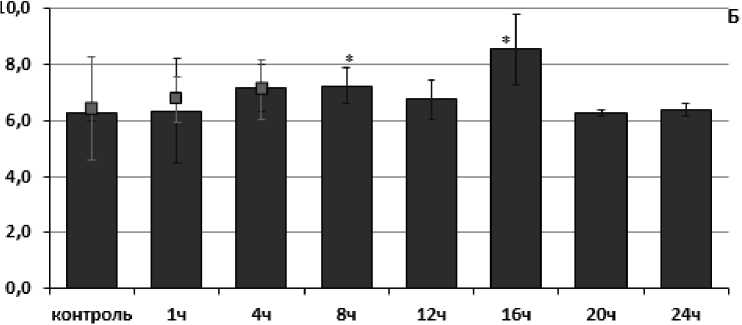
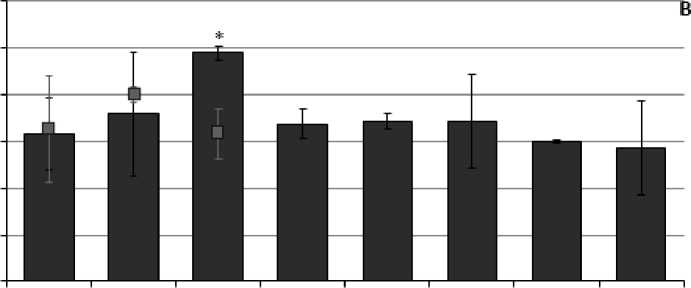
При оценке направленностей стресс-реакций по изменению активности ферментов антиоксидантной системы у инвазированных и неинвазированных представителей L. stagnalis при действии острой гипертермии (35°С) были обнаружены как сходства, так и отличия. Так, у неинвазированных особей, обитающих в Чижовском водохранилище отмечали кратковременное повышение активности каталазы с 79.38±17.79 нКат/мг белка до 122.23 ±10.28 нКат/мг белка через 4 часа экспозиции (рис. 1В). При этом у инвазированных трематодами особей изменения активности каталазы не наблюдали.
Повышение активности каталазы так же наблюдали у неинвазированных моллюсков, отловленных в оз. Нарочь после 8 и 24 часов экспозиции при повышенных температурах (Рис. 2В). Так, активность фермента повышалась с 57.44 ±13.67 нКат/мг белка до 84.42 ±8.9 нКат/мг белка и 93.88 ±15.23 нКат/мг белка соответственно. При этом у инвазированных трематодами особей изменения активности каталазы не наблюдали.
В ходе температурного стрессового воздействия активность глутатион S-трансферазы не изменялась как у инвазированных, так и у неинвазированных особей, собранных в чистом оз. Нарочь (Рис. 2Б). В то же время у представителей L. stagnalis, собранных в загрязненном Чижовском водохранилище, отмечали кратковременное повышение активности глутатион S-трансферазы у неинвазированных особей (Рис. 1Б). Повышение активности фермента отмечали спустя 8 и 16 часов эксперимента с 6.28 ±0.32 нКат/мг белка до 7.25 ±0.68 нКат/мг белка и 8.54 ±1.57 нКат/мг белка соответственно. В то же время изменений активности данного фермента у инвазированных особей не наблюдали. Повышение активности глутатион S-трансферазы может косвенно указывать на накопление продуктов перекисного окисления липидов и функциональную перестройку клеточных мембран, что свидетельствует об усилении выведения поддержания целостности мембран (Le Pennec, 2003).
продуктов перекисного окисления липидов и
IM
контроль 1ч 4ч 8ч 12ч 16ч 20ч 24ч
Figure 1. Оценка активности ферментов АОС (в нКат/мг белка) в мышечной ткани у представителей L. stagnalis , обитающих в Чижовском водохранилище, отличающихся по своей зараженности личинками трематод при температурно-индуцированном стрессе (А-пероксидаза; Б-глутатион S-трансфераза; В-каталаза)
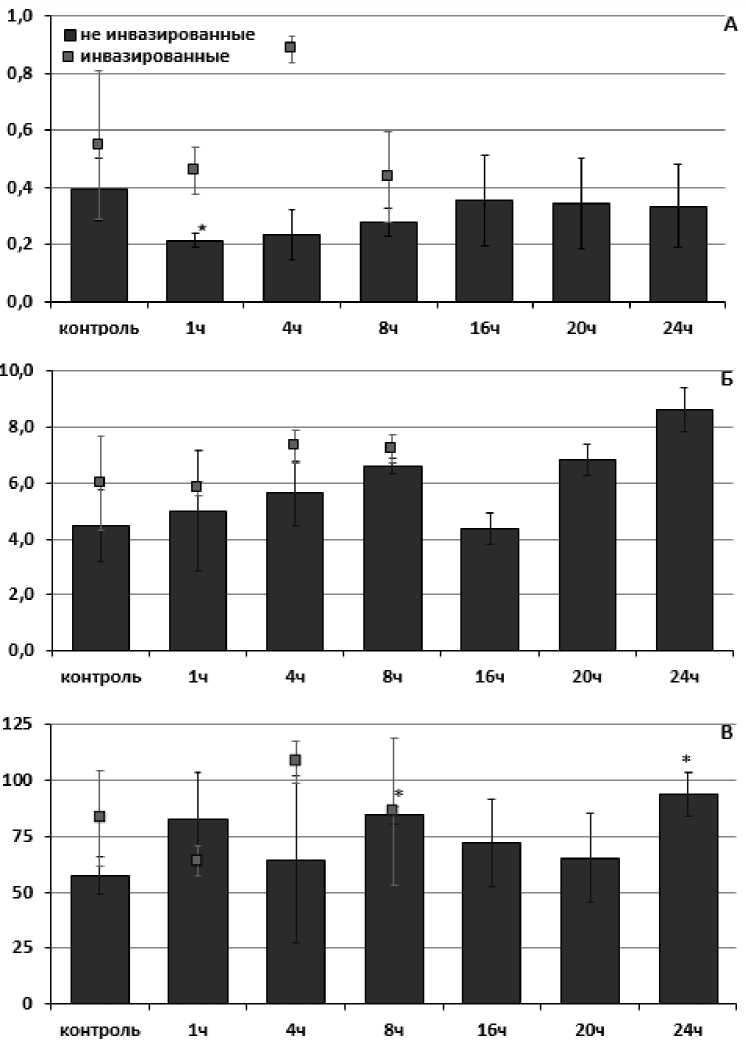
Figure 2. Оценка активности ферментов АОС (в нКат/мг белка) в мышечной ткани у представителей L. stagnalis , обитающих в оз. Нарочь, отличающихся по своей зараженности личинками трематод при температурно-индуцированном стрессе (А-пероксидаза; Б-глутатион S-трансфераза; В-каталаза)
Активность пероксидазы показала более отличную картину между анализируемыми выборками. При температурной экспозиции активность фермента статистически значимо не изменялась в ходе всего эксперимента у инвазированных особей, собранных в оз. Нарочь (Рис. 2А) и у инвазированных представителей, собранных в Чижовском водохранилище (Рис. 1А). Однако отмечали кратковременное понижение активности фермента у неинвазированных обитателей озера Нарочь и
Чижовского водохранилища через 1 час (с 0.4 ±0.17 нКат/мг белка до 0.22 ±0.22 нКат/мг белка) и 4 часа (с 0.26 ±0.092 нКат/мг белка до 0.06 ±0.095 нКат/мг белка) после начала эксперимента соответственно.
В ходе проведенного исследования показано, что при экспериментальной гипертермии у незараженных L. stagnalis повышается активность каталазы и глутатион S-трансферазы, однако снижается активность пероксидазы. Одним из механизмов воздействия температурного фактора на организм гидробионтов является активация их метаболических процессов. Поскольку метаболизм гидробионтов зачастую зависит от температурных изменений в окружающей среде, повышение температуры среды обитания приводит к активации их метаболизма вместе с увеличением потребления кислорода и, соответственно, к окислительному повреждению клеток и клеточных структур, за счет накопления активных форм кислорода (супероксидного аниона, перекиси водорода, гидроксильного радикала в среде и прочих свободных радикалов) (Sies, 2013; Schieber & Chandel, 2014). В ряде экспериментов показано, что повышение температуры ведет к активации упоминаемых ферментов, что свидетельствует о развитии окислительного стресса и активации защитных механизмов неспецифической стресс-адаптации (Tomanek & Zuzow, 2010; Sokolova et al. , 2011; Dimitriadis et al. , 2012).
Изменение активности ферментов антиоксидантной системы указывают на нарушение системы контроля за эндогенно образованными активными формами кислорода. Повышение активности пероксидазы и каталазы при температурном стрессовом воздействии указывает на активацию антиоксидантной системы и утилизацию активных форм кислорода и свободно-радикального окисления (Abele et al., 2011; Freire et al., 2011; Lushchak, 2011). Наблюдаемое же снижение активности ферментов, показанное в случае экспозиции при повышенных температурах у неинвазированных особей, отловленных из обоих водоёмов, может быть связано с сохранением энергетического гомеостаза и снижением метаболической и функциональной активности (de Jong-Brink et al., 2001).
ACKNOWLEDGEMENTS
Работа выполнена в рамках Задания № 5.3.14 Государственной программы научных исследований Республики Беларусь «Химические технологии и материалы, природно-ресурсный потенциал», а также при частичной финансовой поддержке проектов МИНОБРНАУКИ РФ (ГЗ 1354 -2014/51), РНФ (14-1400400), CRDF (FSCX-15-61168-0), РФФИ (14-0400501, 15-54-04062, 16-34-60060) и ФГБОУ ВО «ИГУ».
Список литературы Оценка активности антиоксидантных ферментов у представителей разных популяций Lymnaea stagnalis различается по степени заражения при температурном стрессе
- Abele D., Vazquez-Medina J. P., Zenteno-Savin T. (Eds.). (2011) Oxidative stress in aquatic ecosystems. John Wiley & Sons
- Aebi H. (1984). Catalase in vitro. Methods in enzymology, 105, 121-126
- Axenov-Gribanov D., Vereshchagina K., Lubyaga Y., Gurkov A., Bedulina D., Shatilina Z., Timofeyev M. (2015) Stress Response at the Cellular and Biochemical Levels Indicates the Limitation of the Environmental Temperature Range for Eastern Siberian Populations of the Common Gastropod Lymnaea stagnalis. Malacologia, 59, 1, 33-44
- Bedulina D.S., Zimmer M., Timofeyev M.A. (2010) Sub-littoral and supra-littoral amphipods respond differently to acute thermal stress. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 155, 4, 413-418
- Bodilovskaya O.A., Khomich A.S., Axenov-Gribanov D.V., Lubyaga Y.A., Shatilina Z.M., Shirokova Y.A., Timofeyev М.А., Golubev A.P.(2015) The ability to self-fertilization as a factor of eurybiontness in freshwater pulmonate mollusks. Journal of Stress Physiology & Biochemistry, 11, 1, 39 -51
- Bodilovskaya O.A., Khomich A.S., Axenov-Gribanov D.V., Shatilina Z.M., Shirokova Y.A., Timofeyev М.А., Golubev A.P. (2015). The ability to self-fertilization as a factor of Eurybiontness in freshwater pulmonate mollusks. Journal of Stress Physiology & Biochemistry, 11, 1, 39-51
- de Jong-Brink M., ter Maat A., Tensen C.P. (2001) NPY in invertebrates: molecular answers to altered functions during evolution. Peptides, 22, 3, 309-315
- Di Lorenzo T., Cannicci S., Spigoli D., Cifoni M., Baratti M., Galassi D.M. (2016) Bioenergetic cost of living in polluted freshwater bodies: respiration rates of the cyclopoid Eucyclops serrulatus under ammonia-N exposures. Fundamental and Applied Limnology/Archiv für Hydrobiologie. Published online first
- Dimitriadis V.K., Gougoula C., Anestis A., Pörtner H.O., Michaelidis B. (2012) Monitoring the biochemical and cellular responses of marine bivalves during thermal stress by using biomarkers. Marine environmental research, 73, 70-77
- Drotar A., Phelps P., Fall R. (1985) Evidence for glutathione peroxidase activities in cultured plant cells. Plant Science, 42,1, 35-40
- Fordham D.A., Akçakaya H.R., Araújo M.B., Keith D.A., Brook B.W. (2013) Tools for integrating range change, extinction risk and climate change information into conservation management. Ecography, 36, 9, 956-964
- Freire C.A., Welker A.F., Storey J.M., Storey K.B., Hermes-Lima M. (2011) Oxidative stress in estuarine and intertidal environments (temperate and tropical). Oxidative stress in aquatic ecosystems, 41-57
- Golubev A., Afonin V., Maksimova S., Androsov V. (2005). The current state of pond snail Lymnaea stagnalis (Gastropoda, Pulmonata) populations from water reservoirs of the Chernobyl nuclear accident zone. Radioprotection, 40, S1, S511-S517
- Golubev A.P., Bodilovskaya O.A., Slesareva L.E., Shavel A.A., Timofeyev M.A. (2013). Population dynamics of the pulmonate mollusk Lymnaea stagnalis under the conditions of prolonged reproduction by self-fertilization. Doklady Biological Sciences, 452, 1, 300
- Habig W.H., Jakoby W.B., Guthenberg C., Mannervik B., Vander Jagt D.L. (1984) 2-Propylthiouracil does not replace glutathione for the glutathione transferases. Journal of Biological Chemistry, 259, 12, 7409-7410
- Intergovernmental Panel on Climate Change. (2014) Climate Change 2014-Impacts, Adaptation and Vulnerability: Regional Aspects. Cambridge University Press. 1280
- Jackson D.J., Herlitze I., Hohagen J. (2016) A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments, 109, e53968-e53968
- Kiatsopit N., Sithithaworn P., Kopolrat K., Namsanor J., Andrews R.H., Petney T.N. (2016) Trematode diversity in the freshwater snail Bithynia siamensis goniomphalos sensu lato from Thailand and Lao PDR. Journal of helminthology, 90, 03, 312-320
- Lushchak V.I. (2011) Environmentally induced oxidative stress in aquatic animals. Aquatic Toxicology, 101, 1, 13-30
- Maximova N.V., Melnikova E.N., Shirokaya A.A., Sitnikova T.Y., & Timoshkin O.A. (2012) Seasonal and inter-annual distribution of Gastropoda in three hydrodynamic stony littoral zones of Lake Baikal. Ruthenica, 22, 1, 1-14
- Rogelj J. (2013). Long-term climate change: projections, commitments and irreversibility. in Climate Change 2014-Impacts, Adaptation and Vulnerability: Regional Aspects. 1029-1136
- Schieber M. and Chandel N.S. (2014) ROS function in redox signaling and oxidative stress. Current Biology, 24, 10, R453-R462
- Sies, H. (Ed.). (2013) Oxidative stress. Elsevier. 53
- Sokolova I.M., Sukhotin A.A., Lannig G. (2011) Stress effects on metabolism and energy budgets in mollusks. Oxidative stress in aquatic ecosystems, 263-280
- Timofeyev M.A., Shatilina Z.M., Kolesnichenko A.V., Bedulina D.S., Kolesnichenko V.V., Pflugmacher S., & Steinberg C.E. (2006) Natural organic matter (NOM) induces oxidative stress in freshwater amphipods Gammarus lacustris Sars and Gammarus tigrinus (Sexton). Science of the total environment, 366, 2, 673-681
- Tomanek L., and Zuzow M.J. (2010) The proteomic response of the mussel congeners Mytilus galloprovincialis and M. trossulus to acute heat stress: implications for thermal tolerance limits and metabolic costs of thermal stress. Journal of Experimental Biology, 213, 20, 3559-3574
- Vorobyeva L.I. (2004) Stressors, stress and survival in bacterial (Review). Applied biochemistry and microbiology, 40, 3, 261-269


