Оценка анксиолитической активности оптических изомеров 3-зам ещенных 4-(1н-тетразол-1-ил)бутановых кислот
Автор: Ковалев Н.С., Бакулин Д.А., Саблина Л.А., Воронцов М.Ю., Быкова А.С., Резников А.Н., Климочкин Ю.Н.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 (69), 2021 года.
Бесплатный доступ
3-пара-толилзамещенная ГАМК (толибут) оказывает нейропротекторное, обезболивающее, миорелаксирующее, противотревожное и противосудорожное действие и представляет собой рацемат. Клиническое применение толибута ограничено узкой терапевтической широтой. Одним из способов снижения его токсичности может быть подход, заключающейся в модификации структуры ГАМК, в частности замене аминогруппы на фрагмент тетразола. Тетразолильный заместитель может использоваться в качестве биоизостерического аналога различных функциональных групп. Целью данной работы является исследование анксиолитической активности тетразолильных производных ГАМК с толильным и фенильным радикалом в p-положении. Исследование было проведено на крысах линии Wistar. Была произведена оценка анксиолитического действия (R)- и (S)-энантиомеров 3-арилзамещенных 4-(1Н-тетразол-1-ил)бутановых кислот. По результатам исследования было отмечено наличие анксиолитической активности у (R)-изомера 3-(4-метилфенил)-4-(1Н-тетразол-1-ил)бутановой кислоты в условиях конфликтной ситуации, сопоставимой с таковой у толибута и фенибута.
Гамк, толибут, фенибут, энантиомеры, анксиолитическая активность, крысы
Короткий адрес: https://sciup.org/142229367
IDR: 142229367 | УДК: 615.214.2:547.466.3
Текст научной статьи Оценка анксиолитической активности оптических изомеров 3-зам ещенных 4-(1н-тетразол-1-ил)бутановых кислот
Посредством последовательной структурной модификации молекулы ГАМК было создано значительное число лекарственных препаратов с психотропной активностью. Фенибут является фенильным производным ГАМК (включение фенильного радикала в β-положение структуры ГАМК увеличило её липофильность и соответственно повысило проницаемость через гематоэнцефалический барьер) и, являясь агонистом ГАМК, проявляет анксиолитическую и ноотропную активность, а также церебропротекторную активность в экспериментальных условиях [1, 6]. Препарат эффективен при лечении тревожных расстройств, депрессий, посттравматического стрессового расстройства. Структурные аналоги фенибута с толильным и 4-хлорфенильным заместителем в β-положении проявляют более выраженное анксиолитическое действие, большую активность в отношении ГАМК, а также у данных препаратов появляется дозозависимая миорелаксирующая активность, возможно, вызванная большим сродством к ГАМК-В рецептору.
Также исследования показывают аналогичный механизм действия у фенибута и габапентина, который широко используется для лечения тревожных расстройств и невропатической боли [6].
Толибут – пара -толилзамещенный аналог ГАМК, который, по результатам доклинических исследований, обладает достаточно широким спектром фармакологической активности: анальгетической [8], транквилизирующей [10], нейро-протекторной [12], седативной, миорелаксирующей. По многим фармакологическим эффектам толибут многократно превосходит фенибут, однако последний оказался менее токсичным и получил дальнейшее развитие с внедрением в практику [2]. Клиническое применение толибу-та ограничено узкой терапевтической широтой (LD 50 – 252 мг/кг).
Одним из способов её расширения может быть подход, заключающейся в модификации структуры ГАМК, в частности, замене аминогруппы на тетразольный цикл, который может использоваться в качестве биоизостерического аналога различных функциональных групп (карбоксильной и других) [13].
Многочисленные исследования способствовали акцентированию внимания на фармакологической активности индивидуальных энантиомеров давно известных препаратах.
Изучение активности отдельных энантиомеров фенибута и баклофена показало значительно большую активность ( R )-изомера и почти полное её отсутствие у ( S )-изомера. В дальнейшем как in vitro, так и in vivo, было выявлено, что все фармакологические эффекты фенибута реализуются посредством ( R )-изомера, в то время как ( S )-изомер оказался функционально неактивным [7]. Позже аналогичные результаты в in vitro и in vivo исследованиях были получены в отношении баклофена. Было подтверждено, что ( S )-изомер баклофена не обладает фармакологической активностью [9].
ЦЕЛЬ РАБОТЫ
Исследовать анксиолитическую активность ( S )- и ( R )-энантиомеров. 3-арилзамещенных 4-(1 Н -тетразол-1-ил)бутановых кислот (тетразолсодержащих аналогов фенибута и толибута).
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальное исследование проведено на 90 крысах-самцах линии Wistar, массой 200–230 г, в возрасте 6 месяцев.
Животные содержались в условиях вивария (ГОСТ Р 51849-2001) со свободным доступом к питьевой воде и пище (ООО «Лаборатор-корм», Москва).
Протокол исследования одобрен локальным этическим комитетом (Региональный исследовательский этический комитет Волгоградской области) № 2010-2019 02 апреля 2019 г.
С целью сравнения фармакологических свойств энантиомеров тетразолсодержащих аналогов фенибута и толибута в качестве препаратов сравнения использовались препараты фени-бут в дозе 20 мг/кг и толибут в дозе 10 мг/кг (см. табл.). Исследуемые соединения вводились в эквимолярных дозах 12 мг/кг и 25 мг/кг. Были сформированы следующие группы: контрольная, которым вводили физиологический раствор (плацебо), опытные, которым вводили ( R )-4-(1 Н -тетразол-1-ил)-3-фенилбутановую кислоту (ANR-05) и ее рацемат (ANR-06) (ANR-05 и 06) в дозах 12 и 25 мг/кг, опытные, которым вводили ( R )-4-(1 Н -тетразол-1-ил)-3-(4-метилфенил)бутано-вую кислоту (ANR-07) и ее рацемат (ANR-08) (ANR-07 и 08) в дозах 12 и 25 мг/кг, группа, получающих препарат сравнения толибут в дозе 10 мг/кг (наиболее активная доза, не вызывающая седативного эффекта) и группа, получавших препарат сравнения фенибут в дозе 20 мг/кг (наиболее активная доза). Исследуемые соединения вводили лабораторным животным однократно, внутрибрюшинно за 60 минут до выполнения поведенческих тестов.
Исследуемые соединения и препараты сравнения
|
Исследуемые соединения |
1/10 от Mr, мг/кг |
1/20 от Mr, мг/кг |
|
Фенибут |
20 |
|
|
ANR-05 |
25 |
12 |
|
ANR-06 |
25 |
12 |
|
Толибут |
10 |
|
|
ANR-07 |
25 |
12 |
|
ANR-08 |
25 |
12 |
Анксиолитическую активность исследуемых соединений оценивали в приподнятом крестообразном лабиринте «ПКЛ» и по методике конфликтной ситуации «вариант Vogel» [4, 5].
Соединения для исследования были получены по методикам, представленным в предыдущей работе [3], и предоставлены сотрудниками кафедры Органической химии ФГБОУ ВО «СамГТУ», г. Самара.
Статистическая обработка данных проводилась в MS Excel 2016 и Prism 6, статистический анализ осуществляли с использованием критериев Шапиро – Уилка, Краскела – Уоллиса и Дана.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В тесте приподнятый крестообразный лабиринт (ПКЛ) 4-(1Н-тетразол-1-ил)-3-фенилбутано-вая и 4-(1Н-тетразол-1-ил)-3-(4-метилфенил)бу- тановая кислоты (в рацемической форме и в виде индивидуальных (R)-изомеров) незначи- тельно влияли на поведение животных в условиях переменной стрессогенности (см. рис.).
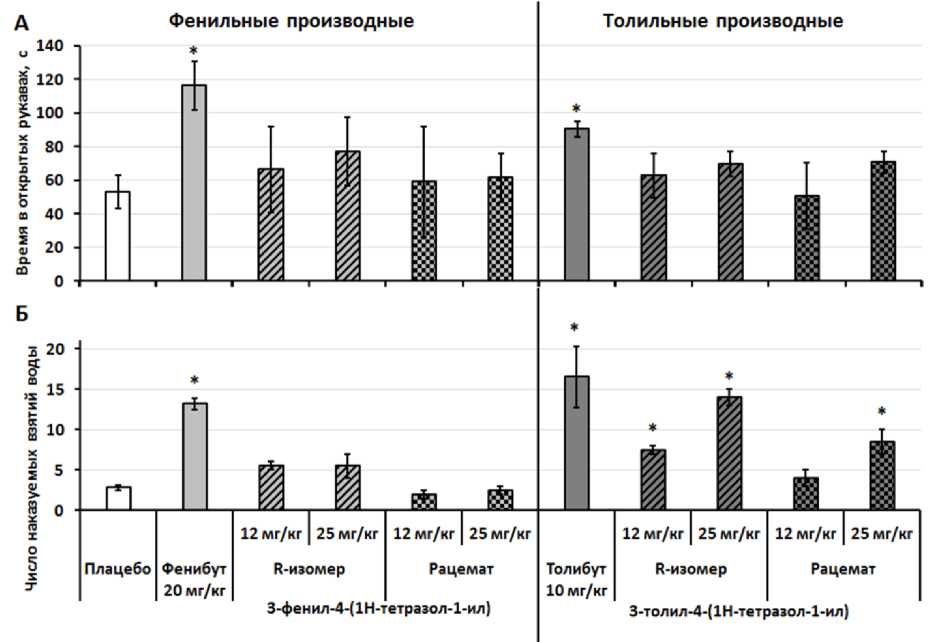
Рис. Продолжительность нахождения в открытых рукавах в тесте ПКЛ (а); количество наказуемых подходов в тесте конфликтной ситуации «вариант Vogel» (б)
Для оценки анксиолитической активности исследуемых соединений дополнительно к тесту ПКЛ был проведен тест конфликтной ситуации «вариант Vogel», в котором соединения вводили за 60 минут до начала тестирования.
Животные, которым вводили соединение ANR-08 (рацемическую 4-(1 Н -тетразол-1-ил)-3-(4-метилфенил)бутановую кислоту) совершали большее количество наказуемых взятий воды по мере увеличения вводимой дозы. Статистически значимые различия с контрольной группой животных достигаются в дозе 25 мг/кг, что свидетельствует о подавлении чувства тревоги перед аверсивным болевым раздражителем и снижении уровня тревоги.
Однако под действием ( R )-изомера 4-(1 Н -тетразол-1-ил)-3-(4-метилфе-нил)бутановой кислоты (ANR-07) животные совершали большее количество наказуемых взятий уже в дозе 12 мг/кг, и данный показатель возрастал по мере увеличения вводимой дозы.
Полученные результаты дают возможность сделать предположение о наличии анксиолитической активности у 4-(1Н-тетразол-1-ил)-3-(4- метилфенил)бутановой кислоты, более выраженной у (R)-изомера в сравнении с рацематом.
Рацемическая форма 4-(1 Н -тетразол-1-ил)-3-фенилбутановой кислоты (ANR-06) не оказывала противотревожных свойств: животные совершали сопоставимое с контрольной группой количество наказуемых взятий воды.
Группа животных, получающая ( R )-изомер 4-(1 Н -тетразол-1-ил)-3-фенилбутановой кислоты (ANR-05) обладала более выраженной анксиолитической активностью в сравнении с рацематом, однако уступало по эффективности как правовращающей, так и рацемической форме тет-разолильных производных ГАМК с толильным радикалом в β-положении (ANR-07 и ANR-08).
Тревожные расстройства характеризуются иррациональным неконтролируемым страхом и стойким чувством тревоги, сопровождаются нарушениями в модуляции мозговых цепей, регулирующих эмоциональные реакции на потенциально опасные стимулы. Множество работ доказывает, что мозговые цепи в миндалине содержат ингибирующие сети γ-аминомаслянной кислоты, и этот нейротрансмиттер играет ключе- вую роль в модуляции как нормальных, так и патологических тревожных реакций. Взаимодействие с аллостерическими сайтами на поверхности ГАМК рецепторов позволяет регулировать уровень ингибирования нейронов в миндалине. Именно этот механизм является основной мишенью многих классов анксиолитиков. Изменения уровней эндогенных модуляторов этих аллостерических сайтов, а также изменения в составе субъединиц рецептора ГАМК-А могут являться механизмом, посредством которого уровень нейронального торможения подавляется в патологических состояниях тревоги [11].
Толибут как препарат с доказанным анксиолитическим, нейропротекторным, седативным и рядом других свойств [9, 11, 13] может являться перспективным средством для лечения тревожных расстройств. Выраженный анксиолитический и седативный эффект толибута может способствовать нормализации чрезмерных эмоциональных и тревожных реакций, которые часто сопровождаются повышенной возбудимостью.
Проведенное исследование нейротропной активности энантиомеров 3-замещенных 4-(1 Н -тетразол-1-ил)бутановых кислот показало, что ( R )-изомер 4-(1 Н -тетразол-1-ил)-3-(4-метилфенил)бу-тановой кислоты обладает умеренной анксиолитической активностью.
ЗАКЛЮЧЕНИЕ
4-(1 Н -тетразол-1-ил)-3-(4-метилфенил)бута-новая кислота обладает более выраженным анксиолитическим действием в сравнении с 4-(1 Н -тетразол-1-ил)-3-(4-метилфенил)бутановой кислотой. Противотревожное действие наиболее выражено в условиях конфликтной ситуации у ( R )-изомера и проявлялось на сопоставимом уровне с препаратами толибут и фенибут.
[и др.] // Экспериментальная и клиническая фармакология. – 2016. – Т. 79, № 4. – С. 18 – 25. – Текст : непосредственный.
Список литературы Оценка анксиолитической активности оптических изомеров 3-зам ещенных 4-(1н-тетразол-1-ил)бутановых кислот
- Волотова Е. В., Филина И. С., Бакулин Д. А. [и др.] // Экспериментальная и клиническая фармакология. – 2016. – Т. 79, № 4. – С. 18 – 25. – Текст : непосредственный.
- Перфилова В. Н., Тюренков И. Н. // Вестник Волгоградского государственного медицинского университета. – 2005. – № 1 (13). – С. 30 – 33. – Текст : непосредственный.
- Резников А. Н., Островский В. А., Климочкин Ю. Н. // Журнал органической химии. – 2018. – Т. 54, № 11. – С. 1699 – 1704. – Текст : непосредственный.
- Султанова К. Т., Яковлев Д. С., Мальцев Д. В. [и др.] // Вестник Волгоградского государственного медицинского университета. – 2018. – № 3 (67). – С. 28 – 32. – Текст : непосредственный.
- Таран А. С., Мальцев Д. В., Яковлев Д. С. [и др.] // Волгоградский научно-медицинский журнал. – 2017. – № 1 (53). – С. 24 – 26. – Текст : непосредственный.
- Ahuja T., Mgbako O., Katzman C., Grossman A. // Case Rep Psychiatry. – 2018. – Vol. 2018. – P. 9864285. – Direct text.
- Dambrova M., Zvejniece L., Liepinsh E. [ et al.] // Eur J Pharmacol. – 2008. – Vol. 583 (1). – P. 128 – 134. – Direct text.
- Dmitriev A. V., Andreev N. I. // Farmakol Toksikol. – 1987. – Vol. 50 (1). – P. 24 – 27. – Direct text.
- Lorrai I., Maccioni P., Gessa G. L., Colombo G. // Front Psychiatry. – 2016. – Vol. 7. – P. 68. – Direct text.
- Morozov I. S., Kovalev G. I., Maisov N. I. [et al.] // Pharm Chem J. – 1977. – Vol. 11. – P. 10 – 12. – Direct text.
- Nuss P. // Neuropsychiatr Dis Treat. – 2015. – Vol. 11. – P. 165 – 175. – Direct text.
- Tyurenkov I. N., Borodkina L. E., Bagmetova V. V. [et al.] // Bull Exp Biol Med. – 2016. – Vol. 160 (4). – P. 465 – 469. – Direct text.
- Voitekhovich S. V., Ivashkevich O. A., Gaponik P. N. // Russian Journal of Organic Chemistry. – 2013. – Vol. 49. – P. 635 – 654. – Direct text.


