Оценка базальных уровней HSP70 у двух термотолерантных видов байкальских амфипод из разных термальных мест обитания
Автор: Бедулина Д.С., Шатилина З.М., Аксенов-Грибанов Д.В., Лубяга Ю.А., Тимофеев М.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.14, 2018 года.
Бесплатный доступ
У двух термотолерантных видов амфипод из оз. Байкал - Eulimnogammarus cyaneus (Dybowsky, 1874) и Gmelinoides flaviatus (Stebbing, 1899), отобранных при различных температурах среды обитания - был оценен уровень Hsp70. Оба вида имеют значительно более высокий уровень Hsp70, чем другие доминирующие амфипод в прибрежной зоне озера. Байкальский эндемичный вид E. cyaneus, отобранный в интервале температурных условий - от 2 до 22 ° C, не обнаружил какой-либо значительной корреляции между базальным уровнем Hsp70 и температурой отбора проб. Однако уровень Hsp70 у G.asciatus зависел от температуры среды обитания и был значительно выше у амфипод, отобранных у горячего источника при 29 ° C, чем на открытом берегу южного Байкала при 8 ° C. Наблюдаемые результаты могут быть объяснены различным эволюционным возрастом изучаемых видов, что указывает на то, что предполагаемый третичный реликт G.asciatus обладает адаптивными преимуществами, позволяющими этому виду широко распространяться за пределами его среды обитания.
Короткий адрес: https://sciup.org/143165197
IDR: 143165197
Текст научной статьи Оценка базальных уровней HSP70 у двух термотолерантных видов байкальских амфипод из разных термальных мест обитания
Белки теплового шока (БТШ, Hsp) -универсальный клеточный механизм защиты от протеотоксических воздействий разного рода (Lindquist and Craig, 1998). Среди множества семейств наиболее изученным являются БТШ с молекулярной массой около 70 кДа – БТШ70, выполняющие функцию молекулярных шаперонов. Эти белки широко применяются в экологических и эволюционных исследованиях за счет их свойств универсальных клеточных биомаркеров стресс-ответа, а также роли в адаптации и приобретении толерантности при распространении видов по разным широтам и условиям с различным давлением абиотических и биотических факторов среды (Tomanek, 2008). Микроэволюционные преобразования мультигенного семейства бтш70 при развитии термотолерантности и адаптации к новым условиям среды включают увеличение числа копий генов этих белков в геноме, изменение их транскрипционной активности, а также увеличение уровня соответствующих белков в протеоме (Evgen’ev et al ., 2004; Zatsepina et al ., 2000; Papot et al ., 2016). На внутривидовом уровне БТШ70 играют важную роль в развитии фенотипической пластичности при распространении видов и последующей адаптации к температурным условиям (Hamdoun et al. , 2003).
Изучение адаптивного потенциала ключевых пресноводных видов очень важно в свете глобальных климатических изменений. Озеро Байкал представляет собой уникальную модель для проведения подобных исследований. Особую роль играет разнообразная фауна эндемичных беспозвоночных, обладающая повышенным уровнем адаптивной радиации (Kozhova and Izmesteva, 1999). Наиболее многочисленная по видовому составу группа организмов принадлежит к отряду высших ракообразных - амфиподам (Crustacea, Amphipoda).
В озере насчитывается 350 эндемичных видов и подвидов (Takhteev et al ., 2015). Байкальские амфиподы отличаются высокой степенью адаптивной радиации, представлены обширным диапазоном форм и размеров, различными экологическими предпочтениями и обитают в широком диапазоне глубин: от верхних отделов литорали до максимальных глубин (Тахтеев и Галимзянова, 2000).
Глобальное изменение климата, влияние которого уже отмечают в прибрежной зоне озера Байкал (Potemkina et al ., 2018), может негативно сказаться на обитающих там сообществах амфипод (Jakob et al. , 2016). В этой связи, особый интерес представляют адаптивные способности видов эврибионтов, которые могут заменить доминирующую в литорали термочувствительную фауну. Самыми распространенными из таких видов являются эндемики Eulimnogammarus cyaneus (Dybowsky, 1874) и Gmelinoides fasciatus (Stebbing, 1899). Оба вида отличаются высокой термотолерантностью и способны обитать в широком диапазоне температур в верхних отделах литорали озера Байкал, а представители вида Gmelinoides fasciatus , кроме того, обнаружены в горячих источниках при температуре 29 ℃ (Тахтеев и Галимзянова, 2009). Мы предполагаем, что система БТШ70 обеспечивает высокий адаптивный потенциал к обитанию при разнообразных температурных условиях, что может являться преимуществом этих двух видов перед другими видами литоральных амфипод в условиях глобального потепления.
Целью настоящего исследования явилась оценка содержания БТШ70 у байкальских амфипод, выловленных при разных температурах в пределах прибрежной зоны озера Байкал и выявление возможной роли этих белков в развитии высокой степени термотолерантности изучаемых видов.
MATERIALS AND METHODS
Исследуемые виды
E. cyaneus (11-15 мм) - типичный представитель верхних отделов литорали оз. Байкал, который населяет каменистые пляжи озера по всей его береговой линии на глубинах от 0 до 20 м, при этом формируя скопления в узкой зоне в полосе прибоя, где отмечаются максимальные колебания температур – от 0 до 21 ℃ в открытой литорали, и до 25-26 ℃ - в бухтах и заливах (Вейнберг, 1995). Для E. cyaneus экспериментально показана повышенная термотолерантность, по сравнению с другими представителями рода Eulimnogammarus , широко представленными в литорали. Выявлено, что такая высокая термотолерантность E. cyaneus обеспечена пятикратным превышением содержания БТШ70, по сравнению с другим, доминирующим в литорали, близкородственным видом Eulimnogammarus verrucosus , увеличенным количеством генов бтш70 в геноме и изоформ БТШ70 в протеоме, а также более эффективной регуляцией экспрессии стресс-индуцированных форм бтш70 (Bedulina et al ., 2013). По экспериментальным данным, температура преферендума для этого вида лежит в диапазоне 1112 ℃ (Тимофеев и Кириченко, 2004).
G. fasciatus (9-15 мм) - типичный литоральный вид, распространенный по всему Байкалу на глубинах от 0 до 5 м, иногда встречающийся на глубине до 100 м (Снимщиковa,1977; Черепанов и др ., 1977). Является одним из предполагаемых теплолюбивых реликтов третичного периода в фауне Байкала (Тахтеев и Галимзянова, 2009; Naumenko et al ., 2017). Данный вид обнаружен в ряде термальных источников в окрестностях Байкала
(Золотой Ключ, Гусихинский, Киронский, Верхняя Заимка), в водах которых обитает в массовом количестве при температурах до 29ºC (Тахтеев и Галимзянова, 2009). Кроме того, G. fasciatus является единственным байкальским видом амфипод, сумевшим преодолеть барьер «несмешиваемости» и широко распространиться за пределы озера по всей длине Ангары и в Енисее до губы включительно. Вид известен тем, что был искусственно акклиматизирован во многих водоемах европейской и азиатской частей России, где успешно прижился (Мордухай-Болтовской и Чиркова, 1971; Нилова, 1976), в дальнейшем распространившись далеко за пределы водоемов, в которые он был первоначально интродуцирован (Panov and Berezina, 2002). Обладает повышенной термотолерантностью и высоким базовым уровнем БТШ70 по сравнению с другими литоральными видами амфипод (Тимофеев, 2010). При экспериментальных исследованиях особи вида проявили предпочтение температурной зоны 17-18℃ (Тимофеев и Кириченко 2004).
Отлов и содержание амфипод
Отбор проб производили в ходе летней кругобайкальской экспедиции. Карта точек вылова и параметры условий среды представлены на рисунке 1 и в таблице 1. Амфипод отлавливали с уреза воды стандартным гидробиологическим методом. Для исследования отбирали взрослых, активно плавающих рачков одной размерно-возрастной группы, избегая пар амфипод и самок с яйцами. Рачков фиксировали в жидком азоте сразу после вылова. Пробы до биохимической обработки хранили в жидком азоте.
Определение конститутивных уровней БТШ70
Выделение общего белка проводили в 0.1 М Трис HCl буфере (рН 7.6). Для выделения белка брали 10
Table 1 Описание точек сбора E. cyaneus и G. fasciatus
|
N |
Название |
Координаты |
Описание и температура |
|
Eulimnogammarus cyaneus |
|||
|
1. |
О. Ольхон, Бухта Хорин-Ирги (Хул) |
53° 4'9.76" СШ 106°55'28.62"ВД |
Грунт - каменисто-илистый, температура при сборе 13°С |
|
2. |
Байкало-Ленский заповедник, мыс Большой Солонцовый |
54°10'13.37"СШ 108°22'15.58"ВД |
Грунт – каменистый, температура 5°С |
|
3. |
Мыс Котельниковский |
55° 4'0.12"СШ 109° 6'24.20"ВД |
Урез воды оз. Байкал рядом с горячими источниками, грунт – каменистый, температура-3°С |
|
4. |
Акватория Забайкальского нац. парка, мыс Самаринский |
53°52'19.10"СШ 109°14'38.84"ВД |
Грунт – крупные камни, температура- 2°С |
|
5. |
Чивыркуйский залив, бух. Змеёвая |
53°45'58.07"СШ 109° 1'37.54"ВД |
На берегу горячие сероводородные источники с температурой »44°С. На урезе воды оз Байкал грунт – мелкие камни, песок, черный ил, макрофиты (элодея) обильно, температура при сборе 22°С |
|
6. |
Чивыркуйский залив, бух. Онкагон |
53°47'32.90"СШ 109° 3'27.92"ВД |
Грунт – каменисто-песчанистый, температура 16°С |
|
7. |
Ушканьи острова, о. Большой Ушканий |
53°51'1.61"СШ 108°39'27.60"ВД |
Грунт – каменисто-песчанистый, температура 16°С |
|
8. |
Пос. Большие Коты |
51°54'11.46"СШ 105° 4'8.55"ВД |
Грунт – каменисто-песчанистый, температура 8°С |
|
Gmelinoides fasciatus |
|||
|
1. |
Мыс Котельниковский, горячие источники |
55° 4'0.12"СШ 109° 6'24.20"ВД |
Горячие минеральные источники, сбор в протоке между выходом источника и Байкалом, грунт-каменистый, температура в месте сбора - 29°С. |
|
2. |
Чивыркуйский залив, бух. Монахово |
53°40'37.56"СШ 109° 1'35.75"ВД |
В изобилии макрофиты, грунт - каменистопесчанистый, температура 25°С |
|
3. |
Пос. Большие Коты |
51°54'11.46"СШ 105° 4'8.55"ВД |
Грунт – каменисто-песчанистый, температура 8°С |
особей E. cyaneus и 20 особей G. fasciatus на одну последующим Вестерн блоттингом. Выровненность пробу.
Количество белка в пробах определяли по методу
М. Брэдфорд (Bradford, 1976) при длине волны 595
нм. Динамику содержания БТШ70 определяли стандартным методом денатурирующего электрофореза с ДДС-Na в 12.5 % полиакриламидном геле (Laemmli, 1970) с белка контролировали, окрашивая мембраны раствором красителя Ponceau 4R. Для анализа использовали только мембраны с одинаковым количеством белка на каждой дорожке. Для визуализации БТШ70 полученные мембраны инкубировали сначала с антителами к БТШ70 (мышиные антитела к БТШ70; Sigma-Aldrich, #H5147, разведение 1:1000). Затем, после промывания от непрореагировавших антител, мембраны инкубировали в растворе вторичных антител, конъюгированных с щелочной фосфатазой (антитела к иммуноглобулину мыши IgG:AP Conj., Sigma-Aldrich # A3562, разведение 1:1000). Полуколичественный анализ содержания исследуемого белка на мембранах проводили с использованием пакета программ ImageJ (v.1.41., Wayne Rasband, NIH, USA). Относительное содержание белка выражено в условных единицах оптической плотности участков связывания антител к БТШ70.
RESULTS AND DISCUSSION
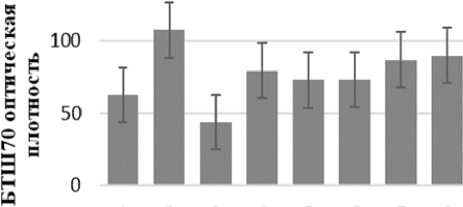
Уровень конститутивного синтеза БТШ70 у зафиксированных сразу после сбора Е. cyaneus варьировал незначительно (Figure 2). Наибольшее содержание БТШ70 отмечали у образцов, выловленных на урезе м. Котельниковский (Сев. Байкал) при температуре в момент вылова 3 ℃. Закономерности, связанной с температурой обитания, в полученных уровнях содержания БТШ70 не выявили. Так, у рачков выловленных в бухте Б. Коты при 8 ℃ уровень БТШ70 не отличается от такового у особей, выловленных в бухте Змеевая при 22℃ (Figure 2).
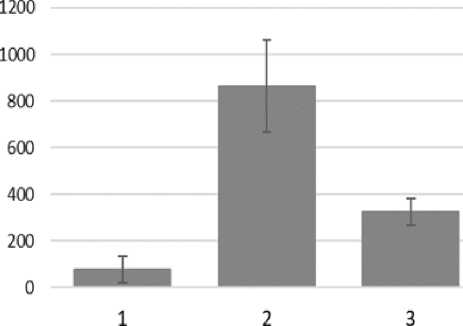
При анализе уровня конститутивного синтеза БТШ70 у другого исследуемого вида - G. fasciatus , была обнаружена корреляция между содержанием белков БТШ70 и температурой вылова (Figure 3). Так, наименьшее содержание БТШ70 отмечали в образцах особей, выловленных в районе Южного Байкала (пос. Большие Коты) при наименьшей из представленных в исследовании температур – 8 ℃. У амфипод, собранных в Чивыркуйском заливе (Центральный Байкал) при 25 ℃ уровень изучаемых стрессовых белков был значительно выше.
Наибольшую интенсивность конститутивного синтеза отмечали у рачков, собранных в протоке гидротермального источника на мысе Котельниковский (Сев. Байкал) при 29 ℃ (Figure 3).
По литературным данным известно, что конститутивные уровни БТШ70 у двух исследованных видов, акклимированных к одинаковым температурным условиям, практически не отличаются и намного превосходят уровни этих белков у других доминирующих видов литоральных амфипод (Тимофеев, 2010). Оба вида в условиях экспериментальной экспозиции при повышенной температуре среды демонстрируют реакцию увеличения содержания БТШ70. Однако, у Е. cyaneus степень повышения содержания этих белков относительно контроля как при остром температурном стрессе (25 ℃), так и при постепенном повышении температуры (со скоростью 1 ℃ в час с 6 до 29 ℃) относительна невелика – не более чем в два раза (Bedulina et al ., 2013; Тимофеев, 2010). Тогда как у G. fasciatus при экспериментальной экспозиции (25 ℃) отмечали повышение содержания БТШ70 более чем в восемь раз относительно контроля (Тимофеев, 2010; Shatilina et al ., 2011).
Согласно современному представлению, высокий конститутивный уровень БТШ70 в клетках многих немодельных организмов является следствием адаптации к выраженным температурным флуктуациям, что позволяет не затрачивать дополнительные энергетические ресурсы на синтез новых БТШ70 при развитии клеточного стресса (Garbuz and Evgen`ev, 2017). Это подтверждают полученные нами ранее данные на байкальских (Bedulina et al., 2013) и балтийских видах амфипод (Bedulina et al., 2010). Полученные в ходе настоящего исследования данные частично согласуются с изложенной концепцией, поскольку уровень БТШ70 у представителей E. cyaneus, выловленных в градиенте температурных условий – от 2 до 22 ℃, флуктуирует незначительно и не коррелирует с температурой вылова.
Однако, у другого исследованного нами вида наблюдается иная картина. Не смотря на изначально высокий уровень БТШ70, содержание этого белка у особей, выловленных в Чивыркуйском заливе при 25
℃ примерно в три раза выше, чем у рачков, выловленных в пос. Большие Коты при 8 ℃, а содержание БТШ70 у рачков из горячего источника (29 ℃) в восемь раз превышает уровень этих белков у популяции из Больших Котов. Причина такой реакции системы БТШ70 на температуру у этого вида может крыться в видоспецифических особенностях структуры и функционирования этого белкового семейства.
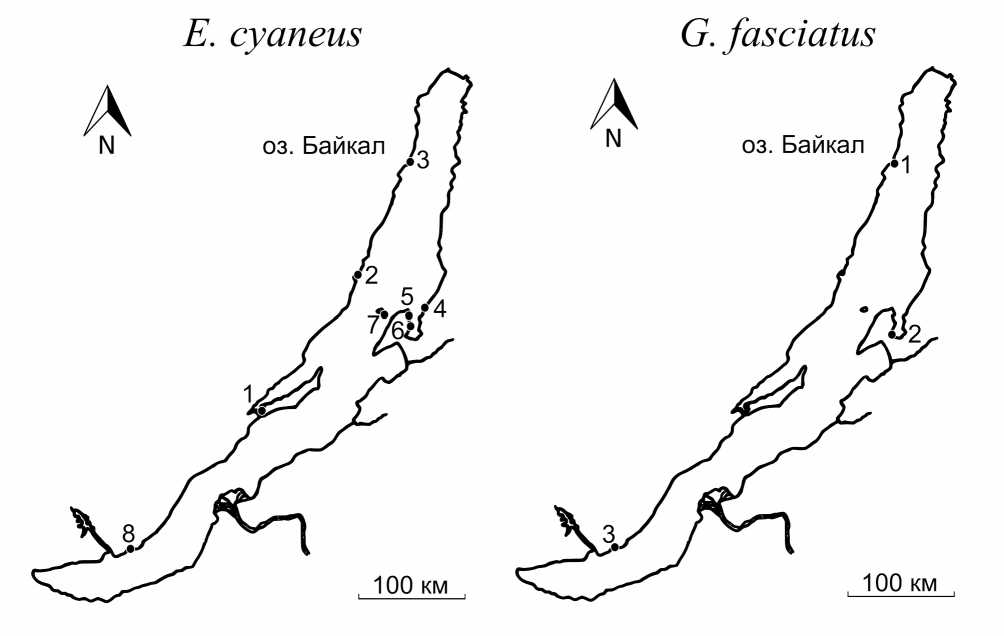
Figure 1. Карта точек вылова E. cyaneus и G. fasciatus . Амфипод отлавливали с уреза воды и фиксировали в жидком азоте в течение 15 минут после вылова. Описание точек вылова представлено в таблице 1.
66,2 кДа —►
1 2 3 4 5 6 7 8
-
1 м. Самаринский, 2 °C
-
2 м. Котельниковский, 3 °C
-
3 м. Б. Солонцовый, 5 °C
-
4 бух. Б. Коты, 8°С
-
5 прол. Малое Море, 13 °C
-
6 о. Большой Ушканий, 16 °C
-
7 Чивыркуйский залив, бух. Онкагон, 16 °C
-
8 Чивыркуйский залив, бух. Змеёвая, 22 °C
Figure 2. Содержание БТШ70 у E. cyaneus, выловленных в различных точках озера Байкал и зафиксированных непосредственно после вылова.

1 бух. Большие Коты, 8°С2 м. Котельниковский, горяч.ист-к., 29°С3 Чивыркуйский залив, бух. Монахово, 25°С
Figure 3. Содержание БТШ70 у G. fasciatus, выловленных в различных точках озера Байкал и зафиксированных непосредственно после вылова.
Известно, что БТШ70 представлены в клетках конститутивными и стресс-индуцибельными формами (Lindquist and Craig, 1998). По данным предыдущего исследования у амфипод обнаружен как достаточно высокий межвидовой полиморфизм числа генов и белков БТШ70, так и функционирования генов, выражающийся в различной структуре промоторов и разной степени связывания факторов теплового шока с элементами теплового шока для обеспечения стресс-индуцируемой экспрессии (Bedulina et al ., 2013). Вероятно, что G. fasciatus обладает определенными видоспецифичными особенностями семейства БТШ70, которые сформировались у него в ходе длительной эволюции в озере Байкал. Учитывая тот факт, что вид является представителем эволюционно древней филогенетической клады Micruropodidae и, предположительно, реликтом третичного периода, он мог приобрести дополнительные молекулярные и биохимические адаптации к температурным условиям среды. Считается, что древняя фауна, сохранившаяся до сегодняшних дней в озере, переживала эпоху оледенений в рефугиумах, каковыми являются горячие источники (Тахтеев и Галимзянова, 2009).
Таким образом, вероятно система БТШ70 G. fasciatus претерпела значительные микроэволю-ционные изменения, что позволяет этому виду демонстрировать высокие показатели толерантности и активно распространяться в новые для него ареалы.
CONCLUSIONS
Проведенное исследование демонстрирует высокую степень эволюционной пластичности семейства БТШ70 у двух наиболее термотолерантных видов байкальских амфипод. Полученные данные указывают на особенности молекулярной эволюции изучаемого генного семейства у амфипод из озера Байкал, связанные с длительной эволюцией. Кроме того, результаты указывают на существенные адаптивные преимущества обоих исследованных видов перед температурно-чувствительными видами, доминирующими в литорали, в свете глобального изменения климата, и на особое положение G. fasciatus, позволяющее этому виду осваивать новые ареалы и вытеснять более чувствительные виды.
ACKNOWLEDGEMENT
Список литературы Оценка базальных уровней HSP70 у двух термотолерантных видов байкальских амфипод из разных термальных мест обитания
- Вейнберг, И.В. (1995). Сообщества макрозообентоса каменистого пляжа озера Байкал. Дис. канд. биол. наук. Иркутск. 180 с
- Мордухай-Болтовской, Ф.Д., Чиркова, З.Н. (1971). О распространении байкальского бокоплава Gmelinoides fasciatus (Stebbing) в Горьковском водохранилище. Биология внутренних вод: Информационный бюллетень, (9), 38-42
- Нилова, О.И. (1976). Некоторые черты экологии и биологии Gmelinoides fasciatus (Stebb.), акклиматизированных в озере Отрадное Ленинградской области. Известия ГосНИОРХ, 110, 10-15
- Снимщикова, Л.Н. (1977). Бентос Истокского сора. Лимнология прибрежно-соровой зоны Байкала. Новосибирск: Наука, 192-197
- Тахтеев, В.В. (2000). Очерки о бокоплавах озера Байкал: Систематика, сравнительная экология, эволюция. Издательство Иркутского университета
- Тахтеев, В.В., Галимзянова, А.В. (2009). Байкальские родники. Экология и жизнь, 3(88), 40-45
- Тимофеев, М.А., Кириченко, К.А. (2004). Экспериментальная оценка роли абиотических факторов в ограничении распространения эндемиков за пределы озера Байкал на примере амфипод. Сибирский экологический журнал, 11(1), 41-50
- Тимофеев, М.А. (2010). Экологические и физиологические аспекты адаптации к абиотическим факторам среды эндемичных байкальских и палеарктических амфипод. Дисс. докт. биол. наук. Иркутск. 384 c
- Черепанов, В.В., Александров, В.Н., Камалтынов, Р.М., Наделяев, И.Н. (1977). Зообентос прибрежно-соровых участков Северного Байкала. Лимнология прибрежно-соровой зоны Байкала. -Новосибирск: Наука. Сиб. отд-ние, 198-207
- Bedulina, D.S., Evgen'ev, M.B., Timofeyev, M.A., Protopopova, M.V., Garbuz, D.G., Pavlichenko, V.V., Sokolova, I.M. (2013). Expression patterns and organization of the hsp70 genes correlate with thermotolerance in two congener endemic amphipod species (Eulimnogammarus cyaneus and E. verrucosus) from Lake Baikal. Mol Ecol, 22(5), 1416-1430
- Bedulina, D.S., Zimmer, M., Timofeyev, M.A. (2010). Sub-littoral and supra-littoral amphipods respond differently to acute thermal stress. Comp Biochem Physiol B, 155(4), 413-418
- Bradford, M.M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72, 248-254
- Garbuz, D.G., Evgen'ev, M.B. (2017). The evolution of heat shock genes and expression patterns of heat shock proteins in the species from temperature contrasting habitats. Rus J Genet, 53(1), 21-38
- Evgen'ev, M.B., Zatsepina, O.G., Garbuz, D., Lerman, D.N., Velikodvorskaya, V., Zelentsova, E., Feder, M.E. (2004). Evolution and arrangement of the hsp70 gene cluster in two closely related species of the virilis group of Drosophila. Chromosoma, 113(5), 223-232
- Hamdoun, A.M., Cheney, D.P., Cherr, G.N. (2003). Phenotypic plasticity of HSP70 and HSP70 gene expression in the Pacific oyster (Crassostrea gigas): implications for thermal limits and induction of thermal tolerance. Biol Bul, 205(2), 160-169
- Jakob, L., Axenov-Gribanov, D.V., Gurkov, A.N., Ginzburg, M., Bedulina, D.S., Timofeyev, M.A., Pörtner, H.O. (2016). Lake Baikal amphipods under climate change: thermal constraints and ecological consequences. Ecosphere, 7(3)
- Kozhova, O.M., Izmesteva L.R. (1998) Lake Baikal: Evolution and Biodiversity. Backhuys Publishers. Leiden. 447 p
- Laemmli, U.K. (1970) Most commonly used discontinuous buffer system for SDS electrophoresis. Nature, 227, 680-685
- Lindquist, S., Craig, E.A. (1988). The heat-shock proteins. Annu Rev Genet, 22(1), 631-677
- Naumenko, S.A., Logacheva, M.D., Popova, N.V., Klepikova, A.V., Penin, A.A., Bazykin, G.A., Yampolsky, L.Y. (2017). Transcriptome-based phylogeny of endemic Lake Baikal amphipod species flock: fast speciation accompanied by frequent episodes of positive selection. Mol Ecol, 26(2), 536-553
- Papot, C., Cascella, K., Toullec, J.Y., Jollivet, D. (2016). Divergent ecological histories of two sister Antarctic krill species led to contrasted patterns of genetic diversity in their heat-shock protein (hsp70) arsenal. Ecol Evol, 6(5), 1555-1575
- anov, V.E., Berezina, N.A. (2002). Invasion history, biology and impacts of the Baikalian amphipod Gmelinoides fasciatus. In Invasive Aquatic Species of Europe. Distribution, Impacts and Management. Springer, Dordrecht. (pp. 96-103)
- Potemkina, T.G., Potemkin, V.L., Fedotov, A.P. (2018). Climatic factors as risks of recent ecological changes in the shallow zone of Lake Baikal. Rus Geol Geophys, 59(5), 556-565
- Shatilina, Z.M., Riss, H.W., Protopopova, M.V., Trippe, M., Meyer, E.I., Pavlichenko, V.V., Timofeyev, M.A. (2011). The role of the heat shock proteins (HSP70 and sHSP) in the thermotolerance of freshwater amphipods from contrasting habitats. J Therm Biol, 36(2), 142-149
- Takhteev, V.V., Berezina, N.A., Sidorov, D.A. (2015). Checklist of the Amphipoda (Crustacea) from continental waters of Russia, with data on alien species. Arthropoda Selecta, 24(3), 335-370
- Tomanek, L. (2008). The importance of physiological limits in determining biogeographical range shifts due to global climate change: the heat-shock response. Physiol Biochem Zool, 81(6), 709-717
- Zatsepina, O.G., Ulmasov, K.A., Beresten, S.F., Molodtsov, V.B., Rybtsov, S.A., Evgen'ev, M.B. (2000). Thermotolerant desert lizards characteristically differ in terms of heat-shock system regulation. J Exp Biol, 203(6), 1017-1025


