Оценка безопасности селективной церебральной перфузии у детей при реконструкции дуги аорты
Автор: Ильинов Владимир Николаевич, Кривощеков Евгений Владимирович, Гинько Владимир Евгеньевич, Киселев Валерий Олегович, Николишин Александр Николаевич, Горохов Антон Сергеевич, Якимова Евгения Валентиновна, Шипулин Владимир Митрофанович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Цель Оценить безопасность методики антеградной селективной церебральной перфузии (АСЦП) и умеренной гипотермии при реконструкции дуги аорты у детей разных возрастных групп. Материал В отделении кардиохирургии № 2 НИИ кардиологии (Томск) прооперировали 25 больных с обструкцией и методы дуги аорты. Пациенты разделены на две группы: в первую группу вошли 13 пациентов до 1 года, во вторую - 12 детей старше 1 года. Всем выполнена реконструкция дуги аорты в условиях АСЦП и умеренной гипотермии. На разных этапах вмешательства пациентам осуществляли заборы венозной крови из верхней и нижней полых вен в целях оценки адекватности перфузии. результаты Летальных исходов, неврологических и ренальных осложнений не наблюдалось. По данным датчиков спектроскопии параинфракрасного диапазона в области головного мозга, снижения сатурации ниже 40% за период реконструкции дуги аорты в обеих группах не зафиксировано. При последующем анализе показателей сатурации венозной крови из полых вен выявлено достоверное отличие между группами среди образцов из нижней полой вены во втором и третьем заборе крови, при этом снижение сатурации менее 40% отмечено только у 6 пациентов второй группы. Выводы Используемый температурный режим, а также объемная скорость перфузии позволяет эффективно обеспечить органопротекцию во время вмешательства на дуге аорты у детей разных возрастных групп.
Коарктация, антеградная селективная церебральная перфузия
Короткий адрес: https://sciup.org/142140681
IDR: 142140681 | УДК: 616.132.14-089.844:612.824-036.8]-053.2
Текст научной статьи Оценка безопасности селективной церебральной перфузии у детей при реконструкции дуги аорты
в условиях АСЦП и умеренной гипотермии. При наличии сопутствующего врожденного порока сердечнососудистой системы (ВПС) также выполняли коррекцию порока. В исследование не включались пациенты с «синими пороками» и гемодинамикой единственного желудочка сердца.
Врожденный порок сердца диагностировали на основании жалоб, анамнеза, объективного осмотра, лабораторных и инструментальных данных. При объективном осмотре градиент давления между верхними и нижними конечностями составил 45±14 мм рт. ст. в обеих группах. Визуализацию дуги аорты осуществляли с помощью ЭхоКГ в сочетании с цветной допплерографией и мультиспиральной компьютерной томографии грудной аортографией.
Пациентов разделили на 2 группы: в первую группу вошли 13 пациентов в возрасте до 1 года, во вторую – 12 детей старше 1 года. Клиническая характеристика пациентов представлена в табл. 1.
В рамках предоперационной подготовки всем пациентам с целью контроля адекватности перфузии на этапе реконструкции дуги аорты выполняли катетеризацию правой лучевой артерии и одной из бедренных артерий для проведения прямой манометрии. Для контроля оксиметрии в головном мозге и почках устанавливали датчики спектроскопии параинфракрасного диапазона INVOS 5100C (Somanetics, США) в соответствующем регионе.
Реконструкцию дуги аорты выполняли через срединную стернотомию. Подключение аппарата искусственного кровообращения осуществляли по схеме «аорта – полые вены» или «брахиоцефальный ствол (БЦС) – полые вены» путем канюляции сосудистого протеза, предварительно реплантированного к БЦС. Больного охлаждали до 28–30 °С в прямой кишке. На каждой венозной канюле устанавливали переходник с «люером», с которым соединялась инфузионная линия с трехходовым краном. При достижении целевой температуры выполняли первый забор крови для анализа кислотно-щелочного состояния из верхней полой вены (ВПВ) и нижней полой вены (НПВ). Все заборы крови осуществляли строго при пережатых турникетами полых венах. На этапе АСЦП объемную скорость перфузии снижали до 30% от нормативной (50–60 мл/ кг . мин). Перед пуском кровотока в нисходящую аорту выполняли второй забор крови. Третий забор крови осуществляли после пуска кровотока в нисходящую аорту и ветви дуги, четвертый – после согревания больного перед этапом деканюляции. Техника операции представлена на рисунке .
После этапа реконструкции дуги аорты при наличии сопутствующего ВПС выполняли коррекцию этого порока. В первой группе 6 пациентам проводили пластику дефекта межпредсердной перегородки (ДМПП), двум из которых выполнены перемещение аберрантной правой подключичной артерии в правую общую сонную и двум пациентам – пластика дефекта межжелудочковой перегородки (ДМЖП), одному – пластика митрального клапана и еще одному пациенту открытая комиссуротомия аортального клапана. Во второй группе двум пациентам выполнена пластика ДМПП и одному – перемещение аберрантной правой подключичной артерии в правую общую сонную. Перед отключением АИК всем пациентам проводили модифицированную ультрафильтрацию.
Результаты исследования обрабатывали с помощью программного обеспечения SPSS 17.0. Для статистического анализа показателей использовали непараметрические критерии (для сравнения данных разных групп – критерий Манна – Уитни, для повторных измерений – критерий Вилкоксона). Различия между значениями считали статистически значимыми при р<0,05.
Результаты и обсуждение
Летальных исходов, неврологических и ренальных осложнений не наблюдалось. Параметры перфузии, а также раннего послеоперационного периода представлены в табл. 2.
По данным датчиков спектроскопии параинфракрасного диапазона, в области головного мозга снижение сатурации ниже 40% за период АСЦП в обеих группах не зафиксировано. Однако отмечено уменьшение почечной сатурации ниже 40% у 3 пациентов первой группы на 2, 11, и 8 мин. На момент второго забора крови значение почечной сатурации по данным датчиков спектроскопии параинфракрасного диапазона восстановилось до нормальных показателей.
При последующем анализе показателей сатурации венозной крови из полых вен выявлено достоверное отличие между группами среди образцов из НПВ во втором и третьем заборе крови, при этом снижение сатурации менее 40% отмечено только у 6 пациентов второй группы. Данные показателей сатурации приведены в табл. 3. В первом заборе крови показатель венозной сатурации в ВПВ выше, чем в НПВ на 3 (2; 13) и 9 (2; 16)% для первой и второй групп соответственно, с учетом того что забор выполняли в условиях гипотермии. В показателях четвертого забора венозная сатурация была выше в НПВ, чем в ВПВ на 9 (1; 21) в первой и 5 (0; 10)% во второй группе.
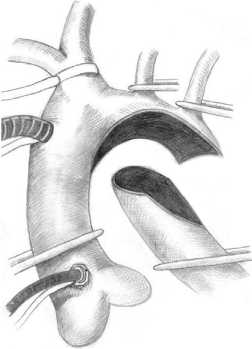
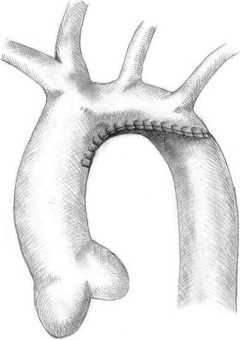
Реконструкция гипоплазированной дуги аорты нативными тканями: а – на этапе селективной перфузии; б – конечный результат
При достижении целевой температуры РО2 в артериальной крови составило 303 (286; 365) и 421 (370; 429) мм рт. ст. для первой и второй групп соответственно. Артериовенозная разница РО2 во втором заборе из ВПВ составила в первой группе 238 (188; 262) и 332 (292; 354) мм рт. ст. во второй, р = 0,011. Артериовенозная разница РО2 во втором заборе из НПВ составила 260 (216; 314) и 390 (360; 394) мм рт. ст. для первой и второй групп соответственно, р = 0,006. Эти данные также свидетельствуют о большем потреблении кислорода тканями у пациентов второй группы.
Наибольшие значения лактата сыворотки выявлены во втором и третьем заборе крови. Показатель лактата в ВПВ во втором заборе 2 (1,5; 2,4) и 1,6 (1,5; 1,8) ммоль/л для 1-й и 2-й групп соответственно. Показатель лактата во втором заборе из НПВ составил в 1-й группе 2,3 (1,9; 3,4) и 2,2 (1,7; 3,8) ммоль/л во 2-й группе. В третьем заборе лактат в ВПВ – 2,6 (1,9; 3,0) и 2,1 (1,8; 2,3) ммоль/л в 1-й и 2-й группах соответственно. Показатели из НПВ в 1-й группе составили 3,1 (2,5; 4,3), во 2-й группе – 3,2 (2,0; 3,3) ммоль/л.
Все пациенты выписаны в удовлетворительном состоянии. Длительность госпитализации составила 11 (8; 12) и 9 (8; 10) дней для первой и второй групп соответственно. При контрольном измерении артериального давления на руках и ногах градиента давления не выявлено.
Используемый температурный режим, а также ОСП обеспечивают эффективную органопротекцию во время вмешательства на дуге аорты у детей разных возрастных групп. Отсутствие осложнений со стороны внут- ренних органов у детей 1-й группы на фоне снижения сатурации, по данным датчиков спектроскопии параинфракрасного диапазона, на этапе АСЦП с нормализацией показателей до момента пуска кровотока в нисходящую аорту, подтвержденное данными анализов из полых вен, указывает на достаточный температурный режим. В работе Ly и соавт. при сравнении пациентов, которым выполняли реконструкцию дуги аорты в условиях гипотермии менее 28 °С и нормотермии в послеоперационном периоде, достоверных отличий не было, при этом смертность в группе с нормотермией выше на 1,5% [6]. Известно, что при уменьшении центральной венозной сатурации, то есть в верхней полой вене, ниже 40% при сердечно-легочной реанимации ассоциируется со 100% летальностью [7]. В нашем исследовании у пациентов 1-й группы такое снижение венозной сатурации в крови не зафиксировано. Влияние гипотермии на снижение обменных процессов более выраженно у маленьких детей, поэтому мы считаем, что 28–30 °С – оптимальный температурный режим для этой категории больных [2].
У детей старше 1 года снижение показателей сатурации при спектроскопии параинфракрасного диапазона на этапе АСЦП в головном мозге и почках не зафиксировано, при этом уменьшение венозной сатурации ниже 40% в анализах из НПВ во втором и третьем заборе крови отмечено у 6 пациентов. Это указывает на то, что спектроскопия параинфракрасного диапазона имеет погрешность: прибор измеряет сатурацию на ограниченном участке тканей и не может заменить показатели крови [8, 9].
Таблица 1 Клиническая характеристика больных по группам
|
— |
|||
|
Показатель |
1-я группа, % |
2-я группа, % |
|
|
0 |
23 |
84 |
|
|
Недостаточность кровообращения |
1 |
31 |
8 |
|
2А |
46 |
8 |
|
|
I |
23 |
84 |
|
|
ФК по NYHA |
II |
31 |
8 |
|
III |
46 |
8 |
|
|
0 |
23 |
100 |
|
|
I |
8 |
||
|
Легочная гипертензия |
II |
15 |
– |
|
III |
54 |
– |
|
|
Возраст |
1 [0; 5] мес. |
8 [4; 12] лет |
|
|
Вес, кг |
4,5 [4,1; 6,4] |
25,5 [16,2; 44,3] |
|
Таблица 2 Параметры перфузии и раннего послеоперационного периода, Ме [Q 25; Q 75]
|
Показатель |
1-я группа |
2-я группа |
р |
|
Время ИК, мин |
83 [75; 90] |
75 [65; 8] |
0,23 |
|
Время окклюзии аорты, мин |
34 [30; 36] |
25 [25; 36] |
0,562 |
|
Время АСЦП, мин |
25 [20; 27] |
23 [23; 34] |
0,026 |
|
Длительность ИВЛ, мин |
180 [140; 510] |
100 [75; 137] |
0,001 |
|
Длительность пребывания в ОАР, сут |
5 [1; 5] |
≤ 1 |
0,002 |
|
Диурез в первые сутки после вмешательства, мл/кг . ч |
2,5 [2; 3,1] |
1,8 [1,2; 2,3] |
0,011 |
|
Лактат после первых суток, моль/л |
1,2 [1,1; 1,6] |
1,4 [1,25; 2,6] |
0,902 |
|
Мочевина после первых суток, ммоль/л |
6,6 [6,3; 6,7] |
5,9 [4,75; 6,2] |
0,021 |
|
Объем кровопотери по дренажам, мл/кг . сут |
12 [11,9; 12,8] |
5,9 [3,7; 8,4] |
<0,001 |
Таблица 3 Показатели сатурации венозной крови из полых вен, Ме [Q 25; Q 75]
|
Этап забора крови |
1-я группа, % |
2-я группа, % |
р |
|
|
1 |
ВПВ |
92 [88; 94] |
92 [86; 95] |
0,724 |
|
НПВ |
87 [80; 91] |
81 [79; 85] |
0,087 |
|
|
2 |
ВПВ |
92 [87; 96] |
90 [88; 95] |
0,786 |
|
НПВ |
78 [67; 81] |
43 [37; 55] |
<0,001 |
|
|
3 |
ВПВ |
88 [82; 92] |
85 [77; 89] |
0,186 |
|
НПВ |
75 [68; 87] |
58 [52; 66] |
0,003 |
|
|
4 |
ВПВ |
75 [67; 86] |
80 [76; 82] |
0,463 |
|
НПВ |
84 [81; 88] |
84 [81; 92] |
1,00 |
|
В литературе появляется все больше публикаций, посвященных реконструктивным вмешательствам на дуге аорты у детей, выполняемым через срединную стернотомию с использованием АСЦП, как более эффективным методам лечения этой категории пациентов [4, 6, 10]. При этом надо отметить, что, по данным Society of Thoracic Surgeons Congenital Heart Surgery Database, использование искусственного кровообра- щения у пациентов с КоАо не повышает риск развития летального исхода [10].
Коррекция обструкции дуги аорты доступом через срединную стернотомию в условиях АСЦП и умеренной гипотермии – эффективный, безопасный и легко воспроизводимый способ устранения этой патологии.
Список литературы Оценка безопасности селективной церебральной перфузии у детей при реконструкции дуги аорты
- Kouchoukos N., Blackstone E., Hanley F., Kirklin J. Kirklin/BarrattBoyes cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications. 2013. 4th ed. Р. 67-132; 1718-1779.
- Mavrodis C., Backer С. Pediatric Cardiac Surgery. 2013. P. 256-282.
- Mossad E., Machado S., Apostolakis J. Bleeding Following Deep Hypothermia and Circulatory Arrest in Children//Semin. Cardiothorac. Vasc. Anesth. 2007. Vol. 11. P. 34-46.
- Fraser C., Andropoulos D. Principles of Antegrade Cerebral Perfusion During Arch Reconstruction in Newborns/Infants//Pediatric. Cardiac. Surgery Annual. 2008. Vol. 11. № 1. P. 61-68.
- Asou T., Kado H., Imoto Y., Shiokawa Y., Tominaga R., Kawachi Y., Yasui H. Selective cerebral perfusion technique during aortic arch repair in neonates//The Ann. of Thorac. Surg. 1996. Vol. 61. № 5. P. 1546-1548.
- Ly M., Roubertie F., Belli E., Grollmuss O., Bui M.T., Roussin R., Lebret E., Capderou A., Serraf A. Continuous Perfusion for Aortic Arch Repair: Hypothermia Versus Normothermia//Ann. Thorac. Surg. 2011. Vol. 92. № 3. P. 942-948.
- Сметкин А.А., Киров М.Ю. Мониторинг венозной сатурации в арнестезиологии и интенсивной терапии//Общая реаниматология. 2008. Т. 4. № 4. С. 86-90.
- Li J., Arsdell G., Zhang G. et al. Assessment of the relationship between cerebral and splanchnic oxygen saturations measured by near-infrared spectroscopy and direct measurements of systemic haemodynamic variables and oxygen transport after the Norwood procedure//Heart. 2006. Vol. 92. № 11. P. 1678-1685.
- McQuillen P., Nishimoto M., Bottrell C., Fineman L., Hamrick S., Glidden D., Azakie A., Adatia I., Miller S. Regional and central venous oxygen saturation monitoring following pediatric cardiac surgery: concordance and association with clinical variables//Pediatr. Crit. Care Med. 2007. Vol. 8. № 2. P. 154-160.
- Ungerleider R., Pasquali S. et al. Contemporary patterns of surgery and outcomes for aortic coarctation: an analysis of the society of thoracic surgeons congenital heart surgery database//J. Thorac. Cardiovasc. Surg. 2013. Vol. 145. № 1. P. 1-20.


