Оценка биораспределения invivo 68Gа-метионина - потенциального радиотрейсера для позитронной эмиссионной томографии опухолей
Автор: Тищенко В.К., Петриев В.М., Михайловская А.А., Сморызанова О.А.
Рубрика: Научные статьи
Статья в выпуске: 2 т.27, 2018 года.
Бесплатный доступ
Позитронная эмиссионная томография (ПЭТ) - один из наиболее надёжных и высокочувствительных методов визуализации опухолей. В течение последних десятилетий ПЭТ с использованием в качестве радиотрейсеров аминокислот с радиоактивной меткой стал широко используемым методом диагностики. Галлий-68 (68Ga) - перспективный радионуклид для проведения ПЭТ-исследований, благодаря своим оптимальным ядерно-физическим свойствам и доступностью получения из генератора 68Ge/68Ga. По этим причинам мы инициировали разработку нового соединения на основе аминокислоты метионина, меченного 68Ga, для визуализации рака. Целью данного исследования стала оценка биораспределения 68Ga-метионина после внутривенного введения крысам Wistar с холангиомой РС-1 и его сравнение с 68GaCl3. Для этого в различные сроки после введения препарата выделяли образцы органов и тканей и проводили их радиометрию с помощью автоматического гамма-счётчика. Проведённые исследования показали, что накопление 68Ga-метионина в опухоли возрастало с 0,28% от введённой дозы на 1 г ткани (%/г) через 5 мин до 0,37%/г через 1 ч, 0,77%/г через 3 ч и 0,85%/г через 5 ч. Содержание же 68GaCl3 не превышало 0,34%/г. Высокое количество радиоактивности (1,56-3,98%/г) отмечалось в крови. Во внутренних органах относительно высокий уровень накопления наблюдался лишь в печени, селезёнке и почках. Аккумуляция радиоактивности в других органах и тканях составляла менее 1%/г. Полученные результаты могут быть использованы при разработке радиотрейсера на основе 68Ga и метионина для визуализации опухолей методом ПЭТ.
Галлий-68, фтор-18, аминокислоты, метионин, позитронная эмиссионная томография, радиофармацевтические препараты, холангиома рс-1, радионуклидная диагностика, радиобиологические эффекты, визуализация опухоли
Короткий адрес: https://sciup.org/170170352
IDR: 170170352 | УДК: 616-006.04-07:615.849.2.03-092.9 | DOI: 10.21870/0131-3878-2018-27-2-97-106
Текст научной статьи Оценка биораспределения invivo 68Gа-метионина - потенциального радиотрейсера для позитронной эмиссионной томографии опухолей
Онкологические заболевания представляют собой важную медико-социальную проблему. В общегосударственном масштабе социальные проблемы онкологических заболеваний связаны с их широким распространением и неуклонной тенденцией к росту заболеваемости. Одним из основных условий, определяющих возможность успешного лечения злокачественных новообразований, является возможность обнаружения потенциально злокачественных изменений ещё на доклиническом этапе их развития.
Позитронная эмиссионная томография (ПЭТ) – один из наиболее высокочувствительных диагностических методов, она позволяет выявлять метаболические нарушения в опухолях и окружающих тканях и обнаруживать опухолевые поражения в ситуациях, когда структурные изменения не определяются или неспецифичны, а также оценивать ранний ответ опухоли на специфическую терапию и прогнозировать результаты лечения.
Важную роль в широком распространении метода ПЭТ играют радиофармпрепараты (РФП). В настоящее время в мире синтезировано более 200 РФП для ПЭТ-диагностики тех или иных патологических состояний [1]. Тем не менее, на сегодняшний день более 90% всех ПЭТ-исследований проводится с 2-18F-фтор-2-дезокси-D-глюкозой (18F-ФДГ). Фтор-18 является цик-
Тищенко В.К. – ст. научн. сотр., к.б.н.; Петриев В.М.* – вед. научн. сотр., д.б.н.; Михайловская А.А. – ст. научн. сотр., к.б.н.; Сморыза-нова О.А. – ст. научн. сотр., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
лотронным радионуклидом с периодом полураспада всего 110 мин, из-за чего мечение необходимо производить непосредственно перед введением РФП. К недостаткам использования 18F-ФДГ относится и необходимость применения медицинского циклотрона и дорогостоящего оборудования для автоматизированного синтеза, что приводит к высокой стоимости клинической дозы РФП [2].
Альтернативным радионуклидом для проведения ПЭТ-исследований является галлий-68 (68Ga). Возможность его получения в ионной форме в течение длительного времени из коммерчески доступного генератора 68Ge/68Ga непосредственно в медицинском учреждении даёт огромное преимущество [3]. Использование таких генераторов создаёт возможность организации мобильных ПЭТ-центров (не «привязанных» к циклотрону), которые позволят обеспечить удалённые районы страны современными методами диагностики. Кроме того, ядерно-физические свойства 68Ga (Т 1/2 =68 мин, β+=89%, Е β +max =1,9 МэВ) являются оптимальными для создания диагностических РФП.
Не менее важен поиск носителей радиоактивной метки. Наилучшими РФП для ПЭТ являются естественные питательные вещества для клеток живого организма, их метаболиты или синтетические аналоги. Подходящими соединениями для этих целей могут стать аминокислоты. Возможность их применения обусловлена метаболическими различиями между нормальными и опухолевыми клетками. Опухолевая трансформация клетки сопровождается повышенным потреблением и утилизацией аминокислот, а также резким возрастанием экспрессии специфических белков-транспортёров аминокислот [4, 5].
Метионин – незаменимая алифатическая серосодержащая аминокислота, играющая важную роль во внутриклеточном метаболизме. Так, метионин является единственным донором метильных групп в реакциях трансметилирования, источником серы при биосинтезе цистеина, а взаимодействие метионина с тРНК инициирует трансляцию белка. 11С-метионин (11С-МЕТ) является вторым РФП по частоте использования в онкологической практике после 18F-ФДГ. Он применяется главным образом в нейроонкологии для диагностики, дифференциальной диагностики и оценки эффективности лечения злокачественных и доброкачественных новообразований головного мозга [6].
Мечение биологических молекул галлием-68 может быть прямым или с использованием хелатора, связывающего 68Ga с биомолекулой. Прямой способ применяется для мечения белков (например, трансферрина, лактоферрина, ферритина), что обусловлено химическим сходством Ga(III) и Fe(III) [7]. Прямое мечение с образованием низкомолекулярных комплексов обычно используется для создания радиотрейсеров для визуализации перфузии или других биологических процессов, где накопление препарата определяется его зарядом, липофильностью и размером [8]. Учитывая перспективность создания новых РФП на основе аминокислот и радионуклида 68Ga, целью данного исследования стали разработка и изучение биораспределения 68Ga-метионина, полученного прямым введением 68Ga в молекулу, на животных-опухоленосителях.
Материалы и методы
Химическая часть. Для получения меченого препарата 10,0 мг метионина растворяют в 2,0 мл бидистиллированной воды, доводят рН до 2,0 с помощью 3 М раствора соляной кислоты. К раствору метионина добавляют 3,7 МБк (0,1 мКи) 68GaCl 3 в 0,5 мл 0,05 М HCl, перемешивают в течение 5 мин, доводят рН до 5,6-6,0 0,1 М раствором бикарбоната натрия.
Для количественного определения уровня связанного 68Ga с метионином, несвязанного и гидролизованного 68Ga использовали метод бумажной хроматографии. В качестве неподвижной фазы использовали Ватман-1 (Sigma-Aldrich), подвижная фаза состояла из ацетона, 0,15 М раствора натрия хлорида и 0,05%-ного раствора лимонной кислоты. При элюировании 0,15 М раствором натрия хлорида 68Ga, связанный с аминокислотами, сдвигается со старта (R f =0,1-0,20), несвязанный 68Ga сдвигается со старта (R f =0,30-0,40), гидролизованный 68Ga остаётся на старте (R f =0). При элюировании 0,05%-ным раствором лимонной кислоты 68Ga, связанный с аминокислотами, и свободный 68Ga поднимается с фронтом элюента (R f =0,80-0,90).
Количественное определение концентрации 68Ga-метионина, свободного 68Ga и гидролизованного 68Ga проводили с помощью радиометрии полосок хроматографической бумаги. Для этого на полоски хроматографической бумаги шириной 10 мм и длиной 110 мм с помощью микропипетки («Labsystems», Финляндия) наносили 5,0 мкл исследуемой пробы, полоски помещали вертикально в стакан и проводили элюирование. После того, как элюент поднимался на высоту 100 мм, полоски удаляли из хроматографического стакана, высушивали при комнатной температуре, разрезали на 5 равных частей и проводили радиометрию. По результатам радиометрии с помощью автоматического гамма-счётчика «Wizard» версии 2480 фирмы PerkinElmer/Wallac (Финляндия) вычисляли в процентах концентрацию 68Ga-метионина, свободного 68Ga и гидролизованного 68Ga.
Уровень связывания 68Ga с метионином составил 92% в самом начале проведения реакции и сохранялся практически на этом же уровне в течение 5 ч.
Биологическая часть. Изучение биораспределения 68Ga-метионина проводили на крысах линии Wistar с перевитой подкожно холангиомой РС-1, самках, с массой тела 140-160 г. Всего было использовано 32 животных.
Для получения солидного варианта холангиомы PC-1 брали крысу-донора с опухолью, де-капитировали и выделяли опухолевую ткань. Затем опухолевую ткань измельчали, разводили в физиологическом растворе в соотношении 3:1 и имплантировали крысам подкожно. Через 8-10 суток после имплантации опухолевых клеток, когда объём опухоли достигал около 0,7-0,8 см3, животные были поделены на 2 равные группы (по 16 крыс в каждой). Первой половине животных внутривенно (в хвостовую вену) вводили 68Ga-метионин. Вторая группа животных служила контролем: им внутривенно вводили элюат 68GaCl 3 , предварительно нейтрализованный 0,1 М бикарбоната натрия до рН 5,6. Вводимая активность составляла 0,18-0,37 МБк в объёме 0,1 мл.
В различные сроки (через 5 мин, 1, 3 и 5 ч) после внутривенного введения меченых препаратов по 4 животных на каждый срок подвергали эвтаназии путём декапитации, выделяли пробы органов и тканей, помещали их в пластиковые пробирки, взвешивали на электронных весах «Sar-torius» (Германия) и проводили радиометрию с помощью автоматического гамма-счётчика «Wizard» версии 2480 фирмы PerkinElmer/Wallac (Финляндия). На момент введения в отдельные пробирки отбирали пробы 68Ga-метионина и 68GaCl 3 в объёме 0,1 мл для использования в качестве стандарта введённой дозы. По данным радиометрии на каждый срок наблюдения рассчитывали количество радиоактивности на 1 г органа или ткани в % от введённой дозы (%/г).
Результаты радиометрии обрабатывали методом оценки с вычислением средней величины и стандартной ошибки средней величины (M±m). Сравнение уровней накопления радиоактивности в группах проводилось с помощью t-критерия Стьюдента. Различия считались статистически значимыми при p<0,05.
Результаты
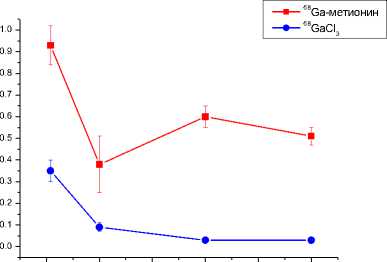
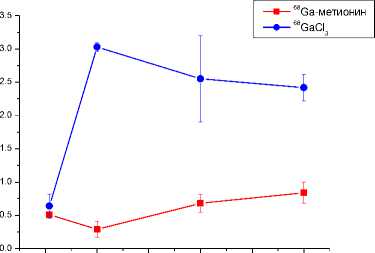
Данные оценки биораспределения 68Ga-метионина и 68GaCl3 представлены на рис. 1 и 2. Уровень радиоактивности в опухолевой ткани при внутривенном введении 68Ga-метионина постепенно возрастает с 0,28%/г через 5 мин до 0,37%/г, 0,77%/г и 0,85%/г через 1, 3 и 5 ч соответственно. Уровень активности несвязанного 68Ga, напротив, снижается с 0,34%/г до 0,07%/г в течение исследования.
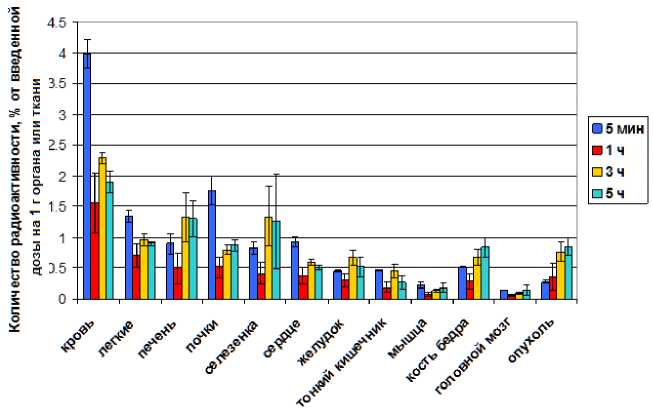
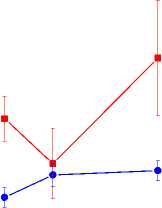
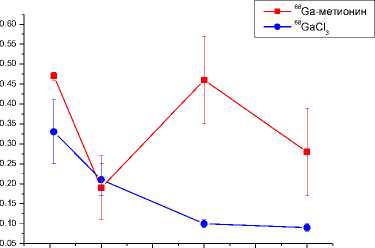
Рис. 1. Динамика изменения уровня радиоактивности в органах и тканях крыс Wistar в различные сроки после внутривенного введения 68Ga-метионина (в % от введённой дозы на 1 г органа или ткани).
Поступление аминокислот в клетки осуществляется с помощью белков-транспортёров различного типа. Для накопления комплексов 68Ga с аминокислотами в опухоли они должны распознаваться белками-транспортёрами и обладать высокой термодинамической стабильностью, поэтому минимальный размер комплекса предпочтителен [9]. Меченый метионин может накапливаться в опухолевых клетках путём пассивного транспорта за счёт работы транспортёра L-типа (преимущественно), а также за счёт работы Na+-зависимых транспортёров А и В0 [10, 11]. Уровень одного из них – LAT1, значительно повышен при опухолевой трансформации клеток [12, 13], а уровень его экспрессии коррелирует с неблагоприятным прогнозом онкологических больных [14, 15]. В то же время белки-транспортёры обеспечивают не только поступление аминокислот внутрь клеток, но и их обратный транспорт. Этим, вероятно, можно объяснить недостаточно высокий уровень 68Ga-метионина в опухоли.
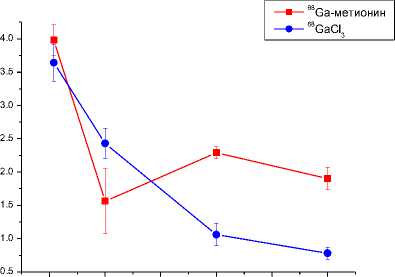
Во внутренних органах и тканях наиболее высокая концентрация активности при внутривенном введении 68Ga-метионина отмечается в крови, печени, почках и селезёнке (рис. 1). Так, сразу же после введения 68Ga-метионина в крови было зарегистрировано 3,98%/г активности, однако уже через 1 ч эта величина снижается более чем в 2 раза.
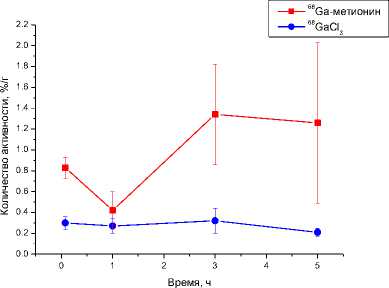
В печени и селезёнке наблюдается постепенное накопление активности. В печени накопление препарата достигает 1,33%/г (3 ч) и 1,31%/г (5 ч), а в селезёнке – 1,34%/г (3 ч). Повышенная аккумуляция препарата в этих органах может быть обусловлена его поглощением макрофагами. Известно, что для 11С-МЕТ характерна физиологическая гиперфиксация в печени, селезёнке, железах внутренней секреции, воспалительных очагах и др., что сдерживает его применение для диагностики опухолей внемозговой локализации [6, 16]. Кроме того, печень играет важную роль в метаболизме метионина, что также может способствовать повышенной аккумуляции 68Ga-метионина в этом органе. Это подтверждается данными фармакокинетики 11С-МЕТ, полученными различными методами, на лабораторных животных [16]. Например, при внутривенном введении 11С-МЕТ мышам nude с перевитым подкожно ксенографтом карциномы молочной железы человека MCF-7 уровень радиоактивности в печени через 1 ч достигал 8,02±2,66%/г [16].
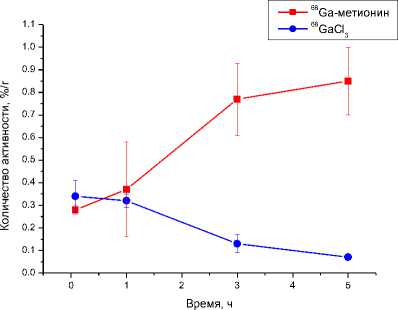
опухоль
Время, ч
кровь
1.5
1.4
1.3
1.2
J 1.1
1.0
0.9
0.8
га 0.7
0.6
§ 0.5
0.4
0.3
0.2
0.1
0.0
Время, ч
1.8
1.7
1.6
1.5
1.4
1.3
1.2
1.1
1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
Время, ч
—■— 68Ga-метионин
—•— 68GaCl
лёгкие
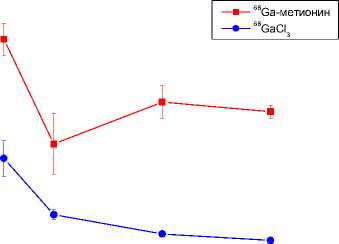
печень
—■— 68Ga-метионин
—•— 68GaCl
4.5
4.0
5 3.5
3.0
I 2.5
2.0
1.5
1.0
0.5
Время, ч
Время, ч сердце
почки
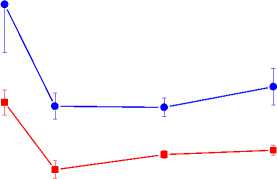
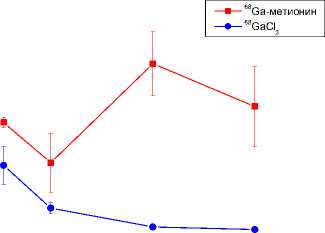
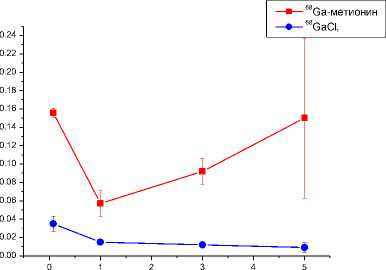
Рис. 2. Изменение уровня радиоактивности в органах и тканях крыс Wistar в различные сроки после внутривенного введения 68Ga-метионина и 68GaCl 3 (в % от введённой дозы на 1 г органа или ткани).
0.85
0.80
0.75
0.70
0.65
0.60
0.55
0.50
0.45
£ 0.40
0.35
0.30
0.25
0.20
0.15
0.10
0.05
0.00
Время, ч
012345 Время, ч кишечник
желудок
селезёнка
Время, ч головной мозг
0.28
0.26
0.24
0.22
^ 0.20
0.18
0.16
0.14
га 0.12
0.10
0.08
0.06
0.04
0.02
0.00
-0.02
Время, ч
0 1 2345
Время, ч кость бедра
мышца
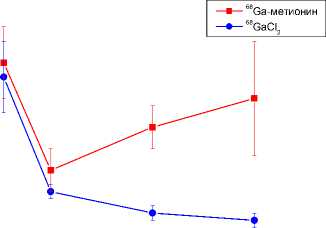
Рис. 2 (окончание). Изменение уровня радиоактивности в органах и тканях крыс Wistar в различные сроки после внутривенного введения 68Ga-метионина и 68GaCl 3 (в % от введённой дозы на 1 г органа или ткани).
В почках пиковая концентрация радиоактивности (1,76%/г) отмечается сразу же после внутривенного введения 68Ga-метионина, однако в последующие сроки происходит элиминация большей части активности, и её уровень составляет 0,52-0,88%/г (рис. 1). В отличие от 68Ga-метионина высокое содержание 68GaCl3 в почках отмечается на протяжении всего исследования (рис. 2). В работе [9] производные аланина и гомоаланина, меченные 68Ga, введённые мышам BALB/c с подкожным ксенографтом рака кишечника СТ-26, накапливались в почках в очень высоких концентрациях (до 60,06%/г), особенно в ранние сроки. Быструю экскрецию препаратов авторы объясняли недостаточной реабсорбцией полученных комплексов в почечных канальцах из-за крупных размеров меченых соединений. В этой связи использование меченых аминокислот, полученных прямым введением 68Ga в молекулу, является предпочтительным.
Из данных литературы следует, что несвязанный 68Ga обладает повышенным сродством к гидроксиапатиту и компактному веществу костной ткани [17]. Этим обусловлен высокий уровень накопления 68GaCl 3 в бедренной кости (до 3,03%/г) (рис. 2). При внутривенном введении 68Ga-метионина уровень радиоактивности в кости бедра приблизительно в 3-10 раз ниже, чем несвязанного 68Ga, и не превышает 0,84%/г. Это свидетельствует о высокой стабильности препарата in vivo .
Способностью метионина проникать через гематоэнцефалический барьер (ГЭБ) можно объяснить относительно высокий уровень радиоактивности в головном мозге. Так, содержание 68Ga-метионина варьировало в диапазоне от 0,057%/г до 0,156%/г, что превышало накопление 68GaCl 3 в головном мозге примерно в 4-17 раз. Известно, что 11С-метионин поступает в головной мозг путём пассивной диффузии, накапливаясь преимущественно в опухолевых очагах и определяя возможность их обнаружения методом ПЭТ [18]. В этой связи повышенное накопление радиоактивности в головном мозге по сравнению с несвязанным 68Ga может быть положительной характеристикой 68Ga-метионина благодаря возможности визуализации различных патологий головного мозга.
В работе [19] оценивалось распределение 68GaCl 3 в организме здоровых крыс Sprague-Dawley. Наибольшие значения активностей отмечались в крови (до 2,97%/г), моче (до 13,16%/г), печени (до 1,60%/г) и кости бедра (до 1,00%/г), что в целом согласуется с полученными нами результатами. Стоит отметить, что в некоторых органах и тканях были выявлены существенные половые различия в уровнях накопления активности, что авторы объясняют повышенным содержанием Fe(III) в организмах самок по сравнению с самцами.
Заключение
Таким образом, накопление 68Ga-метионина в опухоли возрастало с 0,28% от введённой дозы на 1 г ткани (%/г) через 5 мин до 0,37%/г через 1 ч, 0,77%/г через 3 ч и 0,85%/г через 5 ч. Содержание же 68GaCl 3 не превышало 0,34%/г. Высокое количество радиоактивности (1,56-3,98%/г) отмечено в крови. Во внутренних органах относительно высокий уровень накопления наблюдали лишь в печени, селезёнке и почках. Аккумуляция радиоактивности в других органах и тканях составляла менее 1%/г. Полученные результаты могут быть использованы при разработке радиотрейсера на основе 68Ga и метионина для визуализации опухолей методом ПЭТ.
Исследования проведены при финансовой поддержке Российского фонда фундаментальных исследований и Правительства Калужской области (проект № 17-16-40007а(р).
Список литературы Оценка биораспределения invivo 68Gа-метионина - потенциального радиотрейсера для позитронной эмиссионной томографии опухолей
- Гранов А.М., Тютин Л.А., Станжевский А.А. Применение технологий ядерной медицины в неврологии, психиатрии и нейрохирургии//Вестник РАМН. 2012. № 9. С. 13-18.
- Петриев В.М., Тищенко В.К., Красикова Р.Н. 18F-ФДГ и другие меченые производные глюкозы для использования в радионуклидной диагностике онкологических заболеваний (обзор)//Химико-фармацевтический журнал. 2016. Т. 50, № 4. С. 3-14.
- Rösch F. Past, present and future of 68Ge/68Ga generators//Appl. Radiat. Isot. 2013. V. 76. P. 24-30.
- Huang C., McConathy J. Radiolabeled amino acids for oncologic imaging//J. Nucl. Med. 2013. V. 54, N 7. P. 1007-1010.
- Zhao Y., Wang L., Pan J. The role of L-type amino acid transporter 1 in human tumors//Intractable Rare Dis. Res. 2015. V. 4, N 4. P. 165-169.
- Тлостанова М.С., Аветисян А.О., Козак А.Р., Пищик В.Г. Клинический опыт применения позитронно-эмиссионной томографии с 11С-метионином у больных с впервые выявленными образованиями в лёгких//Радиология -практика. 2014. № 2. С. 26-36.
- Kumar V., Boddeti D.K., Evans S.G., Roesch F., Howman-Giles R. Potential use of Ga-68-apo-transferrin as a PET imaging agent for detecting Staphylococcus aureus infection//Nucl. Med. Biol. 2011. V. 38. P. 393-398.
- Velikyan I. Prospective of 68Ga-radiopharmaceutical development//Theranostics. 2014. V. 4, N 1. P. 47-80.
- Shetty D., Jeong J.M., Ju C.H., Lee Y.S., Jeong S.Y., Choi J.Y., Yang B.Y., Lee D.S., Chung J.K., Lee M.C. Synthesis of novel 68Ga-labeled amino acid derivatives for positron emission tomography of cancer cells//Nucl. Med. Biol. 2010. V. 37. P. 893-902.
- Harris S.M., Davis J.C., Snyder S.E., Butch E.R., Vavere A.L., Kocak M., Shulkin B.L. Evaluation of the biodistribution of 11C-methionine in children and young adults//J. Nucl. Med. 2013. V. 54, N 11. P. 1902-1908.
- Ono M., Oka S., Okudaira H., Schuster D.M., Goodman M.M., Kawai K., Shirakami Y. Comparative evaluation of transport mechanisms of trans-1-amino-3-fluorocyclobutanecarboxylic acid and L- methionine in human glioma cell lines//Brain Res. 2013. V. 1535. P. 24-37.
- Yanagida O., Kanai Y., Chairoungdua A., Kim D.K., Segawa H., Nii T., Cha S.H., Matsuo H., Fukushima J., Fukasawa Y., Tani Y., TakeTani Y., Uchino H., Kim J.Y., Inatomi J., Okayasu I., Miyamoto K., Takeda E., Goya T., Endou H. Human L-type amino acid transporter 1 (LAT1): characterization of function and expression in tumor cell lines//Biochim. Biophys. Acta. 2001. V. 1514, N 2. P. 291-302.
- Hayashi K., Anzai N. Novel therapeutic approaches targeting L-type amino acid transporters for cancer treatment//World J. Gastrointest. Oncol. 2017. V. 9, N 1. P. 21-29.
- Sakata T., Ferdous G., Tsuruta T., Satoh T., Baba S., Muto T., Ueno A., Kanai Y., Endou H., Okayasu I. L-type amino-acid transporter 1 as a novel biomarker for high-grade malignancy in prostate cancer//Pathol. Int. 2009. V. 59, N 1. P. 7-18.
- Ichinoe M., Mikami T., Yoshida T., Igawa I., Tsuruta T., Nakada N., Anzai N., Suzuki Y., Endou H., Okayasu I. High expression of L-type amino-acid transporter 1 (LAT1) in gastric carcinomas: comparison with non-cancerous lesions//Pathol. Int. 2011. V. 61, N 5. P. 281-289.
- Amano S., Inoue T., Tomiyoshi K., Ando T., Endo K. In vivo comparison of PET and SPECT radiopharmaceuticals in detecting breast cancer//J. Nucl. Med. 1998. V. 39, N 8. P. 1424-1427.
- Toegel S., Wadsak W., Mien L.K., Viernstein H., Kluger R., Eidherr H., Haeusler D., Kletter K., Dudczak R., Mitterhauser M. Preparation and pre-vivo evaluation of no-carrier-added, carrier-added and cross-complexed -EDTMP formulations//Eur. J. Pharm. Biopharm. 2008. V. 68. P. 406-412.
- Yano H., Shinoda J., Iwama T. Clinical utility of positron emission tomography in patients with malignant glioma//Neurol. Med. Chir. (Tokyo). 2017. V. 57, N 7. P. 312-320.
- Autio A., Virtanen H., Tolvanen T., Liljenbäck H., Oikonen V., Saanijoki T., Siitonen R., Käkelä M., Schüssele A., Teräs M., Roivanen A. Absorption, distribution and excretion of intravenously injected 68Ge/68Ga generator eluate in healthy rats, and estimation of human radiation dosimetry//Eur. J. Nucl. Med. Mol. Imaging Res. 2015. V. 5. P. 40.


