Оценка цитотоксичности низкоразмерных структур оксида алюминия для опухолевых клеток
Автор: Коровин Матвей Сергеевич, Фоменко Алла Николаевна, Бакина Ольга Владимировна, Лернер Марат Израильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.15, 2016 года.
Бесплатный доступ
Введение. В последнее время наноразмерные материалы привлекают внимание исследователей в связи с их потенциальной возможностью использования в медицине. Физические механизмы взаимодействия наноструктур с опухолевыми клетками позволят разработать новые методы борьбы с опухолевыми заболеваниями. Последние исследования показывают, что такие физико-химические характеристики наноструктур, как форма и размер, являются важным фактором их биологической активности и токсичности. Цель исследования - выявление роли формы наноструктур оксида алюминия при их токсическом воздействии на опухолевые клетки. материал и методы. С использованием наночастиц алюминия синтезированы положительно заряженные низкоразмерные структуры на основе оксида алюминия, обладающие различной формой: агломераты нанолистов, нанопластинки, конусовидные наноагрегаты. Полученные частицы были охарактеризованы методами просвечивающей электронной микроскопии и ренгеновской дифракции. Цитотоксическое действие структур определяли при помощи MTT-теста на культурах базальных клеток HeLa, A549, MDA и PyMT. результаты. Показано, что наиболее выраженным токсическим действием по отношению к исследованным линиям клеток обладают агломераты нанолистов оксида алюминия, в то время как нанопластинки и конусовидные наноагрегаты не токсичны. Заключение. Токсическое действие агломератов нанолистов связано с их формой, а именно с наличием у них множественных краев и дефектов поверхности.
Оксид алюминия, наноструктуры, агломераты нанолистов, конусовидные наноагрегаты, опухолевые клетки, токсичность
Короткий адрес: https://sciup.org/140254081
IDR: 140254081 | УДК: 576.32/.36+546.621 | DOI: 10.21294/1814-4861-2016-15-6-35-41
Текст научной статьи Оценка цитотоксичности низкоразмерных структур оксида алюминия для опухолевых клеток
Наноматериалы находят своё применение для обнаружения и разрушения опухолевых клеток [1, 2]. Преимущество наночастиц обусловлено их уникальными свойствами, такими как высокая поверхностная энергия, устойчивая сорбция биомолекул, изменение физико-химических свойств под действием физических полей, малые размеры, сопоставимые с биомолекулами, наличие магнитных свойств и биосовместимость. Эти особенности открывают новые перспективы применения нанопрепаратов в терапии онкологических заболеваний. Различные исследования посвящены использованию наноматериалов различного химического состава для направленного воздействия на клетки [3]. Особый интерес представляют системы на основе магнитных наночастиц [4] и частиц оксидов металлов, таких как алюминий [5] или кремний [6, 7], обладающих низкой токсичностью и развитой поверхностью.
Одним из перспективных материалов является наноcтруктурный оксид алюминия (НОА), характеризующийся невысокой цитотоксичностью, простыми методами синтеза и разнообразием структурных форм. Оксиды алюминия нанометро- вых размеров благодаря развитой поверхности и высокой способности к сорбции могут осуществлять функцию антигенного депо, а также неспецифически усиливать фагоцитоз и использоваться в векторных вакцинах [8]. Наноcтруктурный оксид алюминия находит применение в процессах разделения белковых молекул при помощи фильтрации [9], адсорбции и деградации молекул TNF-α (tumor necrosis factor), выделяющихся при инфицировании, поступлении в организм бактериальных эндотоксинов [10]. Частицы НОА способны проникать через мембраны клеток линий L929 и BJ [11], а при воздействии на клетки линий VERO, HEP 2, MDA MB 231 и A549 с ростом концентрации НОА от 2 до 500 мкг/мл наблюдалось снижение скорости пролиферации клеток [12]. Заметно меньшее цитотоксическое воздействие оказывали частицы НОА со средним размером 10 нм по сравнению с наночастицами размером около 50 нм [13]. В случае TiO2 большей цитотоксичностью обладали наноструктуры дендритной и веретенообразной формы по сравнению со сферическими [14]. При этом у частиц дендритной формы цитотоксичность связана с количеством граней. Поверхность на-
ночастиц оксидов является активной при наличии большого количества углов и краев, т.е. дефектов на поверхности частиц. На примере структур ZnO концентрация поверхностных дефектов снижалась в ряду: нанопластинки, нанолисты, агрегаты наночастиц [15]. Поверхностные дефекты приводили к возникновению окислительно-восстановительных реакций с адсорбированными молекулами воды с образованием гидроксильного радикала и супероксид анион-радикала (О2-). В результате этих реакций в живых клетках индуцировался окислительный стресс, вызываемый генерацией H2O2 [16]. Описанный механизм генерации H2O2 может также реализовываться при воздействии НОА различной формы на нормальные и опухолевые клетки, что может приводить к подавлению их жизнедеятельности. С другой стороны, одним из возможных механизмов подавления пролиферации клеток НОА может служить адсорбция молекул и ионов из микроокружения клеток на поверхности наноструктур [17].
Целью исследования явилось определение роли формы НОА при их воздействии на опухолевые клетки линий HeLa, A549, MDA и PyMT. Для выявления цитотоксичности наночастиц с различной формой были синтезированы наноструктуры оксида алюминия, обладающие гранями и краями, а также изучено их цитотоксическое действие на клетки.
Материал и методы
Для синтеза наноcтруктурного оксида алюминия (НОА) различной формы в качестве прекурсора использовали нанопорошок алюминия, полученный электрическим взрывом алюминиевой проволочки в атмосфере аргона [18]. Порошок алюминия был предоставлен компанией «Передовые порошковые технологии» (г. Томск, Россия). Окислением нанопорошка алюминия дистиллированной водой при 60ºC и атмосферном давлении был получен НОА в виде агломератов нанолистов [19]. Гидротермальной обработкой синтезированных агломератов нанолистов в автоклаве гидродинамического синтеза PTE 05L (Weihai Global Chemical Machinery MFG Co., LTD, Китай) в течение 6 ч при 200ºC был синтезирован НОА в виде нанопластинок. Окислением нанопорошка алюминия водяным паром в эксикаторе при постоянной влажности 80 % и температуре 60ºC был получен НОА в форме конусовидных агрегатов [20]. Форму и размер синтезированных структур исследовали методом просвечивающей электронной микроскопии (JEOL JEM-2100, Япония) [21]. Фазовый состав структур определяли при помощи дифрактометра (XRD-6000, Shimadzu, Япония, Cu-Kα излучение, длина волны 1.54056 Å) [22], удельную поверхность определяли методом тепловой десорбции азота (Сорбтомер М, Россия) [23] и рассчитывали по методу БЭТ (Брунауера– Эммета–Теллера). Заряд поверхности структур оценивали по их ξ-потенциалу (Zetasizer Nano ZSP, Malvern, Великобритания).
Цитологические исследования проводили на базе Института Джозефа Стефана (г. Любляна, Словения). Цитотоксическое действие НОА определяли при помощи MTT-теста [24] на культурах базальных клеток альвеолярной аденокарциномы человека A549, культурах клеток рака шейки матки человека HeLa, культурах аденокарциномы лёгкого человека MDA, предоставленных Американской коллекцией типовых культур (АТСС), и на культурах PyMT клеток – первичных клетках, выделенных из опухоли мышей. Конечная концентрация клеток составила 1×104 клеток/100 мкл в лунке 96-луночного микропланшета. Клетки А549 и HeLa культивировали в виде монослоя в среде MEM (Sigma-Aldrich, США) с добавлением 10 % фетальной бычьей сыворотки (Hyclone, Великобритания) и 1 % пенициллин/стрептомицина (Биолот, Россия). Культивирование клеток проводили при температуре 37 ± 1ºС и 5 % CO2 в течение 24 ч. После инкубирования питательную среду осторожно удаляли и два раза промывали клетки раствором натрий-фосфатного буфера Дульбекко DPBS (Lonza, Швейцария). Для определения цитотоксичности использовали суспензии наноструктур в клеточной среде в концентрациях от 0,001 мг/мл до 10 мг/мл. Клетки с НОА инкубировали при температуре 37 ± 1ºС и 5 % CO2 в течение 24 ч. Для проведения MTT-теста питательную среду удаляли и два раза промывали клетки раствором DPBS. Затем в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора МТТ 3–4,5-диметилтиазол-2,5 дифенил тетразолия бромида (Sigma-Aldrich, США). Инкубирование с раствором MTT проводили в течение 2 ч при температуре 37 ± 1 ºС и 5 % CO2. По окончании инкубирования питательную среду осторожно удаляли и добавляли в каждую лунку по 100 мкл диметилсульфоксида (Sigma-Aldrich, США) для растворения кристаллов формазана. Через 15 мин определяли оптическую плотность на микропланшетном спектрофотометре TecanInfiniteM1000 PRO (Tecan, Австрия) при длине волны 570 нм. Далее вычисляли долю живых клеток в ( CL , %) по формуле
A
C = s x 100 % LA c где As – оптическая плотность исследуемого образца, Ac – оптическая плотность контрольного образца.
Контрольной группой служили клетки без добавления частиц НОА. Для статистической обработки данных использовались параметрические методы с уровнем достоверности p≤0,05.
Результаты и обсуждение
При окислении водой нанопорошка алюминия (рис. 1а) формируются пористые структуры (НОА), представляющие собой агломераты нанолистов

Рис. 1. Электронно-микроскопические изображения частиц, полученных окислением в воде (а, б), при гидротермальной обработке (в, г), во влажном воздухе (д, е)
в фазе бемита, кристаллической модификации оксида алюминия, соответствующей химической формуле AlOOH, элементарная ячейка имеет состав Аl4О4(ОН)4, что соответствует 4 молекулам AlOOH. Образующиеся агломераты обладают практически сферической формой с удельной поверхностью 300 м2/г и размером 0,5–3 мкм и состоят из отдельных листов толщиной 5–10 нм и планарным размером около 150–300 нм (рис. 1б). Агломераты нанолистов имеют развитую поверхность и множество краев, образованных отдельными нанолистами. При обработке синтезированных агломератов нанолистов в гидротермальных условиях образуются гладкие нанопластины бемита размером 40–100 нм и толщиной 4–15 нм (рис. 1б, в). Удельная поверхность структур составила 124 м2/г. При окислении нанопорошка алюминия парами воды образуются конусовидные агрегаты в фазе байерита Al(OH)3 с явно выраженной кристаллизацией. Элементарная ячейка имеет состав 4Аl(ОН)3. Размер агрегатов достигает 100 нм (рис. 1г, д), удельная поверхность 16 м2/г.
Все синтезированные образцы имеют положительный заряд поверхности, противоположный заряду клеток, что может повысить их биоактивность за счет взаимного притяжения и довольно крупных размеров, которые не позволяют им проникать внутрь клеток [25], соответственно, их токсический эффект будет, прежде всего, зависеть от формы их поверхности. Наименьший токсический эффект HeLa клеток во всём диапазоне исследуемых концентраций оказали конусовидные агрегаты и нанопластинки (рис. 2a). Их слабое токсическое действие было также отмечено для PyMT клеток (рис. 2б). Концентрация НОА не влияла на количество живых клеток.
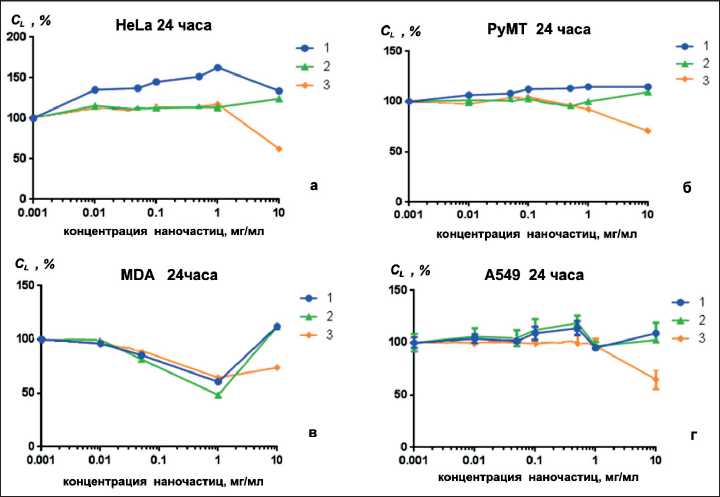
Рис. 2. Влияние низкоразмерных структур оксида алюминия на клетки A549 (а), клетки HeLa (б), клетки MDA (в), клетки PyMT (г): 1 – нанопластины; 2 – конусовидные агрегаты; 3 – агломераты нанолистов
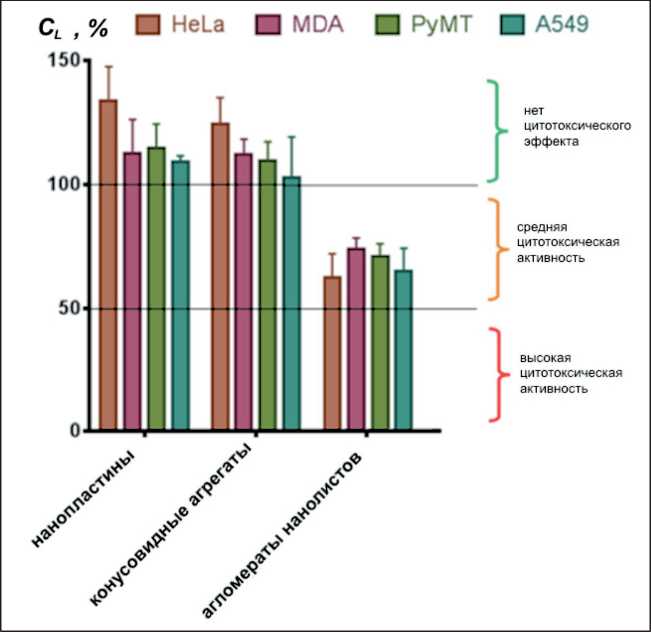
Рис. 3. Жизнеспособность клеток (24 ч, 10 мг/мл)
Наноструктуры вне зависимости от дефектности поверхности оказали токсическое действие на клетки линии MDA (рис. 2в) в диапазоне концентраций от 0,001 до 1 мг/мл. Количество жизнеспособных клеток было снижено на 20–30 %. Токсическое действие НОА заметно уменьшилось при концентрации образцов 10 мг/мл. Это может быть связано с каскадом окислительновосстановительных реакций, индуцирующих окислительный стресс в живых клетках [26], активирующий оксидант-чувствительные факторы транскрипции, которые, в свою очередь, приводят к устойчивости опухолевых клеток к действию антиоксидантов [27]. Нанопластинки и конусовидные агрегаты оказали слабое токсическое действие на клетки линии A549 (рис. 2г) во всем диапазоне концентраций. По сравнению с другими НОА агломераты нанолистов оказали токсическое действие на все линии клеток в диапазоне концентраций 1–10 мг/мл (рис. 2 a–г). Гистограммы, наглядно демонстрирующие величину токсического действия синтезированных НОА при концентрации 10 мг/мл, представлены на рис. 3.
Нанопластинки и конусовидные агрегаты нетоксичны для исследованных линий клеток. Наибольший токсический эффект оказали агломераты нанолистов, не подавляя жизнеспособность клеток полностью. По этой причине их действие на исследованные линии клеток можно определить как среднетоксическое. За счёт большого количества граней агломераты нанолистов обладают большим числом поверхностных дефектов по сравнению с другими наноструктурами. Вероятно, эти центры служат сосредоточением генерации супероксид- ных радикалов, гидроксильных радикалов и пероксида водорода и являются определяющими в индуцировании токсичности [19].
Заключение
Полученные данные свидетельствуют, что цитотоксичность наноструктур на основе оксида алюминия наряду с другими факторами определяется их формой, а конкретно наличием и количеством краев и граней у наноструктур. При исследовании воздействия наноструктур на линии опухолевых клеток A549, HeLa, MDA, PyMT показано, что с увеличением числа краев у наноструктур их токсическое действие усиливается. Нанопластинки и конусовидные наноагрегаты не являются токсичными, в то время как агломераты нанолистов со множественными краями в диапазоне концентраций 1–10 мг/мл оказывают среднетоксическое действие. Полученные данные поддерживают ранее предложенный в литературе механизм подавления жизнедеятельности клеток вследствие образования перекиси водорода на поверхностных дефектах наноструктур. Дальнейшее изучение влияния формы частиц на клетки приведет к созданию новых соединений с противоопухолевой активностью, использование которых позволит повысить эффективность лечения онкологических заболеваний.
Работа выполнена при финансовой поддержке Российского научного фонда (Грант № 14-23-00096). Наночастицы алюминия получены в рамках Программы фундаментальных научных исследований государственных академий наук на 2013–2020 гг.
Список литературы Оценка цитотоксичности низкоразмерных структур оксида алюминия для опухолевых клеток
- Rao W., Wang H., Han J., Zhao S., Dumbleton J., Agarwal P., Zhang W., Zhao G., Yu J., Zynger D., Lu X., He X. Chitosan-Decorated Doxorubicin-Encapsulated Nanoparticle Targets and Eliminates Tumor Reinitiating Cancer Stem-like Cells. ACS Nano. 2015 Jun 23; 9 (6): 5725-40. DOI: 10.1021/nn506928p
- Min Y., Caster J.M., Eblan M.J., Wang A.Z. Clinical Translation of Nanomedicine. Chemical Review. 2015; 115: 11147-11190. 10.1021/ acs.chemrev.5b00116. DOI: 10.1021/acs.chemrev.5b00116
- Gowda R., Jones N.R., Banerjee S., Robertson G.P. Use of Nanotechnology to Develop Multi-Drug Inhibitors For Cancer Therapy. J Nanomedicine & Nanotechnology. 2013; 184-189. DOI: 10.4172/2157-7439.1000184
- Mikhaylov G., Mikac U., Magaeva A.A., Itin V.I., Naiden E.P., Psakhye I., Bogyo M. Ferri-liposomes as an MRI-visible drug-delivery system for targeting tumours and their microenvironment. Nat Nanotechnol. 2011 Aug 7; 6 (9): 594-602. DOI: 10.1038/nnano.2011.112
- Xifré Pérez E., Guaita-Esteruelas S., Baranowska M., Marsal L.F. In Vitro Biocompatibility of Surface-Modified Porous Alumina Particles for HepG2 Tumor Cells: Toward Early Diagnosis and Targeted Treatment. ACS Appl Mater Interfaces. 2015 Aug 26; 7 (33): 18600-8. 10.1021/ acsami.5b05016. DOI: 10.1021/acsami.5b05016


