Оценка цитотоксичности трихотецена Fusarium sp. на линию рака молочной железы in vitro
Автор: Мухаммадиев Ринат Салаватович, Мухаммадиев Ришат Салаватович, Бирюля Вадим Владимирович, Идиятов Ильгиз Ильясович, Набатов Алексей Анатольевич, Глинушкин Алексей Павлович, Валиуллин Ленар Рашитович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
В последнее время трихотеценовые соединения и их производные привлекают внимание исследователей в связи с их потенциальной возможностью применения в медицине, в том числе для лечения различных видов рака. Цель исследования - изучение цитотоксического действия трихотецена Fusarium sp. в отношении линий опухолевых клеток рака молочной железы, нормальных клеток фибробластов кожи и почек эмбриона человека in vitro. Материал и методы. С использованием общепринятого метода МТТ-теста проводилось определение цитотоксического действия трихотецена в отношении исследуемых культур клеток. Оценку изменения в морфологии клеток под воздействием трихотецена проводили методом световой микроскопии. Результаты. Было обнаружено, что трихотецен Fusarium sp. в диапазоне концентрации 1-1000 нМ проявлял дозозависимое токсическое действие в отношении исследуемых линий клеток. Наиболее выраженное цитотоксическое действие трихотецена наблюдали при его действии на линию опухолевых клеток молочной железы (1С50 94,72 ± 4,1 нМ). Совместная инкубация трихотецена с линиями клеток рака молочной железы, клеток фибробластов кожи и почек эмбриона человека в более низких дозах приводила к изменению размеров, формы клеток, потере контактов между ними и их обособлению. При более высоких дозах трихотецена наблюдалась деградация мембран, образование неоформленных клеточных агрегатов и фрагментов (апоптозных тел). Заключение. Трихотецен Fusarium sp. обладает биологически активным потенциалом и является менее токсичным по отношению к нормальным клеткам человека по сравнению с опухолевыми, поэтому его целесообразно в дальнейшем исследовать как возможного противоопухолевого агента.
Трихотецен, культура, рак молочной железы, фибробласты кожи, почки эмбриона, цитотоксичность
Короткий адрес: https://sciup.org/140254309
IDR: 140254309 | УДК: 618.19-006.6: | DOI: 10.21294/1814-4861-2019-18-6-90-95
Текст научной статьи Оценка цитотоксичности трихотецена Fusarium sp. на линию рака молочной железы in vitro
Trichothecenes and their derivatives have recently attracted much attention of researchers with respect of their potential role in medicine, including for the treatment of different types of cancer. The purpose of the study was to investigate the cytotoxic effect of Fusarium trichothecene on human breast cancer cells, human skin fibroblasts and embryonic kidney cells in vitro. Material and Methods. Based on the MTT assay, the cytotoxic effect of trichothecene on cell cultures was determined. Evaluation of morphological changes in cell cultures under the influence of trichothecene was performed by light microscopy. Results. Fusarium trichothecene was found to exhibit a dose-dependent toxic effect on cell lines in the range 1 nM to 1000 nM. The most pronounced cytotoxic effect of trichothecene was observed in human breast cancer cell line (IС50 94.72 ± 4.1 нМ). Lower doses of trichothecene led to a change in the size, shape of human breast cancer cells, human skin fibroblasts and embryonic kidney cells, and loss of contact between them and their isolation. The degradation of cell membranes, formation of unformed cell aggregates and fragments were observed in higher doses of trichothecene. Conclusion. Fusarium trichothecen is a biologically active compound and is less toxic to the normal than to the cancer cell lines, therefore, further studies of this agent are needed.
Трихотецены представляют собой низкомолекулярные вещества, которые продуцируются микромицетами родов Fusarium, Mycothecium, Trichoderma, Trichothecium, Stachybotrys и Cepha-losporium , способные поражать сельскохозяйственные культуры [1, 2]. Эта группа метаболитов имеет характерное для них сесквитерпеноидное кольцо (трихотекан), которое играет значительную роль для токсичности [3]. На клеточном уровне трихо-тецены могут являться мощными ингибиторами синтеза ДНК, РНК или белка [1, 4].
Несмотря на то, что многие трихотеценовые соединения токсичны, они могут сочетать в себе несколько видов фармакологической активности, включая противомалярийную, противомикробную, противовирусную и противоопухолевую [4, 5]. Трихотецены и полученные из них производные, такие как ниваленол, самбуцинол, трихотеллон, триходермол, трихотецин В и трихотецинол А, обладают цититоксической активностью в отношении широкого спектра различных типов клеточных линий [5–7]. Одним из таких наиболее часто встречающихся в природе метаболитов является диацетоксиксирпенол (DAS, ангидин), который проходил клинические испытания как противоопухолевое средство [8]. Тем не менее клинические исследования диацетоксиксирпенола были остановлены из-за его высокой токсичности. В связи с этим актуальным становится поиск новых веществ трихотеценового ряда, которые могут найти применение в качестве потенциальных противоопухолевых агентов.
Целью исследования было изучение цитотоксического действия трихотецена Fusarium sp. на линиях клеток рака молочной железы, клеток фибробластов кожи и почек эмбриона в условиях in vitro.
Материал и методы
В работе использовали трихотеценовое соединение 4β,15-диацетокси-8α-(3α-метилбутирилокси)-
12,13-эпокситрихотецен-3-ол низшего гриба Fusarium sp., полученное в лаборатории микотоксинов Федерального центра токсикологической, радиационной и биологической безопасности (ФГБНУ «ФЦТРБ-ВНИВИ») [9]. Клеточные линии рака молочной железы (MCF-7), клеток фибробластов кожи (HSF) и почек эмбриона (HEK-293) человека были предоставлены Научно-образовательным центром фармацевтики Казанского (Приволжского) федерального университета.
Определение цитотоксического действия трихотецена проводили по выживаемости различных культур клеток с помощью стандартного метода МТТтеста [10]. Работа с культурами клеток осуществлялась в стерильных условиях. Культивированные клетки на среде DMEM («ПанЭко», Россия) с добавлением 10 % эмбриональной телячьей сыворотки, 0,5 % 200мМ L-глутамина и 0,5 % пенициллина-стрептомицина («ПанЭко», Россия) высевали в 96-луночные культуральные планшеты в концентрации 5000 кл/мл. Клетки выращивали в инкубаторе MCO-19AIC («Sanyo», Япония) во влажной атмосфере при температуре 37 °С и 5 % CO2 в течение 24 ч, проводили замену среды. Препарат, растворенный в 96 % этиловом спирте, разводили в отдельном 96-луночном планшете и добавляли в лунки планшета с клетками. Смесь инкубировали при 37 °С и 5 % CO2 в течение 72 ч. Затем добавляли к клеткам МТТ-реагента (4,5-диметилтиазол-2-ил-2,5-дифенилтетразолиум бромид, 0,5 мг/мл, «Sigma-Aldrich», США), растворенного в ФБС (фосфатный солевой буфер, 1,7 мМ KH2PO4, 5,2 мМ Na2HPO4, 150 мМ NaCl, pH 7.4) и инкубировали смесь в течение 3 ч. После замены среды с красителем на раствор ДМСО (диметилсульфоксид, «ПанЭко», Россия) клетки инкубировали в течение 10 мин. Оптическую плотность клеток определяли на микропланшетном ридере TECAN Infinite M200 Pro («Tecan», Австрия) при длине волны 555 нм (референтная длина – 750 нм). Количество живых клеток рассчитывали в процен- тах относительно контроля. Цитотоксичность три-хотецена на клетки в условиях in vitro оценивали в диапазоне концентрации 0,97–1000 нM и выражали через значения IС50 (наименьшая концентрация вещества, вызывающая 50 % подавление роста популяции клеток исследуемой культуры). В качестве отрицательного контроля использовали клетки, инкубированные с коммерческим препаратом цисплатином (цис-диаминдихлороплатина, «Sigma», США). Положительным контролем являлись клетки, выдержанные без добавления вещества, с добавлением количества спирта в соответствии с дозой трихотецена.
Изучение морфологии культур клеток после их совместной инкубации с трихотеценовым соединением проводили с применением оптического микроскопа Zeiss Axio Vert.A1 («Carl Zeiss Microscopy GmbH», Германия).
Анализ проводился в трехкратной биологической и аналитической повторности. Для статистической обработки полученных данных использовали программное обеспечение Microsoft Office Excel 2013. Результаты выражали в виде средней арифметической и ее средней ошибки, данные на нормальность распределения выборок определяли по критерию Шапиро – Уилка. Оценку достоверности различий между группами проводили с использованием t-критерия Стьюдента для независимых переменных. Достоверно отличными считали результаты при р<0,05. Параметры IС50 определяли на основе дозозависимых кривых с помощью программного обеспечения OriginТМ.
Результаты и обсуждение
В настоящее время имеется немало зарубежных работ, посвященных изучению противоопухолевого действия соединений трихотеценового ряда [6, 7]. В связи с этим проводилось определение цитотоксического эффекта трихотецена микроми-цета Fusarium sp. в отношении различных линий клеток в условиях in vitro. В работе использовали
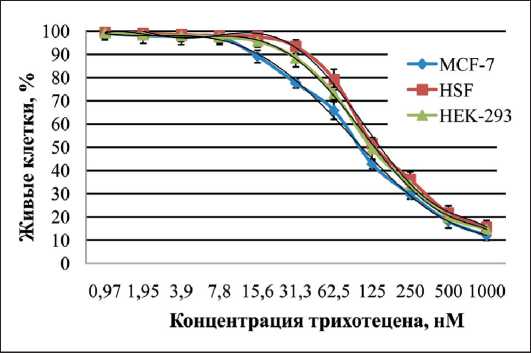
Рис. 1. Влияние трихотецена Fusarium sp. на линии раковых клеток молочной железы (MCF-7), нормальных клеток фибробластов кожи (HSF) и почек эмбриона (HEK-293) человека линии раковых клеток молочной железы (MCF-7), нормальных клеток фибробластов кожи (HSF) и почек эмбриона (HEK-293) человека. Цитотоксичность трихотецена определяли по выживаемости клеток MCF-7, HSF и HEK-293 с применением общепринятого метода МТТ-теста [11].
Результаты экспериментов показали, что после совместной инкубации соединения, содержащего в своей структуре трихотеценовое кольцо, в различных концентрациях с нормальными и опухолевыми клетками происходит значимое ингибирование роста клеток исследуемых культур (p<0,05) (рис. 1). Наиболее выраженной цитотоксической активностью трихотеценовое соединение Fusarium sp. обладало на линию опухолевых клеток MCF-7, величина IС50 составила 94,72 ± 4,1 нM. Для нормальных клеток, фибробластов кожи и почек эмбриона человека, в тех же условиях, величина IС50 трихотецена составляла 129,14 ± 4,6 и 122,34 ± 4,8 нМ.
Действие трихотецена микромицета Fusarium sp. в отношении линий опухолевых клеток рака молочной железы (MCF-7) и нормальных клеток
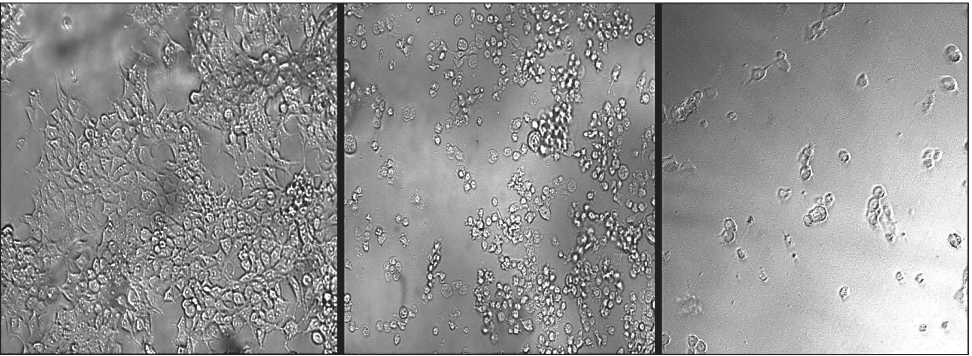
Рис. 2. Микрофото. Влияние трихотецена Fusarium sp. в отношении линии клеток рака молочной железы MCF-7. Слева направо: раковые клетки MCF-7, инкубированные без добавления трихотецена (контроль); MCF-7 + трихотецен (125 нM); MCF-7 + трихо-тецен (500 нM). ×1000
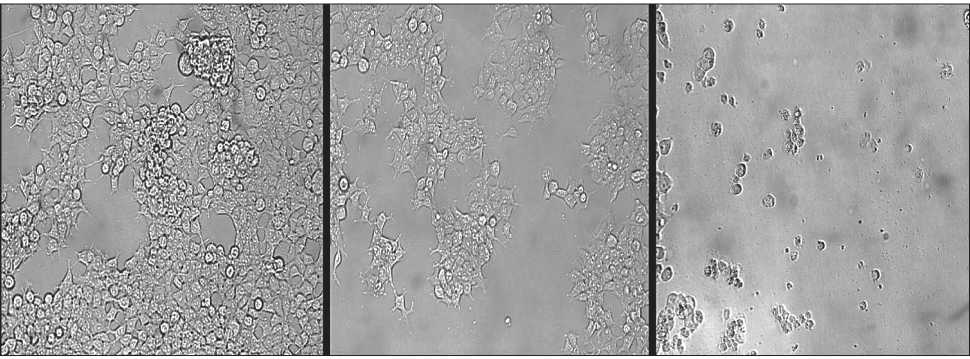
Рис. 3 . Микрофото. Влияние трихотецена Fusarium sp. в отношении линии нормальных клеток почек эмбриона HEK-293. Слева направо: HSF (контроль); HEK-293 + трихотецен (125 нM); HEK-293 + трихотецен (500 нM). ×1000
почек эмбриона (HEK-293) человека хорошо прослеживается на микрофотографиях (рис. 2, 3).
Установлено, что контакт трихотецена Fusarium sp. в более низких концентрациях (1–125 нМ) с исследуемыми линиями клеток приводил к изменениям их морфологии: клетки уменьшались в размерах и приобретали более округлую форму, происходила потеря контактов между клетками, и клетки начинали обособляться.
Культивирование клеток MCF-7 с трихотеценом в концентрации 31,3 нМ приводило к достоверному уменьшению количества живых клеток на 21–25 % (p<0,05). При такой концентрации три-хотецена количество живых клеток для линии клеток HEK-293 и HSF было больше (p<0,05) по сравнению с линиями клеток MCF-7 – 84–91 и 91–97 % соответственно. При этом морфология клеток линии культуры HEK-293 и HSF, инкубированных трихотеценом в данной концентрации, существенно не отличалась от морфологии контрольных клеток.
При более высоких концентрациях трихотеце-нового соединения (более 125 нМ) наблюдается деградация клеточных мембран клеток исследуемых культур, клетки начинают лизировать, число погибших опухолевых и нормальных клеток повышается, наблюдается образование неоформленных клеточных агрегатов и фрагментов. Такая морфологическая картина указывает на высокое подавление процесса деления и возможную гибель клеток путем апоптоза.
Величина IС50 трихотецена микромицета Fusarium sp. относительно действия на тест-культуры, а также в сравнении с коммерческим препаратом цисплатином на данные линии клеток представлена в таблице. Ингибирующее влияние трихотецена Fusarium sp. на рост линии клеток рака молочной железы, нормальных клеток фибробластов кожи и почек эмбриона человека было выше (p<0,05) по сравнению с контрольным препаратом цисплатином, величина IС50 которого была выше 1000 нМ.
Эти результаты согласуются с полученными нами ранее и литературными данными, где показано, что соединения трихотеценового ряда проявляют цитотоксический эффект относительно различных типов клеток рака и способны вызывать их апоптоз [12–14]. Так, недавно были выделены из культуральной жидкости низшего гриба Myrothecium roridum соединения трихотеценовой природы, обладающие цитотоксическим действием в отношении рака молочной железы (MCF-7) с диапазоном IC50 1–170 нМ [14]. Цитотоксический эффект, полученный в результате исследования, показал, что большинство соединений являются потенциальными противоопухолевыми агентами.
Заключение
Исследование цитотоксической активности трихотецена микромицета Fusarium sp. показало, что соединение проявляет дозозависимое токсическое действие в отношении линии раковых клеток молочной железы (MCF-7), нормальных клеток
Таблица
Сравнительная цитотоксичность трихотецена микромицета Fusarium sp. и цисплатина на различные линии клеток
|
Соединения, IС50, нM |
Тест-культура |
||
|
MCF-7 |
HSF |
HEK-293 |
|
|
Трихотецен |
94,72 ± 4,1* |
129,14 ± 4,6 |
122,34±4,8 |
|
Цисплатин |
>1000 |
>1000 |
>1000 |
Примечание: * – отличия статистические значимы по сравнению со значением показателя IС50 трихотецена в отношении линии нормальных клеток HSF и HEK-293 (р<0,05).
фибробластов кожи (HSF) и почек эмбриона (HEK-293) человека. Методом МТТ-теста установлена менее выраженная цитотоксичность трихотецена по отношению к нормальным клеткам человека HEK-293, HSF по сравнению с опухолевыми клетками MCF-7, что подтверждается данными, полученными с применением метода световой микроскопии.
Список литературы Оценка цитотоксичности трихотецена Fusarium sp. на линию рака молочной железы in vitro
- Tola S., Bureau D.P., Hooft J.M., Beamish F.W., Sulyok M, Krska R., Encarnagao P., Petkam R. Effects of Wheat Naturally Contaminated with Fusarium Mycotoxins on Growth Performance and Selected Health Indices of Red Tilapia (Oreochromis niloticusxO. mossambicus). Toxins (Basel). 2015 May 29; 7(6): 1929-44. DOI: 10.3390/toxins7061929
- Pleadin J. Mycotoxins in grains and feed: Contamination and toxic effect in animals. Biotechnology in Animal Husbandry. 2015; 31(4): 441-56. DOI: 10.2298/BAH1504441P
- McCormick S.P., Stanley A., Stover N., Alexander N.J. Trichoth-ecenes: from simple to complex mycotoxins. Toxins (Basel). 2011 Jul; 3(7): 802-14. DOI: 10.3390/toxins3070802
- Makun H. Mycotoxin and Food Safety in Developing Countries; 2013. 280 p. doi: 10.5772/3414.
- Leylaie S., Zafari D. Antiproliferative and antimicrobial activities of secondary metabolites and phylogenetic study of endophytic Trichoderma species from Vinca plants. Front Microbiol. 2018 Jul 11; 9: 1484. DOI: 10.3389/fmicb.2018.01484


