Оценка детоксицирующей эффективности экстракта сапропеля при интоксикации птиц Конфидором Экстра
Автор: Бойко Т.В., Насырова И.А., Гонохова М.Н., Водолага В.С.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 6, 2017 года.
Бесплатный доступ
В статье дана оценка детоксицирующей эффективности экстракта сапропеля при отравлении птиц Конфидором Экстра® (КфЭ). Исследования проведены на пятисуточных петушках породы белый леггорн, подобранных по приниципу аналогов и разделенных на че-тыре группы по пять голов в каждой. Цыпля-та первой группы находились на стандартном рационе и потребляли воду водопроводную. Вторая группа цыплят с водой ежедневно в течение 14 дней потребляла экстракт сапро-пеля масляный в дозе 1 мл на 100 мл воды. Цыплята третьей группы получали водный 0,001%-й раствор КфЭ. Птицы четвертой группы на фоне интоксикации КфЭ получали ежедневно экстракт сапропеля масляный в дозе 1 мл на 100 мл воды. Через 14 суток про-водили убой животных. В результате прове- денных исследований было установлено, что общее состояние цыплят на протяжении все-го периода наблюдения было удовлетвори-тельным, несмотря на периодически реги-струемую диарею у птиц, получавших пести-цид и лекарственное средство. При анализе биохимических показателей крови было уста-новлено снижение концентрации мочевой кис-лоты на 18,5 % (р=0,009) у цыплят, потреб-лявших в течение двух недель раствор сапро-пеля масляный, и повышение данного показа-теля у цыплят, интоксицированных КфЭ, на 29,5 % (р
Экстракт сапропеля масляный, конфидор экстра, детоксикация, кonfidor eхtra®
Короткий адрес: https://sciup.org/14084929
IDR: 14084929 | УДК: 619:615
Текст научной статьи Оценка детоксицирующей эффективности экстракта сапропеля при интоксикации птиц Конфидором Экстра
Введение. Важной частью эффективного ведения сельского хозяйства является химический метод контроля численности вредителей. Современный рынок инсектицидов, применяемых в растениеводстве, ветеринарии, медицине и быту, представлен преимущественно фосфорорганическими соединениями, синтетическими пиретроидами, авермектинами и неоникотинои-дами. Неоникотиноиды (НН) – интенсивно развивающийся класс инсектицидов, акарицидов и фунгицидов, широко используемых в растениеводстве на посевах зерновых, плодовых и овощных культур. Одним из первых представителей этого класса является имидаклоприд (Ик), препараты на основе которого успешно применяют в растениеводстве и в быту для борьбы с муравьями и термитами, в ветеринарной медицине – против экто- и эндопаразитов, а в животноводстве – для обработки помещений [1, 2]. В токсикологическом отношении НН являются нейротропными ядами, механизм действия которых основан на взаимодействии с никотиновыми ацетилхолиновыми рецепторами постсинаптических мембран, что приводит к нарушению проведения нервного импульса и гибели насекомых. Обладая высокой липофильностью, НН легко проникают через биологические мембраны и временно депонируются в органах и тканях организма [3, 4].
Несмотря на то, что пестициды являются необходимым инструментом обеспечения эффективности проводимых мероприятий по борьбе с вредителями и возбудителями болезней, попадая в организм животных и человека в виде остаточных количеств с кормами или продуктами питания, водой, воздухом, а также через кожу при обработках, они неизбежно оказывают влияние на организм. Высокая контаминация кормов ксенобиотиками различного происхождения является основной причиной включения в рационы для животных средств с детоксицирующей активностью. Наряду с широким использованием углеродных сорбентов перспективным направлением в ветеринарной медицине является изучение детоксицирующей активности препаратов на основе сапропеля [5]. Экспериментально подтверждено, что продукты, получаемые из сапропеля, обладают антиоксидантным, антисептическим, гепатопротекторным и иммуномодулирующим эффектом, что послужило теоретической предпосылкой для проведения данных исследований.
Цель исследования. Определение детоксицирующей активности экстракта сапропеля при интоксикации птиц Конфидором Экстра®.
Объекты, материалы и методы исследования. Петушки пятисуточного возраста породы белый леггорн, массой 40,0 г; экстракт сапропеля масляный (ЭСМ); инсектицидный препарат Конфидор Экстра® (имидаклоприд, 70%. Bayer-CropScience, Германия). Методы – клинические, гематологические, гистологические, статистические. ЭСМ изготовлен на кафедре фармацевтической технологии, биотехнологии ФГБОУ ВПО «ОмГМУ» методом двухфазной экстракции [6]. Исследования на петушках проведены в виварии Института ветеринарной медицины и биотехнологии ФГБОУ ВО «Омский ГАУ». Содержание и уход за ними осуществляли в соответствии с требованиями по надлежащей практике при работе с лабораторными животными [7]. Для проведения эксперимента птиц разделили на четыре группы по пять голов в каждой. Цыплята первой группы (контроль 1) находились на стандартном рационе для молодняка птиц, поение осуществляли из автоматических поилок водопроводной водой. Второй группе цыплят (контроль 2) в воду ежедневно в течение 14 дней вносили ЭСМ в дозе 1 мл на 100 мл воды. Цыплята третьей группы (контроль 3) получали водный 0,001%-й раствор КфЭ весь период наблюдения. Птицам четвертой группы (опыт) на фоне интоксикации КфЭ ежедневно с водой выпаивали ЭСМ в дозе 1 мл на 100 мл воды. Оценку детоксицирующей активности ЭСМ проводили с учетом клинического статуса животных, показателей живой массы, реакции биохимических маркеров сыворотки крови, гистологической картины печени. Биохимические показатели определяли в химико-токсикологическом отделе Омской областной ветеринарной лаборатории на биохимическом анализаторе-автомате «Konelab20», используя реагенты фирмы Human (Германия) и Sentinel (Италия). Кусочки печени фиксировали в 4%-м нейтральном растворе формальдегида, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Парафиновые срезы толщиной 3–5 мкм получали на ротационном микротоме LaboCut 4055 (фирма Slee, Германия), окрашивали гематоксилином и эозином. Микрофотосъемку гистологических препаратов проводили на микроскопе Альтами БИО 1Т с цифровой окулярной камерой UCMOS0300KPA. Статистический анализ цифровых данных проводили с помощью пакета прикладных статистических программ Statistica 6.0. Сравнение медиан про- водили используя U-критерий Mannа-Whitney. Различия считали значимыми при p<0,05.
Результаты исследования и их обсуждение. Общее состояние птиц контрольных и опытной групп на протяжении всего периода наблюдения было удовлетворительным. У птиц контрольной группы 1 помет был сформирован, темно-коричневого цвета, моча была белого цвета, вязкой консистенции, у цыплят остальных групп отмечали полужидкий помет от темно-коричневого до черного цвета, моча была без видимых изменений. Состояние перьевого покрова у цыплят всех групп было удовлетворительным. Через неделю во всех контрольных группах наблюдали прирост массы тела, причем наибольшее значение данный показатель отмечали у цыплят второй группы, в воду которым добавляли ЭСМ (р<0,05). Через две недели медианы массы тела цыплят во всех группах имели одинаковое значение, за исключением животных третьей контрольной группы, которые весь период наблюдения получали 0,001%-й раствор КфЭ – у них отмечали снижение массы тела на 4 % (р<0,05).
При анализе биохимических показателей сыворотки крови было установлено снижение концентрации мочевой кислоты на 18,5 % (р=0,009) у цыплят, потреблявших в течение двух недель ЭСМ в дозе 1 мл/100 мл воды, повышение концентрации мочевой кислоты у цыплят, получавших 0,001%-й раствор КфЭ в течение всего периода наблюдения, на 29,5 % (р<0,05), в общий белок (г/л) альбумин (г/л)
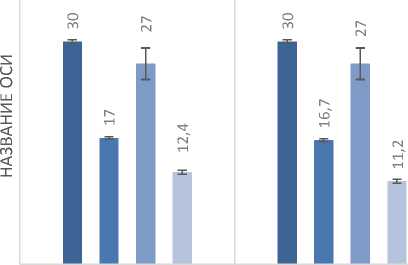
ГРУППА № 1 ГРУППА № 2
опытной группе (КфЭ+ЭСМ) регистрировали повышение данного показателя на 56 % (р<0,05) по сравнению с группой контроля 1.
Известно, что мочевая кислота является конечным продуктом пуринового и белкового обмена. Снижение данного показателя во второй контрольной группе могло быть обусловлено развитием гидропической дистрофии в печени птиц, признаки которой регистрировали гистологическими методами. Повышение данного показателя у птиц третьей контрольной и опытной групп, интоксицированных КфЭ, свидетельствует о развитии у них признаков мочекислого диатеза, что может быть следствием нефротоксического эффекта пестицида. При этом важно отметить, что экстракт сапропеля, вводимый в организм птиц на фоне интоксикации неонико-тиноидом, способствует более интенсивному накоплению мочевой кислоты в организме птиц, что в прогностическом отношении следует рассматривать как неблагоприятный фактор.
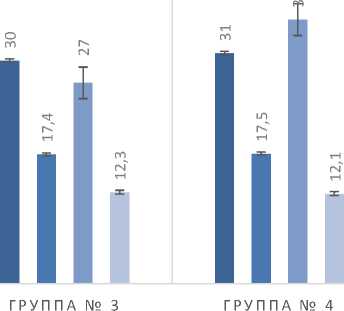
При анализе некоторых других биохимических показателей сыворотки крови птиц контрольных и опытной групп существенных отклонений не регистрировали (рис. 1). Следует отметить повышение концентрации креатинина у цыплят опытной группы на 18,3 % (р<0,05) по сравнению с группой контроля 1, что может указывать на развитие нефропатии, обусловленной в том числе высокой концентрацией мочевой кислоты в организме.
группы
Рис. 1. Медианы биохимических показателей сыворотки крови птиц: 1-я группа - контроль 1 (вода водопроводная); 2-я группа - контроль 2 (ЭСМ); 3-я группа - контроль 3 (0,001%-й раствор Конфидора Экстра ® ); 4-я группа - опыт (0,001%-й раствор Конфидора Экстра ® + ЭСМ)
креатинин(мкмоль/л) глюкоза(ммоль/л)
При патолого-анатомическом вскрытии птиц контрольных и опытной групп отмечали однотипную картину, при этом макроскопических изменений во внутренних органах отмечено не было. При анализе гистологической картины печени птиц контрольной группы 1 гепатоциты имели полигональную форму, цитоплазма однородная, оксифильно окрашена, ядро округлой формы, окрашено базофильно, в нем опреде- лялись одно или два ядрышка. Встречались двуядерные гепатоциты. Синусоидные капилляры расширены умеренно и содержали эритроциты, повреждений эндотелия не было зафиксировано (рис. 2). Междольковая соединительная ткань слаборазвита. Регистрировали небольшие скопления клеток лимфоидного ряда вокруг центральной вены.
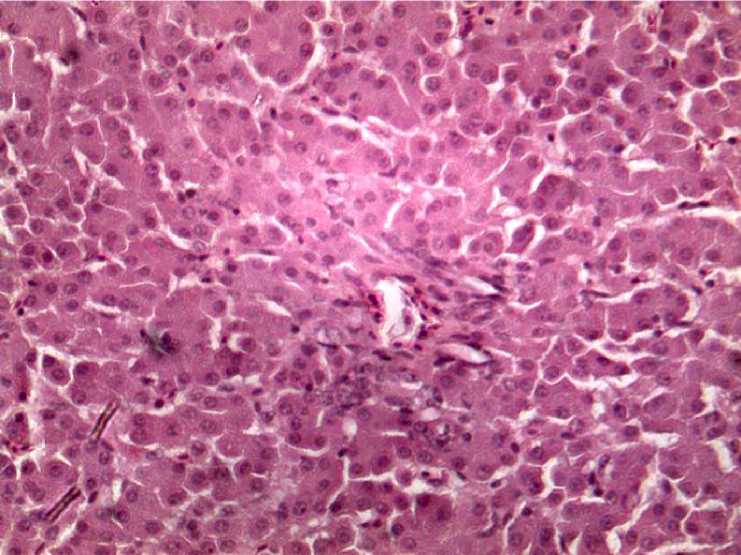
Рис. 2. Печень птиц контрольной группы 1. Гематоксилин и эозин, ×150
В печени птиц контрольной группы 2 гепатоциты находились в состоянии гидропической дистрофии – увеличены в объеме, цитоплазма их заполнена вакуолями, ядра, как правило, смещены на периферию, иногда с признаками вакуолизации (рис. 3). Синусоидные капилляры были расширены. Разрастание междольковой соединительной ткани не регистрировали, скопление лимфоидных клеток в печеночных дольках встречали редко.
Гистологическая картина печени цыплят контрольной группы 3 характеризовалась расширением синусоидных капилляров. Цитоплазма большинства клеток была оксифильно окрашена, ядра клеток были просветленные, содержали несколько ядрышек. Дистрофические изменения в гепатоцитах регистрировали редко (рис. 4). Небольшие скопления клеток лимфоидного ряда обнаруживали вокруг центральной вены.
В печени птиц опытной группы регистрировали гепатоциты в состоянии дистрофии, некробиоза и некроза, при этом ядра клеток отсутствовали или находились в состоянии пикно-за (рис. 5). Границы между клетками не дифференцировались.
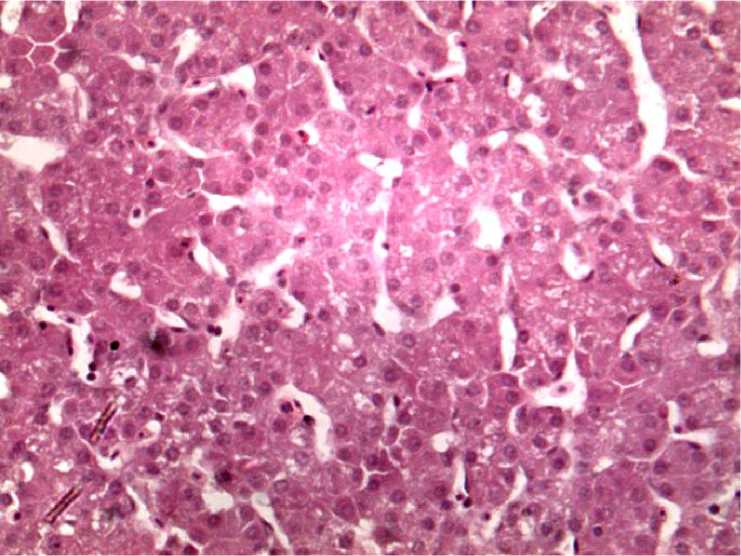
Рис. 3. Печень птиц контрольной группы 2. Расширение синусоидных капилляров, гидропическая дистрофия гепатоцитов. Гематоксилин и эозин, ×150
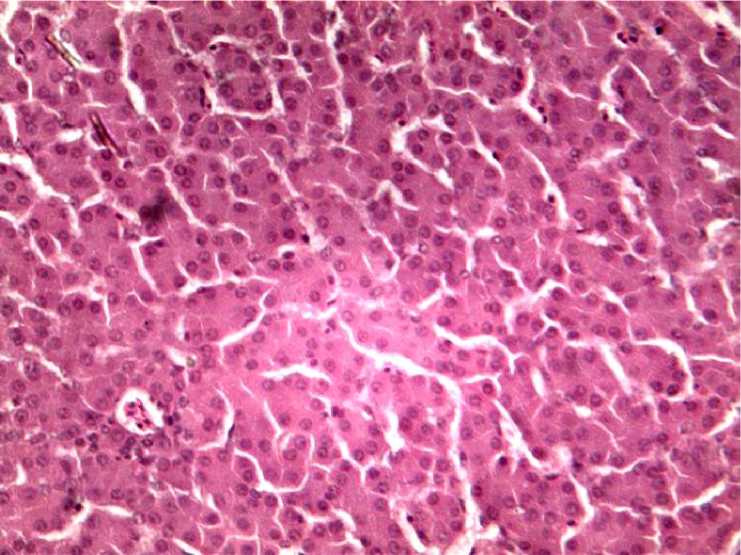
Рис. 4. Печень птиц контрольной группы 3. Расширение синусоидных капилляров. Гематоксилин и эозин, ×150
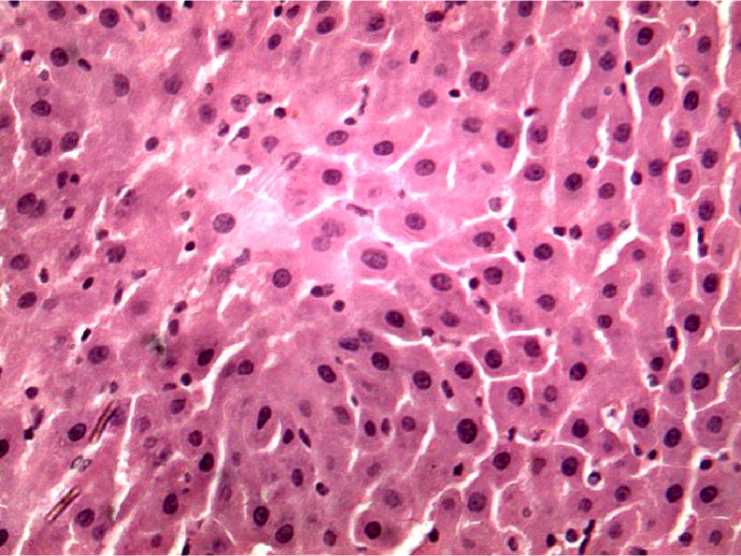
Рис. 5. Печень птиц опытной группы. Участки гепатоцитов в состоянии дистрофии, некроза и некробиоза. Гематоксилин и эозин, ×300
Регистрировали единичные двуядерные гепатоциты. Скопление мононуклеарных клеток обнаруживали на периферии печеночной дольки. Синусоидные капилляры умеренно расширены и заполнены кровью.
Выводы. Ежедневное поение цыплят 0,001%-м раствором КфЭ в течение двух недель способствует снижению массы их тела на 4 %, повышению уровня мочевой кислоты на 29,5 %. Гистологическая картина печени характеризуется преимущественно расширением синусоидных капилляров.
Ежедневное выпаивание цыплятам в течение 14 дней ЭСМ в дозе 1 мл на 100 мл воды способствует снижению мочевой кислоты на 18,5 %; гистологическая картина печени характеризуется признаками гидропической дистрофии.
На фоне интоксикации КфЭ ежедневное выпаивание ЭСМ в дозе 1 мл на 100 мл воды способствует увеличению уровня мочевой кислоты (на 56%) и креатинина (на 18,3%), что может быть обусловлено нарушением выделительной функции почек. Гистологические изменения в печени свидетельствуют о развитии дистрофических, некробиотических и некротических процессов в органе.
Таким образом, результаты проведенных исследований указывают на отсутствие детоксицирующего эффекта ЭСМ в дозе 1 мл на 100 мл воды на фоне интоксикации птиц КфЭ. Напротив, регистрируемые отклонения биохимических показателей сыворотки крови и структурные изменения в печени свидетельствуют о развитии гепато- и нефропатии у экспериментальных животных.
Список литературы Оценка детоксицирующей эффективности экстракта сапропеля при интоксикации птиц Конфидором Экстра
- Захаренко В.А. Пестициды в аграрном сек-торе России конца ХХ -начала ХХI века//Агрохимия. -2008. -№ 11. -С. 86-96.
- Лопатина Ю.В., Еремина О.Ю. Примене-ние инсектицидов группы неоникотиноидов в ветеринарии//С.-х. биология. Сер. «Био-логия животных». -2005. -№ 6. -С. 14-24.
- Токсикологическая характеристика неони-котиноидов/Т.В. Бойко, Л.К. Герунова, В.И. Герунов //Вестник Омск. гос. аграр. ун-та. -2015. -№ 4 (20). -С. 49-54.
- Бойко Т.В. Токсикокинетические особенно-сти неоникотиноида Конфидора Экстра® в организме крыс//Вестник НГАУ. -2013. -№ 1 (26). -С. 74-79.
- Применение сапропеля и продуктов его переработки в ветеринарии/В.И. Зайнчковский, В.Д. Конвай, Е.И. Войщатынский //Сапропель и продукты его перера-ботки: мат-лы Междунар. науч.-практ. конф. -Омск: Изд-во ОМГАУ, 2008. -С. 44-45.
- Насырова И.А. Разработка малоотходной технологии лекарственных и парафарма-цевтических средств на базе сапропелей Омского Прииртышья//Фармация Казах-стана: интеграция науки, образования и производства: мат-лы Междунар. науч.-практ. конф. -Шымкент, 2009. -Т. 2. -С. 68-73.
- ГОСТ 33215-2014. Руководство по содер-жанию и уходу за лабораторными живот-ными. Правила оборудования помещений и организации процедур. -URL: www.internet-law.ru/gosts/gost/61242/. Literatura


