Оценка интраоперационного метаболизма миокарда у детей первого года жизни при коррекции врожденных пороков сердца в условиях искусственного кровообращения
Автор: Углова Елена Владимировна, Князькова Любовь Георгиевна, Ломиворотов Владимир Николаевич, Горбатых Юрий Николаевич, Синельников Юрий Семенович, Шунькин Анатолий Васильевич, Афанасьев Иван Сергеевич, Корнилов Игорь Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 3 т.13, 2009 года.
Бесплатный доступ
Изучены некоторые особенности метаболизма миокарда у 40 детей раннего возраста с ИБС, оперированных в условиях искусственного кровообращения с применением кристаллоидной фармакологической/химической кардиоплегии (ФХК) (11 больных), кровяной кардиоплегии (14 больных) и раствора «Кустодиол» (15 больных). Проведена комплексная оценка интраоперационного содержания глюкозы, лактата, пирувата, свободных жирных кислот (СЖК), неорганического фосфора (НФ) в образцах артериальной крови и крови коронарного синуса. Выявлено, что динамика изучаемых биохимических показателей при сравнении показателей артериальной и венозной (коронарный синус) крови носила однонаправленный характер. Статистических различий этих показателей у больных с ацианотическим и синим пороками сердца не наблюдалось. Несмотря на применение средств кардиопротекции, выявлены утилизация глюкозы и некоторые признаки гипоксии миокарда за счет лактата и пирувата в крови коронарного синуса при одновременном повышении этих сред в артериальной крови. При анализе продукции/экстракции энергетических сред установлено, что метаболические пути в миокарде переключаются на разных этапах репарации ИБС. Интраоперационные и реперфузионные нарушения сердечного метаболизма в виде гипоэргоза и лактацидоза можно рассматривать как факторы риска сердечной недостаточности в раннем послеоперационном периоде.
Кардиохирургия, метаболизм, миокард, врожденные пороки сердца, искусственное кровообращение, первый год жизни
Короткий адрес: https://sciup.org/142233512
IDR: 142233512 | УДК: 616.12-089.168.1-053.3
Текст научной статьи Оценка интраоперационного метаболизма миокарда у детей первого года жизни при коррекции врожденных пороков сердца в условиях искусственного кровообращения
Современный уровень требований к обеспечению операций на открытом сердце у детей с ВПС предполагает адекватную кардиопротекцию при длительных сроках выключения сердца из кровообращения. Изучение интраоперационного метаболизма миокарда на этапах аноксии и реперфузии, особенно у детей с функционально незрелым миокардом, представляется крайне актуальным. В связи с этим представлялось целесообразным определить общую направленность метаболических сдвигов миокарда в период фармакологически контролируемой аноксии, изучить использование энергетических субстратов непосредственно после восстановления коронарного кровотока и окончания реперфузии. Опубликованы единичные работы, показывающие, что при применении ФХКП при коррекции ВПС у детей старшего возраста [12] и раствора «Custodiol» [2] у детей первого года жизни имеются гипоксические расстройства метаболизма миокарда.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 40 пациентов с ВПС (26-ДМЖП, 10-ТФ, ДОМС от ПЖ-2, ДМПП-2). Средний возраст детей 12±0,7 месяцев. Исследования проводились на следующих этапах: в начале анестезии - 0) исходный этап, 1) перед окклюзией аорты (АО) на фоне ИК, 2) непосредственно после восстановления сердечной деятельности, 3) 20-30-я мин реперфузии. Для защиты миокарда у 11 пациентов использовалась ФХКП и у 14 - кровяная кардиоплегия, по принятой в клинике методике, у 15 -раствор «Custodiol». Средняя продолжительность окклюзии АО составила 51,3±3,2 мин, ИК -95,1±4,4 мин. ИК проводилось в режиме умеренной гипотермии (средняя ректальная температура 31,3±0,4 °С). Анестезиологическое обеспечение включало комбинированную внутривенную и ингаляционную анестезию в составе базовых анестетиков: фентанил, изофлюран (в последнее время севофлюран); гипнотиков: дормикум (в последнее время пропофол); миорелаксантов-ардуан.
Забор проб крови производили из артерии и вены в начале на исходном этапе; из артериальной магистрали аппарата искусственного кровообращения (АИК) и коронарного синуса (КС) на 1этапе; из артериальной магистрали АИК и коронарного синуса на 2 этапе; из артериальной магистрали АИК и коронарного синуса на 3этапе. Метаболизм миокарда оценивался по содержанию глюкозы, лактата, пирувата, СЖК, неорганического фосфора в притекающей и оттекающей от сердца крови. На основе этих данных рассчитывалось процентное соотношение пациентов с экстракцией и продукцией метаболитов миокардом. Всем больным в послеоперационном периоде регистрировались ЭКГ и ЭхоКГ.
Статистическую обработку данных проводили с помощью пакета компьютерных программ ОFFICE XP, пакета статистических программ STATISTICA 6.0. В качестве статистически значимых считали результаты при достижении уровня значимости р<0,05, для оценки тенденции использовали уровень p<0,1. Методы статистики: для определения силы связи между параметрами вычислялся коэффициент корреляции Спирмена, различия между двумя группами оценивали непараметрическими критериями Манна-Уитни, Уилкок-сона. Если число сравниваемых групп превышало две, использовали непараметрический тест Краскелла-Уоллиса, для сравнения средних значений, которые нормально распределены, использовался критерий Стьюдента, для сравнения долей использовался z- критерий.
РЕЗУЛЬТАТЫ
Исследование динамики содержания глюкозы в артериальной крови показало статистически значимое возрастание ее концентрации на фоне ИК перед окклюзией АО в 2 раза по сравнению с исходным.
После снятия зажимов с аорты и восстановления сердечной деятельности, а также на 30-й мин реперфузии уровень глюкозы оставался в притекающей крови достоверно высоким по сравнению с исходным (р<0,001) (табл. 1). Аналогичная динамика содержания глюкозы выявлена в крови коронарного синуса (табл. 2), с той лишь разницей, что перед окклюзией АО и на 30-й мин реперфузии в крови КС уровень глюкозы был достоверно выше, чем в артерии (р<0,001).
Содержание лактата в артериальной крови перед коррекцией порока в 2 раза превышало исходное (р<0,001). После снятия зажимов с аорты и восстановления сердечной деятельности отмеча лось дальнейшее нарастание концентрации лактата и к 30-й мин реперфузии она оставалась на том же уровне (табл. 1). Аналогичная динамика содержания лактата выявлена в крови коронарного синуса (табл. 2), однако после восстановления сердечной деятельности концентрация этого метаболита в крови КС была достоверно выше, чем в притекающей артериальной крови (р<0,001).
Содержание пирувата в артериальной крови характеризовалась повышением на 2-м этапе относительно исходного и доокклюзионного с даль-
Таблица 1
Динамика показателей углеводных и липидных субстратов метаболизма миокарда в артериальной крови на этапах коррекции ВПС в условиях ИК у детей первого года жизни, ммоль/л
|
Этап- |
Глюкоза |
Медиана |
Лактат |
Медиана |
Пируват |
Ме- |
СЖК |
Ме- |
Фосфор |
Медиана |
||
|
N М±т |
N М±т |
N |
М±т |
диана |
N |
М±т |
диана |
N М±т |
||||
|
Исходный |
36,00 4,33±0,27 |
4,1 |
35,00 1,41±0,12 |
1,2 |
37,00 |
0,27±0,02 |
0,25 |
36,00 |
0,72±0,08 |
0,58 |
37,00 1,37±0,05 |
1,35 |
|
1 |
40,00 8,59±0,36 |
8,25 |
38,00 2,99±0,15 |
2,78 |
40,00 |
0,26±0,01 |
0,26 |
38,00 |
0,89±0,09 |
0,74 |
38,00 1,25±0,04 |
1,24 |
|
2 |
37,00 9,38±0,50 |
8,1 |
36,00 3,48±0,18 |
3,40 ***. ### |
37,00 |
0,30±0,02 |
0,30 ***. ### |
35,00 |
0,91±0,10 |
0,74 |
35,00 0,98±0,05 |
0,97 ***. ### |
|
3 |
37,00 9,32±0,50 |
8:4 |
35,00 3,68±0,23 |
3,77 ***. ### |
39,00 |
0,38±0,02 |
0,38 ***. ###, @@@ |
37,00 |
0,99±0,08 |
0,87 |
35,00 0,94±0,07 |
0,94 ***. ### |
Таблица 2
Динамика показателей углеводных и липидных субстратов метаболизма миокарда в крови коронарного синуса на этапах коррекции ВПС в условиях ИК у детей первого года жизни, ммоль/л
|
Этап- |
глюкоза |
Ме диана |
Лактат |
Ме-диана |
Пируват |
Ме- |
СЖК Ме- |
Фосфор |
Ме- |
||||
|
N |
М±т |
N |
М±т |
N |
М±т |
диана |
диа- N М±т на |
N |
М±т |
диана |
|||
|
Исходный |
31,00 4,31±0,28 4,0 |
32,00 |
1,67±0,1 |
1,44 |
34,00 |
0,28±0,02 |
0,27 |
31,00 0,87±0,11 0,71 |
32,00 |
1,47±0,06 |
1,44 |
||
|
1 |
37,00 |
9,47±0,5 |
8:7 |
38,00 |
3,13±0,19 |
3,01 |
40,00 |
0,27±0,02 |
0,27 |
38,00 0,97±0,09 0,82 |
36,00 |
1,21±0,05 |
1,22 ::: ### |
|
2 |
35,00 |
9,63±0,5 |
8:1 |
35,00 4,02±0,19 |
4,06 ::: ### |
35,00 |
0,34±0,02 |
0,31 ::: ### |
33,00 0,85±0,09 0,81 |
33,00 |
1,01±0,05 |
1,0 ::: ### |
|
|
3 |
37,00 |
9,61±0,5 |
8,8 |
34,00 |
3,49±0,15 |
3,58 *** , # |
39,00 |
0,37±0,02 |
0,35 ::: ###, @@@ |
35,00 0,85±0,08 0,76 |
35,00 |
1,04±0,07 |
1,1 ::: ### |
Исходный - начало анестезии; 1 - перед окклюзией АО на фоне ИК; 2 - сразу после восстановления сердечной деятельности; 3 - 30-я минута реперфузии
-
* статистически значимое различие между исходным этапом и последующими; # статистически значимое различие между 1 этапом и 2,3 этапом; @ статистически значимое различие между 2 этапом и 3 этапом;
-
*, #, @ p<0,05 (p-уровень значимости); **, ##, @@ p<0,01; ***, ###, @@@ p<0,001
нейшим нарастанием к 30-й мин реперфузии (р<0,001) (табл. 1). Аналогичная динамика содержания пирувата выявлена в крови коронарного синуса (табл. 2). Обнаружено, что после восстановления сердечной деятельности концентрация пирувата в крови КС была статистически значимо отличалась (выше) от артериальной (р<0,01).
Мы не выявили корреляции исследуемых параметров с длительностью пережатия аорты.
Уровень неорганического фосфата в артериальной крови непосредственно после восстановления сердечной деятельности имел статистически значимое различие (снижение) относительно исходного (р<0,001) и доокклюзионного периода (р<0,001) с сохранением низких показателей к 30й мин реперфузии (табл.1). Аналогичная динамика содержания неорганического фосфора выявлена в крови коронарного синуса без достоверных артериовенозных различий на всех этапах исследования (табл. 2).
Концентрация свободных жирных кислот в артериальной крови имела статистически значимое различие (повышение) перед окклюзией АО (р<0,001), сохраняясь на данном уровне до окончания реперфузии (табл. 1). Уровень СЖК в крови коронарного синуса оставался таким же высоким, как и в артериальной крови, статистически достоверных артериовенозных различий по концентрации СЖК на этапах исследования не зарегистрировано (табл. 2).
Установлено, что динамика изменений исследуемых биохимических параметров в притекающей к сердцу артериальной крови и крови коронарного синуса имела четкий однонаправленный характер. Мы не выявили статистических различий по всем представленным показателям между пациентами с цианотическими и бледными пороками.
Оценка распределения доли пациентов по соотношению продукции и экстракции энергетических субстратов миокардом на этапах коррекции ВПС показала, что перед окклюзией АО, на фоне ИК в режиме умеренной гипотермии (средняя ректальная температура 31,3±0,4 °С) отмечалась продукция глюкозы миокардом у 63±8% пациентов, лактата у 61±8%, пирувата у 50±8%, СЖК у 55±8% и экстракция фосфора у 67±8% пациентов. Непосредственно после восстановления сердечной деятельности (2 этап) доля пациентов с продукцией лактата в коронарный синус составила 83±8%, что статистически отличалось в сторону прироста от 1 этапа (р<0,05) и в 65±8% случаев наблюдалось продукция пирувата без статистических отличий с 1 этапом. Экстракция глюкозы выявлена у 63±8% пациентов, что статистически значимо отличалось, увеличилось по сравнению с 1 этапом (р<0,01), СЖК - у 62±8%, фосфора в 50±8% случаев, без статистических отличий с 1 этапом. На этапе реперфузии миокард продуцировал глюко зу у 70±8% пациентов, что статистически отличалось в сторону прироста от 2 этапа (р<0,01). Доля пациентов с экстракцией лактата увеличилась до 68±8% по сравнению со 2 этапом (р<0,001), пирувата - до 64±8% (р<0,01) и наблюдалось экстракция СЖК у 66±8%, фосфора - у 53±8% пациентов, без статистически значимых различий со 2 этапом (рисунок).
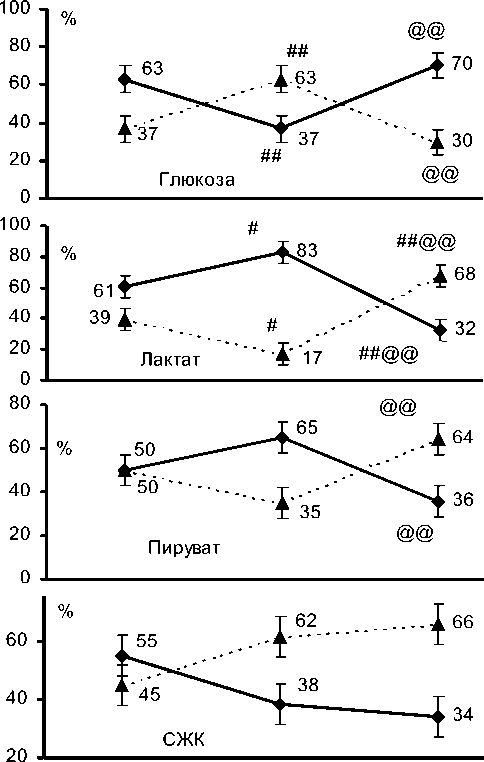
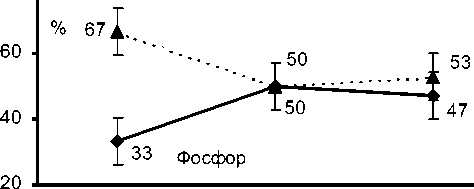
1 этап 2 этап 3 этап
♦ продукция ---А ■■ экстракция
1 этап - перед окклюзией АО на фоне ИК; 2 этап -сразу после восстановления сердечной деятельности; 3 этап - 30 минута реперфузии.
Процент больных по соотношению продукции - экстракции миокардом энергетических субстратов на этапах коррекции ВПС у пациентов первого года жизни.
ОБСУЖДЕНИЕ
В обычном режиме деятельности миокард предпочтительно использует для синтеза АТФ свободные жирные кислоты (60-90%),тогда как оставшаяся часть (10-40%) приходится на окисление глюкозы. В здоровом сердце практически все количество (>95%) АТФ синтезируется в процессе окислительного фосфорилирования в митохондриях и лишь небольшая часть образуется путем анаэробного гликолиза [24]. При увеличенной нагрузке сердечная мышца утилизирует глюкозу, при окислении которой образуется больше АТФ, чем при окислении СЖК. Известно также, что сердце может использовать в качестве энергетических субстратов недоокисленные метаболиты глюкозы лактат и пируват.
Фармакологически контролируемая аноксия миокарда и реперфузия при операциях на открытом сердце вызывает ряд метаболических изменений в сердечной мышце, затрагивающих субстратное обеспечение физиологических функций [8, 17]. Нами установлено, что перед окклюзией аорты на фоне искусственного кровообращения имеются нарушения использования энергетических субстратов сердечной мышцей. Снижение экстракции глюкозы миокардом, несмотря на повышенный уровень ее в артериальной крови, по-видимому, связано с действием на организм экстремальных факторов операционного периода и повышенной резистентностью тканей к инсулину вследствие высокого уровня в крови стрессовых гормонов. Имеются данные о снижении утилизации глюкозы миокардом перед коррекцией ВПС на глубине охлаждения с предпочтительным использованием лактата и жирных кислот в качестве энергетических субстратов [12]. С позиций изменений метаболического состояния миокарда период охлаждения у детей первого года жизни, по нашим данным, характеризовался появлением группы пациентов (61±8%), у которых регистрировалось выведение лактата в кровь коронарного синуса. Это свидетельствовало о развитии гипоксических нарушений в сердечной мышце еще до основного этапа операции, что по мнению ряда авторов связано с непосредственным влиянием гипотермии на миокард [6, 29].
Несмотря на применяемые методы кардиопротекции, у большинства пациентов первого года жизни после снятия зажима с аорты повышенный уровень лактата в крови коронарного синуса может свидетельствовать о его анаэробной природе и подавлении окислительных процессов в миокарде. Выраженную продукцию лактата миокардом на аналогичном этапе операции отмечали и при коррекции клапанных пороков сердца [3, 4], и после операций аорто-коронарного шунтирования. [1, 10, 13], а также при коррекции ВПС в условиях бесперфузионной гипотермии с применением ФХКП у детей старшего возраста [12], при коррекции ВПС в условиях гипотермической перфузии у пациентов первого года жизни с применением ФХКП и раствора «Custodiol» [2].
Увеличение концентрации пирувата в крови коронарного синуса, зарегистрированное нами после снятия зажима с аорты, по-видимому, связано с нарушением включения пирувата в цикл Кребса, что может быть обусловлено снижением активности пируватдегидрогеназы вследствие уменьшения активности инсулина. Полагают, что именно снижение чувствительности тканей к инсулину под влиянием контринсулярных гормонов является причиной уменьшения потребления не только глюкозы, но и лактата и пирувата х [27].
Эта точка зрения подтверждена клиническими наблюдениями и хорошим эффектом лечения раствором, содержащим глюкозу, инсулин, калий (ГИК-смесь) [28]. Известно, что применение препаратов, непосредственно активирующих окисление пирувата, приводило к устранению последствий ишемии, восстановлению ионного гомеостаза и улучшению сократительной активности миокарда [22], По результатам некоторых исследований внутрикоронарная инфузия пирувата приводила к быстрому повышению фракции выброса левого желудочка и минутного объема сердца у пациентов с дилятационной кардиомиопатией. Данный эффект исчезал сразу же после прекращения инфузии [16].
Анализ использования оперированным сердцем энергетических субстратов показал, что значительное снижение доли пациентов с потреблением глюкозы с 63±8% от начала восстановления коронарного кровотока до 30±8% к 30-й мин реперфузии сменяется продукцией этого субстрата соответственно с 37±8 до 70±8% больных, что подтверждает имеющиеся данные о снижении утилизации миокардом энергетических субстратов в постишемическом периоде [26]. Такое переключение с потребления глюкозы миокардом при возобновлении кровотока на ее выведение в кровь коронарного синуса к 30-й мин реперфузии может свидетельствовать о нарушении окислительного фосфорилирования и образования АТФ вследствие повреждения митохондрий. Оно может быть связано с реперфузионной и реоксигенационной активацией перекисного окисления липидов (ПОЛ), приводящего к структурной модификации биологических мембран. Поскольку продукты ПОЛ увеличивают проницаемость липидного бислоя мембран, особенно для ионов H и Са, это может приводить к избытку Са в цитоплазме и накоплению его в митохондриях, что способствует разобщению окисления с фосфолированием и дефициту АТФ [7]. Кардиомиоцит при снижении способности митохондрий осуществлять синтез АТФ может оказаться в условиях энергетического голода (гипоэргоза) [5, 14].
Возрастание доли пациентов с потреблением сердцем свободных жирных кислот по сравнению с потреблением глюкозы к 30-й мин реперфузии отражает существование обратной зависимости между этими субстратами в их влиянии на миокард. Считают, что увеличение концентрации СЖК в системной циркуляции при реперфузии ишемизированного миокарда является одним из главных факторов, приводящих к повышению активности окисления СЖК в сердце, в результате чего резко снижается активность окисления глюкозы [19, 21]. Таким образом, еще одним существенным фактором разобщения гликолиза и окислительного фосфорилирования в этот период является гиперлипидемия, что приводит к избыточному синтезу и накоплению лактата и протонов в клетке [18]. Нельзя исключать и того факта, что экстракция СЖК может быть связана не только с использованием в качестве энергетического источника, но и как субстрата в процессах ПОЛ. По современным данным медикаментозное торможение окисления СЖК и стимуляция окисления глюкозы способны улучшать эффективность работы сердца в условиях ишемии [9]. Кроме того, применение глюкозо-инсулинового раствора способствует снижению концентрации циркулирующих жирных кислот и улучшению сократительной функции сердца [25]. Инфузия ГИК-смеси в периоде реперфузии должна начинаться как можно раньше, поскольку при этом наилучшим образом используется «терапевтическое окно», позволяющее инсулину эффективно блокировать поступление жирных кислот в миокард [17].
Значительное снижение доли пациентов с продукцией лактата с 83±8% от начала восстановления коронарного кровотока до 32±8% к 30-й мин реперфузии сменяется потреблением этого субстрата соответственно от 17±8 до 68±8% больных.
Наши данные о потреблении миокардом лактата, пирувата в качестве энергетических субстратов на этапе реперфузии у большей доли больных первого года жизни сопоставимы с ранее представленными данными после коррекции ВПС у пациентов старшего возраста [12].
Способность миокарда экстрагировать лактат, являющийся эффективным источником энергии для аэробного гликолиза позволяет повысить экономичность потребления кислорода в миокарде на 16-26% [20]. По данным некоторых авторов снижение утилизации лактата у ряда пациентов в этот период совпадало с развитием сердечной недостаточности [3], в тоже время по данным других авторов переключение метаболизма на захват и окисление углеводов, в том числе и лактата, приводило к улучшению функции левого желудочка [15]. По-видимому, следует считать включение лактата в процесс метаболизма у детей первого года жизни на этапе реперфузии прогностически благоприятным признаком, тем более, что нормальный метаболизм сердечной мышцы в данной возрастной группе предполагает предпочтительное использование лактата и глюкозы в качестве энергетических субстратов [11]. Снижение содержания неорганического фосфата как в артериальной, так и в венозной крови коронарного синуса после восстановления сердечной деятельности и на 30-й мин реперфузии может свидетельствовать о его использовании в реакциях окислительного фосфорилирования и образования АТФ.
ВЫВОДЫ
-
1. Интраоперационная динамика метаболических показателей в артериальной крови и крови коронарного синуса у детей первого года жизни при коррекции ВПС носит однонаправленный характер и представлена гипергликемией, лактатемией, пи-руватемией и гипофосфатемией.
-
2. Метаболизм миокарда непосредственно после восстановления сердечной деятельности при сравнении количественных показателей в артерии и коронарном синусе характеризуется продукцией лактата и пирувата, что отражает гипоксические изменения в миокарде и преобладание анаэробного пути обмена, а также продукцией глюкозы на момент реперфузии, что свидетельствует о нарушении утилизации глюкозы.
-
3. Субстратное обеспечение оперированного сердца при оценке доли пациентов с экстракцией -продукцией характеризуется переключением метаболических путей с экстракции глюкозы и продукции лактата на этапе восстановления коронарного кровотока относительно доокклюзионного периода на потребление лактата и пирувата на фоне нарушения утилизации глюкозы на этапе реперфузии по сравнению с этапом восстановления сердечной деятельности.
-
4. Использование лактата на этапе реперфузии можно рассматривать в качестве экономичного энергетического субстрата для оперированного сердца у детей первого года жизни, совпадающего с возрастными особенностями метаболизма сердечной мышцы.
-
5. Интраоперационные и реперфузионные нарушения метаболизма миокарда в форме гипоэргоза и лактацидоза у детей первого года жизни при кардиохирургических вмешательствах являются факторами риска развития сердечной недостаточности в раннем послеоперационном периоде.
Список литературы Оценка интраоперационного метаболизма миокарда у детей первого года жизни при коррекции врожденных пороков сердца в условиях искусственного кровообращения
- Бокерия Л.A., Нисневич Э.Д., Лушкин A.B., Сигаев И.Ю., Крюченков Н.Б., Мовсесян Р.Р.//Грудная и сердечно-сосудистая хирургия, 2000. № 4. С. 25-28.
- EDN: RWZOBP
- Бокерия Л.А., Шебаев Г.А., Нисневич Э.Д., Егорова И.Ф., Ким А.И., Мовсесян Р.Р.//Бюллетень НЦ ССХ им. А.Н. Бакулева РAMH, 2002, Т. 3, № 11. С. 223-223.
- EDN: VTMQIX
- Дементьева И.И., Бабалян Г.В., Соловова Л.Е.//Cor et vasa, 1982. V. 24. P. 16-26.
- EDN: XLXUDR
- Дементьева И.И., Белоус А.Е., Трекова Н.А. Андрианова М.Ю., Мильчаков В.И.//Клиническая и лабораторная диагностика, 1997. Т. 6. С. 53.
- Долгих В.Т. Повреждение и защита сердца при острой смертельной кровопотере. Омск. Изд. ОГМА. 2002. 203 с.


