Оценка эффективности биодеградации полимерных композиционных материалов
Автор: Белик Е.С., Рудакова Л.В., Куликова Ю.В., Бурмистрова М.В., Слюсарь Н.Н.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология и природопользование
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Ежегодно существенно возрастает объем производства и применения в различных отраслях народного хозяйства полимерных композиционных материалов (ПКМ), что в конечном итоге приводит к возникновению экологической проблемы современного общества - утилизации отходов композиционных материалов. Одним из решений данной проблемы является создание полимерных композиционных материалов с установленным сроком службы и способностью сохранения эксплуатационных свойств в течение периода их использования, с последующей деструкцией в условиях окружающей среды без образования токсичных веществ. В литературных источниках недостаточно изучены данные по оценке процесса биоразложения композиционных материалов в окружающей природной среде, в связи с чем исследования в данном направлении представляют собой актуальную экологическую задачу. Цель работы заключалась в оценке возможности биологической деградации полимерных композиционных материалов. В работе представлен анализ методов оценки биологической деструкции полимерных композиционных материалов, на основании которого был выбран метод, изложенный в ГОСТ 9.049-91 «Единая система защиты от коррозии и старения (ЕСЗКС)...
Полимерные композиционные материалы, биодеградация, биодеструкция, микромицеты
Короткий адрес: https://sciup.org/14117030
IDR: 14117030 | УДК: 504.054;
Текст научной статьи Оценка эффективности биодеградации полимерных композиционных материалов
Благодаря своим механическим и физикохимическим свойствам, которые можно регулировать в зависимости от состава, полимерные композиционные материалы (ПКМ) используются в различных отраслях промышленности, таких как строительство, машиностроение, медицина, авиационная и ракетно-космическая техника, судостроение, мостостроение и т.д.
Объем производства ПКМ ежегодно увеличивается, и по данным некоторых специалистов, к 2020 г. может составить более 115 тыс. тонн, а их потребление на душу населения воз расти до 0,8 кг/чел. (Петров и др. 2015). В связи с ростом объемов производства произойдет увеличение образования объемов отходов композиционных материалов, в связи с чем их утилизация становится значимой экологической проблемой современного общества.
Одним из решений данной проблемы является создание полимерных композиционных материалов с установленным сроком службы и способностью сохранения эксплуатационных свойств (прочность, жесткость, стойкость и т.д.) в течение периода их использования, с последующей деструкцией в условиях окружаю- щей среды без образования токсичных веществ. Перспективным направлением для получения биодеградируемых материалов является совмещение синтетических полимеров с природными, которые обеспечивают разложение всего рамова и др. 2012; Абрамова и др. 1981; Маста-лыгина 2015).
Для оценки способности полимерных композиционных материалов к деструкции применяются модельные эксперименты, соот- композита.
В литературных источниках недостаточно данных о кинетике процесса биоразложения композиционных материалов в окружающей природной среде, в связи с чем исследования в данном направлении представляют актуальную экологическую задачу (Замышляева 2012; Ка-
ветствующие реальным условиям деградации в окружающей среде, с воздействием на материал ограниченного количества факторов, таких как температура, влажность, доступ кислорода и т.д. Анализ наиболее часто применяемых методов оценки биологической деструкции ПКМ приведен в таблице 1.
Таблица 1
Методы оценки биологической деструкции полимерных композиционных материалов [4, 6]
|
Метод |
Сущность метода |
Время эксперимента |
Условия эксперимента |
Применяемые культуры |
Стандарт |
|
Микологический тест |
Определение устойчивости материала к воздействию культур плесневых грибов |
28 суток |
|
Плесневые и микроскопические грибы |
ISO 846 ASTMG 21-96 ГОСТ 9.049-91 |
|
Бактериальный тест |
Определение устойчивости материала к воздействию культур бактерий |
300 лк |
Бактериальные клетки |
ISO 846 ASTM G 22-76 |
|
|
Биоразлагаемость нерастворимых веществ |
Определение количества О2, поглощенного при аэробной деградации |
4 месяца |
|
Инокулянт из активного ила или сточной воды |
ISO 10708 OECD 301 D |
|
Тест в свободном пространстве при 25/50 С ' |
Определение количества СО2, выделившегося при инкубации материала |
48 дней |
|
Смешанная популяция микроорганизмов |
ASTM D5988-96 OECD 301 A |
|
Метод Штурма |
Определение выделившегося СО2 в процессе деградации материала |
6 месяцев |
|
Грибная или бактериальная флора |
ISO 9439 ISO 14852 DIN EN 29439 ASTM D 5209 |
|
Определение выделившегося СО2 (аэробный тест в компосте) |
Определение выделившегося СО2 в процессе деградации материала в компосте |
6 месяцев |
|
Аэробные бактерии |
ISO 14855 ASTM D 6400 |
|
Определение степени разложения в компосте |
Определение степени разложения материала в модельном промышленном компосте |
90 дней |
|
Инокулянт, термофильные бактерии |
ISO 16929 ISO 20200 BS EN 14045 |
|
Почвенный гест |
Определение поглощенного О2 или выделившегося СО2в процессе деградации материала в природной почве верхнего слоя полей |
6 месяцев |
|
Почвенные микроорганизмы |
ISO 17556 DIN 53739 ГОСТ 9.060-75 |
Исходя из представленных данных, можно сделать вывод, что существует широкий спектр лабораторных методов исследования биодеструкции полимерных композиционных материалов, которые отличаются длительностью экспериментальных исследований, условиями проведения процесса (температура, влажность, освещенность и пр.), применяемыми культурами микроорганизмов (бактерии, грибы и т.д.).
На основании проведенного литературного анализа для оценки биодеструкции ПКМ был выбран микологический тест, позволяющий ускорить процесс оценки биодеградации объектов исследования благодаря созданию оптимальных условий, таких как температура, влажность, наличие биодеструкторов - микро-мицетов.
Цель работы заключалась в оценке возможности биологической деградации полимерных композиционных материалов.
Экспериментальная часть
Методы исследования. Биодеструкцию полимерных материалов оценивали согласно ГОСТ 9.049-91 «Единая система защиты от коррозии и старения (ЕСЗКС). Материалы полимерные и их компоненты. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов».
Для проведения экспериментальных исследований были отобраны пробы нефтезагрязненных грунтов с технологических площадок биоремедиации. Отбор проб осуществлялся из поверхностного слоя до глубины 0,3 м методом «конверта» (смешанная проба на площади 2025 м2) в соответствии с требованиями ГОСТ 17.4.3.01-83. (Охрана природы. Почвы. Общие требования к отбору проб) и ГОСТ 17.4.4.02-84. (Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа).
Количество клеток микроорганизмов в исследуемой почве определяли высевом на плотные питательные среды (метод Коха) согласно стандартным в микробиологической практике методикам. Количество клеток в 1 мл исследуемого субстрата вычисляли по формуле:
где М - количество клеток в 1 мл; а - среднее число колоний, выросших после посева из дан ного разведения; V - объем суспензии, взятый для посева, мл; 10л - коэффициент разведения (Нетрусов и др. 2005).
Идентификацию выделенных микроскопических грибов проводили на основе культурально-морфологических признаков с использованием стандартных определителей (Литвинов 1967; Билай и др. 1984).
Предварительно образцы материалов очищают от внешних загрязнений, протирая бязевым тампоном, смоченным этиловым спиртом. Подготавливают суспензию спор грибов с концентрацией спор каждого вида гриба 12 млн/см3. После этого материал заражают спорами микроскопических грибов с двух сторон.
Испытания проводят при температуре (29±2) °C и относительной влажности воздуха более 90%. В эксикаторе и камере не допускается конденсация влаги и воздействие прямого естественного или искусственного освещения.
Продолжительность испытаний при оценке грибостойкости материалов по степени развития грибов составляет 28 суток с промежуточными осмотрами через 7 и 14 суток.
Статистическую обработку полученных данных осуществляли с использованием компьютерной программы Excel 2007, рассчитывая среднее арифметическое и стандартную ошибку среднего. Достоверность различий между средними величинами оценивали с помощью t-критерия Стьюдента для уровня значимости а = 0,05 (Боровиков 2001).
Экспериментальные исследования
Объектами исследования являются полимерные композиционные материалы, представленные в таблице 2.
Основные технические характеристики полимерных композиционных материалов приведены в таблице 3.
По своим техническим характеристикам представленные ПКМ являются прочными материалами, широко используемыми в авиастроении.
Для выделения микроскопических грибов использовали почву, отобранную с технологических площадок биоремедиации с содержанием нефтепродуктов 33±8,3 г/кг (табл. 4). Особенностью нефтезагрязненных почв является изменение численности и видового разнообразия педобионтов.
Таблица 2
Характеристика полимерных композиционных материалов
|
№ |
Материал |
Описание |
Состав |
|
1 |
Стеклопластик АГ -4ВГОСТ 20437 |
Волокнит на основе стеклянных нитей |
1. Стеклянные нити 2.Феноло-формальдегидное связующее |
|
2 |
Стеклопластик ДСВ ГОСТ 17478 |
Дозирующийся стекловолокнит на основе комплексных стеклянных нитей, пропитанных модифицированным фенолоформальдегидным связующим |
|
|
3 |
Органопластик ОП-ЖА |
Органоволокно на основе жгута арамидного типа и эпоксидного связующего |
|
|
4 |
Углепластик УП-Урал-Тр-СФ |
Композиция на основе углеродного трикотажного материала с фенолоформальдегидным связующим |
1. Углеродный трикотаж 2.Фенолоформальдегидное связующее |
|
5 |
Углепластик УТЗФ2УМН |
Композиция на основе углеткани и фенолофор-мальдегидного связующего |
|
|
6 |
Углеволокнит ЭПАН-2Б |
Композиция на основе углеродных волокон и фено-лоформальдегидного связующего с минеральными добавками |
|
Таблица 3
Технические характеристики полимерных композиционных материалов _____________
|
Показатель |
АГ-4В |
ДСВ (неокрашенный) с длиной гранул |
ОП- ЖА |
УП-Урал-Тр-СФ |
УТЗФ2УМН |
ЭПАН-2Б |
||
|
6 мм |
10 мм |
18 или 20 мм |
||||||
|
Плотность, кг/м3 |
1 400 1 500 |
1 800-2 000 |
1 320 1 350 |
650 |
1 340 |
1 300 |
||
|
Разрывная нагрузка, Н не менее |
- |
- |
- |
- |
- |
882 |
900 |
- |
|
Изгибающее напряжение при разрушении, МПа, не менее |
158 |
157 |
236 |
296 |
450550 |
90-220 |
- |
66-85 |
|
Разрушающее напряжение при сжатии, МПа, не менее |
130 |
127 |
127 |
127 |
70-210 |
- |
400 -800 |
110-140 |
|
Ударная вязкость кДж/м2, не менее |
69 |
44 |
69 |
79 |
315 |
- |
- |
55 |
|
Массовая доля связующего, % ' |
36+/-4 |
38+/-2 |
38+/-2 |
38+/-2 |
- |
2 |
- |
- |
|
Массовая доля влаги и летучих веществ, % |
2,5-5,5 |
1,5-3,0 |
1,5-3,0 |
1,5-3,0 |
- |
1,5-5,0 |
0,5-2,0 |
4,5-5,6 |
Согласно проведенным исследованиям, в почве присутствуют тяжелые металлы (кадмий, медь, ртуть, свинец, цинк) в концентрациях в пределах ПДК, также отмечено превышение содержания хрома до 147 мг/к. Избыток хрома в почве приводит к изменению микробиоценоза и биологической активности почвы, влияя на численность, видовой состав и жизнедеятельность почвенной микробиоты, ингибируя процессы минерализации и синтеза различных веществ в почвах, подавляя дыхание почвенных микроорганизмов и вызывая микробостатический эффект (Федоров и др. 1980). Микробиологическая характеристика почвы представлена в таблице 4.
В результате микробиологических исследований почвы были выделены Aspergillus niger, Penicillium sp., Paecilomyces sp., являющиеся основными биодеструкторами различных материалов, в том числе полимерных (рис. 1).
Таблица 4
Микробиологическая характеристика почвы
|
Питательная среда |
Показатель |
Значение |
|
МПА |
Сапрофитные микроорганизмы |
(1,5±0,1)-109КОЕ/г |
|
Чапека |
Микроскопические грибы |
(6,0±1,1)1(Г КОЕ/г |
|
Красильникова |
Микроскопические грибы |
(6,35±0,7)-Ю8КОЕ/г |
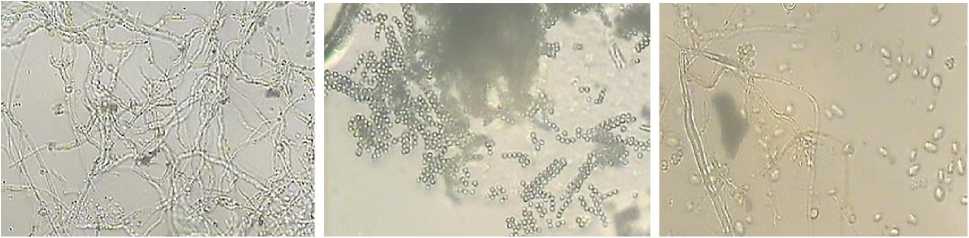
Рис. 1. Микроскопические грибы, выделенные из почв
Обсуждение результатов
Для оценки биодеградации композиционных материалов были подготовлены образцы по ГОСТ 9.048. Испытание предусматривало заражение образцов спорами культур плесневых грибов без использования дополнительной питательной среды. В качестве контроля выступали образцы ПКМ без обработки микроскопическими грибами.
Биоразлагаемость композиционных материалов оценивали по степени развития мицелия плесневелых грибов на поверхности образцов при их выдерживании в эксикаторе при температуре 28±1 С в течение 28 суток с периодическим осмотром через 7 и 14 суток.
После инкубационного периода интенсивность биообрастания композиционных материалов, вызванного ростом плесневых грибов, определяли визуально при освещенности 200300 лк. Степень развития плесневых грибов на поверхности каждого образца оценивали по 6-балльной шкале в соответствии с ГОСТ 9.048 (табл. 5).
Обнаружено, что на первой неделе инкубации происходит начальный рост плесневелых культур с образованием очагов мицелия и формирование спороношения. В течение дальнейшего периода происходит активный рост колоний микромицетов, в результате которого материал покрывается плесневелыми грибами, что свидетельствует о наличии доступного субстрата в системе и подтверждает биодоступность композита для различных родов микроскопических грибов.
Обрастание образцов можно наблюдать уже на 14-е сутки заражения, однако процесс роста грибов на некоторых композиционных материалах продолжался и после. Оценка гри-бостойкости материалов была получена на 28-й день эксперимента.
Таблица 5
Оценка грибостойкости ПКМ в баллах
|
Микро-мицет Образцы^ ПКМ \ |
Aspergillus nig er |
Penicillium sp. |
Paecilo-myces sp. |
|||
|
Период наблюдения |
14 суток |
28 суток |
14 суток |
28 суток |
14 суток |
28 суток |
|
Баллы |
||||||
|
АГ-4В |
3 |
3 |
5 |
5 |
2 |
2 |
|
ДСВ |
4 |
5 |
4 |
5 |
2 |
2 |
|
ОП-ЖА |
4 |
4 |
4 |
5 |
1 |
1 |
|
УП-Урал-Тр-СФ |
5 |
5 |
5 |
5 |
- |
_* |
|
УТЗФ2УМН |
5 |
5 |
5 |
5 |
— |
— |
|
ЭПАН-2Б |
3 |
3 |
5 |
5 |
2 |
2 |
* «—» означает, что не обрабатывали данным мик ромицетом
По окончании инкубационного периода было установлено, что все полимерные композиционные материалы способны использоваться в качестве источника питания микроскопическими грибами, такими как Aspergillus niger и Penicillium sp., однако данные образцы являются грибостойкими к росту микромицета Paeci-lomyces sp.
Показано, что для всех композитов наблюдается рост мицелия плесневых грибов с развитием спороношения. Следовательно, материалы содержат достаточное количество питательных веществ, которые обеспечивают развитие грибов. Однако, отмечается разница в интенсивности развития микромицетов на по- верхности материалов в зависимости от микро-мицета.
Воздействие на образцы композитов плесневелых грибов со временем приведет к изменению таких свойств как разрушающее напряжение, характеристическая вязкость, прочность и деформация при разрыве.
Динамика биообрастания полимерного композиционного материала УП-Урал-Тр-СФ микроскопическим грибом PeniciUium sp. через 28 дней представлена на рисунке 2.

1 -й день эксперимента

28-й день эксперимента
Рис. 2. Динамика биообрастания полимерного композиционного материала УП-Урал-Тр-СФ микроскопическим грибом PeniciUium sp.
В ходе эксперимента образцы композитов находились в условиях высокой влажности и повышенной температуры в течение 28 суток. По истечению срока образцы извлекали из среды, отмывали от культуры и дополнительно протирали спиртом, высушивали на воздухе и взвешивали. Исходя из этого, была определена масса исследуемых образцов ПКМ. Увеличение массы полимерных композиционных образцов представлено на рисунке 3.
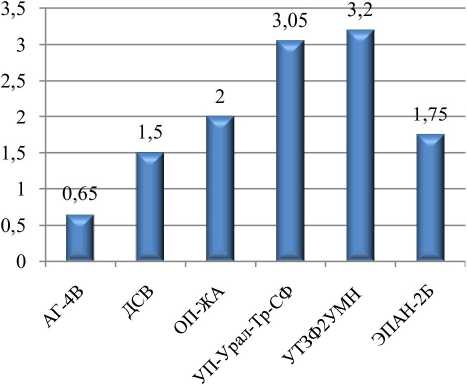
Рис. 3. Показатели увеличения массы полимерных композиционных образцов (%)
Согласно полученным данным, наименьшее изменение массы наблюдалось у образца
АГ-4В, а наибольшее зафиксировано у образцов УП-Урал-Тр-СФ и УТЗФ2УМН. Увеличение массы материалов УП-Урал-Тр-СФ и УТЗФ2УМН на 3% можно объяснить условиями проведения эксперимента (влажность, повышенная температура), а также свойствами самих материалов (плотность меньше, чем у других), склонных к водопоглощению. В результате происходит вспучивание образцов, которое способно повысить биодоступность для микроорганизмов и более интенсивную биодеградацию материалов.
Высокие показатели водопоглощения материалов облегчают проникновение продуктов жизнедеятельности микроорганизмов (кислот и ферментов) в материалы, что приводит к гидролизу компонентов наполнителей. При этом продукты гидролиза, имеющие низкую молекулярную массу и более высокий коэффициент диффузии, могут уходить из образцов, что, в свою очередь, приведет к снижению веса материалов при кондиционировании в почве (Мас-талыгина 2015).
Кроме того, от степени гидрофильности поверхности материала будет зависеть количество адсорбированных клеток микроорганизмов на поверхности композита (Новый справочник химика и технолога 2002). Поэтому наблюдается сильное (5 баллов) и быстрое (менее 7 дней) биообрастание микромицетами на образцах УП-Урал-Тр-СФ и УТЗФ2УМН.
Выводы
В результате проведенных исследований из нефтезагрязненной почвы были выделены микроскопические грибы Aspergillus niger, Penicillium sp., Paecilomyces sp., являющиеся основными биодеструкторами полимерных композиционных материалов.
В качестве объектов исследования использовали композиционные полимерные материалы - Стеклопластик АГ- 4В по ГОСТ 20437; Стеклопластик ДСВ по ГОСТ 17478; Органопластик ОП-ЖА; Углепластик УП-Урал-Тр-СФ; Углепластик УТЗФ2УМН; Углеволок-нит ЭПАН-2Б, которые имеют широкое применение в авиационной промышленности.
Для оценки биодеградации композиционных материалов образцы были заражены спорами культур плесневых грибов согласно стандартной методике ГОСТ 9.049-91 «Единая система защиты от коррозии и старения (ЕСЗКС). Материалы полимерные и их компоненты. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов».
По окончании инкубационного периода (28 дней) было установлено, что все полимер ные композиционные материалы способны использоваться в качестве источника питания микроскопическими грибами, такими как Aspergillus niger и Penicillium sp., однако данные образцы являются грибостойкими к росту мик-ромицета Paecilomyces sp.
В ходе эксперимента образцы композитов постоянно находились в условиях высокой влажности и повышенной температуры. Высокие показатели водопоглощения материалов УП-Урал-Тр-СФ и УТЗФ2УМН способны повысить биодоступность для микроорганизмов и более интенсивную биодеградацию материалов.
Результаты, представленные в статье, были получены в ходе выполнения государственного задания Министерства образования и науки РФ в рамках мероприятия «Инициативные научные проекты», код заявки 5.9729.2017/8.9.
The results presented in the article were obtained during the execution of the state task of the Ministry! of Education and Science of the Russian Federation within the framework of the «Initiative Scientific Projects» event, application code 5.9729.2017/8.9.
Список литературы Оценка эффективности биодеградации полимерных композиционных материалов
- Абрамова Н. Ф., Шкулова Г. А., Астахова Л. С., Шашалович М. П. 1981. Влияние старения на грибостойкость пластмасс // Материалы 2-й Всесоюзной конференции по биоповреждениям. Горький, 35-37.
- Билай В. И., Элланская И. А., Кириленко Т. С. и др. 1984. Микромицеты почв. Киев: Наук. думка.
- Боровиков В. П. 2001. Statistica: искусство анализа данных на компьютере. СПб.: Питер.
- Замышляева О. Г. 2012. Методы исследования современных полимерных материалов. Нижний Новгород: Нижегородский госуниверситет.
- Карамова Н. С., Надеева Г. В., Багаева Т. В. 2014. Методы исследования и оценки биоповреждений, вызываемых микроорганизмами: Учебно-методическое пособие. Казань: Казанский университет.
- Кряжев Д. В. 2014. Экологические основы диагностики процессов биодеструкции природных и синтетических полимерных материалов в условиях воздействия ряда абиотических факторов внешней среды: Дис. … д-ра биол. наук, Нижний Новород.
- Литвинов М. А. 1967. Определитель микроскопических почвенных грибов: (Порядок Moniliales, за ислючением подсемейства Aspergilleae). Ленинград: Наука.
- Масталыгина Е. Е. 2015. Структура, свойства и биоразлагаемость тройных композиций - полипропилен, полиэтилен низкой плотности и природные наполнители: Дис.. канд. хим. наук. М.
- Нетрусов А. И., Егорова М. А., Захарчук Л. М. 2005. Практикум по микробиологии. М.: Издательский центр «Академия».
- Петров А. В., Дориомедов М. С., Скрипачев С. Ю. 2015. Технологии утилизации полимерных композиционных материалов (обзор) // Труды ВИАМ 8 //
- DOI: 10.18577/2307-6046-2015-0-8-9-9
- Федоров К. Н., Стасюк Н. В., Скворцова И. Н., Часовников В. А., Серебренникова Л. Н. 1980. Влияние тяжелых металлов на свойства почв // Биологические науки. Сер. Почвоведение 7, 96-98.


