Оценка эффективности хирургического метода у больных с EGFR-мутированной аденокарциномой легкого III-IV стадии после терапии ингибиторами тирозинкиназы
Автор: Левченко Е.В., Моисеенко Ф.В., Орлов С.В., Имянитов Е.Н., Михнин А.Е., Гельфонд М.Л., Слугин Е.Н., Ергнян С.М., Левченко Н.Е., Жабина А.С., Улитин А.М., Мамонтов О.Ю., Лопушанская О.О., Артемьева Е.В., Муртазин А.И., Шабинская В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - оценить показатели общей и безрецидивной выживаемости у пациентов с EGFR-мутированной аденокарциномой легкого, у которых выполнено хирургическое вмешательство после развития объективного ответа на прием ингибиторов тирозинкиназы (ИТК). материал и методы. Проанализированы показатели общей и безрецидивной выживаемости 18 больных аденокарциномой легкого с наличием активирующей EGFR-мутации, изначально неоперабельных из-за местнораспространенного опухолевого процесса или наличия отдаленного метастазирования. В соответствии со стандартами оказания специализированной медицинской помощи пациентам был рекомендован прием ИТК. Выполнение хирургических вмешательств оказалось возможным после получения объективного ответа опухоли («stage down») на таргетную терапию. В группу сравнения включено 23 больных аденокарциномой легкого с EGFR-позитивным мутационным статусом, получавших ИТК, но без оперативного вмешательства. Результаты. Выявлено значимое влияние хирургического вмешательства на показатели общей выживаемости (ОВ) у больных EGFR-мутированной аденокарциномой легкого III-IV стадии после приема ИТК (р=0,004). Однако значимого влияния на безрецидивную выживаемость (БРВ) не отмечено (р=0,40). Выявлена тенденция к увеличению медианы ОВ у пациентов исследуемой группы (46 мес) по сравнению с контрольной группой (26 мес). По сравнению со стандартным объемом хирургического вмешательства операции, выполненные у исследуемой группы пациентов, отличались техническими сложностями, связанными с выраженным фиброзом при выделении элементов корня легкого и выполнении лимфодиссекции, но не отличались по длительности и объему кровопотери. Заключение. Хирургические вмешательства у больных с EGFR-мутированной аденокарциномой легкого III-IV стадии технически выполнимы и безопасны, но для их проведения необходимы опытные бригады специалистов и хорошо оснащенные медицинские центры. Статистические данные свидетельствуют о значимом росте показателей выживаемости после операций как компонента комплексного лечения у данной когорты больных, с использованием ИТК, однако данное направление требует дальнейшего изучения.
Рак легкого, аденокарцинома легкого, egfr мутация, egfr tki, хирургическое лечение, осложнения
Короткий адрес: https://sciup.org/140297844
IDR: 140297844 | УДК: 616.24-006.66-089-085 | DOI: 10.21294/1814-4861-2023-22-1-5-14
Текст научной статьи Оценка эффективности хирургического метода у больных с EGFR-мутированной аденокарциномой легкого III-IV стадии после терапии ингибиторами тирозинкиназы
Активное внедрение ИТК в качестве «метода выбора» в лечение EGFR-мутированной аденокарциномы III–IV стадии в повседневную практику позволило достичь у данных пациентов улучшения показателей общей выживаемости по сравнению с больными, которые получали стандартные схемы системной терапии [1]. Отмечен достаточно высокий уровень объективного ответа на применение ИТК в виде «stage down», что в ряде случаев позволило выполнить хирургическое вмешательство. На протяжении 15 лет, с начала активного использования таргетной терапии, на данную тему опубликован ряд работ, которые представляют собой описание клинических случаев успешного хирургического лечения EGFR-мутированной аденокарциномы после значимого ответа на терапию ИТК [2–14].
Одной из причин, побудивших к проведению исследования, явился тот факт, что, согласно данным T. Hishida et al., механизм действия ИТК является цитостатическим, а не цитотоксическим. С учетом этого EGFR-ингибиторы не могут уничтожать микрофокусы опухолевых клеток даже после выраженного клинического ответа. Для достижения полного ответа необходимо включение в схему терапии локальных методов лечения, таких как лучевая терапия или хирургическое вмешательство [3]. Данное утверждение подтверждается исследованиями, в которых доказано, что проведение радиотерапии и хирургического вмешательства сопровождается значительным увеличением без-рецидивной выживаемости [15, 16].
Цель исследования ‒ оценка показателей общей и безрецидивной выживаемости у пациентов с EGFR-мутированной аденокарциномой легкого, у которых выполнено хирургическое вмешательство после развития объективного ответа на прием ингибиторов тирозинкиназы (ИТК).
Материал и методы
В исследование включены данные о 41 больном с EGFR-мутированной аденокарциномой легкого III–IV стадии, которым с 2005 по 2020 г. проводилось комплексное лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ, ГБУЗ «Санкт-Петербургский клинический научнопрактический центр специализированных видов медицинской помощи (онкологический)» и в Первом Санкт-Петербургском государственном медицинском университете им. акад. И.П. Павлова. На фоне выраженного регресса после приема ИТК у 18 пациентов осуществлено хирургическое лечение. В контрольную группу включено 23 больных, лечение у которых ограничилось только приемом ИТК (таблица). Группа сравнения по основным клиническим критериям была сопоставима.
С целью оценки возможной прогностической значимости для частоты получения объективного ответа (ОО) после приема ИТК все больные, включенные в данное исследование, были разделены на группы сравнения в зависимости от количества метастатически пораженных анатомических зон. Под ОО понимали стабилизацию, частичный и полный регресс опухолевого процесса. Достижение одного из перечисленных клинических эффектов в ответ на прием ИТК, в сочетании с соответствием опухолевого процесса, по данным КТ органов грудной и брюшной полостей с внутривенным контрастированием, критериям операбельности, являлось показанием к хирургическому вмешательству. Объемы хирургических вмешательств у больных исследуемой группы представлены на рис. 1. Двум больным стандартные объемы вмешательств были дополнены бронхопластическими резекциями, еще в 2 случаях проведена гипертермическая химиоперфузия плевральной полости с препаратом цисплатин. С целью оценки возможных особенностей хирургических вмешательств у пациентов исследуемой группы была отобрана группа из 15 больных с EGFR-мутированной аденокарциномой III стадии, которым была выполнена радикальная операция, но без приема ИТК в неоадъювантном режиме. Особенности хирургических вмешательств у больных исследуемой группы оценивались по
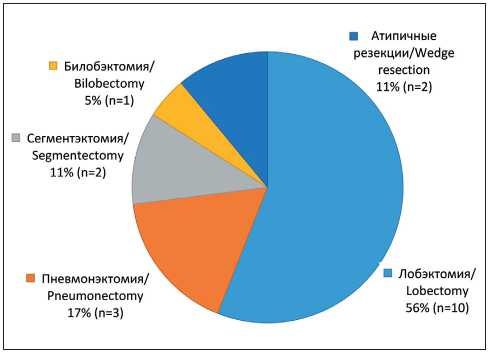
Рис 1. Виды хирургических вмешательств, выполненных пациентам исследуемой группы
Fig. 1. Types of surgeries performed in patients of the study group
Òàблицà /Table
Õàðàêтåðиñтиêà пàциåнтîв
Patient characteristics
Статистическая обработка данных выполнена с использованием пакета Microsoft Office 2019, в частности Microsoft Office Excel и стандартного пакета «Statistical Package for the Social Sciences software program (version 23.0; «SPSS Inc.», Чикаго, США)». Статистическая обработка данных с оценкой общей и безрецидивной выживаемости, определением медианы выживаемости осуществлялась по методу Каплана‒Майера, с формированием таблиц дожития, расчетом средних значений и медианы для времени выживаемости. Для сравнения кривых выживаемости применялся логранговый критерий. Различия статистических показателей считались значимыми при р≤0,05. Для сравнения показателей длительности хирургического вмешательства и объема кровопотери использовался критерий Манна–Уитни, а для сравнения частоты осложнений – точный метод Фишера, учитывая небольшое количество наблюдений.
Результаты
Для оценки особенностей оперативных вмешательств проанализированы продолжительность хирургического вмешательства и объем интраоперационной кровопотери у 15 больных с EGFR-мутированной аденокарциномой легкого III стадии без неоадъювантной таргетной терапии ИТК (БНТ) при соответствующих объемах оперативных вмешательств.
Уровень послеоперационных осложнений является важным показателем качества и безопасности хирургического вмешательства. В большинстве клиник, в которых выполняются схожие объемы операций, данный показатель составляет 15–25 % [17]. По нашим данным, частота послеоперационных осложнений в исследуемой группе составила 33 %, в группе без неоадъювантной таргетной терапии – 20 % (р=0,219). В исследуемой группе осложнения I, II, IIIa, IIIb степени (Clavien–Dindo) наблюдались в 3 (50 %), 1 (17 %), 1 (17 %) и 1 (17 %) случае соответственно. Осложнений IVa и IVb степеней в исследуемой группе не было (рис. 2). В группе БНТ осложнения были представлены только IIIa – 1 (33 %) и IVa степенью – 2 (66 %) случая. С помощью точного метода Фишера выявлено, что
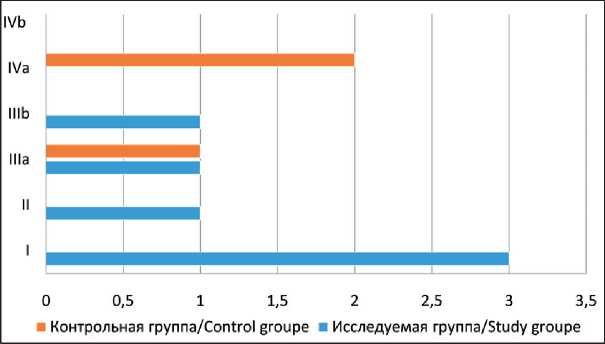
Рис 2. Распределение больных по группам осложнений (Clavien–Dindo)
Fig. 2. Distribution of patients by groups of complications (Clavien–Dindo)
распределение осложнений в группах статистически не значимо (р>0,05). Средние значения общей кровопотери и длительности операции у больных исследуемой группы составили 447 ± 147,5 мл и 232 ± 27 мин; у больных БНТ – 425 ± 158,1 мл и 193 ± 22,7 мин соответственно. При сравнении данных показателей с использованием критерия Манна–Уитни значимых различий между группами не выявлено (p>0,05).
Исходя из того, что значимых различий в таких показателях, как частота осложнений, средняя длительность операции и средний объем кровопотери, между исследуемой группой и группой БНТ не выявлено , можно сделать вывод, что потенциальная сложность оперативного вмешательства у больных с EGFR-мутированной аденокарциномой после терапии ИТК не превышает схожего уровня у больных, которым не проводилась таргетная терапия. Несмотря на этот факт, отмечено наличие выраженного фиброза жировой клетчатки и лимфатических узлов медиастинальной зоны во время операции у пациентов c EGFR-мутированной аденокарциномой после терапии ИТК (рис. 3).
Проанализированы отдаленные результаты у всех 41 больного. Учитывая распространенность опухолевого процесса, оценивалась 1- и 2-летняя выживаемость. Медиана времени наблюдения составила 33 мес. При статистическом анализе общей выживаемости методом Каплана–Майера с использованием логрангового критерия всей популяции пациентов, включенных в исследование, на всем протяжении наблюдения отмечены значимые различия в показателях ОВ между больными в сравниваемых группах (р=0,004). Так, 1- и 2-летняя выживаемость в исследуемой группе составила 94 и 85 %, в контрольной группе – 59 и 41 % (рис. 4). Медиана ОВ у больных, перенесших хирургическое вмешательство, составила 46,0 мес (95 % ДИ: 31,6–60,4), у пациентов, которым не проводилась операция, – 26,0 мес (95 % ДИ: 14,8–37,2). Медиана времени до прогрессирования в исследуемой группе составила 13,0 мес (95 % ДИ: 2,7–23,3), в контрольной – 14,0 мес (95 % ДИ: 9,6–18,4). При анализе показателей безрецидивной выживаемости значимого различия между группами не выявлено (р=0,400).
Учитывая, что подходы к тактике лечения данных пациентов и показатели выживаемости отличаются в зависимости от стадии заболевания, все больные были разделены на 2 подгруппы – III и IV стадии. При статистическом анализе методом Каплана–Майера в подгруппе больных с III стадией полученный уровень значимости различий (р=0,300) свидетельствует об отсутствии значимых различий в показателях выживаемости между исследуемой и контрольной группами. Медиана ОВ в данной подгруппе у больных, которым проводилось хирургическое лечение, составила 60,0 мес (95 % ДИ: 12,7–107,2), в группе сравнения – 40,0 мес (95 % ДИ: 24,3–55,7). Различие данных показателей указывает на наличие тенденции к увеличению ОВ в подгруппе больных с III стадией. При анализе
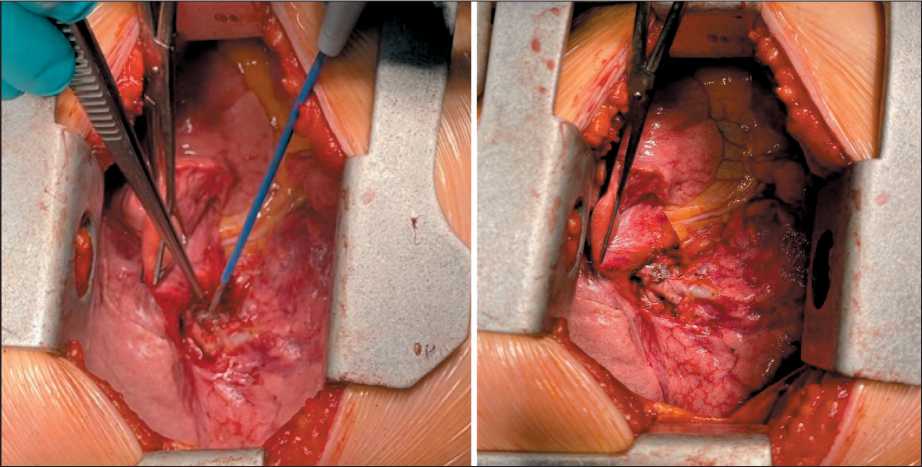
Рис 3. Пример формирования массивного фиброзирования внутригрудных лимфатических узлов у больных, которым проводилась ТТ до хирургического вмешательства (фото до и после выполнения лимфодиссекции)
Fig. 3. An example of the formation of massive fibrosis of the intrathoracic lymph nodes in patients who underwent targeted therapy before surgery (photo before and after lymphadenectomy)
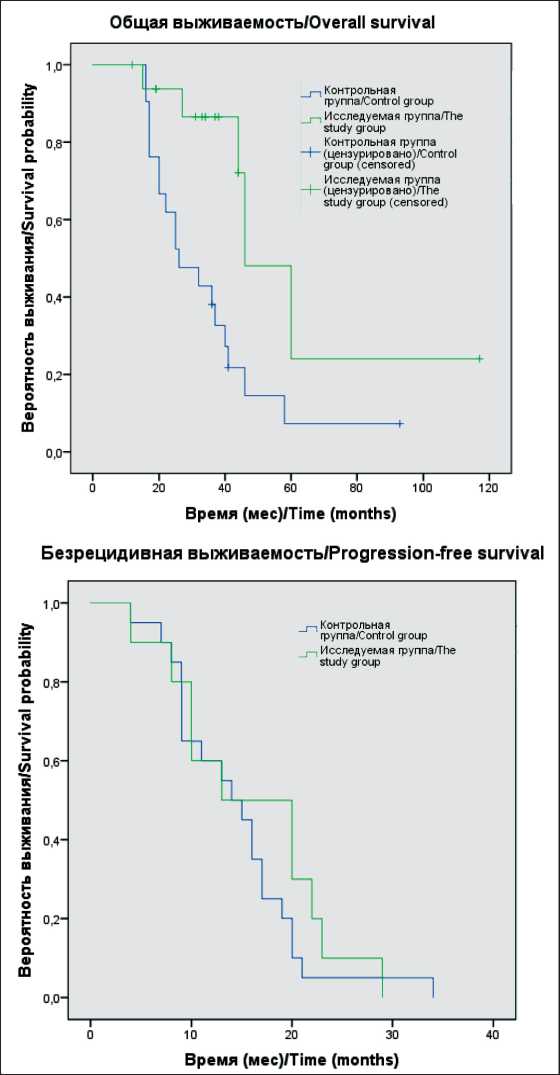
Рис 4. Сравнение общей и безрецидивной выживаемости больных с EGFR-мутированной аденокарциномой исследуемой и контрольной групп
Fig. 4. Comparison of overall and disease-free survival of patients with EGFR-mutated adenocarcinoma of the study and control groups
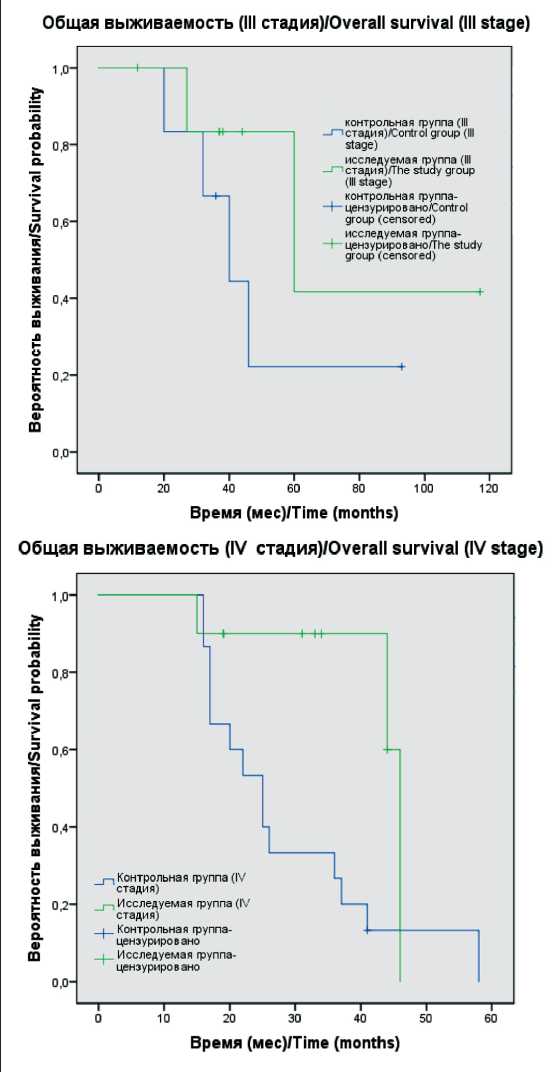
Рис. 5. Общая выживаемость больных с EGFR-мутированной аденокарциномой с наличием и без хирургического вмешательства после таргетной терапии (ІІІ и IV стадии)
Fig. 5. Overall survival of patients with EGFR-mutated adenocarcinoma with and without surgery after targeted therapy (stages III and IV)
подгруппы с IV стадией уровень статистической значимости составил р=0,018, при котором можно утверждать о наличии значимых различий в общей выживаемости у больных, которым была выполнена операция после приема ИТК, по сравнению с неопе-рированными пациентами (рис. 5). При анализе безрецидивной выживаемости в обеих подгруппах (III и IV стадии) не выявлено значимых различий во времени до прогрессирования (р=0,335).
Обсуждение
Хирургический метод у больных с местнораспространенной или метастатической EGFR-мутированной аденокарциномой легкого не является основой лечебной тактики. С учетом наличия «активирующей» мутации в гене EGFR обязательным является использование терапии ИТК, применение которых сопровождается улучшением общей выживаемости [18, 19]. Несмотря на успехи лекарственной терапии, в большинстве случаев применение только системной терапии не позволяет добиться полного контроля над заболеванием. Опубликованные клинические наблюдения указывают на потенциальную перспективность хирургических вмешательств у больных с EGFR-мутированной аденокарциномой легкого, у которых при таргетной терапии отмечен выраженный объективный ответ («stage down»).
В представленном исследовании отмечено значимое положительное влияние на показатели общей выживаемости у всей когорты больных с хирургическими вмешательствами. Однако при сравнении показателей ОВ исследуемой и контрольной групп больных с III стадией заболевания значимость данного подхода не нашла подтверждения. Вероятной причиной такого результата могут быть небольшое число пациентов в исследуемой (n=5) и контрольной (n=8) группах и ограниченное время наблюдения, не превышавшее в большинстве случаев 3-летний период.
Список литературы Оценка эффективности хирургического метода у больных с EGFR-мутированной аденокарциномой легкого III-IV стадии после терапии ингибиторами тирозинкиназы
- Preusser M., de Ribaupierre S., Wöhrer A., Erridge S.C., Hegi M., Weller M., Stupp R. Current concepts and management of glioblastoma. Ann Neurol. 2011; 70(1): 9-21. https://doi.org/10.1002/ana.22425.
- Konovalov A.N., Potapov A.A., Loshakov V.A., Olyushin V.E., Ulitin A.Yu., Kornienko V.N., Pronin I.N., Shishkina L.V., Golanov A.V., Tanyashin S.V., Urakov S.V., Kobyakov G.L. Standarty, rekomendatsii i optsii v lechenii glial'nykh opukholei golovnogo mozga u vzroslykh. Voprosy neirokhirurgii im. N.N. Burdenko. 2006; 2: 3-11.
- Karsy M., Arslan E., Moy F. Current Progress on Understanding MicroRNAs in Glioblastoma Multiforme. Genes Cancer. 2012; 3(1): 3-15. https://doi.org/10.1177/1947601912448068.
- Kuznetsov V.A., Tang Z., Ivshina A.V. Identification of common oncogenic and early developmental pathways in the ovarian carcinomas controlling by distinct prognostically significant microRNA subsets. BMC Genomics. 2017; 18(Suppl 6): 692. https://doi.org/10.1186/s12864-017-4027-5.
- Barciszewska A.M. MicroRNAs as efficient biomarkers in highgrade gliomas. Folia Neuropathol. 2016; 54(4): 369-74. https://doi.org/10.5114/fn.2016.64812.
- Visani M., de Biase D., Marucci G., Cerasoli S., Nigrisoli E., Bacchi Reggiani M.L., Albani F., Baruzzi A., Pession A.; PERNO study group. Expression of 19 microRNAs in glioblastoma and comparison with other brain neoplasia of grades I-III. Mol Oncol. 2014; 8(2): 417-30. https://doi.org/10.1016/j.molonc.2013.12.010. Erratum in: Mol Oncol. 2015; 9(1): 334. Erratum in: Mol Oncol. 2015; 9(1): 334.
- Zhang K., Zhou X., Han L., Chen L., Chen L., Shi1 Z., Yang M., Ren Y., Yang J., Frank T. S., Zhang C., Zhang J., Pu P., Zhang J., Jiang T., Wagner E. J., Li M., Kang C. MicroRNA-566 activates EGFR signaling and its inhibition sensitizes glioblastoma cells to nimotuzumab. Mol Cancer. 2014; 13: 63. https://doi.org/10.1186/1476-4598-13-6.
- Xu L.F., Wu Z.P., Chen Y., Zhu Q.S., Hamidi S., Navab R. MicroRNA21 (miR-21) regulates cellular proliferation, invasion, migration, and apoptosis by targeting PTEN, RECK and Bcl-2 in lung squamous carcinoma, Gejiu City, China. PLoS One. 2014; 9(8). https://doi.org/10.1371/journal.pone.0103698.
- Zhou X., Ren Y., Moore L., Mei M., You Y., Xu P., Wang B., Wang G., Jia Z., Pu P., Zhang W., Kang C. Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status. Lab Invest. 2010; 90(2): 144-55. https://doi.org/10.1038/labinvest.2009.126.
- Adlakha Y.K., Saini N. MicroRNA-128 downregulates Bax and induces apoptosis in human embryonic kidney cells. Cell Mol Life Sci. 2011; 68(8): 1415-28. https://doi.org/10.1007/s00018-010-0528-y.
- Cui J.G., Zhao Y., Sethi P., Li Y.Y., Mahta A., Culicchia F., Lukiw W.J. Micro-RNA-128 (miRNA-128) down-regulation in glioblastoma targets ARP5 (ANGPTL6), Bmi-1 and E2F-3a, key regulators of brain cell proliferation. J Neurooncol. 2010; 98(3): 297-304. https://doi.org/10.1007/s11060-009-0077-0.
- Sun G., Shi L., Yan S., Wan Z., Jiang N., Fu L., Li M., Guo J. MiR15b targets cyclin D1 to regulate proliferation and apoptosis in glioma cells. Biomed Res Int. 2014; https://doi.org/10.1155/2014/687826.
- Chen L.P., Zhang N.N., Ren X.Q., He J., Li Y. miR-103/miR-195/ miR-15b Regulate SALL4 and Inhibit Proliferation and Migration in Glioma. Molecules. 2018; 23(11): 2938. https://doi.org/10.3390/molecules23112938.
- Yang T., Lu X., Wu T., Ding D., Zhao Z., Chen G., Xie X., Li B., Wei Y., Guo L., Zhang Y., Huang Y., Zhou Y., Du Z. MicroRNA-16 inhibits glioma cell growth and invasion through suppression of BCL2 and the nuclear factor-jB1⁄MMP9 signaling pathway. Cancer Sci. 2014; 105(3): 265-71. https://doi.org/10.1111/cas.12351.
- Lai N.S., Wu D.G., Fang X.G., Lin Y.C., Chen S.S., Li Z.B., Xu S.S. Serum microRNA-210 as a potential noninvasive biomarker for the diagnosis and prognosis of glioma. Br J Cancer. 2015; 112(7): 1241-6. https://doi.org/10.1038/bjc.2015.91.
- Wang Z., Yin B., Wang B., Ma Z., Liu W., Lv G. MicroRNA-210 promotes proliferation and invasion of peripheral nerve sheath tumor cells targeting EFNA3. Oncol Res. 2013; 21(3): 145-54. https://doi.org/10.3727/096504013X13841340689573.
- Liu B., Peng X.C., Zheng X.L., Wang J., Qin Y.W. MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo. Lung Cancer. 2009; 66(2): 169-75. https://doi.org/10.1016/j.lungcan.2009.01.010.
- Yamakuchi M., Ferlito M., Lowenstein C.J. miR-34a repression of SIRT1 regulates apoptosis. Proc Natl Acad Sci U S A. 2008; 105(36): 13421-6. https://doi.org/10.1073/pnas.0801613105.
- Lu X., Wang H., Su Z., Cai L., Li W. MicroRNA-342 inhibits the progression of glioma by directly targeting PAK4. Oncol Rep. 2017; 38(2): 1240-50. https://doi.org/10.3892/or.2017.5783.
- Peng Y., Croce C.M. The role of MicroRNAs in human cancer. Signal Transduct Target Ther. 2016; 1. https://doi.org/10.1038/sigtrans.2015.4.
- Seliverstov R. Yu., Zaraiskii M.I., Kataeva G.V., Gurchin A.F. Sposob prognozirovaniya evolyutsii tserebral'nykh gliom. Patent RF № 2740194, byulleten' № 2. Opubl. 12.01.2021.
- Matsko D.E., Matsko M.V., Imyanitov E.N. Klassifikatsiya opukholei tsentral'noi nervnoi sistemy VOZ (2016). Prakticheskaya onkologiya. 2017; 18(1): 103-11.
- Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., FigarellaBranger D., Hawkins C., Ng H.K., Pfister S.M., Reifenberger G., Soffietti R., von Deimling A., Ellison D.W. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021; 23(8): 1231-51. https://doi.org/10.1093/neuonc/noab106.
- Seliverstov R.Yu., Zaraiskii M.I., Tyurin R.V., Naryshkin A.G., Valerko V.G., Semiglazov V.V., Takahachi C. MikroRNK v monitoringe evolyutsii glial'nykh tserebral'nykh opukholei. Sibirskii onkologicheskii zhurnal. 2020; 19(3): 47-53. https://doi.org/10,21294/1814-4861-2020-19-3-47-53.
- Rao X., Huang X., Zhou Z., Lin X. An improvement of the 2ˆ(-delta delta CT) method for quantitative real-time polymerase chain reaction data analysis. Biostat Bioinforma Biomath. 2013; 3(3): 71-85.
- Byuyul' A., Tsefel' P. SPSS: iskusstvo obrabotki informatsii, Analiz statisticheskikh dannykh i vosstanovlenie skrytykh zakonomernostei. M., 2005. 608 s.


