Оценка эффективности комбинированного действия ионизирующего излучения разного качества и доксорубицина на клетки линии HeLa
Автор: Мельникова А.А., Балдов Д.А., Соколова А.Д., Шкавров С.В., Комарова Л.Н.
Рубрика: Научные статьи
Статья в выпуске: 1 т.34, 2025 года.
Бесплатный доступ
В настоящее время перед экспериментальной и медицинской радиологией стоит необходимость решения острой задачи - поиск новых перспективных методов лечения опухолевых заболеваний. В связи с этим представляется актуальным как с точки зрения практического применения в медицине, так и с точки зрения фундаментальных знаний провести исследование по поиску новых комбинаций действия ионизирующего излучения с разными ЛПЭ с противоопухолевыми препаратами ДНК-направленного действия на опухолевые клетки человека. Цель работы - оценка эффектов комбинированного действия ионов 12С и гамма-излучения совместно с доксорубицином по способности клеток линии Hela образовывать колонии. Клетки облучали ионами 12С на синхротроне У-70 в дозах 1, 2, 4 Гр в водном фантоме со средней энергией 450 МэВ/нуклон. Средняя ЛПЭ излучения на начальном участке составила 11 кэВ/мкм, в пике - 120-140 кэВ/мкм. Так же облучение произвели на установке гамма-излучения «ГУР-120» (источник излучения 60Со, Еср=1,25 МэВ). Мощность дозы - 0,9 Гр/мин, дозы облучения - 1, 2, 4, 6 Гр. В качестве химического агента выбран противоопухолевый антибиотик антрациклинового ряда доксорубицин в концентрации 0,004 мг/мл. На основе данных кривых выживаемости рассчитан коэффициент взаимодействия. При комбинированном действии гамма-излучения в исследуемом диапазоне доз с доксорубицином наблюдается антагонистический эффект (k=0,44±0,07). Синергический характер взаимодействия отмечался при действии ионов 12С (k=1,40±0,04). Полученные результаты комбинированного действия применяемых агентов могут иметь важное практическое и теоретическое значение для понимания механизма сочетанного воздействия ионизирующего излучения разного качества и химиопрепарата доксорубицина.
Радиобиология, ионы 12с, доксорубицин, гамма-излучение, клетки рака шейки матки, синергизм, антагонизм, клоногенность, лучевая терапия
Короткий адрес: https://sciup.org/170209547
IDR: 170209547 | УДК: 618.146-006.6-085.849.1-059 | DOI: 10.21870/0131-3878-2025-34-1-128-136
Текст научной статьи Оценка эффективности комбинированного действия ионизирующего излучения разного качества и доксорубицина на клетки линии HeLa
Использование ионизирующего излучения для лечения опухолей имеет долгую историю с момента первого лечения рака с помощью рентгеновских лучей в начале XX века до настоящего времени [1]. В некоторых случаях лучевая терапия с использованием фотонов и электронов может быть неэффективной вследствие того, что излучение не может быть подведено к очагу достаточно локально [1]. По этой причине возникает стремление к максимальной прецизионности с одновременным подходом к сокращению курсов высокодозного облучения [2]. Терапия тяжёлыми заряженными частицами (ТЗЧ) является передовой технологией для высокоточного распределения дозы. Глубинное распределение поглощённой дозы носит название кривой Брэгга и происходит следующим образом: вначале доза медленно возрастает с глубиной, затем следует резкий дозный максимум («пик Брэгга»), вследствие чего поглощённая доза падает до нуля, что позволяет применять более высокие дозы облучения к опухоли, минимизируя повреждение окружающих радиочувствительных тканей [2].
Мельникова А.А.* – аспирант, науч. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Балдов Д.А. – магистр; Соколова А.Д. – магистр 1-го курса; Шкавров С.В. – доцент., к.х.н.; Комарова Л.Н. – проф., д.б.н. ИАТЭ НИЯУ МИФИ.
Одним из распространённых, а иногда даже единственным, методом лечения злокачественных новообразований различного генеза является химиотерапия. В настоящее время известно более десятка лекарственных химиопрепаратов, применяемых для лечения опухолей. Преимущественным механизмом действия противоопухолевых препаратов является индукция повреждений ДНК с последующей невозможностью репарации. Так, в данной работе использовали антибиотик антрациклинового ряда доксорубицин, оказывающий антимитотическое и анти-пролиферативное действие [3].
В последние десятилетия наблюдается тенденция на поиск оптимальных параметров использования комбинированных способов лечения для онкологических заболеваний с целью достижения максимального синергического взаимодействия [4, 5]. Данный подход, в первую очередь, направлен на уменьшение токсического действия на нормальные клетки путём синергического эффекта от двух факторов (например, ионизирующего излучения и химиопрепарата) [5].
Целью исследования была оценка эффектов комбинированного действия ионов 12С и гамма-излучения совместно с доксорубицином по данным колониеобразования клеток линии Hela.
Материалы и методы
Культивирование клеток. В работе использовали клеточную линию эпителиоидного рака шейки матки человека HeLa (предоставлена банком клеток ФГБУ «НМИЦ онкологии»). Выбор данной клеточной культуры обусловлен рядом причин. Во-первых, клеточная линия HeLa является классическим модельным объектом, используемым в различных биомедицинских исследованиях, в том числе для разработки новых препаратов противоопухолевого действия. Во-вторых, клетки линии HeLa обладают гипертиплоидным кариотипом и имеют несколько видов мутаций, что делает их малочувствительными для действия фотонного излучения.
Клетки линии HeLa культивировали в пластиковых культуральных флаконах (Corning, США) в виде монослоя в полной питательной среде DMEM (ПанЭко, Россия), содержащей 10% фетальной сыворотки крупного рогатого скота (Gibсo, USA), пенициллин (50000 ед./л), стрептомицин (50 мг/л) и глютамин (292 мг/л), «ПанЭко», Россия. Поддерживали жизнеспособность культур в СО 2 -инкубаторе (СB 53 Binder, Германия), при 5% содержании СО 2 . Перед началом эксперимента флаконы с монослоем трипсинизировали и готовили суспензии клеток в конечной концентрации ~ 5 x 10 4 кл/мл (для избегания гипоксических условий) [6] с последующим облучением в пробирках типа Эппендорф объёмом 1,5 мл.
В рамках работы сформированы четыре группы исследования. На клетки первой группы действовало только ионизирующее излучение (гамма-кванты или ионы 12С), на клетки второй группы – ионизирующее излучение и доксорубицин, клетки из третьей группы инкубировали с препаратом без действия ионизирующего излучения. Контролем служили клетки (четвёртая группа) без воздействия агентов. После процедуры облучения и на протяжении доставки в лабораторию клетки выдерживали при температуре тающего льда. Комбинированное действие проводили по следующей схеме: в суспензию клеток вносили раствор доксорубицина в концентрации 0,004 мг/мл (средняя терапевтическая доза в переводе на клетки), который до облучения действовал на клетки в течение 24 ч [7-9].
Облучение и дозиметрия. Облучение ионами 12С проходило в пике Брэгга на каскаде ускорителей на базе У-70 Института физики высоких энергий (ИФВЭ) ФГБУ ГНЦ РФ «Курчатовский институт» (г. Протвино). Дозы облучения составили 1, 2, 4 Гр в водном фантоме со средней энергией 450 МэВ/нуклон. Средняя ЛПЭ излучения в пике – 120-140 кэВ/мкм.
Гамма-облучение (источник ионизирующего излучения 60Со) проводили на уникальной научной установке ГУР-120 в НИЦ «Курчатовский институт» - ВНИИРАЭ в дозах 1, 2, 4 и 6 Гр в пробирках типа Эппендорф на расстоянии от облучателя - 73 см, с мощностью дозы - 0,9 Гр/мин. Средняя ЛПЭ излучения - 0,2 кэВ/мкм. Учитывая физические преимущества ТЗЧ и высокую биологическую эффективность излучения, суспензия клеток дополнительно подвергалась гамма-облучению в дозе 6 Гр.
Выживаемость клеток определяли по тесту колониеобразования. Для этого клетки инкубировали на питательной среде в течение 7-14 дней до формирования колоний (в диаметре не менее 0,75 мм). После питательную среду удаляли, затем колонии фиксировали этиловым спиртом (95%). Окрашивание колоний было осуществлено 2% раствором метиленового синего в 50% этаноле [10].
Количественная оценка комбинированного воздействия. Концепция синергизма описывает выживаемость клеточных культур, генетические и канцерогенные эффекты совместного действия ионизирующего излучения и повреждающих факторов. Для количественной оценки взаимодействия агентов используют коэффициент теплового усиления, определяемый для изоэф-фективного уровня как отношение продолжительности облучения после действия одного ионизирующего излучения к продолжительности одновременного действия обоих агентов. Однако вместо продолжительностей воздействия можно применять соответствующие дозы [11-13].
Для оценки синергического эффекта мы использовали коэффициент синергического усиления к , определяемый как отношение продолжительностей воздействия t 2 /t i или изоэффектив-ных доз D 2 /D 1 на теоретической кривой выживаемости, ожидаемой при независимом сложении эффектов от обоих агентов и экспериментальной кривой выживаемости, полученной после одновременного комбинированного воздействия [11, 14]:
к = ^ = ^ t i ° i
Этот коэффициент показывает во сколько раз эффект усилился по сравнению с аддитивным сложением от каждого агента. Так как в работе были получены результаты как синергического проявления комбинированного действия, так и антагонистического характера, было принято решение называть рассчитанный коэффициент - коэффициент взаимодействия.
Статистическая обработка. Для проведения статистического анализа результатов каждого эксперимента использовали данные трёх повторностей. Статистическую обработку результатов и определение параметров кривых доза-эффект осуществляли с помощью стандартных методов, реализованных в программных средствах Miсrosoft Exсel с помощью непараметрического рангового критерия Манна-Уитни для уровня значимости а =5%. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение
На рис. 1 приведены экспериментально полученные кривые выживаемости клеток HeLa после комбинированного действия гамма-излучения и доксорубицина.
Из рисунка видно, что теоретически ожидаемая кривая выживаемости при условии независимого сложения эффектов (кривая 2) лежит ниже экспериментально полученной кривой выживаемости клеток линии HeLa (кривая 3) после комбинированного действия исследуемых агентов в дозах до 6 Гр. Это может свидетельствовать о проявлении антагонистического характера взаимодействия гамма-излучения и доксорубицина. Нами по формуле 1 был рассчитан коэффициент взаимодействия для уровня выживаемости 10%, т.к. при такой выживаемости наблюдается прямолинейный участок кривой. Коэффициент взаимодействия оказался равен 0,44±0,07. Это означает, что при комбинированном действии гамма-излучения в исследуемом диапазоне доз (0,5-5,5 Гр) с доксорубицином (С=0,004 мг/мл) проявляется антагонистический эффект. Наблюдаемый антагонизм при низких дозах может быть объяснён как конкурентным ингибированием репарации ДНК, так и различиями в кинетике действия обоих агентов. Во-первых, разнообразие индуцированных гамма-излучением и доксорубицином повреждений ДНК (например, двойные разрывы, аддукты с ДНК) может приводить к конкурентному использованию клеточных механизмов репарации. При низких дозах эффективная репарация повреждений, вызванных одним агентом, может предотвращать кумулятивный эффект от второго агента. Во-вторых, различия в кинетических профилях - быстрое действие ионизирующего излучения в сравнении с более медленным проникновением и взаимодействием доксорубицина с ДНК - приводят к временной асинхронности в повреждении ДНК и, как следствие, к снижению суммарного цитотоксического эффекта. При этом повышение дозовой нагрузки на клетки рака шейки матки до 6 Гр приводит к синергическому взаимодействию двух факторов (k=1,01±0,08). Наблюдаемый синергизм при высоких дозах (≥6 Гр, k=1,01±0,08) может быть обусловлен результатом действия трёх факторов: индуцированного высокими дозами насыщения механизмов репарации ДНК, кумулятивного эффекта ДНК повреждений (взаимоусиление чувствительности к повреждениям различной этиологии), и полиморфной индукцией программ клеточной гибели (апоптоз и/или некроз). Наблюдаемый переход от антагонизма к синергизму указывает на то, что оптимальная эффективность комбинированной терапии, включающей гамма-излучение и доксорубицин, может быть достигнута только при определённом соотношении доз.
Доза, Гр
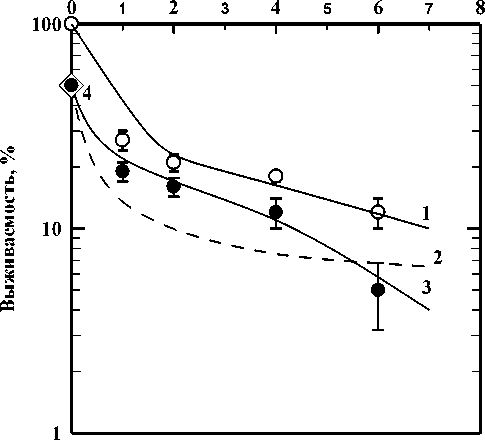
Рис. 1. Кривые выживаемости клеток линии HeLa после комбинированного действия гамма-излучения и доксорубицина.
Кривая 1 - действие гамма-излучения; кривая 2 - теоретически ожидаемая кривая при независимом сложении гамма-излучения и доксорубицина; кривая 3 - экспериментально полученная кривая выживаемости при комбинированном действии этих агентов; 4 - действие только доксорубицина.
На рис. 2 приведены экспериментально полученные кривые выживаемости после комбинированного действия доксорубицина и ионов 12С на клетки линии HeLa.
Доза, Гр
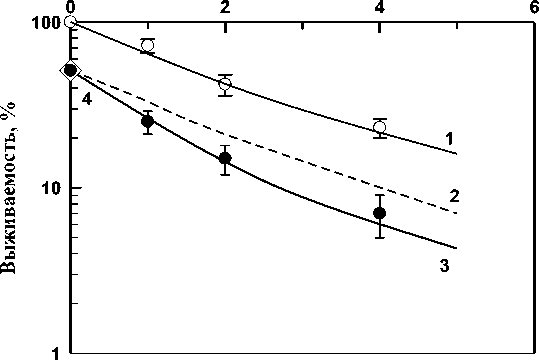
Рис. 2. Кривые выживаемости клеток линии HeLa после комбинированного действия ионами 12С и доксорубицина.
Кривая 1 – действие ионов 12С; кривая 2 – теоретически ожидаемая кривая при независимом сложении ионного излучения и доксорубицина; кривая 3 – экспериментально полученная кривая выживаемости при комбинированном действии этих агентов; 4 – действие только доксорубицина.
Из рис. 2 видно, что теоретически ожидаемая кривая выживаемости при условии независимого сложения эффектов (кривая 2) лежит выше кривой выживаемости клеток линии HeLa (кривая 3) после комбинированного действия исследуемых агентов. Это свидетельствует о синергическом характере взаимодействия излучения ионов 12С и доксорубицина. По формуле 1 был рассчитан коэффициент синергического усиления (КСУ), который оказался равен 1,40 ± 0,04. Экспериментальные данные по выживаемости клеток HeLa после комбинированного воздействия доксорубицина и ионов 12C демонстрируют выраженный синергизм. Тот факт, что экспериментальная кривая выживаемости (кривая 3) расположена ниже теоретической кривой, рассчитанной на основе аддитивного действия (кривая 2), однозначно указывает на синергическое взаимодействие этих двух агентов. Значение КСУ 1,40 ± 0,04 количественно подтверждает существенное усиление цитотоксического эффекта. Это, вероятно, обусловлено сочетанием разнообразных типов повреждения ДНК, ингибированием репарации и усилением апоптоза. Доксорубицин, ингибируя топоизомеразу II, вызывает преимущественно одно- и двунитевые разрывы ДНК и формирование ДНК-аддуктов. Ионы 12C индуцируют высокоплотные кластерные повреждения ДНК, характеризующиеся массивным повреждением на ограниченном участке и, как следствие, сниженной эффективностью репарации.
В предыдущих исследованиях были представлены данные эффективности излучения по кривым выживаемости клеточной линии гепатокарциномы HUH-7 [15]. Количественная оценка синергизма комбинированного действия плотноионизирующего излучения (средняя ЛПЭ в пике 120-140 кэВ/мкм; дозы облучения в пике Брэгга: 1, 2, и 4 Гр) и доксорубицина продемонстрировала дозозависимое увеличение КСУ.
Постепенно на смену дистанционной гамма-терапии приходят новые, имеющие свои преимущества, подходы в облучении злокачественных опухолей, например, адронная терапия тяжёлыми ионами [16]. Ранее нами было установлено синергическое взаимодействие ионов ¹²С и доксорубицина [17].
Заключение
Выявление закономерностей синергического взаимодействия ионизирующего излучения разного качества и химиопрепаратов остаётся актуальной темой в клинической практике. Настоящее исследование посвящено изучению влияния комбинированного воздействия ионизирующего излучения различного качества (12С и гамма-излучения) и доксорубицина на пролиферативный потенциал клеток HeLa, используемых в качестве in vitro модели рака шейки матки. В ходе проведённой работы были получены экспериментальные данные комбинированного действия ионизирующего излучения с разным ЛПЭ (0,2 кэВ/мкм для гамма-излучения и 120-140 кэВ/мкм для адронного излучения) с противоопухолевым препаратом ДНК-направленного действия – доксорубицином на клетках рака шейки матки линии HeLa in vitro . В рамках экспериментальной работы показано, что при комбинации химиопрепарата с редкоионизирующим излучением наблюдается антагонистический эффект, тогда как при комбинированном применении того же химиопрепарата, но с тяжёлыми ионами наблюдался синергический эффект. Дальнейшие исследования должны быть направлены на более глубокое изучение молекулярных механизмов наблюдаемого синергизма и оптимизацию соотношения доз для достижения максимального терапевтического эффекта при минимальной токсичности.


