Оценка эффективности препаратов моноклональных антител против рецептора эпидермального фактора роста на модели подкожных ксенографтов на иммунодефицитных мышах
Автор: Устюгов Я.Ю., Александров А.А., Артюхова М.В., Варавко М.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (70), 2015 года.
Бесплатный доступ
В данной статье представлены результаты сравнительного исследования противоопухолевой активности двух препаратов на основе терапевтических гуманизированных моноклональных антител против рецептора эпидермального фактора роста (EGFR) производства российской биофармацевтической компании ЗАО «Биокад» и коммерческого препарата «Эрбитукс®» (Merck, Германия) на модели подкожных ксенографтов с использованием клеточной линии эпидермоидной карциномы человека A431NS. Гиперэкспрессия EGFR на клетках опухолей эпителиального происхождения является известным фактом, что обусловливает выбор данного рецептора в качестве мишени для препаратов терапевтических моноклональных антител. Основным механизмом действия данных препаратов является блокирование пролиферации эпителиальных клеток вследствие связывания с EGFR. В рамках экспериментов in vivo была проведена оценка динамики роста опухоли у иммунодефицитных мышей Nu/Nu по двум показателям: индексу прироста опухоли и торможению роста опухоли (ТРО, %). Полученные при использованной схеме эксперимента результаты свидетельствуют о том, что исследуемые препараты производства ЗАО «Биокад» и коммерческий препарат «Эрбитукс®» обладают сопоставимой выраженностью противоопухолевого эффекта, оценённого по значениям ТРО и индекса прироста опухоли.
Эрбитукс®, ксенографт, иммунодефицитные мыши, торможение роста опухоли, противоопухолевая эффективность, эпидермоидная карцинома человека, индекс прироста опухоли
Короткий адрес: https://sciup.org/14056561
IDR: 14056561 | УДК: 616-006.6:615.277.3:577.25]-092.9
Текст научной статьи Оценка эффективности препаратов моноклональных антител против рецептора эпидермального фактора роста на модели подкожных ксенографтов на иммунодефицитных мышах
Гиперэкспрессия рецептора эпидермального фактора роста (EGFR) на клетках широкого спектра опухолей эпителиального происхождения (колоректальный рак, плоскоклеточный рак головы и шеи, рак легкого и др.) является известным фактом, что обусловливает выбор этого рецептора в качестве мишени для препаратов терапевтических моноклональных антител с противоопухолевой специфической активностью [3, 4, 8, 9, 10, 12, 14, 15]. Основным механизмом действия данных препаратов является блокирование пролиферации эпителиальных клеток вследствие конкурентного связывания с EGFR. Кроме того, терапевтические моноклональные антитела, связываясь с высокой аффинностью с EGFR, вызывают индукцию апоптоза и реакцию антителозависимой клеточноопосредованной цитотоксичности [5, 7, 11, 13].
В настоящее время примерами препаратов моноклональных антител к EGFR, успешно применяемых в клинической практике, являются панитумумаб (полностью человеческий IgG2) и цетуксимаб (химерное антитело IgG1 мыши / человека); некоторые препараты находятся на стадии клинических исследований: залутумумаб, нимоту-зумаб [2, 6].
Целью данного исследования являлась сравнительная оценка противоопухолевой активности вариантов препаратов терапевтических гуманизированных моноклональных антител против EGFR производства ЗАО «Биокад» и коммерческого препарата «Эрбитукс®» (Цетуксимаб, Merck, Германия) на модели подкожных ксенографтов эпидермоидной карциномы человека (клеточная линия A431NS) при многократном внутрибрюшинном введении бестимусным иммунодефицитным мышам Nu/Nu.
Материал и методы
Исследования проводили на иммунодефицитных мышах Nu/Nu (24 самки и 24 самца) в возрасте 5–6 нед и весом 20,0 ± 5,0 г. Животные были предоставлены компанией Charles River, Германия. В течение эксперимента животных содержали по 6 особей одного пола в каждой клетке. Клетки находились в вентилируемом шкафу для содержания грызунов. Во время эксперимента жи-
вотные содержались в контролируемых условиях, согласно общепринятым международным нормам содержания лабораторных животных: температура окружающего воздуха (24 ± 2)°С; относительная влажность (55 ± 5) %. Для получения ксенограф-та использовали опухолевую клеточную линию эпидермоидной карциномы человека (А431NS). Клеточная линия была получена из банка культур клеток ЗАО «Биокад». Для культивирования использовали полную питательную среду RPMI-1640, содержавшую 10 % телячьей эмбриональной сыворотки, при 37°С в атмосфере 5 % СО2. Клетки поддерживались в логарифмической фазе роста. Прививку опухоли животным проводили подкожно в объеме 0,5 мл суспензии (концентрация 2 млн клеток/мл). Животные были поделены на 8 групп согласно вводимым препаратам и дозам. Исследуемые препараты, «60/28» и «8/3», содержали по две молекулы моноклональных антител к двум различным эпитопам молекулы EGFR, что обеспечивало более активную полимеризацию данного рецептора. Препараты 60/28 и 8/3 вводили животным соответствующих групп в дозах 12,5; 25,0 и 50,0 мг/кг. Животные группы препарата сравнения («Эрбитукс®») получали препарат в дозе 50 мг/кг. Животным контрольной группы вводили изотонический раствор хлорида натрия. Исследуемые препараты, препарат сравнения и вещество-плацебо вводились в виде растворов внутрибрюшинно в одинаковом объеме – 0,2 мл. Два раза в неделю перед введением препарата измеряли опухоль. Для этого циркулем-измерителем измеряли длину, ширину и высоту опухолевого узла. Расчет объема для каждой опухоли проводили по формуле [3]
V = π/6*L*W*H, где L,W,H – линейные размеры опухоли.
Данные объема использовали для расчета значения процента торможения роста опухоли (ТРО, %) и индекса прироста опухоли (I). Расчеты проводили по следующим формулам:
ТРО, % = (V контроля
Ii = Vi/V0,
– V
опыта
) / V
контроля
× 100;
где i – сутки эксперимента, V0– объем опухоли в день начала лечения.
На момент окончания эксперимента эвтаназии были подвергнуты все животные всех групп. Для гистологического исследования выделенные опухоли фиксировали в 10 % забуференном растворе формалина. Фиксированный материал проводили через спирты с повышением концентрации и заливали в парафин. Срезы тканей окрашивали гематоксилином-эозином. Световую микроскопию проводили на Olympus CX41. Статистическая обработка данных производилась с помощью пакета «Statistica for Windows 10.0», применялся тест Манна – Уитни [1].
Результаты исследования и обсуждение
Каждая экспериментальная группа состояла из 3 самцов и 3 самок. Статистический анализ различий в действии исследуемых препаратов на животных разного пола проводился с использованием критерия Манна – Уитни. Значимых различий обнаружено не было, в связи с чем все статистические расчеты проводились для группы в целом (6 особей).
В течение всего срока эксперимента проводилась оценка роста опухоли. Для этого измеряли линейные размеры опухоли (длину, ширину и толщину) и рассчитывали объем опухоли. На осно-
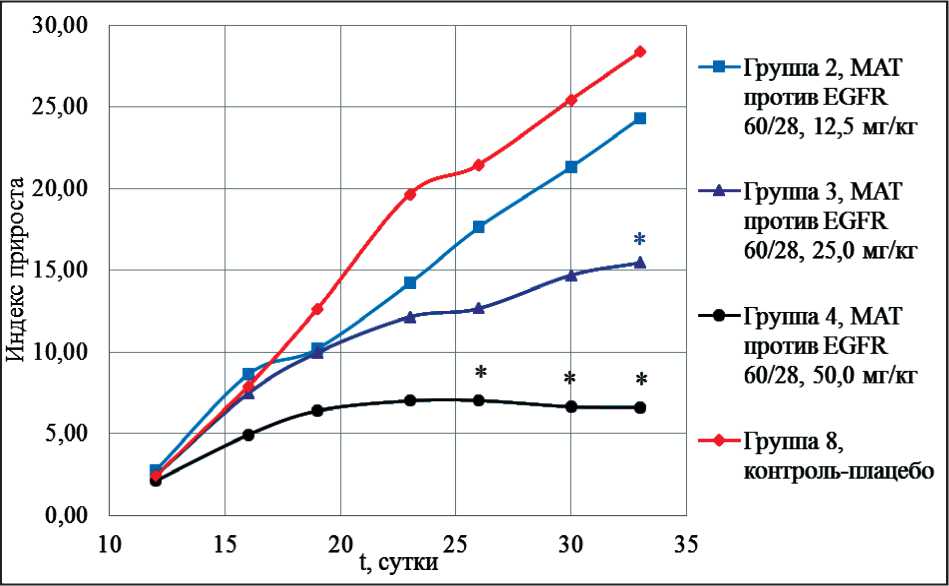
Рис. 1. Динамика роста опухоли при использовании препарата 60/28 в дозах 12,5; 25,0 и 50,0 мг/кг в сравнении с контрольной группой.
Примечание: * – достоверные различия между экспериментальной группой и контрольной группой по критерию Манна – Уитни. По оси абсцисс обозначен срок эксперимента в сутках, по оси ординат – индекс прироста опухоли
вании этих данных был рассчитан индекс прироста опухоли для каждой группы.
Сравнительная оценка индекса прироста опухоли при введении возрастающих доз препарата 60/28 и контрольной группы
Экспериментальные данные, характеризующие динамику показателя индекса прироста опухоли, приведены на рис. 1.
В группе животных, получавших препарат 60/28 в дозе 12,5 мг/кг, наблюдалось увеличение значения индекса прироста опухоли на протяжении всего срока эксперимента, значимых отличий от значений контрольной группы не обнаружено. В группе животных, получавших данный препарат в дозе 25,0 мг/кг, также наблюдалось увеличение индекса прироста опухоли на протяжении всего срока эксперимента, однако после 25 сут от начала лечения и до конца эксперимента значения индекса прироста опухоли данной группы были значимо меньшими в сравнении со значениями в контрольной группе. Наиболее выраженная противоопухолевая активность препарата 60/28 наблюдалась при его применении в дозе 50,0 мг/ кг. У животных соответствующей группы среднее значение размера опухоли оставалось постоянным, начиная с 11-х сут после начала лечения (т. е. после третьего введения препарата).
Из представленных данных можно заключить, что специфический противоопухолевый эффект, выраженный в значении индекса прироста опухоли, носит дозозависимый характер.
Сравнительная оценка индекса прироста опухоли при введении возрастающих доз препарата 8/3 и контрольной группы
В группах животных, получавших препарат 8/3 в дозах 12,5; 25,0 и 50,0 мг/кг, наблюдалось увеличение индекса прироста опухоли на протяжении всего срока эксперимента. Экспериментальные данные, характеризующие динамику показателя индекса прироста опухоли, приведены на рис. 2.
Из представленных результатов видно, что присутствует обратная зависимость между значением
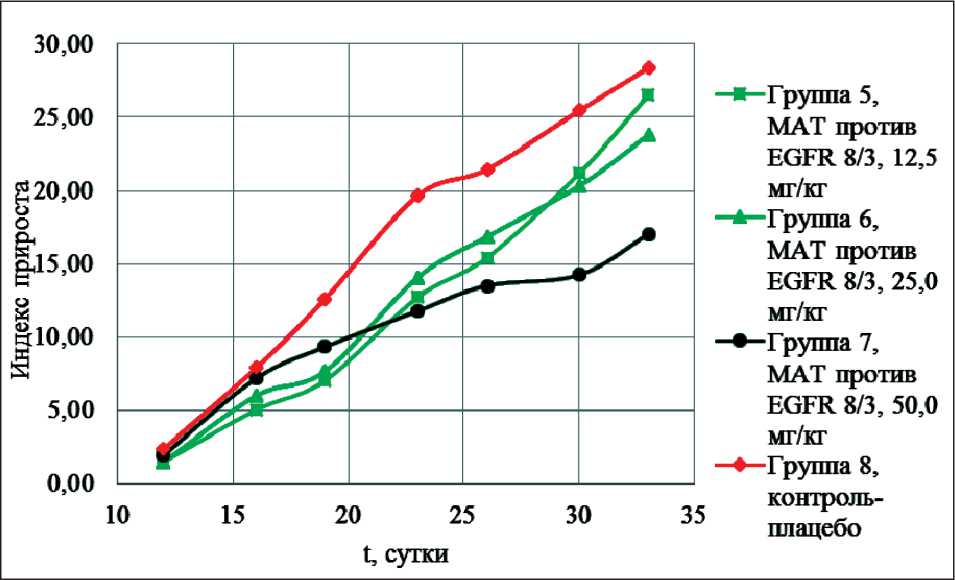
Рис. 2. Динамика роста опухоли при использовании препарата 8/3 в дозах 12,5; 25,0 и 50,0 мг/кг в сравнении с контрольной группой. По оси абсцисс обозначен срок эксперимента в сутках, по оси ординат – индекс прироста опухоли
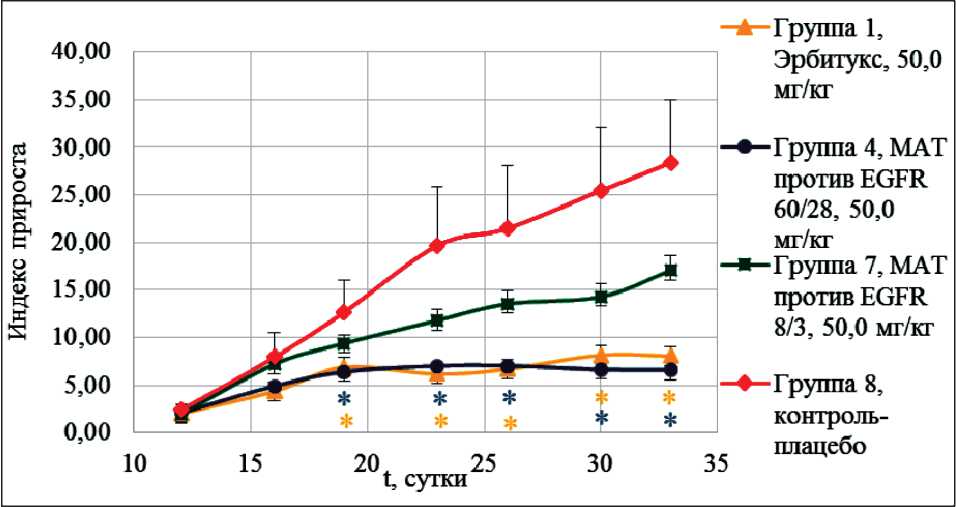
Рис. 3. Динамика роста опухоли при использовании препарата 60/28 в дозе 50,0 мг/кг, 8/3 в дозе 50,0 мг/кг, препарата Эрбитукс® в дозе 50,0 мг/кг и в контрольной группе.
Примечание: * – достоверные различия между экспериментальной группой и контрольной группой по критерию Манна – Уитни. По оси абсцисс обозначен срок эксперимента в сутках, по оси ординат – индекс прироста опухоли
индекса прироста опухоли и вводимой дозой препарата 8/3.
Различия значений индекса прироста опухоли групп, получавших препарат 8/3 в дозах 12,5; 25,0 и 50,0 мг/кг, и значений контрольной группы являлись незначимыми на протяжении всего срока эксперимента.
Сравнительная оценка индекса прироста опухоли для экспериментальных групп препаратов 60/28, 8/3, Эрбитукс® в дозе 50,0 мг/кг и контрольной группы (плацебо)
Динамика роста опухоли при использовании препаратов 60/28, 8/3 и Эрбитукс® в дозе 50 мг/ кг в сравнении с контрольной группой (плацебо) представлена на рис. 3.
Динамика изменения значения индекса прироста опухоли для препарата 60/28 в дозе 50,0 мг/кг и препарата Эрбитукс® в дозе 50,0 мг/кг на протяжении всего срока эксперимента была схожей – значения индекса значимо не различались. Среднее значение размера опухоли при использовании препаратов 60/28 и Эрбитукс® в дозе 50,0 мг/кг оставалось постоянным, начиная с 11-х сут после начала лечения.
Оценка изменения среднего значения индекса прироста опухоли в группе, получавшей препарат 8/3 в дозе 50,0 мг/кг, показала наличие тенденции к увеличению рассматриваемого параметра вплоть до 19-х сут. Начиная с 11-х сут после начала лечения средние значения индекса прироста опухоли данной группы были значимо больше таковых для групп, получавших препарат 60/28 в дозе 50,0 мг/кг и препарат Эрбитукс® в дозе 50,0 мг/кг.
Средние значения индекса прироста опухоли в группах, получавших препарат 60/28 и Эрбитукс® в дозе 50 мг/кг, были значимо меньше, чем аналогичный показатель в контрольной группе (плацебо), начиная с 11-х сут после начала лечения и до конца эксперимента.
На момент окончания эксперимента был рассчитан показатель торможения роста опухоли.
При сравнении значения ТРО для групп, получавших препарат 60/28, наблюдается прямая зависимость между дозой препарата и значением
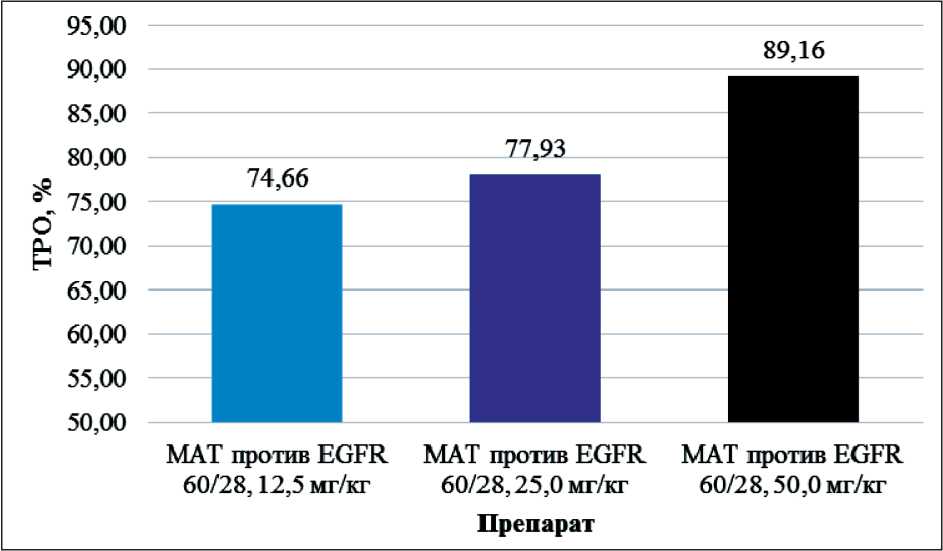
Рис. 4. Показатель ТРО для препарата 60/28 в дозах 12,5; 25,0 и 50,0 мг/кг
показателя ТРО: чем выше доза препарата, тем выше показатель ТРО.
Данные значения ТРО группы, получавшей препарат 60/28, представлены на рис. 4.
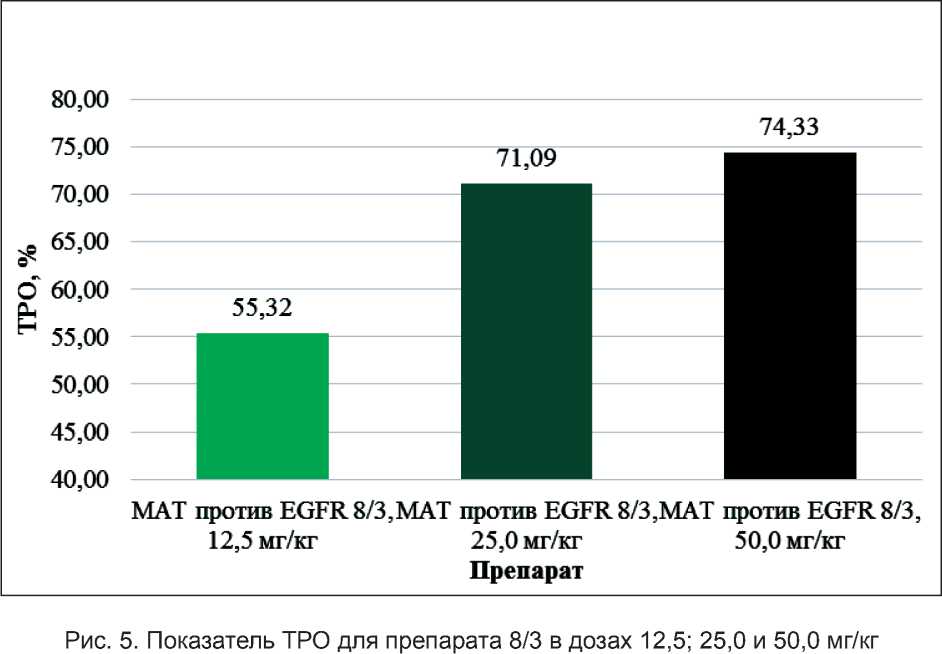
При сравнении значений ТРО в группах, получавших препарат 8/3 в разных дозах, наблюдается прямая зависимость между дозой препарата и значением показателя ТРО. Данные показателя ТРО для препарата 8/3 представлены на рис. 5.
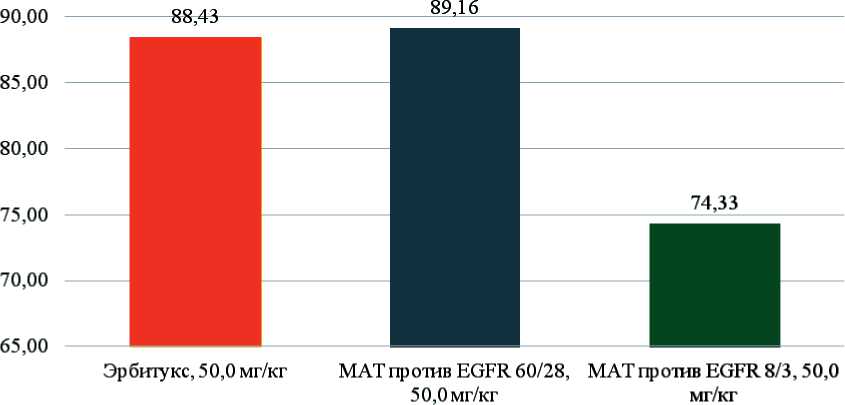
Значения ТРО для групп, получавших препараты 60/28, 8/3 и Эрбитукс® в идентичной дозе 50 мг/кг, представлены на рис. 6.
Значения ТРО для препарата 60/28 в дозе 50,0 мг/кг и препарата Эрбитукс® в дозе 50,0 мг/кг значимо не отличаются, в то время как показатель ТРО для препарата 8/3 в дозе 50,0 мг/кг значимо ниже такового для препарата 60/28 и препарата Эрбитукс® в аналогичной дозе.
Гистологическая картина при применении сравниваемых препаратов носила схожий характер. От мягких тканей и мышц опухолевая ткань была отделена плотной, сформировавшейся фиброзной капсулой, которая в большинстве случаев мало или умеренно инфильтрирована лейкоцитами, нейтрофилами, гистиоцитами, лимфоцитами. Прилегающие ткани сдавлены, отдельные миоциты некротизированы. Межмышечные пространства расширены, отечны, инфильтрированы воспалительным инфильтратом. Большая часть неоплазии в представленных срезах некротизирована (от 30 до 90 % (экспериментальных групп) и от 30 до 70 % (контрольной группы) поля зрения), выполняет преимущественно центральную часть опухолевого узла. Опухолевая ткань линии A431NS состояла из беспорядочно расположенных комплексов атипичных клеток плоского эпителия различной степени выраженности атипии, характеризующейся изменением размеров, формы клеток ядер и ядерно-цитоплазматического соотношения, наличием полиплоидных форм, патологических митозов в большом количестве. Была показана избыточная кератинизация, сопровождаемая дискератозом и дискомплексацией отдельных клеток и формированием «раковых жемчужин». В опухолевой ткани и зоне некроза определялись небольшие округло-овальные кальцинаты по типу псаммомных телец.
Заключение
Специфическая противоопухолевая активность исследуемых препаратов терапевтических моноклональных антител к EGFR оценивалась по двум основным показателям: индексу прироста опухоли и торможению роста опухоли (ТРО, %).
Полученные значения индекса прироста опухоли и ТРО свидетельствуют о выраженном дозозависимом характере эффекта исследуемых препаратов.
Применение минимальной дозы (12,5 мг/кг) препарата 60/28 не привело к значимому уменьшению индекса прироста опухоли в сравнении с контрольной группой, в то время как при использовании дозы 25 мг/кг индекс прироста опухоли был значимо меньше такового для контрольной группы в период с 25-х сут после начала лечения до завершения исследования. Наименьшие значения индекса прироста опухоли в течение эксперимента наблюдались в группе, получавшей препарат 60/28 в дозе 50 мг/кг: начиная с 14-х сут после первого введения препарата и до завершения эксперимента индекс прироста опухоли данной группы был значимо меньше такового для контрольной группы. Следует также отметить, что начиная с 11-х сут после начала лечения средний размер опухоли в данной группе не увеличивался.
Значения ТРО в группе, получавшей препарат 60/28 в дозе 50 мг/кг, значимо не отличались от аналогичных показателей группы, получавшей препарат сравнения Эрбитукс® в той же дозе (89,2 и 88,4 % соответственно).
Таким образом, исходя из результатов проведенного исследования, можно заключить, что исследуемый препарат 60/28 обладает высокой противоопухолевой активностью, что обусловлено
95,00
Препарат
Рис. 6. Показатели ТРО для препаратов 60/28 и 8/3 в дозе 50,0 мг/кг и препарата Эрбитукс® в дозе 50,0 мг/кг
действием моноклональных антител к двум различным эпитопам EGFR, заключающейся в выраженной полимеризации рецептора эпидермального
Список литературы Оценка эффективности препаратов моноклональных антител против рецептора эпидермального фактора роста на модели подкожных ксенографтов на иммунодефицитных мышах
- Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л., 1963. С. 81-117.
- Daiichi Sankyo Announces Discontinuation of Phase 3 Clinical Trial in Japan of Nimotuzumab (DE-766) in Lung Cancer. URL: http://www.daiichisankyo.com/media_investors/media_relations/press_releases/detail/006115.html (05.03.2015).
- Freeman D.J., McDormanK., Ogbagabriel S., Kozlosky C., Yang B.B., Doshi S., Perez-Ruxio J.J., Fanslow W., Starnes C., Radinsky R. Tumor penetration and epidermal growth factor receptor saturation by panitumumab correlate with antitumor activity in a preclinical model of human cancer//Mol. Cancer. 2012. Vol. 11. P. 47. d DOI: 10.1186/1476-4598-11-47
- Friedman L.M., Rinon A., Schechter B., Lyass L., Lavi S., Bacus S.S., Sela M., Yarden Y. Synergistic down-regulation of receptor tyrosine kinases by combinations of mAbs: implications for cancer immunotherapy//Proc. Natl. Acad. Sci. USA. 2005. Vol. 102 (6). P. 1915-1920.
- Kurai J., Chikumi H., Hashimoto K., Yamaguchi K., Yamasaki A., Sako T., Touge H., Makino H., Takata M., Miyata M., Nakamoto M., Burioka N., Shimizu E. Antibody-dependent cellular cytotoxicity mediated by cetuximab against lung cancer cell lines//Clin. Cancer Res. 2007. Vol. 13 (5). P. 1552-1561.
- Lammerts van Bueren J.J., Bleeker W.K., Brännström A., von Euler A., Jansson M., Peipp M., Schneider-Merck T., Valerius T., van de Winkel J.G., Parren P.W. The antibody zalutumumab inhibits epidermal growth factor receptor signaling by limiting intra-and intermolecular flexibility//Proc. Natl. Acad. Sci. USA. 2008. Vol. 105 (16). P. 6109-6114 DOI: 10.1073/pnas.0709477105
- Li S., Schmitz K.R., Jeffrey P.D., Wiltzius J.J., Kussie P., Ferguson K.M. Structural basis for inhibition of the epidermal growth factor receptor by cetuximab//Cancer Cell. 2005. Vol. 7 (4). P. 301-311.
- Mendelsohn J., Baselga J. Epidermal growth factor receptor targeting in cancer//Semin. Oncol. 2006. Vol. 33 (4). P. 369-385.
- Nicholson R.I., Gee J.M., Harper M.E. EGFR and cancer prognosis//Eur. J. Cancer. 2001. Vol. 37. Suppl 4. P. 9-15.
- Pedersen M.W., Jacobsen H.J., Koefoed K., Hey A., Pyke C., Haurum J.S., Kragh M. A Novel Synergistic Anti-Epidermal Growth Factor Receptor Antibody Mixture with Superior Anticancer Efficacy//Cancer Res. 2010. Vol. 70 (2). P. 588-597. CAN-09-1417 DOI: 10.1158/0008-5472
- Pharmacology/toxicology review and evaluation. URL: http://www.accessdata.fda.gov/drugsatfda_docs/bla/2004/125084_ERBITUX_PHARMR_P1.PDF (05.03.2015).
- Rogers J.E., Eng C. Cetuximab in Refractory Squamous Cell Carcinoma of the Anal Canal//J Gastrointest Cancer. 2014. Vol. 45. Suppl. 1. P. 198-200 DOI: 10.1007/s12029-014-9626-7
- Scientific discussion. URL: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Scientific_Discussion/human/000558/WC500029113.pdf (05.03.2015).
- Sorkin A., Krolenko S., Kudrjavtceva N., Lazebnik J., Teslenko L., Soderquist A.M., Nikolsky N. Recycling of epidermal growth factor-receptor complexes in A431 cells: identification of dual pathways//J. Cell Biol. 1991. Vol. 112 (1). P. 55-63.
- Travis W.D., Brambilla E., Muller-Hermelink K.H., Harris C.C. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart//World Health Organization Classification of Tumours. Lyon: IARC Press, 2004. 344 p.


