Оценка эффективности применения резорбируемой мембраны «Bio-Gide» в комбинации с хитозаном для лечения дефектов костной ткани
Автор: Калмин О.В., Никишин Д.В., Володина Ю.М.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.10, 2014 года.
Бесплатный доступ
Цель: оценка эффективности применения резорбируемой мембраны «Bio-Gide» в комбинации с хитозаном для направленной регенерации костной ткани при деструкции в условиях эксперимента. Материал и методы. Гистологическими методами изучены образцы тканей от 6 половозрелых кроликов из области искусственных дефектов нижней челюсти через 14, 28 и 42 суток после операции. В 1-й группе лечение осуществлялось без использования дополнительных материалов, под кровяным сгустком. Во 2-й группе закрытие зоны повреждения произведено с использованием ксеноперикардиальной пластины «Bio-Gide» в комбинации с хитозаном. Результаты. Установлено, что ведение костной раны под кровяным сгустком вызывает выраженный воспалительный ответ, отмечающийся на 14-е сутки после операции, к 28-м суткам явления воспаления стихают и практически не проявляются на 42-е сутки. Кроме того, уже на 14-е сутки выявляется грубоволокнистая соединительная и хрящевая ткани. Закрытие костного дефекта с применением ксеноперикардиальной пластиной «Bio-Gide» с хитозаном вызывает менее выраженный воспалительный ответ. В отдаленные сроки после операции воспалительные изменения в зоне имплантации не обнаруживаются. Заключение. Ксеноперикардиальная пластина «Bio-Gide» в комбинации с хитозаном оказывает позитивное влияние на процессы восстановления костного дефекта. Новообразование костной ткани происходит, минуя хрящевую стадию развития и протекает быстрее. На конечном сроке эксперимента ксеноперикардиальная пластина не обнаруживается, что свидетельствует о высокой скорости ее биодеградации.
Костная ткань, костный дефект, ксеноперикард, регенерация, соединительная ткань
Короткий адрес: https://sciup.org/14917939
IDR: 14917939
Текст научной статьи Оценка эффективности применения резорбируемой мембраны «Bio-Gide» в комбинации с хитозаном для лечения дефектов костной ткани
-
1 Вв едение. Одна из актуальных и окончательно не решенных проблем современной медицины — это оптимизация процессов регенерации костной ткани в зоне ее патологической деструкции [1]. Поэтому разработка материалов и методов для улучшения восстановительного потенциала очага поражения является ключевой как в практической, так и в теоретической медицине [1, 2].
Использование ксеноперикардиальных пластин в коррекции состояний, требующих восстановления или пластики дефектов различной этиологии, — один из прогрессивных аспектов в решении данного вопроса.
В последнее время все больше исследователей уделяют внимание изучению свойств хитина и его производных, в частности хитозану [3, 4]. В сочетании с данным биополимером к биоматериалу добавляются ряд положительных свойств: повышение регенераторной способности, гемостатическая, антиоксидантная и антисептическая активность, иммуностимуляция, выраженные сорбционные свойства, что уменьшает число интра- и послеоперационных
осложнений, сокращает время реабилитации больных [5, 6].
Несмотря на имеющиеся литературные данные об исследованиях и успешном применении хитозана с целью восстановления костной ткани в практическом здравоохранении, его использование при парадонтитах недостаточно изучено [5, 7, 8]. Таким образом, возможность использования хитозана для остеорегенерации в случае поражения челюстей остается актуальной и малоисследованной, что в условиях не всегда успешного консервативного лечения и риска развития осложнений определяет высокую медико-социальную значимость данной проблемы [8, 9].
Цель: оценка эффективности применения резорбируемой мембраны «Bio-Gide»в комбинации с хитозаном для направленной регенерации костной ткани при деструкции в условиях эксперимента.
Материал и методы. Материалом исследования послужили 6 половозрелых кроликов породы «шиншилла» массой 2–2,5 кг. Все эксперименты, уход и содержание животных осуществлялись в соответствии с Директивой № 63 от 22.09.2010 г. Президиума Парламента Европы «О защите животных, используемых для научных исследований» и приказом Минз- драва РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики».
У всех животных были сформированы искусственные дефекты нижней челюсти. Затем экспериментальные животные были разделены на 2 группы. В 1-й (контрольной) группе лечение осуществлялось без использования дополнительных материалов — ведение костной раны под кровяным сгустком. Во 2-й (экспериментальной) группе закрытие зоны повреждения произведено с использованием ксеноперикардиальной пластины «Bio-Gide» в комбинации с хитозаном.
Животных выводили из эксперимента на 14-е, 28-е и 42-е сутки. Образцы тканей фиксировали в 10%-м растворе нейтрального формалина. Затем из каждой зоны оперативного вмешательства были получены по два образца тканей для микроскопического исследования, которые декальцинировали в 6%-м растворе азотной кислоты в течение двух суток и после обезвоживания заливали в парафин. Парафиновые срезы толщиной 6–7 мкм окрашивали гема-токсилином-эозином и по методу Ван-Гизона.
Для микроморфометрии выполняли микросъем-ку10 полей зрения с каждого препарата при увеличении х200 и х400 на микроскопе Leica DM-1000 при помощи фотокамеры Nikon. Изучение микроскопического строения проводили с помощью персонального компьютера с использованием программы ImageTool v.3.0. Были изучены абсолютная и относительная площади поперечного сечения костной, соединительной и хрящевой ткани, красного костного мозга, кровеносных сосудов. Полученные данные подвергались вариационно-статистической обработке с использованием программного пакета Statistica 7.0.
Результаты. При гистологическом исследовании образцов из 1-й (контрольной) группы животных, ведение которой происходило под кровяным сгустком (без использования дополнительных материалов), установлено, что к 14-м суткам в тканях имелись признаки дистрофии по краю костного дефекта и лим-фогистиоцитарная инфильтрация. Отмечались зоны развития грубоволокнистой соединительной ткани. При окраске по методу Ван-Гизона обнаруживались фуксинофильные коллагеновые волокна (рис. 1). Дистальнее зоны повреждения выявлялись начальные признаки остеогенеза. По мере удаления от очага деструкции степень зрелости костной ткани увеличивалась. Наблюдалась воспалительная реакция в тканях пародонта в виде выраженной инфильтрации.
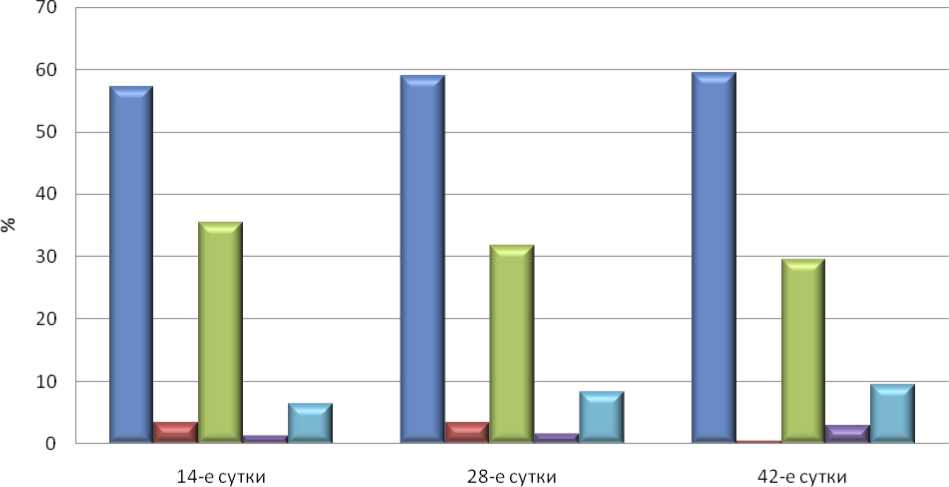
Установлено, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 220722,35±3911,12мкм2, или 57,19±1,01% площади поля зрения. Абсолютная площадь соединительной ткани составила в среднем 136843,66±4062,75мкм2, или 35,46±1,05%. Хрящевая ткань занимала 12901,01±2423,52мкм2, или 3,34±0,63%. Кровеносные сосуды занимали всего 1,25±0,10% площади, или в среднем 4808,04±402,25 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 24585,28±1040,00 мкм2, т.е. 6,37±0,27% от общего поля зрения (табл. 1, рис. 5).
На 28-е сутки эксперимента в зоне дефекта выявлялась грубоволокнистая соединительная ткань, что свидетельствовало о продолжающемся остеогенезе (рис. 2). В зоне новообразования костной ткани определялись хондроциты. Учитывая это, можно предполагать, что образование первичной мозоли происходило преимущественно энхондральным путем. Неупорядоченное положение пластинок с большим
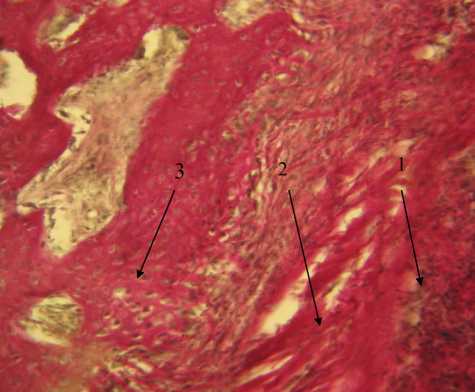
Рис. 1. Участок дефекта костной ткани, 14-е сутки, контрольная группа. Окраска по Ван-Гизону, х 200. 1 — лимфогисти-оцитарная инфильтрация, 2 — формирование грубоволокнистой соединительной ткани, 3 — формирование костной мозоли
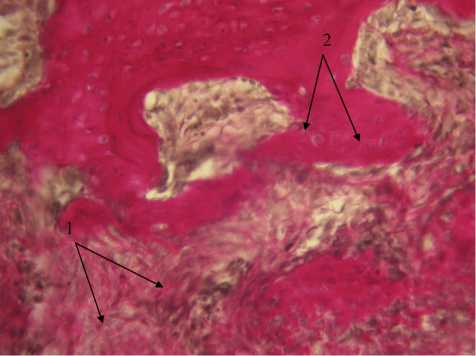
Рис. 2. Грубоволокнистая соединительная ткань в области дефекта (1) и единичные хрящевые клетки (2). 28-е сутки, контрольная группа. Окраска по Ван-Гизону, х400
количеством фибробластов на поверхности свидетельствовало о незрелом характере новообразованной костной ткани. Костные трабекулы содержали большое количество остеобластов и незначительное количество остеоцитов. В ячейках ретикулярной ткани между костными трабекулами располагались очаги кроветворения.
Морфометрическое исследование показало, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 220722,35±3911,12мкм2, или 58,91±0,84% площади поля зрения. Абсолютная площадь соединительной ткани составила в среднем 122050,91±3247,69 мкм2, или 31,62±0,84%. Хрящевая ткань занимала 12569,43±5131,67 мкм2, или 3,26±1,33%. Кровеносные сосуды занимали всего 1,57±0,12% площади, или в среднем 6054,58±470,91 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 31857,10±739,74 мкм2, т.е. 8,25±0,19% от общего поля зрения (табл. 1, рис. 5).
К 42-м суткам эксперимента происходило дальнейшее созревание и формирование костной мозоли. Выявлялись признаки ее ремоделирования, связанные с переходом из соединительнотканой стадии развития в костно-хрящевую. Были выявлены отдельные участки, где встречались локусы гиалинового хряща (рис. 3). Об активных процессах перестройки костной ткани свидетельствовало также значительное количество остеобластов и остеокластов в новообразованной костной ткани.
Между костными пластинками в значительном количестве выявлялась ретикулярная ткань, в ячейках которой находились активные кроветворные клетки. В области эксперимента обнаруживались новообразованные очаги сосудов (рис. 4). Грубоволокнистая соединительная ткань выявлялась в поверхностных слоях по краю дефекта, она содержала в значительном количестве фибробласты.
Установлено, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 229378,83±2589,25 мкм2, или 59,43±0,67%. Абсолютная площадь соединительной ткани составила в среднем 113860,31±2516,99 мкм2, или 29,50±0,65%. Хрящевая ткань занимала 1598,21±461,43мкм2, или 0,41±0,12%. Кровеносные сосуды занимали всего 2,86±0,22 % площади, или в среднем 11044,75±850,13 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 36402,64±476,74 мкм2, т.е. 9,43±0,12% от общего поля зрения (табл. 1, рис. 5).
Таблица 1
Относительная площадь тканевых компонентов в области дефекта в разные сроки после операции у животных контрольной группы (%)
|
Компонент |
14-е сутки |
28-е сутки |
42-е сутки |
|
Костная ткань |
57,19±1,01 |
58,91±0,84 |
59,43±0,67 |
|
Хрящевая ткань |
3,34±0,63 |
3,26±1,33 |
0,41±0,12 |
|
Соединительная ткань |
35,46±1,05 |
31,62±0,84 |
29,50±0,65 |
|
Кровеносные сосуды |
1,25±0,10 |
1,55±0,12 |
2,85±0,22 |
|
Красный костный мозг |
6,37±0,27 |
8,25±0,19 |
9,43±0,12 |
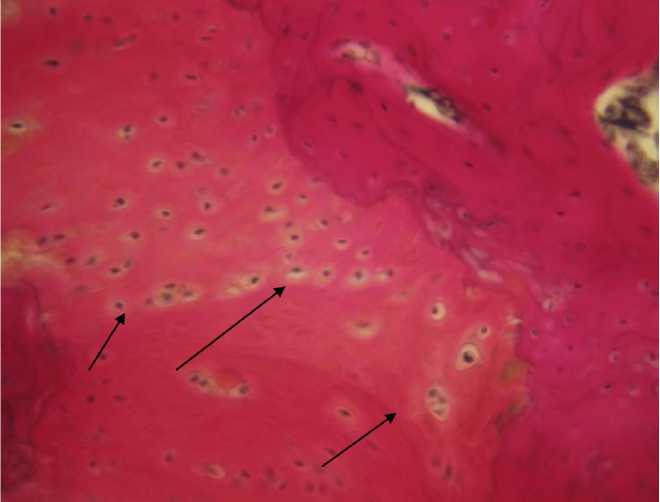
Рис. 3. Участки гиалинового хряща в новообразованной костной ткани. 42-е сутки, контрольная группа. Окраска по Ван-Гизону, х 400
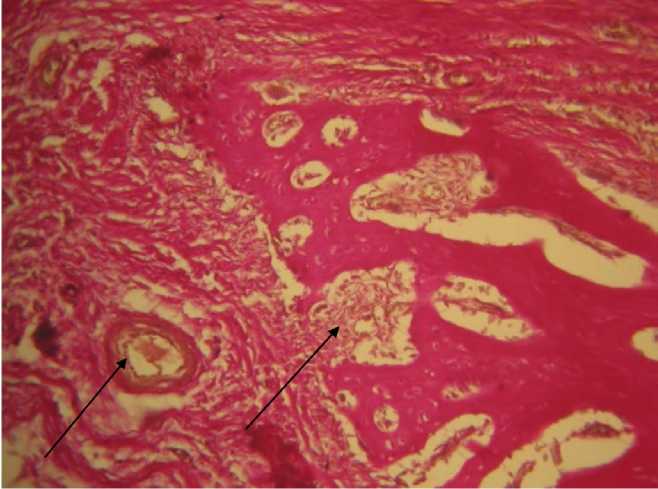
Рис. 4. Большое количество гемопоэтических компонентов и новообразованных сосудов. 42-е сутки, контрольная группа. Окраска по Ван-Гизону, х 200
Таким образом, в группе контроля к 42-м суткам область эксперимента полностью закрывалась незрелой костной тканью. Ее функциональная адаптация к силе и направлению нагрузок не была достаточной и находилась на начальной стадии. Об-
■ Костнаяткань ■ Хрящеваяткань ■ Соединительная ткань
■ Кровеносные сосуды ■ Красный костный мозг
Рис. 5. Относительная площадь тканевых компонентов в образцах контрольной группы животных
разовавшаяся ретикулярная ткань и сосуды выполняли свою функцию.
При использовании метода изоляции костного дефекта ксеноперикардиальной пластиной «Bio-Gide» с хитозаном гистологическое исследование и морфометрия фрагментов нижней челюсти экспериментальных животных позволило выявить следующие изменения.
К 14-м суткам в исследуемых образцах обнаружены незначительныепризнаки дистрофии по краю костного дефекта. Выявлялось малое количество зон лимфогистиоцитарной инфильтрации. Отмечались участки развития грубоволокнистой соединительной ткани в глубоких отделах дефекта. При окраске по методу Ван-Гизона обнаруживались фуксинофильные коллагеновые волокна, дистальнее зоны повреждения, отмечались начальные признаки остеогенеза. По мере удаления от очага деструкции степень зрелости костной ткани увеличивалась. В зоне ксеноперикардиальной пластины имелись сла-бовыраженные признаки воспалительной реакции, происходила биодеградация и биоинтеграция ксеноперикарда. Воспалительный процесс в тканях пародонта был представлен слабовыраженными очагами инфильтрации.
Установлено, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 226476,06±9524,79 мкм2, или 58,68±2,47%. Абсолютная площадь соединительной ткани составила в среднем 124920,31±9146,59 мкм2, или 32,37±2,37%. Хрящевая ткань не выявлялась. Кровеносные сосуды занимали 2,33±0,35% площади, или в среднем 9003,07±1362,36 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 32190,42±1693,11 мкм2, т.е. 8,34±0,44% от общего поля зрения (табл. 2, рис. 8).
В исследуемых образцах на 28-е сутки эксперимента в зоне дефекта выявлялась грубоволокнистая соединительная ткань, что свидетельствовало о продолжающемся остеогенезе (рис. 6). Неупорядоченное положение пластинок с большим количеством фибробластов на поверхности позволяло судить о незрелом характере новообразованной костной ткани. Костные трабекулы содержали большое количество остеобластов и незначительное количество остеоцитов. В ячейках ретикулярной ткани между костными трабекулами располагались очаги кроветворения и новосформированные сосуды. Наблюдалась практически полная биоинтеграция используемой ксеноперикардиальной пластины.
Установлено, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 226623,63±9355,89мкм2, или 58,72±2,42%. Абсолютная площадь соединительной ткани составила в среднем 117159,44±8057,79 мкм2, или 30,36±2,09%. Хрящевая ткань не выявлена. Кровеносные сосуды занимали 3,70±0,44% площади, или в среднем 14295,83±1693,36 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 40730,23±1674,01мкм2, т.е. 10,55±0,43% от общего поля зрения (табл. 2, рис. 8).
К 42-м суткам эксперимента происходило дальнейшее созревание и формирование костной мозоли. На значительном количестве участков выявлялись признаки ее ремоделирования, связанные с переходом из соединительнотканой стадии развития в костную (рис. 7). Об активных процессах перестройки костной ткани свидетельствовало также зна-
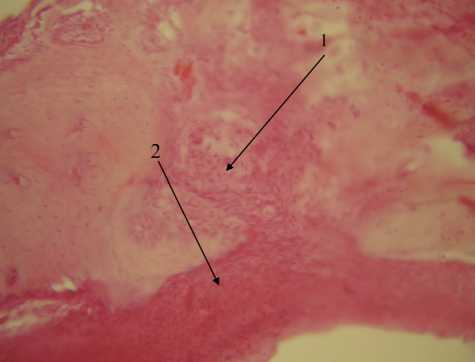
Рис. 6. Участок дефекта костной ткани. 28-е сутки, экспериментальная группа. Окраска гематоксилином-эозином, х 200. 1 — грубоволокнистая соединительная ткань в области дефекта, 2 — фрагменты ксеноперикардиальной пластины
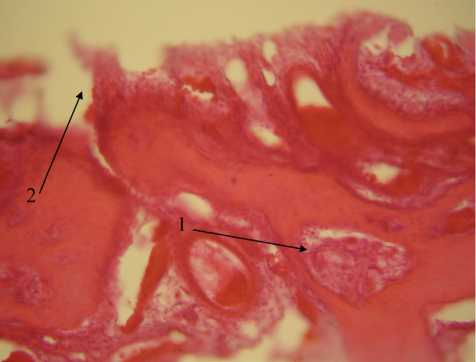
Рис. 7. Участок дефекта костной ткани. 42-е сутки, экспериментальная группа. Окраска гематоксилином-эозином, х200. 1 — гемопоэтический компонент, 2 — грубоволокнистая соединительная ткань чительное количество остеобластов и остеокластов в новообразованной костной ткани.
Между костными пластинками в значительном количестве выявлялась ретикулярная ткань, в ячейках которой находились активные кроветворные элементы. В области эксперимента обнаруживались новообразованные очаги сосудов. Грубоволокнистая соединительная ткань выявлялась в поверхностных слоях по краю дефекта, она содержала фибробласты в значительном количестве. Используемая ксеноперикардиальная пластина «Bio-Gide» подверглась процессам биодеградации и биоинтеграции полностью.
Установлено, что абсолютная площадь поперечного сечения костной ткани составляла в среднем 231326,66±6424,75 мкм2, или 59,94±1,66%. Абсолютная площадь соединительной ткани составила в среднем 106561,79±5573,40 мкм2, или 27,61±1,44%. Хрящевая ткань не выявлена. Кровеносные сосуды занимали 4,30±0,36% площади, или в среднем 16591,06±1406,81 мкм2. Средняя площадь, занимаемая красным костным мозгом, составляла 46836,03±1305,79 мкм2, т.е. 12,14±0,34% от общего поля зрения (табл. 2, рис. 8).
Относительная площадь тканевых компонентов в области дефекта в разные сроки после операции у животных экспериментальной группы (%)
|
Компонент |
14-е сутки |
28-е сутки |
42-е сутки |
|
Костная ткань |
58,68±2,47 |
58,87±2,42 |
59,94±1,66 |
|
Хрящевая ткань |
0,00 |
0,00 |
0,00 |
|
Соединительная ткань |
32,37±2,37 |
30,18±2,09 |
27,16±1,44 |
|
Кровеносные сосуды |
2,37±0,35 |
3,57±0,44 |
3,86±0,36 |
|
Красный костный мозг |
8,34±0,44 |
10,55±0,43 |
12,14±0,34 |
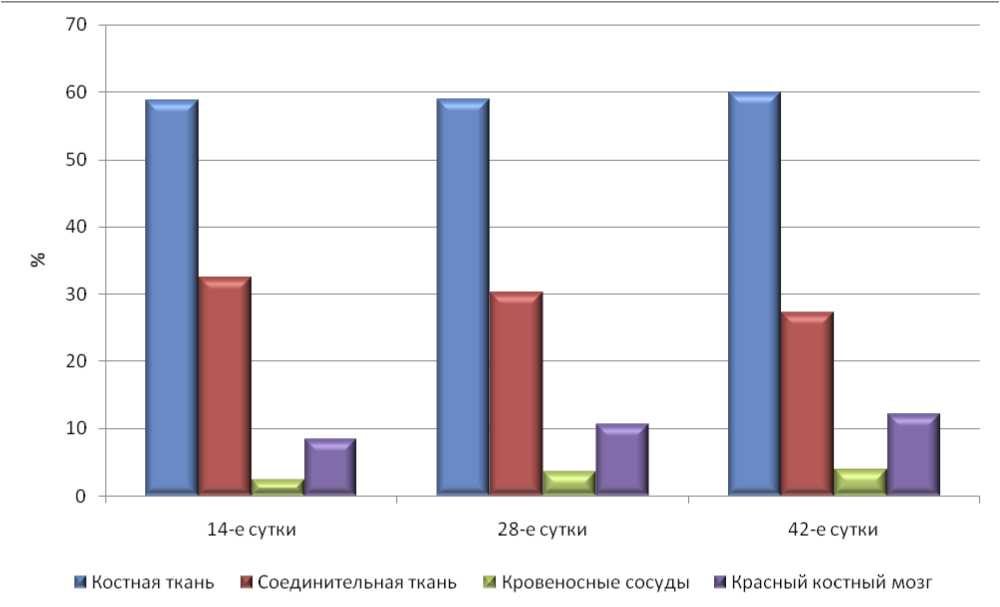
Рис. 8. Относительная площадь тканевых компонентов в образцах контрольной группы животных
Таблица 2
Таким образом, к 42-м суткам экспериментального исследования в группе с применением метода изоляции костного дефекта ксеноперикардиальной пластиной «Bio-Gide» с хитозаном зона повреждения полностью была закрыта незрелой костной тканью. Функциональная адаптация к силе и направлению нагрузок, несмотря на начальные этапы формирования, значительно преобладала над аналогичными показателями в контрольной группе. Образовавшаяся ретикулярная и сосудистая ткань выполняла свою функцию. Используемая ксеноперикардиальная пластина «Bio-Gide» целиком интегрировала в собственные ткани организма.
Обсуждение. Эксперимент на животных показал, что ведение костной раны под кровяным сгустком вызывает выраженный воспалительный ответ, отмечающийся на 14-е сутки после операции, к 28-м суткам явления воспаления стихают и практически не проявляются на 42-е сутки. Кроме того, уже на 14-е сутки выявляется грубоволокнистая соединительная и хрящевая ткань. Наличие значительного количества хрящевой ткани в области костного дефекта свидетельствует о непрямом остеогенезе, а следовательно, в области костного дефекта не в полной мере создаются оптимальные условия для остеогенеза. Также к 42-м суткам не происходит функциональная адаптация новообразованной костной ткани к силе и направлению нагрузок. Полученные нами данные подтверждаются исследованиями П. В. Иванова с со-авт. [9].
Закрытие костного дефекта с применением ксеноперикардиальной пластины «Bio-Gide» с хитозаном вызывает менее выраженный воспалительный ответ. В отдаленные сроки после операции воспалительные изменения в зоне имплантации не обнаруживаются. При анализе компонентного состава нами отмечено отсутствие в области дефекта костной ткани хрящевого компонента, даже на ранних сроках, что свидетельствует о создании наиболее оптимальных условий для остеогенеза. Таким образом, результаты наших исследований, свидетельствующие об эффективности применения метода изоляции костного дефекта ксеноперикардиальной пластиной «Bio-Gide» с хитозаном, согласуются с результатами ряда клинических исследований [8, 9].
Заключение. Таким образом, применение ксеноперикардиальной пластины «Bio-Gide» в комбинации с хитозаном для направленной регенерации костной ткани в условиях эксперимента показало, что она оказывает позитивное влияние на процессы восстановления костного дефекта. Новообразование костной ткани происходит, минуя хрящевую стадию развития, и в целом протекает быстрее, составляя в среднем 59,94±1,66% от общего поля зрения. Ее функциональная адаптация к силе и направлению нагрузок, несмотря на начальные этапы формирования, значительно преобладает над аналогичными показателями в группе сравнения. Доля новообразованных сосудов к 42-м суткам эксперимента составляет 3,86±0,3б%, и на 1,01 % превышает контрольную группу, что свидетельствует о более эффективной остеорегенерации. При исследовании образцов на конечном сроке эксперимента ксеноперикардиальная пластина не обнаруживается, что свидетельствует о высокой скорости ее биодеградации.
Список литературы Оценка эффективности применения резорбируемой мембраны «Bio-Gide» в комбинации с хитозаном для лечения дефектов костной ткани
- Лекишвили M.B., Васильев M. Г., Зайцев В. В. Биологические имплантаты в реконструктивной хирургии. Труды Астраханской государственной медицинской академии 2009; (38): 61-62
- Грудянов A.M., Ерохин A.M. Осте-опластические материалы, используемые при хирургическом лечении заболеваний пародонта.Пародонтология 1998; (1): 13-23
- Петрович Ю.А., Григорьянц Л. А, Гурин A. H., Гурин Н.А. Хитозан: структура и свойства, использование в медицине. Стоматология 2008; 87 (4): 72-77
- Хасина Э. И., Гребне-ва М. Н., Ермак И. М., Горбач В. И. Хитозан инеспецифическая резистентность организма. Вестн. ДВОРАН 2005; (1): 62-71
- Горовой Л., Косяков В. Сорбционные свойства хитина и его производных. В кн: Хитин и хитозан: получение, свойства и применение/под ред. К. Г. Скрябина, ГА. Вихревой, В. П. Варламова. М.: Наука; 2006; с. 217-247
- Strobin G, Kuharska М, Ciechanska D, et al. Biomaterials containing chitosan and fibroin. Polish chitin Society: Monograph №11. Lodz, 2006; p. 61-68
- Пестов А., Бондарь Ю., Мирсаев Т. Стоматологические материалы из хитозана и карбоксиэтилхитозана. В сб.: Современные перспективы в исследовании хитина и хитозана: Материалы VIII международной конференции. М.: ВНИ-РО, 2006; с. 233-236
- Солнцев A. C, Орешкин И. В., Зыкова Л. Д. Патоморфологическое обоснование комплексного лечения деструктивных форм периодонтита с применением хитозана. Клиническая стоматология 2010; (1): 17-20
- (Иванов П. В., Зудина И. В., Булкина Н.В. и др. Противовоспалительный эффект аскорбата хитозана в комплексной терапии заболеваний пародонта. Современные проблемы науки и образования 2013; (4) http://www.science-education.ru/110-9517 (02 июля 2013).


