Оценка эффективности седатации у детей с ДЦП в раннем послеоперационном периоде после многоуровневых одномоментных оперативных ортопедических вмешательств
Автор: Евреинов Вадим Викторович, Томов Ахмед Даутович, Попков Дмитрий Арнольдович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Цель. Проведение сравнительной оценки седативного эффекта дексмедетомидина и мидазолама в раннем послеоперационном периоде в отделении реанимации и интенсивной терапии у детей с ДЦП после выполнения многоуровневых одномоментных вмешательств, сопровождающихся реконструктивными вмешательствами на тазобедренном суставе. Материалы и методы. Проведена сравнительная оценка эффективности седатации дексмедетомидином и мидазоламом у 14 детей с ДЦП в раннем послеоперационном периоде после многоуровневых одномоментных оперативных ортопедических вмешательств, которые были разделены на 3 сопоставимые группы. Для оценки степени седатации использовали шкалу Ramsay, шкалу оценки возбуждения - седатации Richmond. Послеоперационное обезболивание во всех группах осуществлялось посредством введения в эпидуральное пространство ропивокаина 0,2 % через установленный ранее эпидуральный катетер. Результаты. Показано, что в 1 группе (без седатации) дети взволнованы, беспокойны, и комфорта ребенку достичь не удается. Во 2 (седатация дексмедетомидином) и 3 (седатация мидазоламом) группах уровень седатации был достоверно выше, чем в контрольной группе и достигал легкой и средней степени. Заключение. Таким образом, дексмедетомидин и медазолам являются эффективными препаратами для седатации детей с ДЦП в ОРИТ в раннем послеоперационном периоде, и достоверных преимуществ в достижении поверхностной седатации между ними не выявлено.
Дети, детский церебральный паралич, ортопедические вмешательства, послеоперационный период, седатация
Короткий адрес: https://sciup.org/142121859
IDR: 142121859 | УДК: 615.214.24:616.831-009.11-053.2-089.168.1-089.5 | DOI: 10.18019/1028-4427-2015-4-36-41
Текст научной статьи Оценка эффективности седатации у детей с ДЦП в раннем послеоперационном периоде после многоуровневых одномоментных оперативных ортопедических вмешательств
Частота встречаемости спастического паралича у детей в странах Западной Европы и Северной Америки составляет, в среднем, 2-3 случая на 1000 [1, 2].
У детей с тяжелыми формами ДЦП (IV и V уровень по GMFCS [1]) частота подвывихов и вывихов бедер варьирует от 2,6 до 28 % [3]. В настоящее время концепция оперативного лечения таких ортопедических осложнений подразумевает выполнение многоуровневых одномоментных вмешательств, сопровождающихся реконструкциями тазобедренного сустава (бедренного и ацетабулярного компонента), тено- и апоневротомиями в области тазобедренного, коленного и голеностопного суставов, пересадками сухожилий [3, 4]. Объем оперативного вмешательства и, соответственно, выраженный болевой синдром в сочетании с эмоциональной возбудимостью детей способствуют резкому увеличению спастичности мускулатуры, которая, в свою очередь, увеличивает болевой синдром. Для предотвраще- ния данной ситуации необходимы особые требования к сопровождению данной категории пациентов в раннем послеоперационном периоде и наблюдение в первые сутки в отделении реанимации и интенсивной терапии (ОРИТ) [5]. Вышесказанное заставляет рассматривать вопросы седативной терапии и послеоперационного обезболивания в едином комплексе, персонализировать выбор седативных препаратов в ОРИТ с учетом их фармакокинетическими и фармакодинамическими свойствами, а также сопутствующей патологии пациентов.
Цель работы – проведение сравнительной оценки седативного эффекта дексмедетомидина и мидазолама в раннем послеоперационном периоде в отделении реанимации и интенсивной терапии у детей с ДЦП после выполнения многоуровневых одномоментных вмешательств, сопровождающихся реконструктивными вмешательствами на тазобедренном суставе.
Ш Евреинов В.В., Томов А.Д., Попков Д.А. Оценка эффективности седатации у детей с ДЦП в раннем послеоперационном периоде после многоуровневых одномоментных оперативных ортопедических вмешательств // Гений ортопедии. 2015. № 4. С. 36-41.
МАТЕРИАЛЫ И МЕТОДЫ
В данном проспективном исследовании все дети (14 человек – 8 девочек, 6 мальчиков), страдающие спастической диплегией тяжелой формы, имели одно- или двусторонние вывихи и подвывихи бедер (у четырех пациентов были выполнены вмешательства только на одной стороне, у 10 – последовательно с обеих сторон, с интервалом не менее 30 дней), по поводу которых было произведено, в общей сложности, 24 многоуровневых оперативных вмешательства. С точки зрения двигательных возможностей по GMFCS пациенты относились к IV уровню в 12 случаях и к V уровню в 2 случаях. В таблице 1 представлены элементы оперативного вмешательства, выполненные у пациентов в различных группах.
Все пациенты в зависимости от вида послеоперационной седатации в отделении реанимации и интенсивной терапии были разделены на 3 группы, сопоставимые между собой по возрасту, полу и объему хирургического вмешательства. В группе 1 седатация в послеоперационном периоде не проводилась, в группе 2 осуществлялась дексмедетомидином, в группе 3 – мидазоламом. Средний вес по группам составлял 18 кг, 16,25 кг и 14,75 кг соответственно. Возраст на момент вмешательства варьировал от 4 до 12 лет, составляя в среднем 7,1 года для первой группы, 7,6 года – для второй и 7,1 – для третьей. Рандомизацию на группы проводили методом таблицы случайных чисел. Оценка глубины седатации, а также эффективность аналгезии проводилась четырехкратно за сутки: через 2, 6, 10, 18 часов после оперативного вмешательства.
Операционно-анестезиологический риск по классификации американской ассоциации анестезиологов (ASA) у 11 пациентов соответствовал 2 классу, у 3 пациентов 3 классу.
В группе 1 дети были оперированы под общей анестезией с ИВЛ в сочетании с эпидуральной аналгезией ропивокаином 0,5 % в дозе 2 мг/кг, введенным через эпидуральный катетер диаметром G19, установленный на уровне дерматома, соответствующего операции [6, 7]. Использовался набор препаратов, дозы которых рассчитывались, исходя из массы тела: пропофол, фентанил, рокурония бромид, севоран. Фентанил вводился однократно, только на момент интубации трахеи. По окончании операции всех пациентов будили на операционном столе и переводили в отделение реанимации и интенсивной терапии. Послеоперационное обезболивание в ОРИТ проводилось посредством введения в эпидуральное пространство через катетер ропивокаина 0,2 % в дозировке 0,3 мг/кг/час с помощью эластомерной помпы или дозатора для микроструйного введения лекарств [8, 10-12]. Седатация не проводилась.
В группе 2 анестезиологическое пособие при оперативных вмешательствах и послеоперационное обезболивание было идентичным группе 1. Седатация в раннем послеоперационном периоде в отделении реанимации и интенсивной терапии проводилась дексмедетомидином
20 % путем внутривенного введения раствора (200 мкг дексмедетомидина, разведенного в 38 мл физиологического раствора) с помощью микроструйного дозатора со скоростью 0,4 мкг/кг/час [9, 13, 14]. Дексмедетомидин (дексдор) является селективным агонистом α2-адренорецепторов с широким спектром фармакологических свойств. Обладает симпатолитическим эффектом, реализующимся за счет снижения высвобождения норадреналина симпатическими нервными окончаниями. Седативный эффект опосредован снижением возбуждения в голубоватом месте – ядре с преобладанием норадренергических нейронов, расположенном в стволе головного мозга.
В группе 3 также интраоперационное и послеоперационное обезболивание было подобно обезболиванию пациентов 1-й и 2-й групп. Седатация в раннем послеоперационном периоде в отделении реанимации и интенсивной терапии проводилась мидазоламом 0,5 % путем внутривенного введения раствора (5 мг мидазолама, разведенного в 19 мл физиологического раствора) с помощью микроструйного дозатора со скоростью 0,04 мг/кг/час [15]. Мидазолам – это бензодиазепин короткого действия, стимулирующий ионотропные рецепторы ГАМК, расположенные в центральной нервной системе. Мидазолам (дормикум) связывается с рецепторами бензодиазепинов на каналах для ионов хлора, что приводит к активации рецептора ГАМК и снижению возбудимости подкорковых структур головного мозга. Вследствие этого мидазолам оказывает седативное и снотворное действие, а также анксиолитическое, противосудорожное и центральное миорелаксирующее действие.
Добровольное письменное согласие на седатацию дексмедетомидином или мидазоламом в раннем послеоперационном периоде в отделении реанимации и интенсивной терапии от родителей или официальных опекунов получено.
Кроме того, у больных всех групп в динамике контролировали ЧСС, АД, SpO2, показатели крови.
Для оценки послеоперационной аналгезии использовали рейтинговую шкалу оценки боли по изображению лица Вонга-Бейкера для детей старше 3 лет, объективную шкалу боли Hanallah и соавторов для оценки послеоперационной боли, шкалу боли Riley [16, 17, 18]. Для оценки степени седации в раннем послеоперационном периоде использовали шкалу Ramsay, шкалу оценки возбуждения – седатации Richmond [19, 20, 21]. Все исследования по шкалам проводили через 2, 6, 10 и 18 часов после операции – в период пребывания ребенка в отделении реанимации и интенсивной терапии.
Статистические исследования проводились с применением программы Attestat®. Для описательной статистики были определены средние значения показателей и их стандартные отклонения. Сравнение между выборками осуществлялось с применением критериев Стьюдента и Манна-Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всех группах в послеоперационном периоде средний объем инфузионно-трансфузионных средств составил 1018,4±180 мл. Дренажная кровопотеря была в среднем 103,3±23,96 мл. В течение 1-х суток послеоперационного периода больные получали стандартную инфузионную терапию, в состав которой входили кристаллоидные растворы, коллоидные препараты. Донорскую эритроцитарную массу применяли у 3 больных. Судя по диурезу и ЦВД, значимой гиповолемии, которая могла бы влиять на показатели гемодинамики, у детей в 1-е сутки после операции не было.
В 1-й группе у детей после пробуждения и на всем протяжении до конца нахождения в ОРИТ был достоверно учащен пульс: ЧСС через 2 часа – 123±16,5 в ми- нуту, через 6 часов – 116±20 в минуту, через 10 часов – 112,6±11,8 в минуту, через 18 часов – 119,6±14 в минуту. Средние значения АД составили: через 2 часа САД – 130±0,08 мм рт. ст., ДАД – 71,3±9,8 мм рт. ст., через 6 часов САД – 134,3±12,1 мм рт. ст., ДАД – 66,7±5,7 мм рт. ст., через 10 часов САД – 131,3±11,6 мм рт. ст., ДАД – 68±7,2 мм рт. ст., через 18 часов САД – 136,3 мм рт. ст., ДАД – 74,3±5,1 мм рт. ст.
Интенсивность боли по шкале Вонга-Бейкера составила: через 2 часа – 0,75±0,7 балла, через 6 часов – 0,75±0,7 балла, через 10 часов – 0,5±0,5 балла, через 18 часов – 0,87±0,35 балла; по шкале Riley – 3,75±2,54 балла, 3,12±2,1 балла, 3,71±2,56 балла, 1,87±1,8 балла и по шкале Hanallah – 2±1,19 балла, 1,6±1,18 балла, 1,25±0,7 балла, 1,12±0,6 балла соответственно, что расценивалось как отсутствие боли или незначительная болезненность.
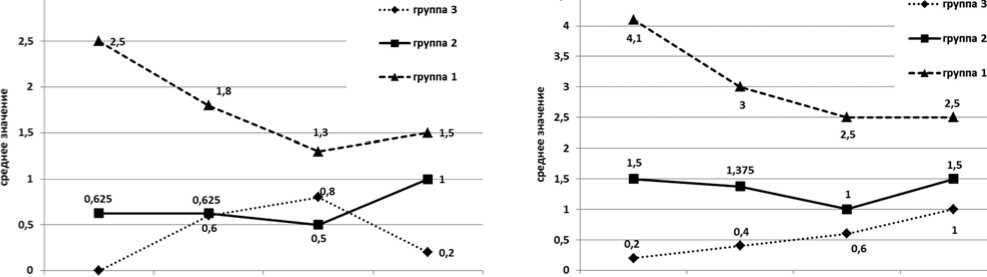
У пациентов 2-й группы, у которых седатация обеспечивалась дексмедетомидином, не наблюдалось учащения пульса (табл. 1) по отношению к первой группе, а показатели артериального давления не увеличивались. При оценке боли получены следующие результаты: по шкале Вонга-Бейкера через 2 часа – 0,5±0,75 балла, через 6 часов – 0,25±0,46 балла, через 10 часов – 0,25±0,46 балла, через 18 часов – 0,5±0,75 балла; по шкале Riley (рис. 1) – 1,5±1,5 балла, 1,37±1,3 балла, 1±1,19 балла, 1,5±1,41 балла; по шкале Hanallah (рис. 2) – 0,63±0,9 балла, 0,63±0,9 балла, 0,5±0,75 балла, 0,75±1,16 балла, что интерпретировалось как полное отсутствие боли.
В 3-й группе пациентов, седатированных мидазоламом, отмечено также достоверное снижение ЧСС, САД и ДАД по отношению к контрольной группе, но менее выраженное по отношению ко 2-й группе (табл. 2). При оценке боли по шкалам получены следующие результаты: по шкале Вонга-Бейкера 0 баллов за все время наблюдения, по шкале Riley через 2 часа – 0,13±0,35 балла, через 6 часов – 0,25±0,7 балла, через 10 часов – 0,63±0,91 балла, через 18 часов – 0,63±1,76 балла; по шкале Hanallah – 0 баллов, 0,63±0,91 балла, 1±1,06 балла, 0,13±0,35 балла, что соответствует полному отсутствию боли.
Таблица 1
Показатели гемодинамики в раннем послеоперационном периоде в исследуемых группах
|
Время |
Группа |
САД мм рт. ст. |
ДАД мм рт. ст. |
ЧСС в мин. |
|
Через 2 часа |
1 группа |
130,3±0,08 |
71,3±9,8 |
123±16,5 |
|
2 группа |
110,8±4,4 |
67,7±11,09 |
101,5±17,1 |
|
|
3 группа |
107,4±9,5 |
63,2±15,6 |
118±9,9 |
|
|
Через 6 часов |
1 группа |
134,3±12,1 |
66,7±5,7 |
116±20 |
|
2 группа |
100,4±12,7 |
55±8,2 |
93,1±11,6 |
|
|
3 группа |
107,4±14,05 |
67,4±13,1 |
119±13,1 |
|
|
Через 10 часов |
1 группа |
131,3±11,6 |
68±7,2 |
112,6±11,8 |
|
2 группа |
104,3±17,4 |
56,7±8.7 |
93,7±14,4 |
|
|
3 группа |
106,4±14,2 |
57,8±9,4 |
115,4±14,05 |
|
|
Через 18 часов |
1 группа |
136,3±10 |
74,3±5,1 |
119,6±14 |
|
2 группа |
98,6±8,2 |
54±9,4 |
101,1±10,6 |
|
|
3 группа |
107,2±9,5 |
70,2±10,8 |
120,6±4,7 |
Таблица 2
Элементы оперативных вмешательств
|
Элемент вмешательства |
Группа 1 |
Группа 2 |
Группа 3 |
|
Деротационно-варизирующая остеотомия бедра |
8 |
8 |
8 |
|
Ацетабулопластика |
3 |
3 |
4 |
|
Теномиотомия аддукторов |
6 |
7 |
6 |
|
Удлинение сгибателей коленного сустава |
4 |
5 |
5 |
|
Низведение надколенника |
4 |
4 |
5 |
|
Апоневротомия икроножных мышц |
7 |
6 |
6 |
|
Пересадка сухожилий на стопе |
3 |
2 |
3 |
|
Артроэрез по Grice |
3 |
2 |
2 |
|
Подтаранный артродез |
0 |
2 |
0 |
|
Коррекция hallux valgus |
0 |
2 |
0 |
S т------------------------------------------------------------ 4,5
Через 2 часа Через 6 часов Через 10 часов Через 18 часов Через 2 часа Через 6 часов Через 10 часов Через 18 часов
Рис. 1. Оценка болевого синдрома по шкале Hanallah Рис. 2. Оценка болевого синдрома по шкале Riley
После перевода из операционной в отделение реанимации и интенсивной терапии параллельно с оценкой боли проводилась оценка степени седатации. Балльная оценка седатации с динамикой по времени для каждой группы представлена в таблице 3.
В группе 1 пациенты за весь период наблюдения бодрствовали, были беспокойны, взволнованны. За время нахождения в ОРИТ пациенты группы 2 были сонливы, не полностью бдительны, реагировали открыванием глаз на голос. В третьей группе все пациенты находились в состоянии легкой седатации, дремали, но реагировали на прикосновение или громкий звук. В группах 2 и 3 в период через 2, 6 и 10 часов после операции уровень седатации был достоверно выше, чем в контрольной группе. В более позднее время (18 часов после операции) не было различий по уровню седатации между первой и второй группой при оценке по шкале Richmond и первой и третьей группой – по шкале Ramsay (табл. 3).
Таблица 3
Изменения оценки степени седатации в раннем послеоперационном периоде в группах
|
Группа |
2 часа |
6 часов |
10 часов |
18 часов |
||||
|
Шкала Ramsay |
Шкала Richmond |
Шкала Ramsay |
Шкала Richmond |
Шкала Ramsay |
Шкала Richmond |
Шкала Ramsay |
Шкала Richmond |
|
|
Группа 1 |
1,8±0,46 |
0,6±0,74 |
1,9±0,83 |
0,0±0,53 |
2,3±1,04 |
0,4±0,52 |
2,4±1,06 |
-0,5±0,93 |
|
Группа 2 |
3,8±0,461sw |
-1,5±0,761sw |
3,9±0,351sw |
-1,8±0,461sw |
3,5±1,071sw |
-1,8±0,461sw |
3,5±0,761sw |
-1,5±1,20 |
|
Группа 3 |
4,0±0,761sw |
-2,1±0,831sw |
3,3±1,491s |
-1,9±0,831sw |
4,0±1,411sw |
-2,4±0,741sw |
3,5±1,19 |
-1,9±0,831sw |
Примечание: 1 – достоверная разница с группой 1 (p<0,05), S – достоверная разница по критерию Стьюдента, w – достоверная разница по критерию Манна-Уитни.
ДИСКУССИЯ
Реконструктивные оперативные вмешательства при подвывихах и вывихах бедра у детей с тяжелыми формами детского церебрального спастического паралича являются необходимостью и имеют целью предотвратить раннее развитие коксартроза, протекающего со значительным болевым синдромом, облегчить уход за ребенком, улучшить или создать условия для возможности сидения и вертикали-зации такого пациента, ликвидировать неудобства укладки пациента, ведущие часто к трофическим нарушениям, а в некоторых случаях – вернуть ребенку способность самостоятельно передвигаться с использованием вспомогательных средств [22, 23]. Столь сложные и травматичные вмешательства выполняются, как правило, у детей, имеющих ряд сопутствующих хронических заболеваний внутренних органов, что требует поиска путей снижения тяжести оперативного вмешательства и оптимизации анестезиологического пособия, а также седатации в раннем послеоперационном периоде [2, 5, 24, 25]. Особенно это необходимо при выполнении одномоментных многоуровневых оперативных вмешательств у детей с тяжелыми формами спастического паралича (SEMLS – single-event multilevel ortopaedic surgery), подразумевающих две и более хирургических процедуры на сухожильно-мышечном аппарате и/или костях двух и более анатомических областей во время одного оперативного вмешательства, одной госпитализации, сопровождающейся одним ранним реабилитационным периодом [26, 27]. Проведение адекватной седа-тации в раннем послеоперационном периоде способствует уменьшению спастичности у детей с церебральным параличом, что, в свою очередь, способствует снижению болевого синдрома и обеспечивает раннее начало реабилитационных мероприятий, являющихся основополагающим нехирургическим компонентом системы многоуровневых одномоментных оперативных вмешательств у пациентов с ДЦП [22, 26, 27].
Целью седативной терапии в ОРИТ является обеспечение физического и психологического комфорта [28, 29, 30]. Психомоторное возбуждение у детей с тяжелыми нарушениями психического развития при отсутствии или недостаточной седатации осложняет ранний послеоперационный период, увеличивает риск самопроизвольного удаления катетеров, дренажей и подвергает непосредственной опасности самих пациентов [17, 30]. Наконец, недостаточная седатация может оставить у пациентов стойкие травмирующие воспоминания о пребывании в ОРИТ [13].
Ранее проведенные исследования показали эффективность дексмедетомидина и мидазолама с точки зрения проведения седативной терапии в раннем послеоперационном периоде у кардиохирургических пациентов [14].
В нашем исследовании мы также обнаружили достоверно высокий уровень седатации у данной категории пациентов после выполнения объемных оперативных вмешательств. Применяемые при исследовании дексмедетомидин и мидазолам обеспечивали необходимую степень седатации при минимальных эффективных дозировках в условиях продленной эпидуральной аналгезии.
С другой стороны, в нашей серии не удалось выявить различий в седативном эффекте между исследуемыми препаратами. В группах 2 и 3 была достигнута легкая или умеренная степень седации у детей с ДЦП на протяжении раннего послеоперационного периода.
Важно отметить, что ни у одного из пациентов, получавших дексмедетомидин и мидазолам в описанных выше дозировках в раннем послеоперационном периоде через микроструйный дозатор, не выявлено эпизодов угнетения дыхания, не получено каких-либо значимых осложнений в виде гипотонии или брадикардии.
ВЫВОДЫ
-
1. Дексмедетомидин и мидазолам являются эффективными препаратами, используемыми для достижения легкой или средней степеней седатации в ОРИТ у
- детей с ДЦП после многоуровневых одномоментных оперативных ортопедических вмешательств.
-
2. В нашем исследовании достоверных преимуществ
-
3. Оба препарата могут быть использованы для се-
- датации детей со спастическими формами ДЦП сразу же после перевода из операционной в ОРИТ в раннем послеоперационном периоде.
между дексмедетомидином и мидазоламом в достижении поверхностной седатации у детей с ДЦП не выявлено.
Список литературы Оценка эффективности седатации у детей с ДЦП в раннем послеоперационном периоде после многоуровневых одномоментных оперативных ортопедических вмешательств
- Development and reliability of a system to classify gross motor function in children with cerebral palsy/R. Palisano, P. Rosenbaum, S. Walter, D. Russell, E. Wood, B. Galuppi//Dev. Med. Child.Neurol. 1997. Vol. 39, No 4. P. 214-223.
- Irgens L.M. The Medical Birth Registry of Norway. Epidemiological research and surveillance throughout 30 years//Acta Obstet. Gynecol. Scand. 2000. Vol. 79, No 6. P. 435-439.
- Long term follow-up after one-stage reconstruction of dislocated hips in patients with cerebral palsy/W.N. Sankar, D.A. Spiegel, J.R. Gregg, B.J. Sennett//J. Pediatr. Orthop. 2006. Vol. 26, No 1. P. 1-7.
- McNerney N.P., Mubarak S.J., Wenger D.R. One-stage correction of the dysplastic hip in cerebral palsy with the San Diego acetabuloplasty: results and complications in 104 hips//J. Pediatr. Orthop. 2000. Vol. 20, No 1. P. 93-103.
- Попков Д.А., Попков А.В., Аранович А.М. Сравнительное исследование результатов реконструктивных вмешательств на 45 тазобедренных суставах у 25 детей со спастическим церебральным параличом//Гений ортопедии. 2013. № 1. С. 48-54.
- Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеоперационной анальгезии//Анестезиология и реаниматология. 1998. № 5. С. 11-15.
- Diordiev A.V., Aizenberg V.L. Peripheral regional block role in orthopedics in pediatric patients with cerebral palsy//Anesteziol. Reanimatol. 2013. No 1. P. 45-48.
- Гельфанд Б.Р., Кириенко П.А., Черненко Л.Ю. Постоперационное обезболивание//Рус. мед. журн. 2003. № 12. С. 707-713.
- Козлов И.А. Агонист альфа 2 адренорецепторов дексмедетомидин в практике современной седации//Общая реаниматология. 2013. № 2. С. 55-65.
- Овечкин А.М., Морозов Д.В., Жарков И.П. Контролируемое обезболивание и седация в послеоперационном периоде: реалии и возможности//Вестн. интенсив. терапии. 2012. № 4. С. 1-12.
- Буров Н.Е. Послеоперационное обезболивание//Рус. мед. журн. 2003. № 21. С. 1172-1177.
- Effectiveness of an anesthetic continuous-infusion device in children with cerebral palsy undergoing orthopaedic surgery/K. Muthusamy, S.M. Recktenwall, R.M. Friesen, J. Zuk, J. Gralla, N.H. Miller, J.L. Galinkin, F.M. Chang//J. Pediatr. Orthop. 2010. Vol. 30, No 8. P. 840-845.
- Keating G.M., Hoy S.M., Lyseng-Williamson K.A. Dexmedetomidine: a guide to its use for sedation in the US//Clin. Drug Investig. 2012. Vol. 32, No 8. P. 561-567.
- Еременко А.А., Чернова Е.В. Применение дексмедетомидина для внутривеннойседации и лечения делирия в раннем послеоперационном периоде у кардиохирургических пациентов//Анестезиология и реаниматология. 2013. № 5. С. 4-7.
- A pharmacokinetic study of midazolam in paediatric patients undergoing cardiac surgery/H.M. Mathews, I.W. Carson, S.M. Lyons, I.A. Orr, P.S. Collier, P.J. Howard, J.W. Dundee//Br. J. Anaesth. 1988. Vol. 61, No 3. P. 302-307.
- Wong’s Essentials of Pediatric Nursing/D.L. Wong, M. Hockenberry-Eaton, D. Wilson, M.L. Winkelstein, P. Schwartz. 6th ed. St. Louis: Mosby Inc., 2001. P. 1301.
- Comparison of caudal and ilioinguinal/iliohypogastric nerve blocks for control of post-orchiopexy pain in pediatric ambulatory surgery/R.S. Hanallah, L.M. Broadman, A.B. Belman, M.D. Abramowitz, B.S. Epstein//Anesthesiology.1987. Vol. 66, No 6. P. 832-834.
- Reliability and validity of preverbal pain assessment tools/B.A. Joyce, J.G. Schade, J.F. Keck, J. Gerkensmeyer, T. Raftery, S. Moser, G. Huster//Issues Compr. Pediatr. Nurs.1994. Vol. 17, No 3. P. 121-135.
- Controlled sedation with alphaxalone-alphadolone/M.A. Ramsay, T.M. Savege, B.R. Simpson, R. Goodwin//Br. Med. J. 1974. Vol. 2, No 5920. P. 656-659.
- The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients/C.N. Sessler, M.S. Gosnell, M.J. Grap, G.M. Brophy, P.V. O’Neal, K.A. Keane, E.P. Tesoro, R.K. Elswick//Am. J. Respir. Crit. Care Med. 2002. Vol. 166, No 10. P. 1338-1344.
- Monitoring sedation status over time in ICU patients: reliability and validity of the Richmond Agitation-Sedation Scale (RASS)/E.W. Ely, B. Truman, A. Shintani, J.W. Thomason, A.P. Wheeler, S. Gordon, J. Francis, T. Speroff, S. Gautam, R. Margolin, C.N. Sessler, R.S. Dittus, G.R. Bernard//JAMA. 2003. Vol. 289, No 22. P. 2983-2991.
- Krebs A., Strobl W.M., Grill F. Neurogenic hip dislocation in cerebral palsy: quality of life and results after hip reconstruction//J. Child. Orthop. 2008. Vol. 2, No 2. P. 125-131.
- Popkov D., Journeau P., Popkov A. Comparative study on results of reconstructive surgery in 45 hip joints of 25 children with cerebral palsy//Eur. Orthop. Traumatol. 2014. Vol. 5, No 1. P. 57-63.
- Bladder and bowel control in children with cerebral palsy: case-control study/M. Ozturk, F. Oktem, N. Kisioglu, M. Demirci, I. Altuntas, S. Kutluhan, M. Dogan//Croat. Med. J. 2006. Vol. 47, No 2. P. 264-270.
- Burns A.M., Shelly M.P., Park G.R. The use of sedative agents in critically ill patients//Drugs. 1992. Vol. 43, No 4. P. 507-515.
- Результаты многоуровневых одномоментных оперативных вмешательств у пациентов с детским церебральным параличом/А.М. Аранович, А.В. Попков, А.А. Щукин, С.Н. Медведева, В.В. Евреинов, А.Н. Третьякова, А.Г. Третьякова, А.Г. Зыков, О.В. Климов, Э.М. Парфенов, P. Lascombes, Д.А. Попков//Гений ортопедии. 2013. № 4. С. 53-59.
- Single-event multilevel surgery for children with cerebral palsy: a systematic review/J.L. McGinley, F. Dobson, R. Ganeshalingam, B.J. Shore, E. Rutz, H.K. Graham//Dev. Med. Child. Neurol. 2012. Vol. 54, No 2. P. 117-128.
- Козлов И.А. Современные подходы к седации в отделениях реанимации и интенсивной терапии//Неотложная медицина. 2013. № 1. С. 22-31.
- Riker R.R., Fraser G.L. Adverse events associated with sedatives, analgesics, and other drugs that provide patient comfort in the intensive care unit//Pharmacotherapy. 2005. Vol. 25, No 5. Pt. 2. P. 8S-18S.
- Dexmedetomidine vs midazolam for sedation of critically ill patients: a randomized trial/R.R. Riker, Y. Shehabi, P.M. Bokesch, D. Ceraso, W. Wisemandle, F. Koura, P. Whitten, B.D. Margolis, D.W. Byrne, E.W. Ely, M.G. Rocha; SEDCOM (Safety and Efficacy of Dexmedetomidine Compared with Midazolam) Study Group//JAMA. 2009. Vol. 301, No 5. P. 489-499.


