Оценка эффективности воздействия бор-нейтронозахватной терапии на различные опухолевые и нормальную клеточные культуры
Автор: Каныгин Владимир Владимирович, Касатова Анна Исмагиловна, Разумов Иван Алексеевич, Завьялов Евгений Леонидович, Кичигин Александр Иванович, Мухамадияров Ринат Авхадьевич, Таскаев Сергей Юрьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Введение. В Институте ядерной физики им. Г.И. Будкера СО РАН был сконструирован источник нейтронов ускорительного типа с параметрами потока, позволяющими проводить эксперименты по бор-нейтронозахватной терапии (БНЗТ). В основе БНЗТ лежит микроядерная реакция внутри клетки, возникающая в результате поглощения нейтрона стабильным изотопом 10B. Целью исследования явилось определение влияния БНЗТ на опухолевые клеточные линии и на первично-перевиваемую эмбриональную линию с использованием борфенилаланина (BPA), боркаптата (BSH) и липосомального боркаптата в качестве препаратов бора. Материал и методы. Клеточные культуры человека: глиобластома (U87), колоректальная аденокарцинома человека (SW-620), меланома человека (SK-Mel28) и первичная эмбриональная клеточная линия были облучены потоком нейтронов в присутствии препаратов бора с концентрацией 10В 40 мкг/мл. Результаты. Ранних цитотоксических эффектов облучения (через 2-4 ч) в отношении всех 4 линий клеток при окрашивании трипановым синим обнаружено не было. По данным МТТ и клоногенного тестов наиболее выраженное снижение выживаемости после БНЗТ было отмечено для линий SW-620 и U87 вне зависимости от используемого препарата доставки бора. Для линии SK-Mel28 наилучший цитотоксический эффект был достигнут при облучении с липосомальным боркаптатом. Для первично-перевиваемой эмбриональной линии была выявлена высокая токсичность при проведении БНЗТ с препаратами борфенилаланина и боркаптата. Выводы. Анализ полученных данных указывает на эффективность воздействия БНЗТ, проводимой на источнике нейтронов ускорительного типа ИЯФ СО РАН, на опухолевые линии глиобластомы, колоректальной аденокарциномы и меланомы при использовании препаратов борфенилаланин, боркаптат и липосомальный боркаптат.
Бор-нейтронозахватная терапия, ускорительный источник эпитепловых нейтронов, борфенилаланин, боркаптат, липосомы, клеточные линии
Короткий адрес: https://sciup.org/140254509
IDR: 140254509 | УДК: 616-006.04-091.811-08+615.849.12+612.085.2 | DOI: 10.21294/1814-4861-2021-20-3-56-66
Текст научной статьи Оценка эффективности воздействия бор-нейтронозахватной терапии на различные опухолевые и нормальную клеточные культуры
Бор-нейтронозахватная терапия (БНЗТ) – перспективная методика лечения злокачественных опухолей за счет избирательного уничтожения опухолевых клеток без повреждения окружающих нормальных тканей. В основе данного вида терапии лежит ядерная реакция поглощения нейтрона стабильным изотопом 10B, в результате чего возникают альфа-частица (4He) и ядро лития (7Li), которые обладают высоким темпом торможения и малой длиной пробега, что в 93 % случаев сопровождается выделением γ-кванта. Таким образом, основное повреждающее действие реакции не превышает диаметра одной клетки и делает БНЗТ потенциально идеальным способом таргетного поражения опухоли. Для успешной реализации метода БНЗТ нужны препараты бора, которые будут селективно накапливаться в новообразовании в достаточном количестве, и источник, обеспечивающий генерацию нейтронов с энергией, необходимой для бор-нейтронозахватной реакции [1].
Достигнутые параметры получаемого потока эпитепловых нейтронов позволили провести ряд исследований. Было выполнено облучение клеток глиобластомы человека U87 и нормальных мышиных фибробластов в дозах от 1,9 до 4,1 Гр, в ходе чего выявили активацию клеточной гибели по типу некроза. Однако, по мнению авторов, данные дозы не являются терапевтически эффективными, они сделали предположение, что использование препаратов доставщиков бора может улучшить результат [3]. Эксперименты на клеточных культурах глиального ряда U251, T98G и нормальных клетках китайского хомячка CHO-K1 и V79 показали, что поток нейтронов, формируемый на ускорительном источнике эпитепловых нейтронов в присутствии 10В, снижает жизнеспособность и клоногенные свойства опухолевых клеток в 3 раза по сравнению с группой облученных клеток без борфенилаланина (BPA) [4]. Влияние потока нейтронов на клетки глиомы человека U251MG in vitro после предварительного инкубирования с BPA также угнетает клоногенные свойства клеток. [5]. Отмечается, что уменьшение количества колоний происходит с увеличением концентрации бора, наименьшее количество колоний формируется при концентрации 10В 40ppm при использовании BPA. При этом для V79 доля выживших клеток в 4 раза больше, чем для CHO-K1 и U251 [6]. Была доказана эффективность воздействия БНЗТ на клетки глиомы U251 и меланомы SK-Mel28 после обучения на источнике эпитепловых нейтронов ускорительного типа в присутствии BPA в концентрациях 10В 6,25–50 мкг/мл. При этом мощность дозы составила от 2,7 Гр (ОБЭ) до 9,6 Гр (ОБЭ) [7]. Ещё одно исследование проведено на клеточной линии U87, которую предварительно инкубировали с препаратами бора и затем облучали эпитепловыми нейтронами. Проведенная бор-нейтронозахватная терапия приводила к снижению выживаемости клеток более чем в 2 раза в сравнении с контролем и составила 18 % при инкубировании с BPA и 13 % – с боркаптатом (BSH) [8].
Данная работа посвящена изучению влияния БНЗТ на клеточные линии опухолей человека, ранее задействованные в экспериментах: U87 (глиобластома) и SK-Mel28 (меланома), которые чаще всего использовались при БНЗТ [9]. Кроме того, изучали клетки колоректальной аденокарциномы человека SW-620 [10]. В качестве нормальной, нетрансформированной клеточной линии применяли первичную эмбриональную линию. БНЗТ в данном исследовании проведено с использованием общеупотребимых препаратов ВРА и BSH, а также с использованием пегилированных липосом, разрабатываемых для адресной доставки бора в опухолевые клетки.
Целью исследования явилась оценка эффективности бор-нейтронозахватной терапии на различные опухолевые и нормальную клеточные линии, используя обогащенные 10В BPA, BSH и пегилированную липосомальную форму BSH в качестве препаратов бора и уникальный источник нейтронов ускорительного типа ИЯФ СО РАН.
Материал и методы
Культуры клеток глиобластомы человека (U87), колоректальной аденокарциномы человека (SW-620), меланомы человека (SK-Mel28) были получены в ЦКП «Центр генетических ресурсов лабораторных животных» ИЦИГ СО РАН. Первичная неиммортализованная клеточная линия выделена из костно-хрящевой ткани 10-недельного эмбриона, который был получен из Родильного дома № 7 (г. Новосибирск). Ткань механически диспергирована в среде DMEM/F12 и после центрифугирования (10 мин при 1000 об/мин) подвергнута трипсинизации при помощи раствора 1:1 трипсин-версен. Далее клетки культивировали на среде DMEM/F12 (1:1) (Биолот, Россия) с добавлением 10 % фетальной бычьей сыворотки (Gybco,
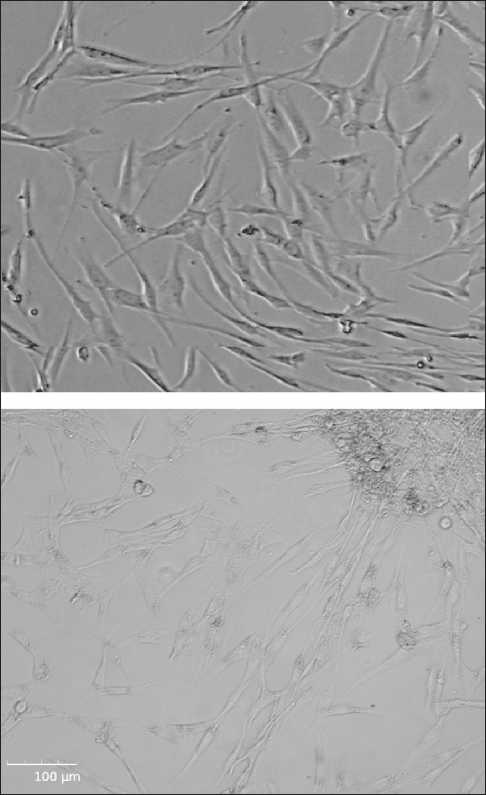
Рис. 1. Прижизненные фотографии клеток первичной эмбриональной линии
Fig. 1. Vital photographs of cells of the primary embryonic cell line
США), с добавлением антибиотика гентамицина 50–100 мкг/мл (Дальхимфарм, Россия) при температуре 37 °С в СО2-инкубаторе с дотацией 5 % СО2. Пересевали клетки, используя раствор трипсин-версен, 2–3 раза в нед в соотношении 1:3–1:5.
На 6-м пассаже провели определение эффективности клонирования, которая составила 25 % (рис. 1). Доля живых клеток от общего числа – 92 %. Среднее время удвоения клеточной популяции – 30 ч, время логарифмической фазы роста – 48 ч. Клетки использовали в эксперименте на 5–7 пассаже в логарифмическую фазу роста.
Для приготовления раствора борфенилалани-на (BPA) на фруктозе использовался L-p-бор-фенилаланин, обогащенный изотопом 10В>99,5 %, (Katchem, Чехия), и фруктоза (Sigma-Aldrich, США) в молярном избытке, согласно протоколу Coderre и др. [11]. Раствор боркаптата натрия (BSH), обогащенный изотопом 10В>99,5 % (Katchem, Чехия), был получен путем разведения в 0,9 % растворе натрия хлорида (Renewal, Россия). Пегилированные липосомы с инкапсулированным обогащенным изотопом 10В боркаптатом получали методом, описанным ранее [12]. Размер и заряд полученных частиц измеряли при помощи прибора ZetasizerNano ZS90 (UK).
Для каждой клеточной культуры была представлена 1 контрольная группа и 4 опытные: группа БНЗТ с BPA, группа БНЗТ с BSH, группа БНЗТ с липосомальным BSH и группа облучения без препаратов бора. За сутки до проведения БНЗТ в опытные группы добавили препараты бора. Концентрации 10В в среде составила 40 мкг/мл. Контрольную группу и опытную группу облучения инкубировали без бора. В каждой группе было по 3 культуральных флакона. По окончании времени инкубации среду заменяли на среду без сыворотки в объеме 55 мл (под горло) и BPA, BSH и липосомальный BSH добавили в концентрации 10В 40 мкг/мл. Горлышко каждого флакона оборачивали парафильмом для герметизации, транспортировали все образцы – как опытные, так и контрольные – в термоизолирующем контейнере, температура в котором находилась в интервале от 26 до 30 °С.
Облучение проводили на ускорительном источнике эпитепловых нейтронов ИЯФ СО РАН [13] при энергии протонов 2,05 МэВ, поток нейтронов располагался в энергетическом диапазоне от 1 до 30 кэВ [14], что является оптимальным для проведения БНЗТ, плотность потока составила 3×108см-2с-1. Интеграл тока протонов и расчетная поглощенная доза представлены в табл. 1. Обратим
Таблица 1/table 1
Параметры облучения клеток на ускорительном источнике эпитепловых нейтронов: интеграл тока и расчетная поглощенная доза
Parameters of cell irradiation using the accelerator-based epithermal neutron source: fluence and calculated absorbed dose
|
Клеточная культура/ Cell culture |
Группа/ Group |
Время (мин)/ Time (min) |
Интеграл тока протонов (мА×ч)/ Integral proton current (mA×h) |
Поглощенная доза (Гр (ОБЭ))/ Absorbed dose (Gy (RBE)) |
|
Без бора/Without boron |
8 мин/8 min |
0,22 |
0,94 |
|
|
BPA |
8 мин/8 min |
0,22 |
6 |
|
|
U87 |
BSH |
8 мин/8 min |
0,22 |
6 |
|
Липосомы с BSH/ Liposomes with BSH |
8 мин/8 min |
0,22 |
6 |
|
|
Без бора/Without boron |
10 мин/10 min |
0,27 |
1 |
|
|
BPA |
8 мин/8 min |
0,22 |
6,1 |
|
|
SW-620 |
BSH |
7 мин/7 min |
0,21 |
5,8 |
|
Липосомы с BSH/ Liposomes with BSH |
7 мин/7 min |
0,22 |
6 |
|
|
Без бора/Without boron |
9 мин/9 min |
0,22 |
1 |
|
|
BPA |
7 мин/7 min |
0,22 |
6 |
|
|
SK-Mel 28 |
BSH |
9 мин/9 min |
0,22 |
6 |
|
Липосомы с BSH/ Liposomes with BSH |
7 мин/7 min |
0,22 |
6 |
|
|
Без бора/Without boron |
10 мин/10 min |
0,27 |
1,1 |
|
|
Эмбриональ- |
BPA |
8 мин/8 min |
0,22 |
2,7 |
|
ные клетки/ |
BSH |
7 мин/7 min |
0,21 |
2,6 |
|
Embryonic cells |
Липосомы с BSH/ Liposomes with BSH |
8 мин/min |
0,22 |
2,7 |

Рис. 2. Позиционирование фантома под мишенью
Fig. 2. Positioning of the phantom under the target внимание на то, что поглощенная доза выражена в единицах Гр (ОБЭ) (в англоязычных статьях часто используют Gy-Eq), полученная умножением поглощенной дозы компонент ионизирующего излучения на соответствующие коэффициенты относительной биологической эффективности или составной биологической эффективности [2].
Образцы помещали в фантом диаметром 200 мм на вращающейся платформе, верхняя плоскость которого находилась на расстоянии 5 мм от полиме-тилметакрилатного замедлителя толщиной 74 мм, установленного под нейтроногенерирующую мишень. Толщина замедлителя выбрана с учетом результатов моделирования, в которых на этой глубине в фантоме показано наилучшее терапевтическое соотношение: отношение поглощенной дозы в опухоли к дозе в здоровых тканях. Рядом с образцами располагали детектор-свидетель – золотую активационную фольгу массой 0,1 г (рис. 2). За один подход облучали по 2 флакона, находящихся ростовой площадкой кверху. Во время облучения температура под мишенью составляла 32 ºС. Контрольные образцы находились в тех же условиях, что и опытные.
Для определения жизнеспособности через 2–4 ч после облучения клетки опытных и контрольных групп снимали с пластика трипсином, в клеточную суспензию добавляли 0,4 % трипанового синего (Applichem, Германия). Подсчёт живых, окрашенных (мертвых) клеток и процент жизнеспособных клеток проводили на автоматическом счетчике клеток Countess (Invitrogen), согласно инструкции производителя. Для проведения других клеточных тестов учитывали только количество живых клеток.
Для определения выживаемости через 96 ч после облучения использовали МТТ-тест. При этом все 4 клеточные культуры высевали в 96-луночные планшеты по 1*104 клеток на лунку по 5 повторов для каждой экспериментальной точки. Через 96 ч в каждую лунку на 100 мкл среды добавляли 20 мкл раствора [3- (4,5-диметилтиазол-2-ил)-5- (3-карбоксиметоксифенил) -2- (4-сульфофенил)-2H] тетразолия с метазульфатом феназина (Cell Titer 96® AQueous One Solution, Promega, США). Планшеты инкубировали в стандартных условиях в течение 2 ч, оптическую плотность измеряли на BioRad iMark Microplate reader при длине волны 490 нм. Данные представлены как процент выживаемости от контроля.
При оценке пролиферативной активности клеток использовали клоногенный анализ. Клетки высевали по 200 на лунку 12-луночного планшета по 4 повтора для каждой экспериментальной точки, что в итоге составило по 12 повторов на каждую группу. Планшеты культивировали в CO2-инкубаторе, мониторируя количество клеток в колониях. На 8–10-е сут в зависимости от линии планшеты промывали физиологическим раствором, клетки фиксировали с помощью 10 % формалина (Panreac AppliChem, Германия), окрашивали раствором Гимза (Sigma, США) и просушивали. Подсчет проводился при помощи светового инвертированного микроскопа Zeiss Primo Vert (Германия), колониями считали те, которые содержали более 50 клеток [15]. Расчеты проводили, используя следующие формулы:
количество колоний Эффективность посева = , количество высеянных клеток эффективность посева эксперимент
Доля выживших клеток =-- —------------------------X 100 % .
эффективность посева контроль
Результаты сравнивали с данными контрольных групп.
Полученные значения выражали как среднее ± стандартное отклонение. Статистическую обработку данных проводили c помощью языка программирования Python 3 (библиотеки Numpy, Scipy) с использованием U-критерия Манна–Уитни при уровне достоверности 95 % (p<0,05).
Результаты
Жизнеспособность клеток после окрашивания трипановым синим в группах опухолевых клеток составила 98–99 ± 1 %, а нормальных клеток – 91 ± 3,6 %, что может быть связано с особенностями культуры. Процент жизнеспособных клеток до и после облучения достоверно не отличался во всех группах клеток (табл. 2).
Через 96 ч после облучения оценивали МТТ-тест для определения функции митохондрий, данные выражали как процент выживаемости относительно необлученного контроля. В группах облучения без препаратов бора выживаемость всех четырех линий значимо не отличалась от контроля, тогда как в группах БНЗТ выживаемость снижалась. В группе БНЗТ с BPA выживаемость значительно снижалась для клеток U87 (63 %), SW-620 (90 %) и эмбриональной неопухолевой первичной
Таблица 2/table 2
Жизнеспособность клеток (окрашивание трипановым синим) оценивали в течение 2–4 ч после облучения
Cell viability (trypan blue staining) assessed within 2–4 hours after irradiation
Клоногенный анализ применяли для оценки пролиферативной функции клеток и их способности образовывать клон после облучения в присутствии бора и без него. Наблюдали за размером колоний и количеством клеток в них. После того, как в необлученной контрольной группе опухолевых линий количество клеток в колонии превысило 50, все группы фиксировали и окрашивали. Первичная линия в силу морфологических особенностей не образовала колоний, которые можно было бы визуально разделить, однако по случайно выбранным полям зрения определялось снижение плотности монослоя (рис. 4)
Доля выживших клеток глиобластомы U87 в группах БНЗТ достоверно уменьшилась более чем в 2 раза: в группе с BPA она составила 29 %, в группе с BSH – 33 %, а в группе липосомального
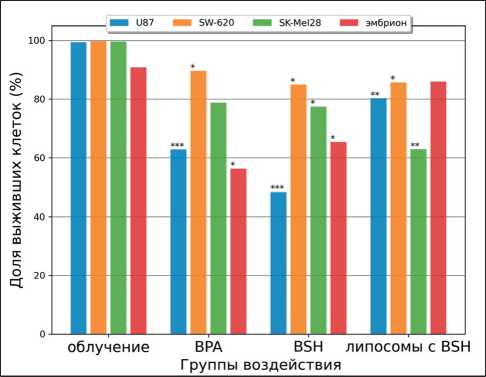
Рис. 3. Определение эффективности воздействия БНЗТ на клетки линий U87, SW-620, SK-Mel 28 и первичную эмбриональную линию при помощи МТТ-теста через 96 ч. Примечание: * – р≤0,05; ** – р≤0,01; *** – р≤0,001 по отношению к группе контроля в отношении каждой линии
Fig. 3. Determination of the effectiveness of BNCT on cell lines U87, SW-620, SK-Mel 28 and the primary embryonic line using MTT-test after 96 hours.
Note: * – p≤0.05; ** – p≤0.01; *** – p≤0.001 in relation to the control group of each line
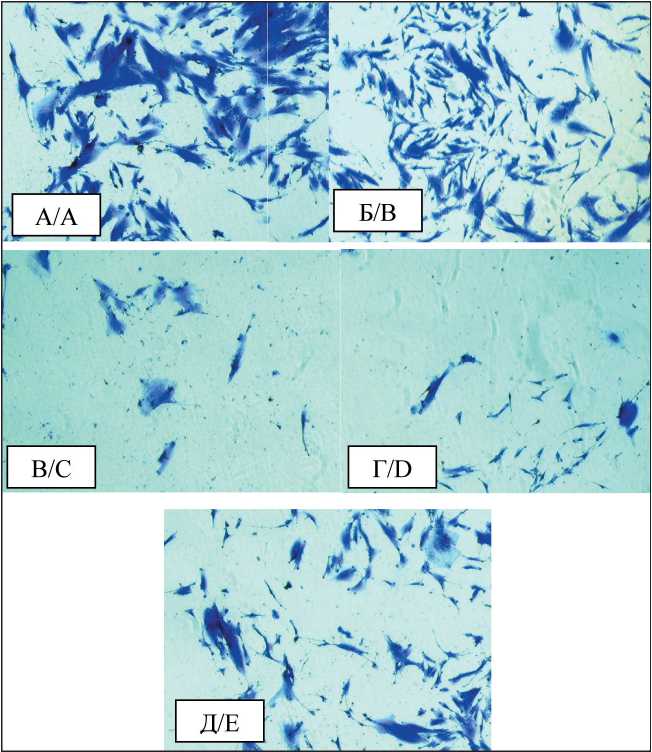
Рис. 4. Фотографии случайно выбранных полей зрения при микроскопическом исследовании первичной эмбриональной линии клеток: А – контроль; Б – облучение; В – БНЗТ с борфенилаланином; Г – БНЗТ с боркаптатом; Д – БНЗТ с липосомальным боркаптатом. Низкая адгезивная способность клеток не позволяет сформироваться колониям, но вместе с тем визуализируется уменьшение плотности клеток в группах после проведения БНЗТ
Fig. 4. Photographs of randomly selected fields of view during microscopic analysis of the primary embryonic cell line: A – control, B – irradiation, C – BNCT with BPA, D – BNCT with BSH, E – BNCT with liposomal BSH. Low adhesive capacity of cells does not allow for colonies, however, a decrease in cell density in groups after BNCT is visualized
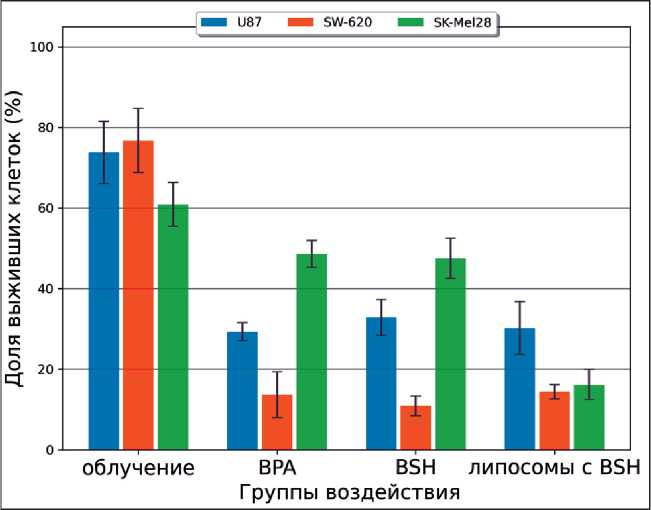
Рис. 5. Результаты клоногенного анализа через 8–10 сут после облучения: на гистограмме показана доля выживших клеток линий U87, SW-620, SK-Mel 28. Все значения, полученные в опытных группах, значимо отличались от группы контроля (p≤0,05)
Fig. 5. Results of clonogenic analysis 8–10 days after irradiation: the histogram shows surviving fraction of cells lines U87, SW-620, SK-Mel 28. All values obtained in the experimental groups differed from those obtained in the control group (p≤0.05)
BSH – 30 %. Жизнеспособность клеток линии колоректальной аденокарциномы SW-620 уменьшилась более чем на 80 % и для групп с BPA, BSH и липосомальным BSH составила 14 %, 11 % и 14 % соответственно. Похожие результаты достигнуты для линии меланомы SK-Mel 28: доля выживших клеток снизилась значительно и составила в группах БНЗТ с BPA – 49 % и с BSH – 48 %. Для этой линии наилучшие значения получены при облучении с липосомальным BSH: доля выживших клеток в этой группе равна 16 % (рис 5).
Обсуждение
В данной работе 3 клеточные культуры, полученные из опухолей человека, были облучены потоком нейтронов в присутствии исследуемых препаратов бора с концентрацией 10В 40 мкг/мл и проведено сравнение эффективности воздействия. Одна из них U87 – глиобластома человека, которая часто используется для создания орто- и гетеротопического ксенотрансплантата глиобластомы у мышей линии SCID и Nu/J [13, 17]. Также использована линия меланомы человека SK-Mel 28, которая продемонстрировала чувствительность к облучению эпитепловыми нейтронами в сочетании с борфенилаланином [7]. Кроме того, была взята линия колоректальной аденокарциномы человека SW-620, так как в исследовании K. Maruyama et al. [17] отмечено эффективное накопление различных липосом, в том числе PEG-липосом с BSH, в клетках мышиной колоректальной карциномы, имплантированной в BALB/c мышей. Первичная линия, имеющая фибробластоподобную морфологию, была выбрана как нормальная, не опухолевая, подходящая, по литературным данным, для того, чтобы оценить эффект воздействия метода не только на опухолевые, но и на здоровые ткани [18, 19].
Все 4 клеточные линии были облучены пучком нейтронов, мощность дозы составила около 1 Гр (ОБЭ), также эти линии были облучены пучком нейтронов в присутствии изотопа 10В, где итоговая доза была около 6 Гр (ОБЭ) для опухолевых линий и 2,6–2,7 Гр для нормальной эмбриональной первичной линии, контрольная группа получила 0 Гр (ОБЭ).
Наибольшая эффективность при БНЗТ получена в отношении линии SW-620. Тест на выживаемость при окраске трипановым синим, проведенный для выявления ранних цитотоксических эффектов, не показал значимых отличий между результатами опытных и контрольной групп. Вместе с тем в МТТ-тесте отмечено достоверное снижение жизнеспособности во всех 3 группах БНЗТ. Клоногенный тест подтвердил долгосрочный эффект БНЗТ – доля выживших клеток составила менее 15 % в группах, облученных с препаратами бора.
Наименьший эффект БНЗТ был отмечен для линии меланомы. Жизнеспособность при окраске трипановым синим в опытных и контрольной группах достоверно не отличалась. МТТ-тест, проведенный через 96 ч после облучения, выявил незначительное снижение функции митохондрий и гибель этих клеток в группе облучения, в то время как липосомальная форма BSH оказалась наиболее токсичной для клеток меланомы. При клоногенном анализе отмечено, что в группах БНЗТ с BPA и BSH доля выживших клеток снизилась лишь на 51,5 и 52,5 % соответственно, однако в группе с липосомальным BSH она снизилась на 84 %. Таким образом, оба теста подтверждают наибольшую эффективность липосомальной формы доставки бора для БНЗТ в сравнении со стандартными борсодержащими препаратами для линии SK-MEL-28.
Напротив, в исследовании A.E. Rossini et al. [20], проведенном на ядерном реакторе RA-3, выживаемость при 2 Гр (ОБЭ) при взаимодействии нейтронов в присутствии борфенилаланина с концентрацией 10В 10 мкг/мл составила 20 % для линии меланомы Mel-J и 4 % для M8. Данные различия могут быть объяснены, во-первых, отсутствием общепринятой методики достоверного измерения поглощенной дозы при недостаточной определенности коэффициентов относительной биологической эффективности или составной биологической эффективности. Во-вторых, особенностями клеточных культур, полученных из разных типов опухолей (Mel-J – метастаз меланомы в легкое, M8 – кожная меланома, SK-MEL-28 – кожная меланома) и от разных пациентов, следовательно, имеющих разные гистотипы, что может влиять на способность накапливать бор [9, 21]. Так, в работе M. Carpano et al. [21] на 3 клеточных линиях меланомы человека был продемонстрирован различный характер накопления бора после инкубации с BPA. Ученые отмечают, что в клинике пациенты, имеющие одинаковый гистологический диагноз «кожная меланома» и одинаковую локализацию опухоли, по-разному отвечают на БНЗТ, что вызывает трудности в стандартизации и оптимизации метода.
В наших предшествующих экспериментах на ускорителе эту линию облучали с BPA с концентрацией 10В 25 мг/мл, мощность дозы составила 5,7 Гр (ОБЭ), в результате чего ни одной колонии образовано не было [7]. Можно предположить, что модель облучения влияет на выживаемость [22], но это требует дальнейшего изучения.
Через 2–4 ч после БНЗТ выживаемость первичной эмбриональной линии при окрашивании трипановым синим в контрольной и опытных группах значительно не отличалась. МТТ-тест показал, что жизнеспособность достоверно снизилась в группах БНЗТ с BPA и BSH. На 10-е сут, когда был закончен клоногенный тест для других клеточных линий, отмечалось уменьшение плотности монослоя и для нормальной линии во всех трех группах БНЗТ, особенно в группах с BPA и с BSH, также изменилась морфология клеток и снизилась степень их адгезии к пластику, что, вероятно, указывает на токсический эффект. Такая высокая радиочувствительность первичной линии может быть связана с тем, что она была получена из эмбриона зародыша [25].
Необходимо отметить, что в группах облучения без препаратов бора также отмечается снижение выживаемости для всех клеточных линий. Это может быть объяснено присутствием гамма-излучения и быстрых и тепловых нейтронов, сопутствующих пучку эпитепловых нейтронов.
В ходе анализа результатов клоногенного теста было выявлено, что доля выживших клеток в опытных группах с препаратами бора снизилась более чем на 50 % для всех трех опухолевых линий, что говорит о значительном влиянии БНЗТ на подавление способности клеток к пролиферации. Эффект БНЗТ на выживаемость клеток линии колоректальной аденокарциномы в клоногенном тесте был наибольший по сравнению с двумя другими опухолевыми линиями. Использование липосомальной формы BSH в качестве агента доставки бора было результативно для линий меланомы. Для других клеточных линий достоверных отличий между используемыми препаратами найдено не было.
Заключение
Полученные in vitro данные говорят об эффективности использования БНЗТ в отношении опухолевых линий глиобластомы, колоректальной аденокарциномы и меланомы с препаратами BPA, BSH и пегилированной липосомальной формы BSH на источнике нейтронов ускорительного типа ИЯФ СО РАН. Снижение выживаемости клеток эмбриональной линии, отмеченное в эксперименте, может быть обусловлено ее высокой радиочувствительностью. Использование инкапсулированного в пегилированные липосомы BSH при проведении БНЗТ значительно снижало выживаемость всех 3
Список литературы Оценка эффективности воздействия бор-нейтронозахватной терапии на различные опухолевые и нормальную клеточные культуры
- Taskaev S.Yu., Kanygin V.V. Bor-neitronozakhvatnaya terapiya. Novosibirsk, 2016. 216 s.
- Sauerwein W.A., Wittig A., Moss R., Nakagawa Y. Neutron Capture Therapy: Principles and Applications. Springer, 2012. 543 p.
- Mostovich L.A., Gubanova N.V., Kutsenko O.S., Aleinik V.I., Kuznetsov A.S., Makarov A.N., Sorokin I.N., Taskaev S.Yu., Nepomnyashchikh G.I., Grigoreva E.V. Effect of Epithermal Neutrons on Viability of Glioblastoma Tumor Cells in Vitro. Bull Exp Biol Med. 2011; 151(2): 264-7. https://doi.org/10.1007/s10517-011-1304-1.
- Volkova O.Yu., Mechetina L.V., Taranin A.V., Zaboronok A.A., Nakai K., Lezhnin S.I., Frolov S.A., Kasatov D.A., Makarov A.N., Sorokin I.N., Sycheva T.V., Shchudlo I.M., Taskaev S.Yu. Vliyanie neitronnogo izlucheniya na zhiznesposobnost' opukholevykh kletok, kul'tiviruemykh v prisutstvii izotopa bora 10V. Vestnik rentgenologii i radiologii. 2016; 97(5): 283-8. https://doi.org/10.20862/0042-4676-2016-97-5-283-288.
- Zaboronok A., Byvaltsev V., Kanygin V., Iarullina A., Kichigin A., Taranin A., Volkova O., Mechetina L., Taskaev S., Muhamadiyarov R., Zavyalov E., Nakai K., Sato E., Yamamoto T., Mathis B., Matsumura A. Boron-neutron capture therapy in Russia: preclinical evaluation of efficacy and perspectives of its application in neurooncology. New Armen Med J. 2017; 11(1): 6-15. https://doi.org/10.18632/oncotarget.24078.
- Sato E., Zaboronok A., Yamamoto T., Nakai K., Taskaev S., Volkova O., Mechetina L., Taranin A., Kanygin V., Isobe T., Mathis B.J., Matsumura A. Radiobiological response of U251MG, CHO-K1 and V79 cell lines to accelerator-based boron neutron capture therapy. J Radiat Res. 2018; 59(2): 101-7. https://doi.org/10.1093/jrr/rrx071.
- Kasatova A.I., Kanygin V.V., Razumov I.A., Taskaev S.Yu., Kasatov D.A., Byval'tsev V.A. Issledovanie biologicheskoi effektivnosti borneitronozakhvatnoi terapii na kletkakh gliomy i melanomy cheloveka. Patologicheskaya fiziologiya i eksperimental'naya terapiya. 2020; 64(3): 110-116.
- Byval'tsev V.A., Zav'yalov E.L., Kanygin V.V., Kasatova A.I., Kichigin A.I., Razumov I.A., Sycheva T.V., Taskaev S.Yu. Tsitopaticheskie effekty bor-neitronozakhvatnoi terapii na uskoritel'nom istochnike epiteplovykh neitronov dlya kul'tury kletok glioblastomy cheloveka. Sibirskii onkologicheskii zhurnal. 2019; 18(4): 34-42. https://doi.org/10.21294/1814-4861-2019-18-4-34-42.
- Barth R.F., Zhang Z., Liu T. A realistic appraisal of boron neutron capture therapy as a cancer treatment modality. Cancer Commun (Lond). 2018 Jun 19; 38(1): 36. https://doi.org/10.1186/s40880-018-0280-5.
- World Health Organization. Cancer; 2018 [Internet]. URL: https://www.who.int/ru/news-room/fact-sheets/detail/cancer (cited 12.09.2018).
- Coderre J.A., Chanana A.D., Joel D.D., Elowitz E.H., Micca P.L., Nawrocky M.M., Chadha M., Gebbers J.O., Shady M., Peress N.S., Slatkin D.N. Biodistribution of boronophenylalanine in patients with glioblastoma multiforme: boron concentration correlates with tumor cellularity. Radiat Res. 1998 Feb; 149(2): 163-70.
- Zavjalov E., Zaboronok A., Kanygin V., Kasatova A., Kichigin A., Mukhamadiyarov R., Razumov I., Sycheva T., Mathis B.J., Maezono S.E.B., Matsumura A., Taskaev S. Accelerator-based boron neutron capture therapy for malignant glioma: a pilot neutron irradiation study using boron phenylalanine, sodium borocaptate and liposomal borocaptate with a heterotopic U87 glioblastoma model in SCID mice. Int J Radiat Biol. 2020 Jul; 96(7): 868-878. https://doi.org/10.1080/09553002.2020.1761039.
- Ivanov A.A., Kasatov D.A., Koshkarev A.M., Makarov A.N., Ostreinov Yu.M., Sorokin I.N., Taskaev S.Yu., Shchudlo I.M. Poluchenie protonnogo puchka s tokom 5 mA v uskoritele-tandeme s vakuumnoi izolyatsiei. Pis'ma v Zhurnal tekhnicheskoi fiziki. 2016; 42(12): 1-8. https://doi.org/10.1134/S1063785016060225.
- Taskaev S.Yu. Uskoritel'nyi istochnik epiteplovykh neitronov. Fizika elementarnykh chastits i atomnogo yadra. 2015; 46(6): 1770-1830. https://doi.org/10.1134/S1063779615060064.
- Franken N.A., Rodermond H.M., Stap J., Haveman J., van Bree C. Clonogenic assay of cells in vitro. Nat Protoc. 2006; 1(5): 2315-9. https://doi.org/10.1038/nprot.2006.339.
- Kanygin V.V., Zav'yalov E.L., Simonovich A.E., Kasatova A.I., Kichigin A.I., Razumov I.A., Taskaev S.Yu. Bor-neitronozakhvatnaya terapiya glioblastomy cheloveka na modelyakh opukholi in vivo. Sovremennye problemy nauki i obrazovaniya. 2019; 1: 16.
- Maruyama K., Ishida O., Kasaoka S., Takizawa T., Utoguchi N., Shinohara A., Chiba M., Kobayashi H., Eriguchi M., Yanagie H. Intracellular targeting of sodium mercaptoundecahydrododecaborate (BSH) to solid tumors by transferrin-PEG liposomes, for boron neutron-capture therapy (BNCT). J Control Release. 2004 Aug 11; 98(2): 195-207. https://doi.org/10.1016/j.jconrel.2004.04.018.
- Honkanen J., Rantanen V., Kulmala J., Grénman R., Klemi P., Pekkola K. Radiosensitivity of dermal and tumor fibroblasts derived from the same patient. J Cancer Res Clin Oncol. 1998; 124(8): 415-20. https://doi.org/10.1007/s004320050193.
- Menichetti L., Gaetano L., Zampolli A., Del Turco S., Ferrari C., Bortolussi S., Stella S., Altieri S., Salvadori P.A., Cionini L. In vitro neutron irradiation of glioma and endothelial cultured cells. Appl Radiat Isot. 2009 Jul; 67(7-8 Suppl): S336-40. https://doi.org/10.1016/j.apradiso.2009.03.058.
- Rossini A.E., Dagrosa M.A., Portu A., Saint Martin G., Thorp S., Casal M., Navarro A., Juvenal G.J., Pisarev M.A. Assessment of biological effectiveness of boron neutron capture therapy in primary and metastatic melanoma cell lines. Int J Radiat Biol. 2015 Jan; 91(1): 81-9. https://doi.org/10.3109/09553002.2014.942013.
- Carpano M., Perona M., Rodriguez C., Nievas S., Olivera M., Santa Cruz G.A., Brandizzi D., Cabrini R., Pisarev M., Juvenal G.J., Dagrosa M.A. Experimental Studies of Boronophenylalanine ((10)BPA) Biodistribution for the Individual Application of Boron Neutron Capture Therapy (BNCT) for Malignant Melanoma Treatment. Int J Radiat Oncol Biol Phys. 2015 Oct 1; 93(2): 344-52. https://doi.org/10.1016/j.ijrobp.2015.05.039.
- Kulmala J., Rantanen V., Pekkola-Heino K., Tuominen J., Grénman R. Dosimetry of irradiation models. The 96-well clonogenic assay for testing radiosensitivity of cell lines. Acta Oncol. 1995; 34(1): 105-9. https://doi.org/10.3109/02841869509093647.
- https://doi.org/A., Kawabata S., Iida K., Yokoyama K., Kajimoto Y., Kuroiwa T., Shirakawa T., Kirihata M., Kasaoka S., Maruyama K., Kumada H., Sakurai Y., Masunaga S., Ono K., Miyatake S. Tumor-specific targeting of sodium borocaptate (BSH) to malignant glioma by transferrinPEG liposomes: a modality for boron neutron capture therapy. J Neurooncol. 2008 May; 87(3): 287-94. https://doi.org/10.1007/s11060-008-9522-8.
- Kanygin V., Zaboronok A., Taskaeva I., Zavjalov E., Mukhamadiyarov R., Kichigin A., Kasatova A., Razumov I., Sibirtsev R., Mathis B.J. In Vitro and In Vivo Evaluation of Fluorescently Labeled BorocaptateContaining Liposomes. J Fluoresc. 2021 Jan; 31(1): 73-83. https://doi.org/10.1007/s10895-020-02637-5.
- Belenko A.A., Vasil'ev S.A., Lebedev I.N. Markery individual'noi radiochuvstvitel'nosti ekstraembrional'nykh kletok zarodyshei cheloveka v usloviyakh in vitro. Ekologicheskaya genetika. 2015; 13(4): 34-36.


