Оценка экспрессии PD-l1 у пациентов с уротелиальным раком, имеющих противопоказания к назначению препаратов платины
Автор: Завалишина Л.Э., Повилайтите П.Е., Раскин Г.А., Андреева Ю.Ю., Петров А.В., Харитонова Е.А., Пугач И.М., Франк Г.А., Румянцев А.А., Тимофеев И.В., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.9, 2019 года.
Бесплатный доступ
Введение. Уротелиальный рак во всем мире находится на 7 и 17 местах среди всех злокачественных опухолей у мужчин и женщин соответственно. Появление новых иммунотерапевтических препаратов открывает новые возможности для лечения таких пациентов, особенно учитывая группу пациентов, имеющих противопоказания к назначению препаратов платины. Применение иммуноонкологических препаратов требует определения экспрессии PD-L1, для которого используются различные диагностические системы. Актуальным является вопрос о сопоставлении результатов определения экспрессии PD-L1 разными методами. Материалы и методы. Исследования проведено на 100 образцах операционного и биопсийного материала уротелиального рака. Для исследования были использованы два клона антител 22C3 и SP142 с соответствующими системами детекции. Оценивалась экспрессия PD-L1 в опухолевых и иммунных клетках. Результаты. Исследование показало высокое совпадение негативного PD-L1 статуса опухоли, выявленного при использовании обоих диагностикумов (92% и 97%) и низкое совпадение результатов по позитивному PD-L1 статусу (67% и 43%)...
Уротелиальный рак, оценка экспрессии pd-l1, ингибиторы контрольных точек, непереносимость препаратов платины
Короткий адрес: https://sciup.org/140243808
IDR: 140243808
Текст научной статьи Оценка экспрессии PD-l1 у пациентов с уротелиальным раком, имеющих противопоказания к назначению препаратов платины
Уротелиальный рак мочевого пузыря во всем мире находится на 7 и 17-м местах среди всех злокачественных новообразований у мужчин и женщин соответственно. С каждым годом частота встречаемости данного злокачественного новообразования в российской популяции возрастает. Выбор вариантов лечения метастатического уротелиального рака, характеризующегося плохим прогнозом, до последних лет был весьма ограничен. Большой проблемой терапии уротелиального рака является также и то, что более 50% пациентов с прогрессирующей уротелиальной карциномой не могут получить высокотоксичную химиотерапию на основе цисплатина в качестве терапии первой линии из-за неудовлетворительного состояния и сопутствующих заболеваний [1]. Замена цисплатина карбоплатином не дает желаемого увеличения эффективности, и, кроме того, 20% больных не могут получить или прерывают лечение карбоплатином [2]. Новым подходом к терапии этих злокачественных опухолей стала разработка новых подходов, а именно иммунотерапия, т.е. применение ряда препаратов, влияющих на ключевые точки противоопухолевого иммунитета. Опухолевые клетки умеют уклоняться от иммунной системы организма с помощью различных механизмов, в том числе путем гиперэкспрессии лиганда программированной клеточной смерти PD-L1. Этот процесс как на опухолевых клетках, так и на иммунных клетках микроокружения в различных типах рака, в том числе и в уротелиальном.
Атезолизумаб — первый ингибитор контрольных точек, одобренный для лечения пациентов с местно-распространенным или метастатическим уротелиальным раком после прогрессирования на платиносодержащей химиотерапии. Одобрение атезолизумаба в первой линии терапии больных, которые не подлежат лечению цисплатином, было основано на результатах крупного исследования II фазы IMvigor211, в котором принимали участие 123 пациента из 47 исследовательских центров [3]. Атезолизумаб применяли в стандартной схеме (1200 мг внутривенно каждый 21 день до прогрессирования). Основной конечной точкой, оцениваемой в исследовании, была объективная частота ответа, как во всей популяции больных, так и у пациентов с экспрессией PD-L1. Медиана наблюдения составила 17,2 месяца. Оцененная объективная частота ответа 23% во всей популяции и 28% у пациентов с выраженной экспрессией PD-L1 достоверно превышала исторический контроль. Ответы были долговременными; медиана продолжитель- ности ответа не была достигнута. Медиана общей выживаемости составила 15,9 месяцев [4].
В этом исследовании PD-L1 положительный статус опухоли определяли как наличие 5% и более окрашенных иммунных клеток, инфильтрирующих опухоль. Определение экспрессии PD-L1 проводилось иммуногистохимическим методом с помощью моноклональных антител SP142 (Ventana). Для оценки биомаркеров использовались архивные парафиновые блоки ткани опухоли, фиксированной формалином.
Вторым иммуноонкологическим препаратом, который применяется для терапии этой группы пациентов, стал пембролизумаб [4]. Решение об ускоренном одобрении пембролизумаба в качестве терапии первой линии было принято более года назад на основе результатов 2 фазы клинического исследования KEYNOTE-052 [4]. В нём участвовали 370 пациентов, которым невозможно было назначить лечение на основе цисплатина. Все пациенты получали пембролизумаб (200 мг, внутривенное введение каждые 3 недели). Основной конечной точкой была скорость объективного ответа. При медиане наблюдения 11,5 месяцев показатель объективного ответа составил 28,9%, медиана продолжительности ответа не была достигнута [5]. Медиана общей выживаемости от начала назначения пембролизумаба составила 11,5 месяцев, показатели 6 — и 12-месячной общей выживаемости оказались 67.2% и 47,5% соответственно. PD-L1 в сочетании с положительной оценкой в 10% и более ассоциировался с более высокой частотой ответов (47,3%) и лучшей общей выживаемостью (18,5 месяцев). Частота ответов была существенно выше у пациентов с экспрессией PD-L1 и составила 39%.
В данном исследовании PD-L1- положительный статус опухоли определялся как процентное содержание клеток (опухолевых клеток, макрофагов или лимфоцитов), экспрессирующих PD-L1 в биопсии опухоли в 10% и более. Определение проводилось иммуногистохимическим методом с помощью клона моноклональных антител 22C3 (Agilent Technologies) на тканях, фиксированных формалином и залитых в парафин. Использовался закрытый набор для фармакодиагностики PD-L1 IHC 22C3 PharmDx (Dako, Inc.)
Замена химиотерапии ингибиторами контрольных точек прошла всесторонне успешно. В исследованиях IMvigor210 и KEYNOTE-052 только 8% и 5% пациентов прекратили лечение атезолизумабом и пембролизумабом, соответственно, из-за неприемлемой токсичности. Частота серьезных нежелательных явлений составила 16% для обоих препаратов. Помимо снижения токсичности, применение атезолизумаба и пембролизумаба позволило повысить эффективность за счет увеличения скорости ответа в два раза по сравнению с химиотерапией у всех больных, а у пациентов с наличием позитивного PD-L1 статуса опухоли — в 3 раза. Таким образом, результаты этих клинических исследований показали, что больные, которые ранее не могли получать лечение, теперь получили более эффективную возможность терапии.
Однако эти исследования продемонстрировали и объективные трудности при тестировании статуса PD-L1 у больных уротелиальным раком, которые возникали из-за наличия различных диагностических и аналитических систем, а также инструментальных платформ, на которых проводятся исследования. Кроме того, для различных клонов антител (22С3 и SP142) существуют разные пороговые значения (cut-off) и способы оценки наличия положительной реакции, разработанные производителями диагностических наборов. Не решен однозначно вопрос и о том, в каких клетках необходимо оценивать экспрессию PD-L1 — только в опухолевых (ОК), только в иммунных (ИК), или и в ОК, и в ИК. Рекомендации производителей строго регламентируют применение одного конкретного диагностикума для конкретного лекар- ственного препарата. Поэтому вопрос гармонизации результатов при использовании различных диагностических систем остаётся крайне актуальным, особенно с учетом того, что исследования по гармонизации использования различных диагностических тестов проведены в основном для немелкоклеточного рака легкого, а для уротелиального рака такие исследования немногочисленны и проведены на ограниченных выборках. В настоящее время во многих отделениях патологической анатомии в России имеются в наличии не все автоматизированные платформы и реагенты для in vitro диагностики, а использование всех диагностикумов для каждого случая является финансово затратным. Отсутствие единой методики определения рецептора PD-L1 усложняет процесс отбора пациентов для иммунотерапии уротелиального рака. Отсутствие единых диагностических рекомендаций может отрицательно влиять на выбор терапии и как следствие — на эффективность лечения и выживаемость пациентов. Таким образом, правильная диагностика и, следовательно, правильная терапия не только влияют на эффективность лечения, но и на снижение стоимости лечения. Поэтому актуальным остается вопрос о сопоставлении результатов, полученных с помощью различных диагностикумов, инструментов и систем оценки результатов.
Задачей многоцентрового совместного исследования, проведенного Российским обществом клинической онкологии (RUSSCO) и Российским обществом патологоанатомов, являлось сравнение результатов иммуногистохимической оценки экспрессии PD-L1 опухолевыми и иммунными клетками при использовании диагностических систем (22С3 и SP142) двух производителей (Agilent Technologies и Ventana), применение различных систем оценки результатов тестирования, изучение сопоставимости результатов количественной оценки экспрессии PD-L1 статуса опухоли при использовании различных пороговых значений положительного статуса [6]. В связи с наличием различных cut-off, принятых в настоящее время, и с появлением результатов новых клинических исследований, возможно изменение ныне существующих критериев оценки, поэтому определение фактического количества позитивно окрашенных ОК и ИК с помощью 2 исследуемых антител является актуальной задачей данного исследования.
Материалы и методы
Материалом для исследования послужили 100 образцов операционного и биопсийного материала уротелиального рака мочевого пузыря, предоставленных кафедрой патологической анатомии РМАНПО (60 случаев) и Ростовского патологоанатомического бюро (40 случаев). Пациенты были преимущественно мужского пола (89%), средний возраст — 63 года (29–87 лет), стадия Т1–45% (45/100), Т2–45% (45/100), по степени дифференцировки опухоли в 47% случаев (47/100) были высокодифференцированными (High Grade). Все парафиновые блоки содержали достаточное количество материала для исследования экспрессии белка 2 антителами с использованием как позитивного, так и негативного контролей.
Исследование проводилось иммуногистохимическим методом с использованием набора PD-L1 IHC 22C3 PharmDx (Dako, Inc.) и антител PD-L1 SP142 с системой детекции OptiView DAB IHC Detection Kit c амплификацией сигнала (Ventana Medical Systems, Inc.). С каждого образца опухоли делали по 2 среза для исследования и контрольные срезы для негативного контроля. В качестве контроля применяли стекла c образцами клеточных культур (NCL-H226-позитивная клеточная линия и MCF-7 — негативная клеточная линия), образцы ткани миндалины (для 22С3 и SP142) и плаценты (для SP142) в каждом цикле постановки реакции. Для всех антител применялся автоматизированный метод иммуногистохимического исследования, для 22С3 исследование проводилось на автостейнере Avtostainer Link 48 (ASL48) (Dako, Inc.) с использованием оптимизированного закрытого протокола, заложенного в автоматизированную платформу. Для постановки реакции с антителом SP142 (Ventana Medical Systems, Inc.) использовался иммуногистостейнер VENTANA BenchMark ULTRA (Ventana Medical Systems, Inc.) по протоколам, рекомендованным в инструкциях к антителам и системой внешнего контроля качества NordiQC.
На первом этапе анализа оценивалась правильность окрашивания позитивных и негативных клеточных линий и позитивного тканевого контроля (ткань миндалины и плаценты). Затем проводили оценку иммуногистохимических реакций на образцах уротелиального рака. Для каждого антитела наличие фактической иммуногистохимической реакции как в ОК, так и в ИК оценивали визуально (Manual Scoring), а также оценивали PD-L1 статус опухоли по пороговым значениям (cut-off), рекомендованным в настоящее время для рака мочевого пузыря: 22С3: отношение ОК+ИК, экспрессирующих PD-L1, ко всем клеткам в образце ≥10%, а для SP142: ИК≥5%. Также для каждого из антител применяли точки отсечения в 1%, 10%, 25% и 50% для ОК и ИК.
В соответствии с рекомендациями по оценке результатов экспрессии PD-L1 оценивалось только наличие мембранного окрашивания в опухолевых и иммунных клетках независимо от его интенсивности.
Все полученные препараты анализировались визуально независимо друг от друга 4 патоморфологами и затем сканировались для создания цифрового архива изображений. При расхождении в оценке препаратов специалисты принимали консенсусное решение.
Все полученные результаты были подвергнуты статистической обработке с определением корреляционных коэффициентов Пирсона.
Результаты
В результате иммуногистохимического исследования было получено 200 препаратов с иммуногистохимическими реакциями с 2 антителами 22C3 и SP142.
При использовании cut-off в 1% экспрессии на ОК было выявлено 22 позитивных образца (78 — негативных) при использовании антитела 22C3 и 8 позитивных образцов (92 — негативных) при использовании антитела SP142. При использовании более высоких значений cut-off (10, 25 и 50%) все антитела выявляли 6–7% положительных образцов (6 — SP142, 7–22C3), кроме того, уменьшалось число позитивных образцов при cut-off25 и 50% до 4–5%.
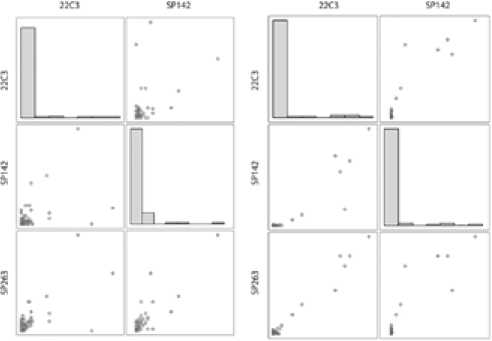
Анализ экспрессии PD-L1 в ИК был проведен с использованием аналогичного подхода. Диагностикум на основе антитела 22С3 идентифитицировал как позитивные 50 образцов из 100 и SP142–42 из 100. Повышение порогового значения для ИК приводило к резкому уменьшению числа позитивных случаев: при 10%-барьере выявлено 3 (SP142) и 6 (22C3) случаев из 100. Дальнейшее повышение пороговых значений приводило к уменьшению позитивных случаев примерно вдвое. Рисунок 1 отражает корреляцию между тестами по экспрессии PD-L1 на ИК и ОК.
После непосредственной оценки на препаратах количества ОК и ИК, окрашенных анти-PD-L1 антителами, PD-L1 статус образца уротелиального рака определяли в соответствии с принятыми в настоящее время cut-off для каждого маркера. Определение PD-L1 статуса опухоли с использованием этих критериев выявило наличие различного количества позитивных случаев при использовании двух анти-PD-L1 антител: для SP142–9% и 22С3–11 % из 100 исследованных случаев. Различалось и количество выявляемых по наличию мембранного окрашивания клеток. Однако
ИММУННЫЕ КЛЕТКИ ОПУХОЛЕВЫЕ КЛЕТКИ
Sutter Hot MMrix
|
2X3 |
5P1« |
|
|
2X3 |
1.00 |
0.50 |
|
SP142 |
030 |
1.00 |
|
S₽X3 |
069 |
035 |
|
2X3 |
«■142 |
|
|
2X3 |
LOO |
0.93 |
|
SP142 |
0.93 |
1.00 |
|
$Р2« |
0.99 |
0.91 |
Рисунок 1.
Таблица 1. Согласие между тестами 22C3 и SP142 в негативных и позитивных случаях на основании стандартных cut-off
Сопоставление результатов PD-L1 статуса, полученного при использовании разных оценочных систем, выявило следующие закономерности:
-
1. Пациенты с негативным статусом по SP142 имеют также негативный статус по 22С3 в 92% случаев;
-
2. Пациенты с негативным статусом по 22С3 имеют также негативный статус по SP142 в 97% случаев;
-
3. Пациенты с позитивным статусом по SP142 имеют также позитивный статус по 22С3 в 67% случаев;
-
4. Пациенты с позитивным статусом по 22С3 имеют также позитивный статус по SP142 в 43% случаев;
Обсуждение
Сложность в тестировании статуса экспрессии PD-L1 при уротелиальном раке обусловлена наличием различных диагностических реагентов, оценочных систем, рекомендациями производителей о жесткой привязке диагностикума к лекарственному препарату. Наличие таких различных подходов обусловливает необходимость исследования конкордантности между различными диагностикумами и изучение возможности использования разных диагностических систем для определения чувствительности к препарату и/или прогноза ответа на терапию [7].
Для немелкоклеточного рака легкого был уже проведен ряд подобных исследований по гармонизации применения диагностических антител — 22C3, 28.8, SP263 и SP142 (исследования Blueprint, Germany Study и др). Анализ этих работ показал сходные результаты, выявившие высокое совпадение данных, полученных с помощью антител 22C3, 28.8 и SP263.
Антитела показали меньшую согласованность результатов с другими антителами, но большую выявляемость экспрессии на ИК по сравнению с другими диагностикумами. Клон SP142 позиционируется как антитело для лучшего обнаружения именно ИК. Для уротелиального рака для SP142 приняты cut-off только для ИК. Системы оценки реакции для клонов 22C3, 28.8, SP263 были в первую очередь валидированы для оценки PD-L1 статуса на ОК.
В представляемом исследовании были изучены 100 образцов уротелиального рака, которые были окрашены с помощью 2 антител — 22C и SP142, применяемых в практике для назначения пембролизумаба и атезолизумаба у больных уротелиальным раком, ранее не получавших терапию и не являющихся кандидатами для лечения препаратами платины. Результаты независимой оценки экспрессии PD-L1 4 патологами были проанализированы как по совпадению выявляемости экспрессии PD-L1 на ИК и ОК разными антителами, так и по совпадению PD-L1 статуса пациентов по критериям cut-off, рекомендованным для каждого теста.
Количество опухолей с позитивным статусом по существующим оценочным критериям составило для SP142–9% и для 22C3–11%. Полученные результаты несколько ниже в сравнении с другими исследованиями [8]. Так, по данным М. Treiakova с соавторами, среди 235 образцов от 156 пациентов с уротелиальным раком были обнаружены 56 позитивных образцов (23,8%). Однако в нашем исследовании не проводился отбор пациентов по другим критериям, кроме наличия уротелиального рака и минимума клинических данных (пол, возраст, стадия и степень дифференцировки опухоли), поэтому меньшее число пациентов с позитивным статусом может быть связано с меньшим количеством исследованных случаев и наличием в представленной выборке Т1 стадии почти в половине образцов (45%). Стоит отметить, что главной целью работы было сравнение уровня экспрессии при использовании различных диагностикумов в одном и том же образце опухоли, поэтому отбор пациентов по стадии или сравнение уровня экспрессии между первичной опухолью и метастазами не представлялись целесообразными, так как не соответствовали основной задаче. Оценка экспрессии в ткани метастазов для чистоты эксперимента (создание однородной группы больных) не проводилась. Нужно подчеркнуть, что в настоящее время как в исследованиях по эффективности ингибиторов контрольных точек, так и в практической деятельности в большинстве случаев оценка экспрессии PD-L1 проводится в ткани первичной опухоли, забор которой для иммуногистохимического анализа является достаточно простым у больных уротелиальным раком [3–6]. Однако возможное появление в будущем данных о дискордантности экспрессии PD-L1 на клетках первичной опухоли и метастазов может повлиять на существующий подход [9].
В нашем исследовании было обнаружено более высокое число окрашенных ИК по сравнению с ОК со всеми маркерами (45% vs 8% SP142, 55% vs 24% 22C3). Коэффициенты корреляции Пирсона были для ИК — 0,5 между SP142/22C3 и для ОК — 0,93. В единственном крупном исследовании по сравнению экспрессии PD-L1, выявляемого различными тестами, М. Treiakova с соавторами указывают коэффициенты корреляции для всех образцов как 0,76–0,9 и 0,69–0, 86 — для позитивных случаев. Наиболее высокое совпадение результатов обнаружено для пар 22С3/28.8 и 28.8/E1L3. N и более низкое для пар 22C3/SP142 и 28.8/SP142, что сходно с результатами, полученными при исследованиях по гармонизации для НМРЛ. Аналогично для ИК наибольшие совпадения были для 22C3/28.8–0,85, 22C3/E1L3. N — 0,74. В целом тест SP142 во всех образцах имел значительно более низкую конкордантность SP142/22C3/28.8/E1L3. N — 0,3–0,38. В нашем исследовании коэффициент корреляции был несколько выше — от 0,5, но также мал для вывода о совпадении результатов. Наш анализ согласованности результатов для негативных и позитивных образцов различался. Так, для негативных образцов по 2 тест-системам было получено высокое совпадение результатов — 0,91 для SP142/22C3. Такие результаты позволяют считать, что оба маркера (22С3 и SP142) при использовании существующих систем оценки достоверно и с разницей менее чем 10% (9% — 0%) позволяют определить пациентов с негативным PD-L1 статусом без проведения повторного исследования с другими маркерами и решить вопрос о лекарственной терапии. При определении согласованности результатов для позитивного PD-L1 статуса опухоли были получены значительные расхождения результатов между 22С3 и SP142–43%. М. Treiakova с соавторами показали схожие результаты. Такое расхождение в выявлении опухолей с позитивным статусом экспрессии не позволяет рекомендовать использование только одного антитела для определения чувствительности к иммунотерапии. При обнаружении позитивного статуса по одному тесту пациент может иметь негативный статус по другому тесту с вероятностью 44–57%.
В заключение надо отметить, что проведенное исследование подтвердило возможность применения двух диагностических систем для определения PD-L1 статуса уротелиального рака с целью определения чувствительности к иммунотерапии. Использование диагностических систем с антителами SP142 и 22C3 по рекомендованным протоколам, системам оценки и инструментальным платформам показало, что при негативном статусе пациента по одному тесту он будет иметь негативный статус и по другому тесту, причем с высокой вероятностью в 97–100%. При обнаружении позитивного статуса по одному тесту пациент может иметь отрицательный статус с другим тестом с вероятностью 44–57%, что позволяет рекомендовать использовать повторное тестирование, особенно в пограничных случаях, с тестом, рекомендованным для предполагаемого к лечению препарата.
Список литературы Оценка экспрессии PD-l1 у пациентов с уротелиальным раком, имеющих противопоказания к назначению препаратов платины
- Tsimafeyeu I, Tjulandin S. First-line checkpoint inhibitors in PD-L1-positive patients with advanced urothelial carcinoma. BJU Int. 2018 Nov 20. 627 DOI: 10.1111/bju.14
- Sonpavde G, Galsky MD, Latini D, Chen GJ. Cisplatin-ineligible and chemotherapy-ineligible patients should be the focus of new drug development in patients with advanced bladder cancer. Clin Genitourin Cancer 2014; 12: 71-73.
- Powles T, Duran I, van der Heijden MS, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet. 2018 Feb 24;391 (10 122):748-757.
- Balar AV, Galsky MD, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet. 2017 Jan 7; 389 (10 064): 67-76.
- Balar AV, Castellano D, O'Donnell PH, et al. First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol. 2017 Nov; 18 (11): 1483-1492.
- Vuky J, Balar AV, Castellano D, O'Donnell PH, et al. Updated efficacy and safety of KEYNOTE-052: A single-arm phase 2 study investigating first-line pembrolizumab (pembro) in cisplatin-ineligible advanced urothelial cancer (UC). Journal of Clinical Oncology 36, no. 15_suppl (May 2018) 4524-4524 DOI: 10.1200/JCO.2018.36.15_suppl.4524
- Zavalishina L, Tsimafeyeu I, Povilaitite P, et al. RUSSCO-RSP comparative study of immunohistochemistry diagnostic assays for PD-L1 expression in urothelial bladder cancer. Virchows Arch. 2018. https://doi.org/10.1007/s00 428-018-2453-7.
- Tretiakova M, Fulton R, Kocherginsky M, et al. Concordance study of PD-L1 expression in primary and metastatic bladder carcinomas: comparison of four commonly used antibodies and RNA expression. Mod Pathol. 2018 Apr;31 (4):623-632.
- Burgess EF, Livasy C, Hartman A, et al. Discordance of high PD-L1 expression in primary and metastatic urothelial carcinoma lesions. Urol Oncol. 2019 Jan 16. pii: S1078-1439 (19) 30 002-X. doi: 10.1016/j.urolonc.2019.01.002. .


