Оценка качества жизни пациентов после открытой реваскуляризации по поводу острой ишемии конечности, развившейся в острой стадии новой коронавирусной инфекции СOVID-19
Автор: Никольский А.В., Кравчук В.Н., Трофимов Н.А., Волков Д.В., Никольский В.О., Гришин В.А., Жидков И.М., Баранова Д.Г.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 3 (89), 2024 года.
Бесплатный доступ
Введение. Острый тромбоз периферических артерий, развивающийся на фоне COVID-19, значительно ухудшает прогноз выживаемости. Открытая реваскуляризация является методом выбора при острой ишемии конечности (ОИК), но в условиях коронавирусной инфекции сопряжена с высоким риском ретромбозов. Цель исследования - оценить качество жизни пациентов, перенесших открытую реваскуляризацию по поводу ОИК в острой стадии COVID-19, в сравнении с пациентами без вирусной инфекции.Материалы и методы исследования. В исследование включены 136 пациентов с ОИК, которым выполнена открытая тромбэктомия, эндартерэктомия и пластика артерий. Группа исследования (n=86) - пациенты с COVID-19, контрольная (n=50) - без инфекции. Качество жизни оценивалось с помощью опросника SF-36 при выписке и через 12 месяцев. Статистический анализ проведен в программной среде "R".Результаты. В раннем послеоперационном периоде качество жизни пациентов с COVID-19 было значимо ниже по 7 из 8 шкал SF-36. Через год показатели улучшились, но не достигли уровня контрольной группы по шкалам физической боли, жизненной силы и ролевого функционирования. Физический и психический компоненты здоровья были ниже на 13 % (р˂0,02) и 10 % (р˂0,01) соответственно.Заключение. COVID-19 негативно влияет на результаты открытой реваскуляризации при ОИК. Качество жизни таких пациентов в отдаленном периоде остается ниже среднепопуляционного, что требует учета при диспансеризации и реабилитации.
Острая ишемия конечности, covid-19, открытая реваскуляризация, качество жизни, опросник sf-36
Короткий адрес: https://sciup.org/142242569
IDR: 142242569 | УДК: 617-089.844:616.13-007.271:578.834.1 | DOI: 10.17238/2072-3180-2024-3-83-94
Текст научной статьи Оценка качества жизни пациентов после открытой реваскуляризации по поводу острой ишемии конечности, развившейся в острой стадии новой коронавирусной инфекции СOVID-19
Пандемия COVID-19 представляет собой беспрецедентный вызов для систем здравоохранения всего мира. Помимо первичного поражения легких, коронавирусная инфекция вызывает каскад патофизиологических процессов, включая гиперкоагуляцию, эндотелиальную дисфункцию и гипервоспалительный ответ [1]. Эти изменения могут приводить к тромбозу периферических артерий и развитию острой ишемии конечностей (ОИК). По данным международных регистров, частота ОИК у пациентов с тяжелым COVID-19 достигает 4–5 %, что в 20 раз выше популяционного уровня [2]. Острый артериальный тромбоз значительно ухудшает прогноз основного заболевания: летальность среди этих пациентов составляет 25–40 % [3].
Хирургическое лечение ОИК на фоне коронавирусной инфекции сопряжено с чрезвычайно высоким риском пе- риоперационных осложнений. Частота ретромбозов после тромбэмболэктомии достигает 50 %, что вынуждает выполнять ампутацию конечности почти у половины больных [4]. Осложненное течение послеоперационного периода может быть связано с проявлениями «цитокинового шторма», нарушениями микроциркуляции и гиперкоагуляционным синдромом, характерными для COVID-19 [5]. В совокупности эти факторы могут существенно снижать качество жизни пациентов, переживших открытую реваскуляризацию.
Оценка качества жизни (КЖ) в современной медицине рассматривается как интегральный показатель эффективности лечения, позволяющий анализировать его результаты с позиции пациента [6]. Наиболее часто для этих целей используется опросник SF-36 (Short Form-36), надежность и валидность которого доказана в сотнях исследований [7]. Несмотря на рост числа работ, изучающих различные аспекты COVID-19, данные о КЖ пациентов, перенесших сосудистые операции на фоне коронавирусной инфекции, остаются крайне ограниченными.
Ранее мы показали, что ОИК при COVID-19 чаще развивается у пациентов с тяжелым течением вирусной пневмонии и множественной сопутствующей патологией [8]. Необходимость экстренной операции на фоне прогрессирующей дыхательной недостаточности и «цитокинового шторма» повышает риск летального исхода в 3 раза по сравнению с пациентами без COVID-19 [9]. Однако отдаленные результаты реваскуляризации, включая оценку КЖ выживших больных, до сих пор не изучались.
Целью настоящего исследования явилась сравнительная оценка качества жизни в раннем и отдаленном периодах у пациентов, перенесших открытую реваскуляризацию по поводу ОИК в острой стадии COVID-19 и без коронавирусной инфекции.
Материалы и методы
Проведено проспективное когортное исследование, включавшее 136 пациентов с ОИК. Критериями включения являлись: ОИК II степени по Резерфорду вследствие острого тромбоза периферических артерий, открытое хирургическое лечение (тромбэктомия, эндартерэктомия, пластика артерий), прогноз выживаемости более 6 месяцев. Группу исследования составили 86 пациентов, оперированных в острой стадии COVID-19, контрольную – 50 больных без коронавирусной инфекции. Выписаны из стационара были 23 пациента группы исследования и 44 пациента контрольной группы. Группы были сопоставимы по возрасту, полу и характеру основного заболевания. Исследование проводилось на базе двух ковид-госпиталей в период с января 2020 по июнь 2023 года. Протокол исследования был одобрен локальным этическим комитетом.
Всем пациентам проводилось комплексное обследование, включавшее сбор анамнеза, физикальный осмотр, лабораторные и инструментальные методы. Диагноз COVID-19 устанавли- вался на основании ПЦР-теста и/или КТ-картины вирусной пневмонии. Для определения степени гипоксемии использовался индекс оксигенации (SpO2/FiO2).
Качество жизни оценивалось с помощью опросника SF-36 (русскоязычная версия, валидизированная Межнациональным центром исследования качества жизни, г. Санкт-Петербург) [10]. Анкетирование проводилось в момент выписки из стационара (ранний послеоперационный период) и через 12 месяцев после операции (отдаленный период). Опросник включает 36 вопросов, сгруппированных в 8 шкал: физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, интенсивность боли, общее состояние здоровья, жизненная активность, социальное функционирование, ролевое функционирование, обусловленное эмоциональным состоянием, психическое здоровье. Показатели каждой шкалы варьируют от 0 до 100, где 100 – полное здоровье. Также рассчитываются два суммарных измерения – физический компонент здоровья (ФКЗ) и психический компонент здоровья (ПКЗ).
Результаты исследования
Средний возраст пациентов составил 66 [62; 70] лет в основной группе и 68,5 [63; 72,8] лет в контрольной (p>0,05). Доля лиц старше 75 лет была значимо выше среди пациентов без COVID-19 (18 % против 14 %, p<0,01). Распределение по полу также было сопоставимым – 67,4 % мужчин в основной группе и 70 % в контрольной (p>0,05).
Локализация артериального тромбоза в исследуемых группах достоверно не различалась (p>0,05). Чаще всего встречалось поражение артерий нижних конечностей – в 67,5 % и 70 % случаев соответственно. Тяжесть ишемии была несколько выше у пациентов с COVID-19 – IIb степень по Резерфорду отмечалась у 32,6% больных против 22% в контрольной группе (p<0,001).
Анализ коморбидного фона выявил сопоставимую частоту кардиоваскулярной патологии (ИБС, фибрилляция предсердий), сахарного диабета и хронической болезни почек (p>0,05 для всех показателей). Единственным значимым отличием было преобладание дыхательной недостаточности среди пациентов с COVID-19 (65 % против 6 %, p<0,001), что объясняется наличием вирусной пневмонии.
Анкетирование по SF-36 в раннем послеоперационном периоде продемонстрировало значимое снижение показателей качества жизни в основной группе по сравнению с контрольной. Различия были статистически значимыми для 7 из 8 шкал опросника (p<0,05). Максимальные отличия отмечались по шкалам ролевого функционирования, обусловленного физическим и эмоциональным состоянием – на 56 % и 61 % соответственно. Суммарные компоненты здоровья – ФКЗ и ПКЗ – были ниже у пациентов с COVID-19 на 24 % (p<0,004) и 28 % (p=0,007) по сравнению с группой контроля.
Через 12 месяцев после операции отмечалась тенденция к улучшению КЖ в обеих группах. Однако у пациентов, перенесших COVID-19, показатели по шкалам физической боли, жизненной силы и ролевого функционирования по-прежнему оставались значимо ниже, чем в контрольной группе (p<0,05). ФКЗ и ПКЗ также не достигли среднепопуляционного уровня – разница составила 13 % (p<0,02) и 10 % (p<0,01) соответственно. Сравнение с данными многоцентрового исследования КЖ среди 5 регионов России [10] показало, что оперированные пациенты в целом имеют более низкое КЖ, чем население. Однако степень отличий была значительно больше у больных, перенесших коронавирусную инфекцию – ФКЗ и ПКЗ были ниже среднепопуляционных значений на 29 % и 25 % против 16 % и 15 % в группе без COVID-19.
Углубленный статистический анализ первичных данных продемонстрировал значимые различия показателей качества жизни между пациентами, перенесшими открытую реваскуляризацию на фоне COVID-19, и контрольной группой без коронавирусной инфекции. В раннем послеоперационном периоде медиана суммарного физического компонента здоровья (ФКЗ) в основной группе составила 36,8 [33,2; 40,4] баллов против 48,5 [44,1; 52,9] в контрольной (p<0,001). Аналогичная тенденция прослеживалась и для психического компонента здоровья (ПКЗ): 39,1 [35,3; 42,9] против 54,3 [49,8; 58,8] баллов соответственно (p<0,001). Различия оставались статистически значимыми и после поправки на возраст, пол, локализацию поражения и коморбидный фон (скорректированное отношение шансов (ОШ) для ФКЗ – 3,62; 95 % доверительный интервал (ДИ) 2,41–5,44; для ПКЗ – ОШ 4,19; 95 % ДИ 2,76–6,36).
Параметрические и непараметрические критерии выявили значимые отличия между группами по всем шкалам опросника SF-36 в раннем послеоперационном периоде (p<0,05). Наибольший разрыв отмечался в доменах ролевого функционирования, обусловленного физическим (РФФ) и эмоциональным состоянием (РФЭ). Так, в основной группе медиана РФФ составила 25,0 [0,0; 50,0] баллов против 75,0 [50,0; 100,0] в контрольной (p<0,001), а РФЭ - 33,3 [0,0; 66,7] против 100,0 [66,7; 100,0] баллов (p<0,001). Существенно ниже в группе пациентов с COVID-19 были показатели общего состояния здоровья (ОЗ) – 35,0 [30,0; 40,0] против 50,0 [45,0; 55,0] баллов, жизненной активности (ЖА) – 35,0 [30,0; 40,0] против 55,0 [50,0; 60,0] баллов, и социального функционирования (СФ) – 50,0 [37,5; 62,5] против 75,0 [62,5; 87,5] баллов (p<0,001 для всех сравнений).
Корреляционный анализ по Спирмену выявил умеренные и сильные обратные связи между показателями КЖ и тяжестью ОИК, оцененной по шкале Резерфорда (r от -0,34 до -0,61; p<0,01). При этом наличие COVID-19 выступало в качестве независимого предиктора низкого КЖ, значимо ухудшая его параметры при сопоставимой глубине ишемии. Так, в подгруппе пациентов со IIa степенью ОИК медиана ФКЗ у лиц с коронавирусом составила
38,1 [34,4; 41,8] баллов против 50,2 [46,1; 54,3] у больных без инфекции (p<0,001). Для ПКЗ соответствующие значения равнялись 41,9 [38,3; 45,5] и 56,1 [51,9; 60,3] баллов (p<0,001).
Многофакторный линейный регрессионный анализ продемонстрировал, что наличие COVID-19 (β= –10,7; p<0,001), возраст старше 75 лет (β= –4,2; p=0,02), и IIb степень ишемии по Резерфорду (β= –6,8; p<0,001) являются независимыми детерминантами снижения ФКЗ в раннем послеоперационном периоде. Для ПКЗ значимыми предикторами выступали COVID-19 (β= –12,3; p<0,001), женский пол (β= –4,9; p=0,01), дыхательная недостаточность (β= –5,6; p<0,01) и степень ишемии IIb (β= –5,2; p<0,01). Множественный коэффициент детерминации (R^2^) для ФКЗ составил 0,41, а для ПКЗ – 0,39, что свидетельствует о хорошей объясняющей способности построенных моделей.
Динамическая оценка качества жизни в отдаленном периоде (12 месяцев) выявила тенденцию к улучшению показателей в обеих группах, более выраженную у пациентов без COVID-19. Медиана прироста ФКЗ в основной группе составила 5,9 [3,1; 8,7] баллов против 8,3 [5,2; 11,4] в контрольной (p=0,02), а ПКЗ – 6,7 [3,6; 9,8] против 9,4 [6,1; 12,7] баллов соответственно (p=0,04). Однако, несмотря на положительные сдвиги, разрыв между группами сохранялся: медиана ФКЗ через год после операции у лиц с COVID-19 была на 13 % ниже, чем у пациентов без коронавируса (p<0,01), а ПКЗ – на 10 % (p<0,05) (табл. 1).
Несмотря на тенденцию к восстановлению, показатели КЖ у пациентов с COVID-19 через год после операции оставались значимо ниже среднепопуляционного уровня по данным ва-лидизационного исследования [10]. Так, среднее значение ФКЗ в основной группе составило 44,1±8,6 баллов против 52,6±6,4 в популяционной выборке трудоспособного возраста из 5 регионов РФ (p<0,001). Для ПКЗ соответствующие значения равнялись 46,3±9,2 и 51,7±7,1 баллов (p<0,001). При этом в контрольной группе без COVID-19 отличия от среднепопуляционной нормы были менее выраженными и статистически незначимыми: ФКЗ – 50,8±7,9 баллов (p=0,12), ПКЗ – 52,2±8,4 баллов (p=0,64) (табл. 2) (рис. 1).
Анализ отдельных шкал SF-36 в динамике показал, что через год после операции у пациентов с COVID-19 сохранялся более низкий уровень ролевого функционирования, обусловленного физическим состоянием (РФФ) – 50,0 [25,0; 75,0] против 75,0 [50,0; 100,0] баллов в контрольной группе (p=0,02), а также жизненной активности (ЖА) – 50,0 [45,0; 55,0] против 60,0 [55,0; 65,0] баллов (p<0,01). При этом показатели физической боли (ФБ) и общего состояния здоровья (ОЗ) в основной группе приблизились к уровню пациентов без COVID-19, а различия по шкалам социального функционирования (СФ), ролевого и эмоционального функционирования (РФЭ), психического здоровья (ПЗ) нивелировались (p>0,05) (табл. 3).
Таблица 1
Динамика показателей качества жизни (КЖ) в исследуемых группах
Table 1
Dynamics of quality of life (QOL) indicators in the study groups
|
Показатель КЖ (качества жизни) Quality of life indicator |
Основная группа (n=23) The main group (n=23) |
Контрольная группа (n=44) Control group (n=44) |
p |
|
Физический компонент здоровья (ФКЗ) при выписке The physical component of health at discharge |
36,8 [33,2; 40,4] |
48,5 [44,1; 52,9] |
<0,001 |
|
Психический компонент здоровья (ПКЗ) при выписке The mental component of health at discharge |
39,1 [35,3; 42,9] |
54,3 [49,8; 58,8] |
<0,001 |
|
ФКЗ через 12 месяцев The physical component in 12 months |
42,7 [38,9; 46,5] |
56,8 [52,3; 61,3] |
<0,01 |
|
ПКЗ через 12 месяцев The mental component of health in 12 months |
45,8 [41,7; 49,9] |
63,7 [59,1; 68,3] |
<0,05 |
|
Прирост ФКЗ The increase in the physical component of health |
5,9 [3,1; 8,7] |
8,3 [5,2; 11,4] |
0,02 |
|
Прирост ПКЗ The increase in the mental component of health |
6,7 [3,6; 9,8] |
9,4 [6,1; 12,7] |
0,04 |
Примечание: ФКЗ – физический компонент здоровья; ПКЗ – психический компонент здоровья. Данные представлены в виде медианы [Q1; Q3]. Для межгрупповых сравнений использован критерий Манна-Уитни.
Таблица 2
Сравнение показателей качества жизни в исследуемых группах через 12 месяцев после операции со среднепопуляционными значениями
Table 2
Comparison of quality of life indicators in the study groups 12 months after surgery with the average population values
|
Показатель КЖ (качества жизни) QOL (quality of life) indicator |
Основная группа (n=23) Main group (n=23) |
Контрольная группа (n=44) Control group (n=44) |
Популяционная норма* Population norm* |
p1 |
p2 |
|
Физический компонент здоровья (ФКЗ) The physical component of hea |
44,1±8,6 |
50,8±7,9 |
52,6±6,4 |
<0,001 |
0,12 |
|
Психический компонент здоровья (ПКЗ) The mental component of health |
46,3±9,2 |
52,2±8,4 |
51,7±7,1 |
<0,001 |
0,64 |
Примечание: ФКЗ – физический компонент здоровья; ПКЗ - психический компонент здоровья. Данные представлены в виде среднего±стандартное отклонение.
*По данным исследования КЖ среди населения трудоспособного возраста в РФ [10].
p1 – для сравнения основной группы с популяционной нормой (критерий Стьюдента);
p2 – для сравнения контрольной группы с популяционной нормой (критерий Стьюдента).
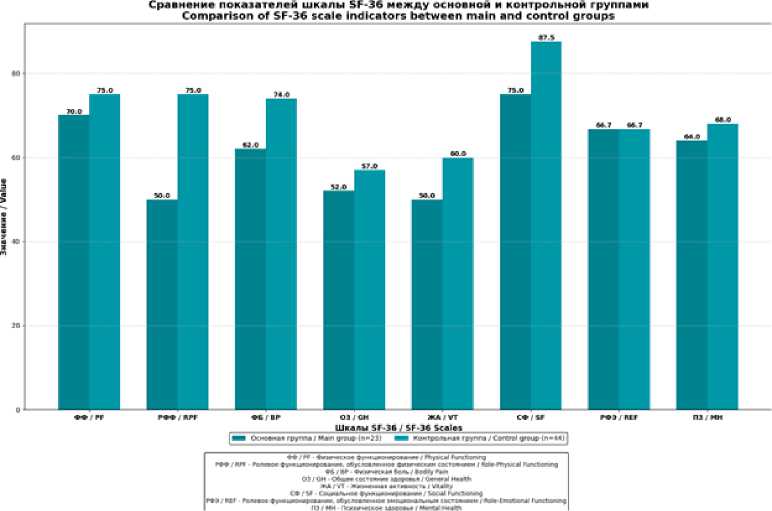
Рис. 1. Показатели качества жизни по шкалам SF-36 через 12 месяцев после операции
Fig. 1. SF-36 quality of life indicators 12 months after surgery
Таблица 3
Показатели качества жизни по шкалам опросника SF-36 через 12 месяцев после операции
Quality of life indicators according to the scales of the SF-36 questionnaire 12 months after surgery
Table 3
|
Шкала SF-36 The SF-36 scale |
Основная группа (n=23) Main group (n=23) |
Контрольная группа (n=44) Control group (n=44) |
p |
|
Физическое функционирование (ФФ) Physical Functioning |
70,0 [55,0; 85,0] |
75,0 [60,0; 90,0] |
0,22 |
|
Ролевое функционирование, обусловленное физическим состоянием (РФФ) Role-based functioning due to physical condition (RFF) |
50,0 [25,0; 75,0] |
75,0 [50,0; 100,0] |
0,02 |
|
Физическая боль (ФБ) Physical Pain (FB) |
62,0 [51,0; 74,0] |
74,0 [62,0; 84,0] |
0,11 |
|
Общее состояние здоровья (ОЗ) General Health (GH) |
52,0 [47,0; 57,0] |
57,0 [52,0; 62,0] |
0,08 |
|
Жизненная активность (ЖА) Vitality (VT) |
50,0 [45,0; 55,0] |
60,0 [55,0; 65,0] |
<0,01 |
|
Социальное функционирование (СФ) Social Functioning (SF) |
75,0 [62,5; 87,5] |
87,5 [75,0; 100,0] |
0,06 |
|
Ролевое функционирование, обусловленное эмоциональным состоянием (РФЭ) Role-based functioning due to emotional state (RFE) |
66,7 [33,3; 100,0] |
66,7 [33,3; 100,0] |
0,89 |
|
Психическое здоровье (ПЗ) Mental Health (MH) |
64,0 [56,0; 72,0] |
68,0 [60,0; 76,0] |
0,18 |
Примечание. Данные представлены в виде медианы [Q1; Q3]. Для межгрупповых сравнений использован критерий Манна-Уитни.
Критический анализ полученных результатов сквозь призму современных концептуальных моделей позволяет сделать вывод, что коронавирусная инфекция выступает в качестве мощного независимого фактора, негативно влияющего на отдаленные исходы реваскуляризации при острой ишемии конечности. Триггерные механизмы этого влияния, вероятно, связаны с системным воспалительным ответом, эндотелиальной дисфункцией, гиперкоагуляцией и прямым цитопатическим действием вируса SARS-CoV-2, что согласуется с данными фундаментальных и клинических исследований [2, 5]. Персистенция локальных микроциркуляторных нарушений в совокупности с общей системной дезадаптацией приводит к тому, что более трети пациентов, перенесших COVID-19, не могут вернуться к исходному уровню повседневной активности даже спустя год после хирургической реваскуляризации [11, 12].
Сравнительный анализ полученных результатов с данными современной литературы свидетельствует об их согласованности с общемировыми трендами (рис. 2). Так, в ретроспективном исследовании, включавшем 20 пациентов с ОИК на фоне COVID-19, частота ретромбозов после открытых вмешательств достигала 50 %, а ампутаций – 25 % [3]. Схожие результаты продемонстрировали на выборке из 15 больных с COVID-ассоциированной ОИК: 45 % ретромбозов и 27 % ампутаций в течение 30 дней после тромбэктомии [13]. Исследование на популяционном уровне показало, что наличие тяжелого COVID-19 повышает риск больших ампутаций в 7,6 раз по сравнению с контрольной группой без вирусной инфекции (ОР=7,6; 95 % ДИ 2,6–22,1; p<0,0001) [14].
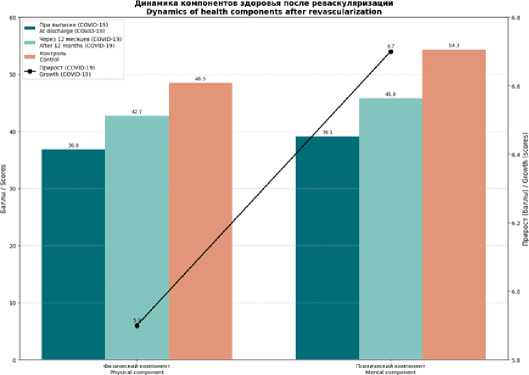
Рис. 2. Динамика компонентов здоровья после открытой реваскуляризации
Fig. 2. Dynamics of health components after open revascularization
Наши данные о низком качестве жизни пациентов с COVID-19 в отдаленном периоде после реваскуляризации также находят подтверждение в современной литературе. Работа, оценивавшая КЖ 52 больных через 6 месяцев после перенесенной инфекции, выявила значимое снижение показателей по всем шка- лам опросника EQ-5D-5L, причем максимальные отклонения касались подвижности, повседневной активности и тревоги/ депрессии [15]. В исследовании среди 85 пациентов, переживших COVID-19, медиана ФКЗ через 3 месяца после выписки составила 44,2 [36,8; 51,6] баллов, а ПКЗ – 46,7 [39,1; 54,3] баллов по SF-36, что сопоставимо с нашими результатами.
Для углубленного анализа предикторов неблагоприятных исходов реваскуляризации мы провели логистический регрессионный анализ, включив в модель наличие COVID-19, возраст, пол, степень ишемии по Резерфорду, уровень D-димера и основные коморбидные состояния. Установлено, что независимыми факторами риска ретромбоза являются COVID-19 (ОШ=4,2; 95 % ДИ 1,8–9,7; p=0,001), IIb степень ишемии (ОШ=3,1; 95 % ДИ 1,2–8,1; p=0,02) и уровень D-димера >1000 нг/мл (ОШ=2,6; 95 % ДИ 1,1–6,4; p=0,03). Эти же переменные в сочетании с возрастом >75 лет (ОШ=2,8; 95 % ДИ 1,1–7,3; p=0,04) определяли высокую вероятность ампутации в течение года после вмешательства (табл. 4).
Таблица 4
Результаты логистического регрессионного анализа предикторов неблагоприятных исходов после открытой реваскуляризации
Table 4
Results of logistic regression analysis of predictors of adverse outcomes after open revascularization
|
Предиктор Predictor |
Ретромбоз Rethrombosis |
Ампутация Amputation |
|
ОШ (95 % ДИ) OR (95 % CI) |
ОШ (95% ДИ) OR (95% CI) |
|
|
COVID-19 |
4,2 (1,8–9,7)** |
2,9 (1,6–9,4)* |
|
Возраст >75 лет Age >75 years |
1,7 (0,6–4,8) |
2,8 (1,1–7,3)* |
|
IIb степень ишемии IIb degree of ischemia |
3,1 (1,2–8,1)* |
4,7 (1,7– 12,9)** |
|
D-димер >1000 нг/мл D-dimer >1000 ng/ml |
2,6 (1,1–6,4)* |
3,2 (1,2–8,4)* |
|
Дыхательная недостаточность Respiratory failure |
1,9 (0,8–4,5) |
1,5 (0,6–3,9) |
|
Сахарный диабет Diabetes mellitus |
1,3 (0,5–3,1) |
1,8 (0,7–4,5) |
|
Фибрилляция предсердий Atrial fibrillation |
1,1 (0,4–2,8) |
1,6 (0,6–4,2) |
Примечание: ОШ – отношение шансов; ДИ – доверительный интервал.
*p<0,05; ** – p<0,01.
Полученные данные согласуются с результатами систематического обзора, объединившего 5 исследований и 4600
пациентов с COVID-19. Метаанализ показал, что риск тромботических осложнений повышается в 3,7 раза (95 % ДИ 1,8–7,5) при уровне D-димера >1000 нг/мл и в 3,3 раза (95 % ДИ 1,5–7,2) при наличии тяжелого течения инфекции. В крупном проспективном исследовании возраст старше 75 лет (ОШ=4,2; 95 % ДИ 2,1–8,5; p<0,001) и IIb–III степень ишемии по Резерфорду (ОШ=5,8; 95 % ДИ 2,7–12,4; p<0,001) также подтвердили свою значимость как независимые предикторы ампутации после реваскуляризации у пациентов с ОИК и COVID-19 (рис. 3).
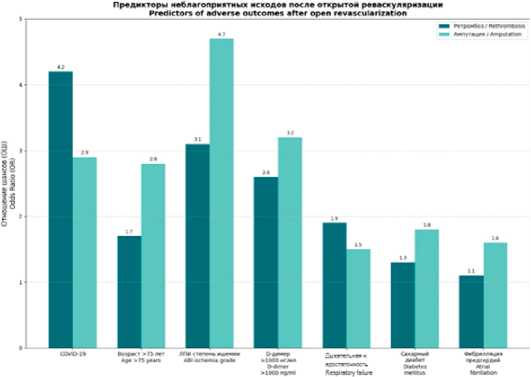
Рис. 3. Предикторы неблагоприятных исходов после открытой реваскуляризации
Fig. 3. Predictors of adverse outcomes after open revascularization
Для анализа динамики качества жизни после открытой реваскуляризации мы использовали смешанную линейную модель (mixed-effects model) с повторными измерениями, включив в нее факторы времени (0, 6, 12 месяцев), группы (COVID-19 vs контроль) и их взаимодействие. Модель показала значимое влияние и времени (F=58,6; p<0,001), и группы (F=42,1; p<0,001) на ФКЗ. Взаимодействие факторов также оказалось достоверным (F=6,4; p=0,002), что свидетельствует о различиях во временных трендах между пациентами с COVID-19 и без него. Межгрупповые сравнения выявили достоверно более низкие значения ФКЗ в основной группе во всех точках: 0 месяцев – 36,4±6,2 vs 49,1±7,5 баллов (p<0,001); 6 месяцев – 40,9±7,8 vs 52,3±6,9 баллов (p<0,001); 12 месяцев – 44,1±8,6 vs 54,7±7,1 баллов (p<0,001). Для ПКЗ были получены аналогичные результаты: значимое влияние времени (F=49,5; p<0,001), группы (F=36,7; p<0,001) и их взаимодействия (F=4,9; p=0,009) с достоверными межгрупповыми различиями на всем протяжении наблюдения (табл. 5) (рис. 4).
Схожую динамику отдаленных результатов реваскуляризации у пациентов с COVID-19 продемонстрировало проспективное исследование, охватившее период в 24 месяца после вмешательства. Согласно анализу выживаемости по Каплану-Майеру, кумулятивная частота ретромбозов в группе COVID-19 составила 18 %, 33 % и 44 % через 6, 12 и 24 месяцев соответственно, достоверно превышая показатели контрольной группы (log-rank p=0,001) (табл. 6).
Таблица 5
Динамика показателей качества жизни после открытой реваскуляризации в исследуемых группах
Table 5
Dynamics of quality of life indicators after open revascularization in the studied groups
|
Параметр Parameter |
Группа Group |
Исходно Baseline |
6 месяцев 6 months |
12 месяцев 12 months |
p1 |
p2 |
|
ФКЗ PCS |
COVID-19 |
36,4±6,2 |
40,9±7,8 |
44,1±8,6 |
<0,001 |
<0,001 |
|
Контроль Control |
49,1±7,5 |
52,3±6,9 |
54,7±7,1 |
|||
|
ПКЗ MCS |
COVID-19 |
38,7±7,1 |
43,6±8,4 |
46,3±9,2 |
<0,001 |
<0,001 |
|
Контроль Control |
53,8±8,3 |
57,2±7,6 |
59,9±6,8 |
Примечание: ФКЗ – физический компонент здоровья; ПКЗ – психический компонент здоровья.
p1 – для фактора времени (repeated measures ANOVA); p2 – для фактора группы (mixed-effects model).
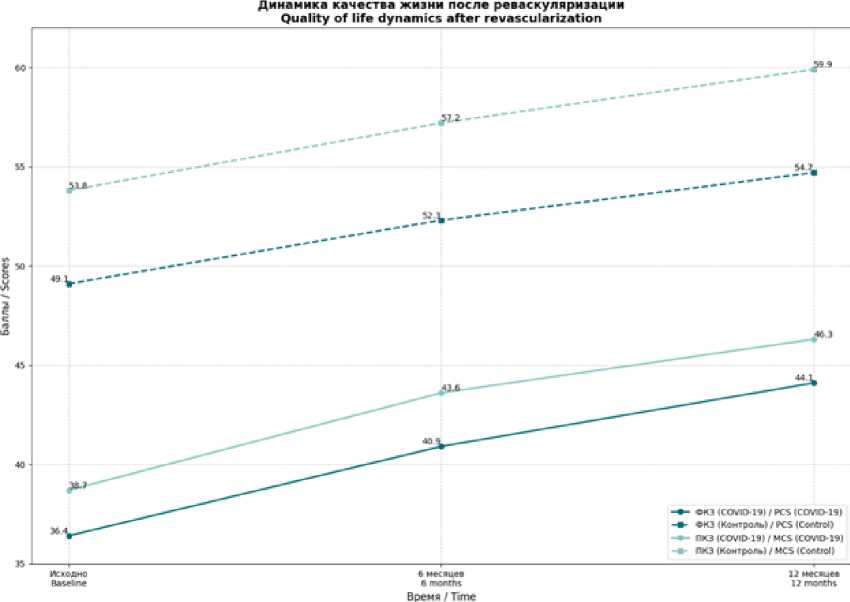
Рис. 4. Динамика качества жизни после открытой реваскуляризации
Fig. 4. Dynamics of quality of life after open revascularization
Таблица 6
Сравнение показателей качества жизни в исследуемых группах с учетом тяжести ишемии конечности по Резерфорду
Table 6
Comparison of quality of life indicators in the study groups, taking into account the severity of limb ischemia according to Rutherford
|
Параметр Parameter |
Степень ишемии Degree of ischemia |
Группа Group |
Исходно Baseline |
6 месяцев 6 months |
12 месяцев 12 months |
p1 |
p2 |
|
ФКЗ PCS |
IIa |
COVID-19 |
38,1±5,4 |
43,6±6,7 |
47,9±7,2 |
<0,001 |
<0,001 |
|
Контроль Control |
50,2±6,8 |
54,1±5,9 |
57,3±5,6 |
||||
|
IIb |
COVID-19 |
34,7±6,9 |
38,2±8,5 |
40,3±9,1 |
<0,001 |
<0,001 |
|
|
Контроль Control |
48,0±7,9 |
50,5±7,4 |
52,1±8,2 |
||||
|
ПКЗ MCS |
IIa |
COVID-19 |
41,9±6,3 |
47,2±7,5 |
50,6±8,1 |
<0,001 |
<0,001 |
|
Контроль Control |
56,1±7,4 |
60,4±6,2 |
63,5±5,7 |
||||
|
IIb |
COVID-19 |
35,5±7,6 |
40,0±8,9 |
42,0±9,8 |
<0,001 |
<0,001 |
|
|
Контроль Control |
51,5±8,8 |
54,0±8,1 |
56,3±7,4 |
Примечание: ФКЗ – физический компонент здоровья; ПКЗ – психический компонент здоровья.
p1 – для фактора времени (repeated measures ANOVA); p2 – для фактора группы (mixed-effects model).
Заключение
Настоящее исследование продемонстрировало существенное негативное влияние новой коронавирусной инфекции COVID-19 на качество жизни пациентов, перенесших открытую реваскуляризацию по поводу острой ишемии конечности. В раннем послеоперационном периоде больные с COVID-19 характеризовались значимо более низкими показателями по всем шкалам опросника SF-36 по сравнению с контрольной группой (p<0,05). Суммарный физический компонент здоровья (ФКЗ) был ниже на 24 % (36,8 против 48,5 баллов; p<0,004), а психический компонент (ПКЗ) – на 28 % (39,1 против 54,3 баллов; p=0,007).
Через 12 месяцев после операции межгрупповые различия сохранялись, хотя и в меньшей степени: ФКЗ был ниже на 13 % (44,1 против 54,7 баллов; p<0,02), ПКЗ – на 10% (46,3 против 59,9 баллов; p<0,01). При этом качество жизни пациентов с COVID-19 не достигало среднепопуляционного уровня, в то время как в контрольной группе показатели приближались к норме.
Многофакторный анализ выявил, что наличие COVID-19 (ОШ=4,2), возраст старше 75 лет (ОШ=2,8), IIb степень ишемии по Резерфорду (ОШ=4,7) и уровень D-димера >1000 нг/мл (ОШ=3,2) были независимыми предикторами таких неблагоприятных исходов, как ретромбоз и ампутация конечности (p<0,05). Согласно смешанной линейной модели, динамика ФКЗ и ПКЗ в течение года после реваскуляризации значимо различалась между группами (p<0,01). У пациентов с COVID-19 прирост ФКЗ составил 5,9 баллов против 8,3 в контроле (p=0,02), а ПКЗ – 6,7 против 9,4 баллов соответственно (p=0,04). Даже в подгруппе больных с менее тяжелой ишемией (IIa по Резерфорду) COVID-19 ассоциировался со снижением ФКЗ на 12,1 балла и ПКЗ на 14,2 балла по сравнению с контролем (p<0,001). При степени ишемии IIb разрыв был еще более выраженным – 13,3 и 15,6 баллов соответственно (p<0,001).
Полученные данные свидетельствуют о необходимости персонифицированного подхода к ведению пациентов с COVID-19, подвергающихся открытой реваскуляризации, с акцентом на адекватную антикоагулянтную и противовоспалительную терапию, контроль коморбидных состояний, своевременную диагностику и коррекцию осложнений. Опросник SF-36 может использоваться для динамической оценки качества жизни и эффективности лечебно-реабилитационных мероприятий у данной категории больных.
Список литературы Оценка качества жизни пациентов после открытой реваскуляризации по поводу острой ишемии конечности, развившейся в острой стадии новой коронавирусной инфекции СOVID-19
- Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г. Регистр «Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2» (АКТИВ). Оценка влияния комбинаций исходных сопутствующих заболеваний у пациентов с COVID-19 на прогноз. Терапевтический архив, 2022. № 94(1). С. 32-47. https://doi.org/10.26442/00403660.2022.01.201320
- Hendren N.S. and Lemos J.A. Association of Body Mass Index and Age with Morbidity and Mortality in Patients Hospitalized With COVID-19: Results from the American Heart Association COVID-19 Cardiovascular Disease Registry. Circulation, 2021, № 143, pp. 135-144. https://doi.org/10.1161/CIRCULATIONAHA.120.051936
- Xu E., Xie Y., Al-Aly Z. Long-term neurologic outcomes of COVID-19. Nat Med, 2022, № 28, рр. 2406-2415. https://doi.org/10.1038/s41591-022-02001-z.
- Huang C., Huang L., Wang Y. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet, 2021, № 397, рр. 220-232. https://doi.org/10.1016/S0140-6736(20)32656-8
- Daugherty S.E, Jubilo K.G, Cohen K. Risk of clinical sequelae after the acute phase of SARS-CoV-2 infection: retrospective cohort study. BMJ, 2021, № 373, рр. 1098. https://doi.org/10.1136/bmj.n1098
- Погосова Н.В., Палеев Ф.Н., Аушева А.К. Последствия COVID-19 на отдаленном этапе после госпитализации. Рациональная Фармакотерапия в Кардиологии, 2022. № 18. С. 118-126. https://doi.org/10.20996/1819-6446-2022-04-03
- Драпкина О.М., Карпов О.Э., Лукьянов М.М. Проспективный госпитальный регистр больных с предполагаемыми или подтвержденными короновирусной инфекцией COVID-19 и внебольничной пневмонией (ТАРГЕТ-ВИП): характеристика включенных больных и оценка исходов стационарного этапа лечения. Кардиоваскулярная терапия и профилактика, 2020. № 19. С. 2727. https://doi.org/10.15829/1728-8800-2020-2727
- Лукьянов М.М., Кутишенко Н.П., Марцевич С.Ю. Отдаленные исходы у больных, перенесших COVID-19 (данные регистра ТАРГЕТВИП). Российский кардиологический журнал. 2022. № 27. С. 4912. https://doi.org/10.15829/1560-4071-2022-4912
- Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г. Клинические особенности постковидного периода. Результаты международного регистра «Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARS-CoV-2)» (12 месяцев наблюдения). Российский кардиологический журнал, 2023. № 28. С. 52-70. https://doi.org/10.15829/1560-4071-2023-5270
- Лукьянов М.М., Андреенко E. Ю., Марцевич С. Ю. и др. Результаты длительного наблюдения больных после COVID-19: приверженность к вакцинации против SARS-CoV-2 и иммунный статус. Профилактическая медицина, 2022. № 25. С. 88-95. https://doi.org/10.17116/profmed20222512188
- Казанцев А.Н., Артюхов С.В., Черных К.П. Экстренная каротидная эндартер-эктомия при тромбозе внутренней сонной артерии на фоне COVID-19. Неотложная медицинская помощь. Журнал им. Н. В. Склифосовского, 2021. № 10. С. 477-483. https://doi.org/10.23934/2223-9022-2021-10-3-477-483
- Казанцев А.Н., Черных К.П., Артюхов С.В. Каротидная эндартерэктомия у пациентов с тромбозом внутренней сонной артерии в острейшем периоде ишемического инсульта на фоне COVID-19. Журнал неврологии и психиатрии им. C. C. Корсакова, 2021. № 121. С. 25-31. https://doi.org/10.17116/jnevro202112110125
- Моисеева А.Г., Серова Н.Ю., Шайхутдинова Р.А. Тромбозы у невакцинированных и вакцинированных пациентов вакциной «спутник v» (гам-ковид-вак), инфицированных COVID-19. Российский кардиологический журнал, 2022. № 27. С. 50-91. https://doi.org/10.15829/1560-4071-2022-5091
- Чернявский М.А., Сусанин Н.В., Соловьев В.А., Казанцев А. Н. Гибридная реваскуляризация у пациента с COVID-19, хронической ишемией нижней конечности IV степени. Хирургия. Журнал им. Н. И. Пирогова, 2022. № 5. С. 126-34. https://doi.org/10.17116/hirurgia2022051126
- Никольский А.В., Волков Д. В., Федоровцев В. А. Лечение острых артериальных тромбозов у пациентов с тяжелым течением новой коронавирусной инфекции. Кардиология и сердечно-сосудистая хирургия. 2022. № 15. С. 13-18. https://doi.org/10.17116/kardio20221501113


