Оценка клинико-функциональной эффективности комплексного лечения макулярного отёка, обусловленного окклюзией ретинальных вен
Автор: Жайворонок Н. С., Егоров В. В., Смолякова Г. П., Данилова Л. П., Еманова Л. П., Поваляева Д. А., Удовиченко Е. В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.17, 2021 года.
Бесплатный доступ
Цель: оценить эффективность сочетанного применения ранибизумаба и сулодексида в лечении макулярного отёка (МО) при окклюзии ретинальных вен (ОРВ). Материал и методы. В ходе исследования велось наблюдение за 40 пациентами с макулярным отёком при ОРВ, не превышающим 1,5 месяца давности. Всем проведены: стандартное офтальмологическое обследование, а также оптическая когерентная томография с функцией ангиографии и электрофизиологические исследования. Для оценки эффективности сочетанного использования Саратовский научно-медицинский журнал. 2021. Т. 17, № 2. Глазные БОЛЕЗНИ ранибизумаба и сулодексида все пациенты были разделены на две группы. Пациентам первой группы (n=21) первая интравитреальная инъекция ранибизумаба была дополнена курсом приема сулодексида. Вторая группа (n=19) сулодексид не получала. Результаты. Степень улучшения функций глаза у пациентов первой группы, получавших в комплексном лечении сулодексид, обусловлена максимальным уровнем восстановления ретинального микрокровотока в макуле за счет увеличения плотности капиллярной сети в поверхностном и глубоком сосудистом сплетении сетчатки более чем в 1,2 раза и уменьшения площади ее фовеальной аваскулярной зоны в 1,5 раза в сравнении с исходным состоянием. Заключение. Результаты исследования показали высокую эффективность сочетанного применения ранибизумаба и сулодексида в лечении МО при ОРВ и позволяют рекомендовать применение препаратов для улучшения гемомикроциркуляции в макулярной сетчатке и повышения зрительных функций.
Макулярный отёк, окклюзия ретинальных вен, ранибизумаб, сулодексид
Короткий адрес: https://sciup.org/149135627
IDR: 149135627 | УДК: 617.736:616.145.154–005.6
Текст научной статьи Оценка клинико-функциональной эффективности комплексного лечения макулярного отёка, обусловленного окклюзией ретинальных вен
1 Введение. Окклюзия ретинальных вен (ОРВ) ‒ нарушение кровообращения в центральной вене сетчатки (ЦВС) или ее ветвях. ОРВ занимает лидирующие позиции среди причин снижения остроты зрения [1, 2]. Эта патология стоит на втором месте после ретинопатии на фоне диабета [3, 4].
В последнее время отмечается рост частоты сердечно-сосудистых заболеваний, что приводит к увеличению удельного веса пациентов с нарушениями кровообращения в сосудах сетчатки глаза, в том числе c ОРВ [5].
Макулярный отёк (МО) необратимо снижает остроту зрения и занимает ведущее место в структуре осложнений ОРВ. Эндотелиальные дисфункции, а также нарушения целостности эндотелия составляют его патофизиологическую основу, приводящую к повышению проницаемости капилляров, а также к накоплению жидкости в межклеточных пространствах всех слоев сетчатки. При отсутствии лечения прогноз зрительных функций неблагоприятный [6, 7].
В имеющейся офтальмологической литературе в настоящий момент не представлены данные по изучению эффективности сочетанного применения ра-нибизумаба и сулодексида для лечения МО при ОРВ.
Цель: оценить эффективность сочетанного использования ранибизумаба и сулодексида при лечении МО при ОРВ.
Материал и методы. Объект исследования ‒ 40 пациентов (из них 17 мужчин, 23 женщины) (40 глаз) в возрасте от 42 до 76 лет (в среднем 53,4±4,1 года) с МО при ОРВ.
Критерии для включения пациентов в проводимое исследование: МО при ОРВ, со сроком давности не более 1,5 месяца; без какой-либо терапии данного заболевания.
В 12 глазах выявлена окклюзия ЦВС, в 28 — окклюзия ветвей ЦВС (13 — верхневисочная аркада, 15 — нижневисочная аркада). У 28 пациентов (12
глаз) диагностирован кистозный МО, у 12 пациентов (12 глаз) диффузный.
У исследуемых установлена хроническая сопутствующая патология: 26 пациентов имели гипертоническую болезнь II стадии; 4 пациента — сахарный диабет 2-го типа. Семь пациентов ранее перенесли инфаркт миокарда, а два человека — нарушение мозгового кровообращения.
Всем пациентам проводилось как стандартное офтальмологическое обследование: визометрия с максимальной коррекцией (максимально корригированная острота зрения (МКОЗ), отн. ед.), тонометрия по Маклакову, биомикроскопия, бесконтактная офтальмоскопия с линзой 90 дптр, так и специальные методы обследования: оптическая когерентная томография (ОКТ) и ОКТ с функцией ангиографии (ОКТ-А, спектральный томограф RTVue XR Avanti, Optovue, США), компьютерная статическая периметрия (MS, дБ) на периметре Humphrey (Германия), исследовался порог электрической чувствительности (ПЭЧ, мкА) сетчатки и электрической лабильности (ЭЛ, Гц) зрительного нерва на аппарате «Диагност» (Россия).
При проведении ОКТ-А измеряли центральную толщину сетчатки (ЦТС, мкм), а также объем макулы (ОМ, мм³). Проводился анализ параметров микрокровотока в макулярной области: плотности поверхностной капиллярной сети (ППКС, %) и плотности глубокой капиллярной сети (ПГКС, %), площади фо-веальной аваскулярной зоны сетчатки (ФАЗ, мм²).
Всем пациентам, находящимся под наблюдением, однократно в месяц проведено три инъекции Лу-центиса (ранибизумаба) по 0,5 мг (0,05 мл) в стекловидное тело (ЛСР004567/08, от 16.06.2008 г., Novartis Pharma Stein AG, Швейцария).
Для оценки эффективности сочетанного использования ранибизумаба и сулодексида все пациенты были разделены на две группы, сопоставимые по всем исследуемым параметрам.
В первой группе исследования (21 пациент) первая инъекция Луцентиса была дополнена 15-днев-
Динамика центральной толщины и объема сетчатки при динамическом наблюдении у пациентов групп сравнения
|
Исследуемые показатели |
Группы и сроки исследования |
||||||||
|
Первая группа (n=21) |
Вторая группа (n=19) |
Контроль |
|||||||
|
Исходно |
1 мес. |
3 мес. |
12 мес. |
Исходно |
1 мес. |
3 мес. |
12 мес. |
||
|
Центральная толщина сетчатки, мкм |
604 (598; 622) |
301 (291; 305) ** |
229 (193; 268) ** |
209 (179; 236) ** |
599 (577; 604) |
327 (320; 331) */** |
276 (244; 287) */“ |
227 (200; 249) */“ |
198 (191; 218) |
|
Объем макулярной сетчатки, мм³ |
13,9 (12,3; 15,5) |
11,7 (10,7; 13,8) ** |
10,5 (9,8; 11,8) ** |
10,0 (8,8; 10,9) ** |
14,1 (12,1; 15,7) |
12,4 (11,5; 14,5) *** |
11,5 (9,5; 13,5) */** |
11,1 (9,1; 11,9) */** |
9,4 (8,7; 9,8) |
П р и м еч а н и е : * ‒ статистически значимая разница по сравнению с первой группой в соответствующие периоды наблюдения; ** ‒ статистически значимая разница по сравнению с исходным уровнем.
ным курсом ежедневных внутривенных инъекций сулодексида 600 ЛЕ/2 мл, а затем двукратным пероральным приемом двух капсул сулодексида 250 ЛЕ в течение месяца.
Во вторую группу исследования вошли 19 пациентов, которые сулодексид не получали.
За показатели оценки функциональной, морфологической и гемодинамической эффективности проводимого лечения у пациентов групп сравнения принимались изменения МКОЗ, ПЭЧ и ЭЛ сетчатки, световой чувствительности центральной зоны сетчатки, показателей ОКТ-А в динамике.
В качестве контроля рассматривали аналогичные показатели парных глаз исследуемых пациентов: ЦТС ‒ 198 (191; 218) мкм; ОМ ‒ 9,4 (8,7; 9,8) мм³; ППКС ‒ 55,17 (54,43; 55,80) %; ПГКС ‒ 56,82 (55,44; 57,97) %; ФАЗ ‒ 0,33 (0,31; 0,34) мм², МКОЗ ‒ 0,99 (0,98; 1,0); MS ‒ 27,4 (26,2; 28,3) дБ; ПЭЧ ‒ 90,2 (89,9; 90,6) мкА; ЭЛ ‒ 50,7 (50; 51,5) Гц.
Исследование МКОЗ, ОКТ сетчатки у пациентов обеих групп выполнялось при первичном осмотре и затем через 1, 3 и 12 месяцев.
ОКТ-А, MS, ЭЛ, ПЭЧ сетчатки проводили исходно и спустя 12 месяцев.
Полученные результаты исследования статистически обрабатывались при помощи компьютерной программы IBM SPSS Statistics 20. Нормальность выявленных распределений проверялась с использованием критерия Шапиро — Уилка. Так как почти все распределения не явились нормальными, данные представлены в виде Me (Q25; Q75), где Me — медиана, Q25; Q75–25-й и 75-й квартили.
Множественные сравнения независимых групп осуществляли с помощью критерия Краскела — Уоллиса с последующими попарными сравнениями с U-критерием Манна — Уитни. Независимые выборки сравнивались U-критерием Манна — Уитни, связанные выборки — с критерием Уилкоксона. Поправка на множественные сравнения групп производилась с помощью метода Холма — Бонферрони. Значимыми считались различия при p<0,05.
Результаты. Исходно у всех сорока исследуемых пациентов отмечалось снижение центрального зрения в среднем до 0,24 (0,16; 0,40) (от 0,09 до 0,40).
Уровень внутриглазного давления достигал 18– 21 мм рт. ст.
При осмотре глазного дна у всех обследованных пациентов выявлялся отёк диска зрительного нерва и стушеванность его границ. Отмечалось полнокровие, извитость и неравномерность калибра венозных сосудов сетчатки. Фовеолярный и макулярный рефлексы отсутствовали. В заднем полюсе определялось большое количество разнокалиберных геморрагий, доходящих до крайней периферии.
В табл. 1 представлена динамика центральной толщины и объема сетчатки в различные сроки наблюдения.
Исходно у пациентов обеих групп выявлено диффузное увеличение ЦТС: в первой группе до 604 (598; 622) мкм, во второй до 599 (577; 604) мкм. Объем макулы в первой группе достиг 13,9 (12,3; 15,5) мм³ и был сопоставим с пациентами во второй группе: 14,1 (12,1; 15,7) мм³ (см. табл. 1).
У 4 пациентов первой и 5 пациентов второй группы в макуле определялись множественные кисты (рис. 1).
Через 1 месяц после первой инъекции раниби-зумаба отмечалось уменьшение толщины сетчатки в обеих группах по сравнению с исходным уровнем (р<0,05), у пациентов первой группы более выражен-
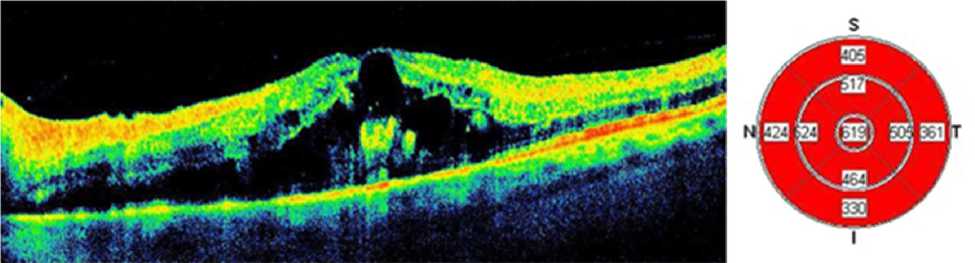
Рис. 1. Результаты оптической когерентной томографии левого глаза пациента Ц. (47 лет) исходно: кистозный макулярный отёк, увеличение центральной толщины сетчатки
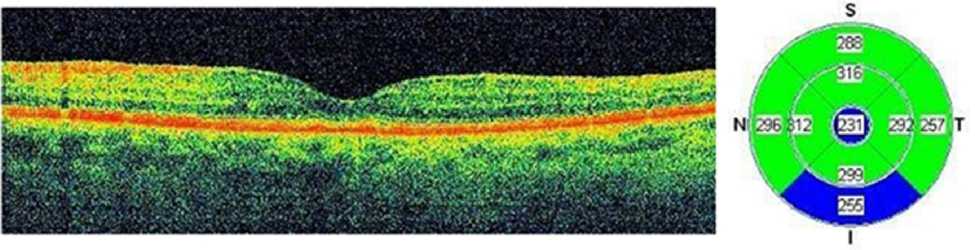
Рис. 2. Результаты оптической когерентной томографии левого глаза пациента Ц. (47 лет) через 12 месяцев после лечения (ранибизумаб+сулодексид): редукция макулярного отека, нормализация морфометрических показателей сетчатки
ное по сравнению со второй: 301 (291; 305) и 327 (320; 331) мкм соответственно (р<0,05).
Почти полное купирование МО и уменьшение ЦТС до показателей, достоверно не отличающихся от варианта нормы (р>0,05), у пациентов первой группы зарегистрировано после трех последовательных инъекций ранибизумаба. У пациентов второй группы отёк уменьшился до 276 (244; 297) мкм, но был достоверно больше, чем в первой группе (229 (193; 268) мкм) (р<0,05).
К этому сроку наблюдения у 19 пациентов (90,4%) первой группы купировался отек диска зрительного нерва, а также произошло рассасывание ретинальных кровоизлияний, а у 13 пациентов (68%) второй группы ретинальные геморрагии сохранялись.
К 12-му месяцу наблюдения у всех пациентов первой группы регистрировали нормализацию морфометрических показателей сетчатки (рис. 2) относительно контроля (209 (179; 236) и 198 (191; 218) мкм соответственно), (р>0,05), а во второй группе данные показатели не только не достигли нормы (227 (200; 249) и 198 (191; 218) мкм соответственно), (р<0,05), но и достоверно отличались от показателей первой группы (227 (200; 249) и 209 (179; 236) мкм соответственно) (р<0,05).
Объем макулы достоверно уменьшался по сравнению с исходными данными (р<0,05), составив 10,0 (8,8; 10,9) мм³ в первой и 11,1 (9,1; 11,9) мм³ во второй группе. Но во второй группе по сравнению с первой сохранялась статистически достоверная разница этого показателя (р<0,05).
Динамика восстановления микроциркуляции в макулярной сетчатке у пациентов обеих групп наблюдения спустя 12 месяцев после лечения представлена в табл. 2.
Показатели, представленные в табл. 2, свидетельствуют о существенных межгрупповых различиях. У пациентов первой группы через 12 месяцев после курса лечения плотность капиллярных сплетений в поверхностных и глубоких слоях сетчатки достигла 92 и 88,3% от показателей контроля соответственно, тогда как у пациентов второй группы эти показатели достигли только 81 и 74,1% соответственно. У пациентов обеих групп исследования площадь ФАЗ через 12 месяцев не достигла показателей контрольной группы. Но у пациентов первой группы она превышала показатель контроля только в 1,9 раза, а во второй в 2,8 раза.
Анализ динамики функциональных показателей в группах сравнения до и после курса лечения представлен в табл. 3.
Проведя анализ представленных в табл. 3 данных, можно констатировать, что, несмотря на выявленную однонаправленную тенденцию в повышении функциональных показателей в группах сравнения, они не достигли к 12-му месяцу после окончания курса лечения показателей нормы (р<0,05). В то же время у пациентов первой группы их повышение достоверно выше в сравнении с пациентами второй группы (р<0,05). Так, у пациентов, получавших комплексное лечение МО (ранибизумаб + сулодексид), спустя год зарегистрировано повышение остроты зрения в 3,3 раза, световая чувствительность центральной сетчатки увеличилась в 2,5 раза, ЭЛ зрительного нерва повысилась в 1,6 раза, а ПЭЧ сетчатки снизилась в 2,5 раза в сравнении с исходными показателями. У пациентов же второй группы наблюдения уровень повышения перечисленных показателей к концу исследования был менее выражен.
Обсуждение. Наличие у пациентов в анамнезе ОРВ сочетается с высоким риском развития ишемической болезни сердца [8, 9] и летального исхода от церебро- и кардиоваскулярных заболеваний [10].
По данным S. Cugati [11] и М. Aghamirsalim [10], после перенесенной ОРВ в первые пять лет от инсульта умирают 5,3% пациентов, от острого инфаркта миокарда 26% пациентов, а у лиц моложе 69 лет
Таблица 2
Значения показателей сетчатки у пациентов групп сравнения по данным оптической когерентной томографии в режиме ангиографии через 12 месяцев после начала лечения
|
Показатель |
Группа наблюдения |
||
|
Первая группа |
Вторая группа |
Контроль |
|
|
ППКС, % |
50,75 (49,89; 53,52) **/*** |
44,71 (40,85; 49,62) */*** |
55,17 (54,43; 55,80) */** |
|
ПГКС, % |
50,15 (47,11; 51,68) **/*** |
42,12 (41,15; 43,10) */*** |
56,82 (55,44; 57,97) */** |
|
ФАЗ, мм² |
0,63 (0,57; 0,70) **/*** |
0,98 (0,87; 1,31) */*** |
0,33 (0,31; 0,34) */** |
П р и м еч а н и е : * ‒ статистически значимая разница по сравнению с первой группой; ** ‒ статистически значимая разница по сравнению с второй группой; *** ‒ статистически значимая разница по сравнению с контролем; ППКС ‒ плотность поверхностной капиллярной сети; ПГКС ‒ плотность глубокой капиллярной сети; ФАЗ ‒ площадь фовеальной аваскулярной зоны сетчатки.
Характеристика функциональных показателей зрительного анализатора у пациентов первой и второй групп исследования через 12 месяцев после окончания курса лечения
|
Показатель |
Группа наблюдения |
||||
|
Первая группа |
Вторая группа |
Контроль |
|||
|
Исходно |
Через 12 мес. |
Исходно |
Через 12 мес. |
||
|
МКОЗ, отн. ед. |
0,24 (0,16; 0,40) |
0,78 (0,64; 0,91) * 2, 3 |
0,24 (0,19; 0,40) |
0,61 (0,55; 0,80) * 1, 3 |
0,99 (0,98; 1,00) 1, 2 |
|
MS, дБ |
10,1 (8,2; 10,7) |
24,8 (23,9; 26,2) * 2, 3 |
9,1 (8,3; 10,5) |
14,1 (13,2; 15,2) *1, 3 |
27,4 (26,2; 28,3) 1,2 |
|
ПЭЧ, мкА |
238,9 (226; 251,7) |
97,5 (91,8; 99,0) * 2, 3 |
227,2 (224,4; 236,7) |
69,1 (65,2; 73,1) *1, 3 |
90,2 (89,9; 90,6) 1,2 |
|
ЭЛ, Гц |
26,2 (24,8; 28,3) |
43,6 (42,1; 45,4) * 2, 3 |
25,4 (24,3; 27,1) |
31,3 (30,1; 33,6) *1, 3 |
50,7 (50,0; 51,5) 1, 2 |
П р и м еч а н и е : * ‒ статистически значимая разница по сравнению с исходным уровнем; ¹ ‒ статистически значимая разница по сравнению с первой группой; ² ‒ статистически значимая разница по сравнению со второй группой; ³– статистически значимая разница по сравнению с контролем; МКОЗ ‒ максимальная корригированная острота зрения; MS ‒ данные компьютерной статической периметрии; ПЭЧ ‒ порог электрической чувствительности; ЭЛ ‒ электрическая лабильность.
более чем в 2 раза повышается риск развития тромбоэмболий.
Общее старение населения также приводит к увеличению распространенности ОРВ. Однако выявляется и множество молодых пациентов, страдающих этой патологией [5].
При ОРВ в условиях гипоксии и при нарушенной эндотелиальной целостности сосудов сетчатки важным патобиохимическим компонентом является выброс в полость стекловидного тела биологически активных веществ, стимулирующих развитие МО и внутриглазной неоваскуляризации, таких как фактор роста эндотелия сосудов (vascular endothelial growth factor — VEGF) и провоспалительных цитокинов [12, 13].
Терапия макулярного отёка, обусловленного ОРВ, должна подавлять два ведущих триггера: неконтролируемое повышение уровня факторов неоангиогенеза и локальное воспаление [2].
Ранибизумаб и афлиберцепт считаются препаратами выбора в лечении МО [14].
Убедительные данные, полученные в результате рандомизированных исследований, подтверждают способность ингибиторов VEGF при ИВВ блокировать действие эндотелиального сосудистого фактора роста, резорбировать МО, снижать как проницаемость сосудов, так и риск развития внутриглазной неоваскуляризации [14–17].
Постоянно ведутся поиски лекарственных препаратов для анти-VEGF-терапии с целью повышения эффективности медицинской реабилитации пациентов [14].
Особого внимания заслуживает антикоагулянт прямого действия сулодексид (Вессел Дуэ Ф, Италия), разрешенный и известный в офтальмологической практике фармакологический препарат, оказывающий антикоагулянтное, ангиопротекторное, антитромботическое, а также профибринолитиче-ское действие. Сулодексид является натуральным продуктом, выделенным из слизистой оболочки тонкой кишки свиньи. Антикоагулянтное действие его проявляется за счет сродства к кофактору II гепарина, который инактивирует тромбин. Механизм антитромботического действия связан с подавлением активированного Х фактора, усилением синтеза и секреции простациклина (простогландин Pg I2) и снижением уровня фибриногена в плазме крови.
Профибринолитическое действие сулодексида обусловлено увеличением уровня тканевого активатора плазминогена в крови и уменьшением содер- жания его ингибитора. Механизм ангиопротекторно-го действия связан с восстановлением структурной и функциональной целостности клеток эндотелия сосудов, нормальной плотности отрицательного электрического заряда пор базальной мембраны сосудов. Данный препарат улучшает также реологические свойства крови путем снижения уровня триглицеридов [18].
Исследования показали, что улучшение макулярного кровотока может сопровождаться повышением функциональной активности фоторецепторов, о чем свидетельствует улучшение остроты зрения [19].
Проведенное нами исследование состояния функциональных и электрофизиологических показателей у пациентов с макулярным отёком, обусловленным ОРВ, свидетельствует, что назначение ежедневных внутривенных инъекций сулодексида 600 ЛЕ в течение 15 дней, а затем пролонгированный двукратный пероральный прием двух капсул сулодексида 250 ЛЕ в течение месяца в дополнении к трем инъекциям ранибизумаба обеспечивает их выраженную положительную динамику. У пациентов первой группы, принимавших сулодексид, уровень повышения функций глаза обусловлен восстановлением микрокровотока в макуле за счет повышения ППКС и ПГКС более чем в 1,2 раза, а также за счет сокращения площади ее ФАЗ в 1,5 раза в сравнении с исходным состоянием.
Заключение. Результаты исследования показали высокую эффективность сочетанного применения ранибизумаба и сулодексида в лечении МО при ОРВ и позволяют рекомендовать применение препаратов для улучшения гемомикроциркуляции в макулярной сетчатке и повышения зрительных функций.
Список литературы Оценка клинико-функциональной эффективности комплексного лечения макулярного отёка, обусловленного окклюзией ретинальных вен
- Boyko EV, Sosnovsky SV. Antiangiogenic therapy in ophthalmology. St. Petersburg: VMA, 2013; 292 p. Russian (Бойко Э. В., Сосновский С. В. Антиангиогенная терапия в офтальмологии. СПб.: ВМА, 2013; 292 с.).
- Tultseva SN, Astakhov YuS. The role of inflammation in the pathogenesis of macular edema: modern trends of medical treatment. Ophthalmology Journal 2012; 5 (4): 35–42. Russian (Тульцева С. Н., Астахов Ю. С. Роль воспаления в патогенезе посттромботического макулярного отека: современные направления медикаментозного лечения. Офтальмологические ведомости 2012; 5 (4): 35–42).
- Astakhov YuS, Petrishchev NN, Tultseva SN. Retinal vein thrombosis: etiology, pathogenesis, clinical picture, diagnosis, treatment. St. Petersburg: SPbGMU, 2005; 60 p. Russian (Астахов Ю. С., Петрищев Н. Н., Тульцева С. Н. Тромбоз вен сетчатки: этиология, патогенез, клиника, диагностика, лечение.
- СПб.: СПбГМУ, 2005; 60 с.).
- Kiseleva TN. Ocular ischemic syndrome (clinical picture, diagnosis, treatment): DSc abstract. Moscow, 2001; 32 p. Russian (Киселева Т. Н. Глазной ишемический синдром (клиника, диагностика, лечение): автореф. дис. … д-ра мед. наук. М., 2001; 32 с.).
- Tultseva SN, Astakhov YuS. Retinal vein occlusion (etiology, pathogenesis, clinical picture, diagnosis, treatment). St. Petersburg: NL Publ., 2010; 112 p. Russian (Тульцева С. Н., Астахов Ю. С. Окклюзии вен сетчатки (этиология, патогенез, клиника, диагностика, лечение). СПб.: Изд-во Н-Л, 2010; 112 с.).
- Khudyakov AYu, Sorokin EL. Analysis of long-term results of treatment of branch retinal vein occlusion. In: Makula-2010. Rostov-on-Don, 2010; p. 477–8. Russian (Худяков А. Ю., Сорокин Е. Л. Анализ отдаленных результатов лечения тромбозов ветвей центральной вены сетчатки. В кн.: Макула-2010. Ростов-на-Дону, 2010; с. 477–8).
- Wong TY, Scott IU. Clinical practice: Retinal vein occlusion. N Engl J Med 2010; 363 (22): 2135–44.
- Martin SC, Butcher A, Martin N, et al. Cardiovascular risk assessment in patients with retinal vein occlusion. Br J Ophthalmol 2002; 86 (7): 774–6.
- Khan Z, Almeida DR, Rahim K, et al. 10‑Year Framingham risk in patients with retinal vein occlusion: a systematic review and meta-analysis. Can J Ophthalmol 2013; 48 (1): 40–5.
- Aghamirsalim M, Sorbi R, Naderian M, et al. Management of retinal vein occlusion, who is responsible? Acta Med Iran 2016; 54 (11): 731–6.
- Cugati S, Wang JJ, Knudtson MD, et al. Retinal vein occlusion and vascular mortality. Ophthalmology 2007; 114 (3): 520–4.
- Karia N. Retinal vein occlusion: pathophysiology and treatment options. Clin Ophthalmol 2010; (4): 809–16.
- Pearse AK, Srinivas RS. Retinal vein occlusion and macular edema — critical evaluation of the clinical value of ranibizumab. Clin Ophthalmol 2011; (5): 771–81.
- Danilova LP, Egorov VV, Smoliakova GP, et al. Clinical efficacy of complex using Lucentis and neuroprotective therapy in treatment of macular edema during retinal vein occlusion.
- Berger AR, Cruess AF, Altomare F, et al. Optimal treatment of retinal vein occlusion: Canadian expert consensus. Ophthalmologica 2015; 234 (1): 6–25.
- Campochiaro PA, Pearlman SR, Brown DM. Long-term outcomes in patients with retinal vein occlusion treated with ranibizumab: the retain study. Ophthalmology 2014; 121 (1): 209–19.
- Ip MS, Scott IU, VanVeldhuisen PC, et al. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with observation to treat vision loss associated with macular edema secondary to central retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 5. Arch Ophthalmol 2009; 127 (9): 1101–14.
- Egorov EA, Astakhov YuS, Stavitskaya TV. Ophthalmic Pharmacology. Moscow: GEOTAR-Media, 2009; 592 p. Russian (Егоров Е. А., Астахов Ю. С., Ставицкая Т. В. Офтальмофармакология. М.: ГЭОТАР-Медиа, 2009; 592 с.).
- Zlobin IV. Predicting the effectiveness of antiangiogenic treatment of macular edema caused by retinal vein occlusion: PhD abstract. Moscow, 2017; 23 p. Russian (Злобин И. В. Прогнозирование эффективности антиангиогенного лечения макулярного отёка, обусловленного окклюзией вен сетчатки): автореф. дис. … канд. мед. наук. М., 2017; 23 с.).


