Оценка микробного пула углерода в черноземе и дерново-подзолистой почве разных типов сельскохозяйственного землепользования методом люминесцентной микроскопии
Автор: Семенов М.В., Никитин Д.А., Леонов В.Д., Пинчук И.П., Тхакахова А.К., Ксенофонтова Н.А., Хитров Н.Б.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Статья в выпуске: 126, 2025 года.
Бесплатный доступ
Углерод микробной биомассы (Смик) является биологически активным пулом почвенного органического вещества и чувствительным индикатором, реагирующим на изменения в землепользовании гораздо раньше, чем содержание общего органического углерода и других пулов в его составе. Метод люминесцентной микроскопии позволяет оценивать не только общее содержание Смик, но и определять структуру микробной биомассы: количество спор и длину мицелия грибов, а также количество бактериальных клеток и гиф актиномицетов. Целью исследования было оценить структуру микробного пула углерода в профилях чернозема типичного и дерново-подзолистой почвы в зависимости от типа сельскохозяйственного землепользования (сенокос, залежь, пашня, пастбище) методом люминесцентной микроскопии. Микробный пул углерода в поверхностном слое дерново-подзолистой почвы составлял от 258 до 446 мкг/г почвы в зависимости от типа землепользования, в черноземе – 387 мкг/г для почвы залежи и 161 мкг/г для почвы пашни. До глубины 30 см Смик в черноземе залежи был в 1.5–3 раза выше по сравнению с пашней. В более глубоких горизонтах различия между разными землепользованиями становились менее явными, но сохранялись для ряда микробиологических показателей. В микробном пуле углерода обеих почв полностью преобладал (97–99%) грибной компонент, представленный преимущественно мицелием. Длина мицелия грибов в дерново-подзолистой почве и черноземе уменьшалась с глубиной на порядок от сотен м/г к десяткам м/г почвы. Большая часть показателей структуры микробного пула углерода (численность грибов, длина мицелия грибов и актиномицетов, биомасса прокариот) были выше в черноземе залежи по сравнению с пашней, однако эти закономерности не наблюдались для дерново-подзолистой почвы. Биомасса и доля прокариот, а также длина мицелия были отмечены как показатели структуры микробного пула углерода, определяемые методом люминесцентной микроскопии, которые ассоциировались с разными типами землепользования для обоих типов почв. Очень высокие значения соотношений грибы/бактерии, вероятно, обусловлены недоучетом биомассы бактериальных клеток используемым методом. Несмотря на выявленные ограничения метода, люминесцентная микроскопия может быть использована в качестве дополнения к более точным методам оценки микробного пула углерода, позволяя определить размеры и структуру грибной биомассы в почвах разных типов сельскохозяйственного землепользования.
Биомасса микроорганизмов, прокариоты, грибы, мицелий, споры, пашня, залежь, сенокос, пастбище
Короткий адрес: https://sciup.org/143185304
IDR: 143185304 | УДК: 579.26:631.46 | DOI: 10.19047/0136-1694-2025-126-156-203
Текст научной статьи Оценка микробного пула углерода в черноземе и дерново-подзолистой почве разных типов сельскохозяйственного землепользования методом люминесцентной микроскопии
1Federal Research Centre “V.V. Dokuchaev Soil Science Institute”, 7 Bld. 2 Pyzhevskiy per., Moscow 119017, Russian Federation, *, e-mail: , **, ***,
****,
*****,
******,
*******
Почвенное органическое вещество (ПОВ) – крупнейший резервуар углерода на планете, важный депозитарий питательных элементов, основа плодородия и развития сельского хозяйства (Семенов, Когут, 2015; Liang et al., 2017). Одним из главных факторов, определяющих уровень ПОВ является тип землепользования (Semenov et al., 2018; Семенов и др., 2023). Его смена в первую очередь влияет на растительный покров, характеристики углеродного пула, агрохимические и физико-химические свойства почвы, плодородие (Семенов, Когут, 2015), а также структуру пулов ПОВ и почвенного микробиома (Добровольская и др., 2015; Лебедева и др, 2024). Углерод микробной биомассы (С мик ) является важным биологически активным пулом лабильного ПОВ, так как он прямо и косвенно воздействует на многие ферментативные, энергетические и биогеохимические процессы в почве, определяя скорость разложения ПОВ и интенсивность круговорота макро- и микроэлементов, секвестрацию и минерализацию органического углерода (Семенов, Когут, 2015; Добровольская и др., 2015; Благодатская и др., 2016; Семенов и др., 2013, 2018, 2019). Доля микробного пула в составе общего органического углерода (С орг ) обычно составляет 1–5%, при этом до 50–55% С орг может иметь микробное происхождение (Семенов, Когут, 2015; Liang et al., 2019; Angst et al., 2021; Никитин и др., 2022). Также С мик является чувствительным индикатором трансформации и деградации ПОВ (Благодатская и др., 2016; Семенов и др., 2013, 2019; Никитин и др., 2022), откликающимся на изменения в землепользовании гораздо раньше, чем содержание С орг и других пулов в его составе (Курганова и др., 2009; Сушко и др., 2019; Семенов и др., 2023; Никитин и др., 2023). Поскольку влияние землепользования на запасы ПОВ проявляется замедленно, необходимы более чувствительные индикаторы, каковым является микробный пул углерода (Семенов, 2020; Никитин и др., 2023).
Определение микробного пула углерода возможно с помощью широкого спектра подходов – прямых, физиологических, биохимических, биомаркерных и т. д. (Благодатская и др., 2016; Семенов и др., 2013, 2019, 2016; Никитин и др., 2022). Наиболее распространенным прямым методом оценки С мик служит люминесцентная микроскопия, которая позволяет оценить численность клеток микроорганизмов непосредственно в почве (Звягинцев, 1991; Благодатская и др., 2016; Полянская и др., 2017, 2020). Кроме того, люминесцентная микроскопия позволяет определить не только величину микробной биомассы, но и ее морфологию и структуру (численность, размер и форму клеток, длину мицелия, соотношение мицелий/споры и грибы/бактерии), которые напрямую связаны с процессами трансформации и минерализации ПОВ (Звягинцев, 1991; Добровольская и др., 2015; Семенов и др., 2023). Доминирование микобиоты и высокие значения отношения гри-бы/прокариоты характерны для почв с большим секвестрирующим потенциалом и низким C/N, а уменьшение отношения гри-бы/бактерии говорит о снижении секвестрации углерода в почве (Семенов и др., 2023; Никитин и др., 2023). Тем не менее оценка индикаторной роли показателей микробного пула углерода и его структуры, получаемых с помощью люминесцентной микроскопии, до сих пор не проводилась для почв разных типов сельскохозяйственного использования.
Целью исследования была оценка структуры микробной биомассы в профилях чернозема и дерново-подзолистой почвы разных типов сельскохозяйственного землепользования (сенокос, залежь, пашня, пастбище) методом люминесцентной микроскопии.
ОБЪЕКТЫ И МЕТОДЫ
Первая группа объектов исследования находилась на полях ВНИИМЗ в Калининском районе Тверской области (пос. Эм-маусс). Почвенный покров представлен дерново-подзолистыми почвами разной степени оглеения в зависимости от положения в элементах мезорельефа. На большей части поля в 1980-х годах проводились осушительные мелиоративные мероприятия. В условиях крайне высокой почвенной пестроты выбрана схема отбора крестом. Отбор образцов проводился в 5-кратной пространственной повторности в октябре 2022 г. на пашне (EM-28), пастбище (EM-35), сенокосе под многолетними травами (EM-21) и залежи (EM-24) с трех глубин (5–10 см, 10–20 см, 30–40 см), что обусловлено мощностью гумусового горизонта в дерново-подзолистых почвах и формированием дернины в поверхностных слоях на залежи, сенокосе и пастбище. Всего было отобрано 60 образцов дерново-подзолистых почв.
Другая группа объектов исследования находилась на территории Биосферного полигона Института Географии РАН (Курская обл.). Почвенный покров представлен черноземами типичными южной лесостепной подзоны. Отбор образцов выполнен в 3-кратной пространственной повторности в конце октября 2022 г. на залежи (VIPK-46, VIPK-47, VIPK-48) и пашне (VIPK-40, VIPK-42, VIPK-44) на глубинах 0–10 см, 20–30 см, 40–50 см, 60–70 см и 80– 90 см. Всего было отобрано 30 образцов черноземов.
Площадки на дерново-подзолистых почвах и черноземах были подобраны исходя из схожести рельефа и литологии, чтобы вид угодья можно было считать основным фактором их различий.
Содержание валового органического углерода (C орг ) оценено с помощью СNHS-анализатора (Leco 932, USA). Повторность анализа каждого образца – 3-кратная.
Биомасса прокариот оценивалась с помощью метода люминесцентной микроскопии с применением флуоресцентного красителя акридина оранжевого (микроскоп “Биомед 5 ПР ЛЮМ” (Россия)) при увеличении 1000× с масляной иммерсией (Звягинцев, 1991). Десорбцию клеток с поверхности почвенных частиц проводили при помощи ультразвуковой установки УЗДН-1 (2 мин., сила тока 0.40 А, частота 22 кГц) (Полянская и др., 2017). Расчет числа клеток прокариот на 1 г субстрата производили по формуле:
N = S1×a×n/V×S2×C, где N-число клеток на 1 г субстрата; S 1 – площадь препарата (мкм2); a – количество клеток в одном поле зрения (усреднение производится по всем препаратам); n – показатель разведения бактериальной смеси (мл); V – объем капли, наносимой на стекло
(мл); S 2 – площадь поля зрения микроскопа (мкм 2 ); C – навеска субстрата (г).
Длину актиномицетного мицелия в 1 г образца (NМА) определяли по формуле:
NМА = S1×a×n/v×S2×c×106, где: S1 – площадь препарата (мкм2); а – средняя длина фрагментов актиномицетного мицелия в поле зрения (мкм); n – показатель разведения суспензии (мл); v – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Биомассу грибов определяли методом люминесцентной микроскопии с применением флуоресцентного красителя калько-флуора белого (КБ) (Звягинцев, 1991; Полянская и др., 2017). Учет спор и длины мицелия осуществляли на люминесцентном микроскопе “Биомед 5 ПР ЛЮМ” (Россия) при увеличении 400×. Десорбцию клеток с почвы проводили при помощи вортекса “MSV-3500” (Латвия) при скорости 3500 об./мин. в течение 10 мин. Расчет грибной биомассы (мг/г почвы) осуществляли, полагая, что плотность спор равна 0.837 г/см 3 , а плотность мицелия – 0.628 г/см 3 (Полянская, Звягинцев, 2005). Содержание грибной биомассы на грамм сухой почвы рассчитывали с учетом ее влажности. Величины микробного пула углерода рассчитывались как сумма биомассы прокариот и грибов. Пространственное и аналитическое варьирование показателей на основе люминесцентной микроскопии в связи с их средним значением даны в приложении к статье (рисунки S10–S22, Приложение).
Статистика и визуализация данных. Оценка влияния типа землепользования в каждом слое почвы на изученные показатели проводилась при помощи критерия Краскела–Уоллиса в программной среде R с помощью функции kruskal.test из базового пакета stats. Предварительно были оценены нормальность распределений остатков дисперсионного анализа с помощью теста Шапиро–Уилка (функция shapiro.test базового пакета stats) и равенство дисперсий с помощью теста Левена (функция leveneTest из пакета car), и, поскольку некоторые изученные почвенные показатели не удовлетворяли условиям применимости более строгих статистиче- ских тестов (дисперсионного анализа), было решено применить тест Краскела–Уоллиса. Значимость попарных различий между вариантами оценена с помощью теста Данна (функция testDunn из пакета R FSA). Уровень значимости для описанных тестов принят равным 0.05. Диаграммы ящиков с усами построены с помощью пакета ggplot2 (Wickham, 2016) по следующей схеме: центральная линия – среднее значение по выборке, границы ящиков – среднее ± стандартная ошибка среднего, усы – минимальное и максимальное значение выборки.
Для оценки взаимосвязей между характеристиками почвенного микробного сообщества на основе данных люминесцентной микроскопии и типами землепользования был применен факторный анализ с использованием пакетов FactoMineR и factoextra (Kassambara, Mundt, 2020; Lê et al., 2008) и анализ связей (анализ графов, relevance networks) c помощью пакета mixOmics (Rohart et al., 2017) в программной среде R. В нашем случае этот метод визуализации основан на анализе PLS-DA и демонстрирует корреляцию переменных (данных люминесцентной микроскопии) с тем или иным типом землепользования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание общего органического углерода (Сорг) в верхнем слое дерново-подзолистых почв значительно изменялось в зависимости от типа землепользования и снижалось в ряду: сенокос под многолетними травами (2.3%) – залежь (1.9%) – пашня (1.4%) – пастбище (1.1%) (табл. 1). На глубине 10–20 см различия в содержании С орг между разными типами землепользования сокращались, а на глубине 30–40 см увеличивалось пространственное варьирование содержания С орг на участках сенокосов и залежей.
Содержание Сорг в черноземе под залежью в верхнем слое было выше по сравнению с изученным черноземом пашни – 5.0% и 3.7% соответственно (табл. 1), что показано в ряде работ (Семенов и др., 2008, 2016; Курганова и др., 2009; Семенов, Когут, 2015; Semenov et al., 2018; Семенов, 2020). Однако уже на глубине 20–30 см значения Сорг в черноземе залежи (3.6%) и пашне (3.4%) статистически не различались. С увеличением глубины различия в со- держании Сорг в почве залежи и пашни полностью нивелировались, что согласуется с аналогичными работами по черноземам (Semenov et al., 2018; Булышева и др., 2020).
Таблица 1. Содержание С орг в почвах (n = 5 для дерново-подзолистых почв; n = 3 для черноземов)
Table 1. The content of C org in soils (n = 5 for soddy-podzolic soils; n = 3 for chernozems)
|
Почва |
Тип землепользования |
глубина, см |
С орг , % |
Ст. откл. |
|
то Н О S ч о 8 о к 6 со о я о |
Сенокос |
5–10 |
2.32 |
0.34 |
|
10–20 |
1.84 |
0.66 |
||
|
30–40 |
0.63 |
0.33 |
||
|
Залежь |
5–10 |
1.89 |
0.42 |
|
|
10–20 |
1.55 |
0.25 |
||
|
30–40 |
0.44 |
0.33 |
||
|
Пашня |
5–10 |
1.36 |
0.13 |
|
|
10–20 |
1.23 |
0.10 |
||
|
30–40 |
0.17 |
0.05 |
||
|
Пастбище |
5–10 |
1.10 |
0.06 |
|
|
10–20 |
0.98 |
0.07 |
||
|
30–40 |
0.21 |
0.10 |
||
|
£ о о я о |
Залежь |
0–10 |
5.01 |
0.71 |
|
20–30 |
3.59 |
0.13 |
||
|
40–50 |
2.56 |
0.26 |
||
|
60–70 |
1.66 |
0.25 |
||
|
80–90 |
1.26 |
0.09 |
||
|
Пашня |
0–10 |
3.65 |
0.14 |
|
|
20–30 |
3.41 |
0.13 |
||
|
40–50 |
2.51 |
0.04 |
||
|
60–70 |
1.66 |
0.17 |
||
|
80–90 |
1.36 |
0.13 |
Общий микробный пул углерода в поверхностном слое дерново-подзолистых почв составлял от 258 до 456 мкг/г почвы в зависимости от типа землепользования (рис. S1, Приложение). На глубине 10–20 см микробный пул углерода не различался статистически (269–334 мкг/г почвы) под залежью, пашней и сенокосом, но значимо снижался до 184 мкг/г почвы под пастбищем (рис. S1). В слое 30–40 см микробный пул углерода резко уменьшался под залежью, пашней и пастбищем до 76 мкг/г почвы, в то время как под сенокосом этот показатель был в 2 раза выше (170 мкг/г почвы). Это свидетельствует о влиянии типа землепользования на почвенный микробиом и микробный углерод на глубине ниже 30 см, несмотря на то что глубина основной вспашки составляла 22 см, которая проводится (пашня), либо ранее проводилась (сенокос, залежь, пастбище) для каждого исследуемого типа землепользования.
Общий микробный пул углерода в поверхностном слое чернозема достигал 387 мкг/г для почвы залежи и 161 мкг/г для почвы пашни (рис. S1). До глубины 30 см микробный углерод в черноземе залежи был в 1.5–3 раза выше (p < 0.05), чем в черноземе под пашней (рис. S1). С глубиной различия между черноземом залежи и пашни выравнивались. Влияние длительной вспашки на микробный углерод подпахотных слоев ранее было отмечено для черноземов Каменной Степи и бурых полупустынных почв (Semenov et al., 2018).
Биомасса грибов в составе микробного пула углерода. В исследованных черноземах и дерново-подзолистых почвах в микробной биомассе полностью преобладали (97–99%) грибы (рис. S2, S3, Приложение), поэтому характер распределения биомассы грибов по глубинам и типам землепользования совпадал с таковым для общего микробного углерода (рис. 1). В дерновоподзолистых почвах отмечалось значительное уменьшение биомассы грибов на глубине 30–40 см для всех типов землепользования. Доля мицелия грибов в дерново-подзолистых почвах была идентична (54–61%) для всех типов землепользования в верхних 10 см (рис. 2). Для слоя 30–40 см наибольшая доля мицелия была выявлена под сенокосом (до 51%), в остальных типах землеполь- зования составляла лишь 23–34% (рис. 2).
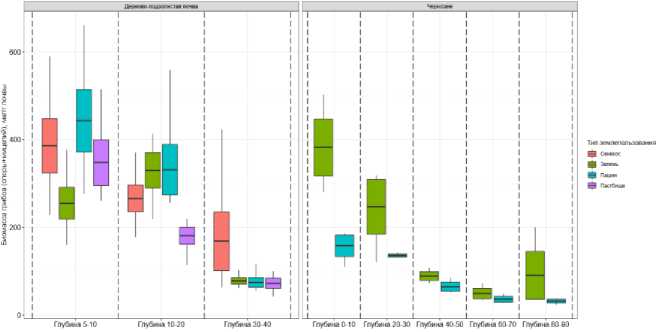
Рис. 1. Биомасса грибов (споры + мицелий) в составе микробного пула углерода дерново-подзолистой почвы и чернозема разных типов землепользования на различных глубинах (N = 5 для дерновоподзолистых почв; N = 3 для черноземов).
Fig. 1. The total biomass of fungi (spores + mycelium) in the microbial carbon pool of soddy-podzolic soil and chernozem under different land use types at different depths (N = 5 for soddy-podzolic soils; N = 3 for chernozems).
Доля мицелия в грибной биомассе в поверхностном слое черноземов залежи составляла 73%, пашни – 50% (рис. 2). Для слоя 20–30 см доля мицелия в черноземе под залежью составляла 52%, под пашней – 38%. В слое 80–90 см доля мицелия в черноземе залежи составляла лишь 31%, а в черноземе под пашней мицелий не был выявлен.
Длина мицелия грибов в дерново-подзолистой почве уменьшалась с глубиной от сотен м/г почвы к десяткам м/г почвы (рис. 3). В поверхностном слое длина мицелия в почве залежи, пашни и пастбища составляла 96–131 м/г почвы, сенокоса – 206 м/г. В слое 30–40 см протяженность гиф микобиоты в почве залежи, пашни и пастбища составляла 21–27 м/г почвы, в то время как сенокоса – 104 м/г почвы.
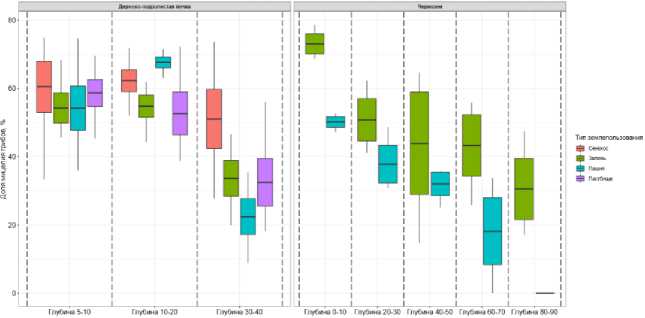
Рис. 2. Доля мицелия грибов в общей грибной биомассе дерновоподзолистой почвы и чернозема разных типов землепользования на различных глубинах (N = 5 для дерново-подзолистых почв; N = 3 для черноземов).
Fig. 2. Proportion of fungal mycelium in the total fungal biomass of soddy-podzolic soil and chernozem under different land use types at different depths (N = 5 for soddy-podzolic soils; N = 3 for chernozems).
Длина мицелия грибов в поверхностном слое чернозема залежи составляла 223 м/г почвы, пашни – 63 м/г почвы (p < 0.05). С увеличением глубины величина данного показателя сокращалась. В слое 20–30 см в почве залежи длина мицелия снижалась почти в 2 раза (130 м/г почвы), в то время как под пашней почти не менялась (52 м/г почвы). Более глубокие слои чернозема залежи также характеризовались большими значениями длины мицелия грибов по сравнению с черноземом пашни (рис. 3).
Дерново-подзолистые почвы содержали 10 4 –10 5 спор/г почвы (рис. S4, Приложение). Основная часть пропагул микобиоты была представлена экземплярами мелких размеров в 2–3 мкм. Крупные пропагулы (5 мкм и более) были выявлены только в поверхностном слое дерново-подзолистой почвы залежи и сенокоса, составляя порядка 10 3 клеток/г почвы.
Образцы черноземов содержали 103–104 одноклеточных грибных пропагул (спор и дрожжей) на г почвы (рис. 4S). Большая часть пропагул микобиоты была представлена мелкими формами (2–3 мкм), доля которых была больше в почве под пашней (до 89%) по сравнению с залежью (до 76%). Крупные пропагулы (5 мкм и более) были выявлены только в почве залежи, численность которых составляла около 102 клеток/г почвы.
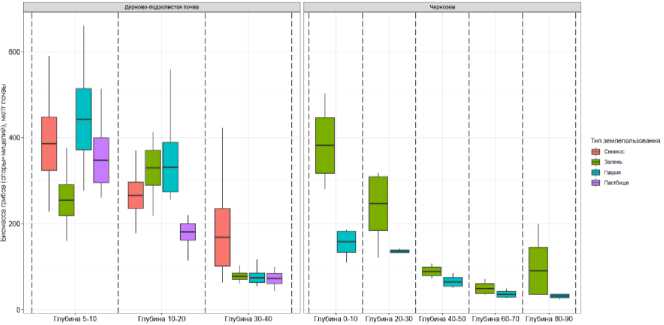
Рис. 3. Длина мицелия грибов в дерново-подзолистой почве и черноземе разных типов землепользования на различных глубинах (N = 5 для дерново-подзолистых почв; N = 3 для черноземов).
Fig. 3. The length of fungal mycelium in soddy-podzolic soil and chernozem under different land use types at different depths (N = 5 for soddy-podzolic soils; N = 3 for chernozems).
Биомасса прокариот в составе микробного пула углерода в верхнем слое дерново-подзолистой почвы была идентична (2.5 мкг/г почвы) под сенокосом, залежью и пашней, но значительно повышалась (до 4 мкг/г) под пастбищем (p < 0.05) (рис. 4). С глубиной тенденция к повышению величин биомассы прокариот в почве пастбища сохранялась. Биомасса прокариот в черноземе залежи была значительно выше по сравнению с почвой пашни для всех рассмотренных глубин (p < 0.05) (рис. 4). Протяженность мицелия актиномицетов в проанализированных черноземах и дерново-подзолистых почвах составляла несколько десятков метров на г почвы (рис. S5, Приложение).
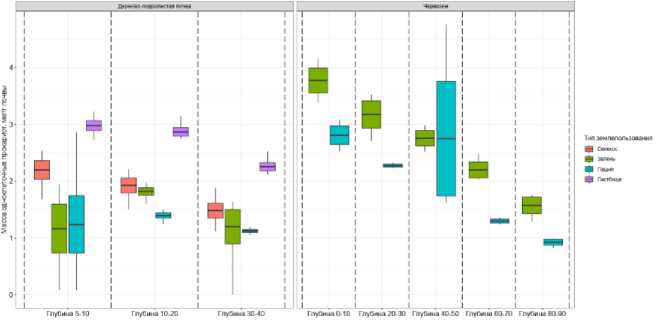
Рис. 4. Общая биомасса прокариот (одноклеточные формы + мицелий) в составе микробного пула углерода дерново-подзолистой почвы и чернозема разных типов землепользования на различных глубинах (N = 5 для дерново-подзолистых почв; N = 3 для черноземов).
Fig. 4. The total prokaryotic biomass (unicellar organisms + mycelium) in the microbial carbon pool of soddy-podzolic soil and chernozem under different land use types at different depths (N = 5 for soddy-podzolic soils; N = 3 for chernozems).
По порядку значений биомасса прокариот в изученных черноземах и дерново-подзолистых почвах соответствует таковым для черноземов Башкортостана и дерново-подзолистых почв средней полосы России (Полянская и др., 2012, 2017; Никитин и др., 2019), а также серо-гумусовым глеевым почвам Костромской области (Полянская и др., 2020). Однако это на порядок выше по сравнению со значениями для черноземов Алтайского края и Челябинской области (Полянская и др., 2016) и ниже, чем для обыкновенных черноземов Каменной степи (Манучарова и др., 2005).
Доля прокариот в общем микробном пуле углерода составила 1–3%. Полученные величины полностью соответствует тем, которые получаются в почвах при использовании метода люминесцентной микроскопии (Полянская и др., 2005; 2012; Ананьева и др., 2008). Тем не менее сравнение структуры микробной биомассы, полученной методами люминесцентной микроскопии и инги- бирования антибиотиками субстрат-индуцированного дыхания, показало, что используемые методы дают принципиально разные значения вклада бактерий в общую микробную биомассу (1–3% по микроскопии и 26–48% по ингибированию дыхания соответственно) (Полянская и др., 2017). Использование метода каскадной фильтрации показывает, что люминесцентная микроскопия может значительно недоучитывать количество бактериальных клеток и спор, и, как следствие, численность, биомассу и долю прокариот из-за неучтенных мелких форм бактериальных клеток (Полянская и др. 2017; 2020). Другой возможной причиной низких значений биомассы прокариот может служить коэффициент пересчета численности бактериальных клеток в углерод микробной биомассы, который основан на среднем объеме, плотности и диаметре бактериальной клетки. Таким образом, хотя люминесцентная микроскопия может быть использована для определения общего микробного углерода, определяемые величины прокариотной биомассы и отношения грибы/бактерии сильно недоучитываются этим методом при существующем порядке их учета.
Связь типов землепользования с микробными показателями на основе люминесцентной микроскопии. Чтобы оценить влияние типа землепользования на состояние микробного пула углерода на основе данных люминесцентной микроскопии, для полученных переменных был проведен факторный анализ (рис. 6; рис. S6, S7, S8, Приложение).
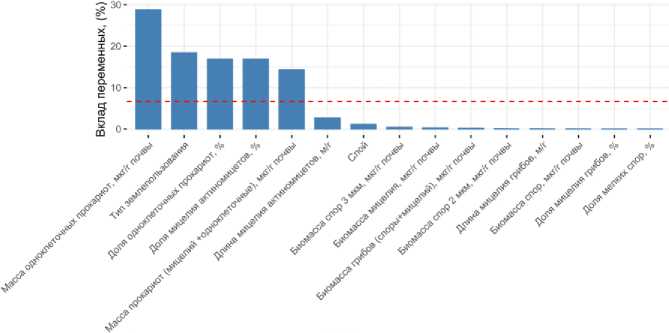
В случае дерново-подзолистой почвы первая и вторая компоненты факторного анализа в сумме объясняли 51% вариации данных (рис. S6). Вдоль компоненты 1, которая объясняет 33.5% вариации переменных, разделились точки, связанные с глубиной отбора проб, а вдоль компоненты 2, объясняющей 17.6% вариации, разделились точки, связанные с рассматриваемыми типами землепользования (рис. S6). Таким образом, согласно результатам факторного анализа, в случае дерново-подзолистой почвы на измеренные показатели микробного пула углерода, полученные методом люминесцентной микроскопии, существенно большее влияние оказывает глубина отбора проб, нежели чем тип землепользования.
Тем не менее можно выделить показатели, изменение которых было связано со сменой типа землепользования. Наибольшее влияние на компоненту 2 (ось Y), по которой идет разделение точек по типам землепользования, оказывают биомасса одноклеточных прокариот, доля одноклеточных прокариот, доля мицелия ак-тиномицетов и суммарная масса прокариот (рис. 5). Данные микробиологические показатели достигали максимальных значений в почве пастбища (рис. 4; рис. S2, S5). Для других типов землепользования (сенокос, залежь, пашня), которые не образовывали выраженных скоплений точек (рис. S6), связанные с ними параметры люминесцентной микроскопии по результатам факторного анализа не были выявлены. Таким образом, биомасса и доля прокариот, а также длина мицелия были основными показателями структуры микробного пула углерода, связанными с изменением типа землепользования для обоих типов почв.
По результатам анализа PLS-DA c визуализацией relevance network были отмечены корреляции некоторых других параметров с типами землепользования (рис. 6). Влияние сенокоса выражалось в увеличении доли мицелия грибов и биомассы мицелия, а также уменьшении доли мелких спор (рис. 6). Для почвы залежи было отмечено уменьшение массы одноклеточных прокариот, суммарной массы прокариот и увеличение доли мицелия актино-мицетов. В почве пашни уменьшалась биомасса одноклеточных прокариот и доля одноклеточных прокариот. Однако, как правило, эти закономерности носили спорадический характер (отмечены только в отдельных слоях) и были слабо выражены (имеют низкий уровень корреляции) из-за сильной дисперсии переменных.
Результаты факторного анализа для чернозема согласуются с результатами анализа PLS-DA c визуализацией relevance network (рис. 5, 6, 7). Помимо выделенных выше микробиологических показателей на основе люминесцентной микроскопии, изменение которых было ассоциировано с разными типами землепользования, ряд показателей почти не изменялся в черноземе разного землепользования: доля грибов, доля прокариот, биомасса спор, биомасса спор размером 3 мкм, биомасса спор размером 2 мкм (рис. 7).
Влияние переменных на ось Y, Дерново-подзолистая почва
Влияние переменных на ось Y, Чернозем
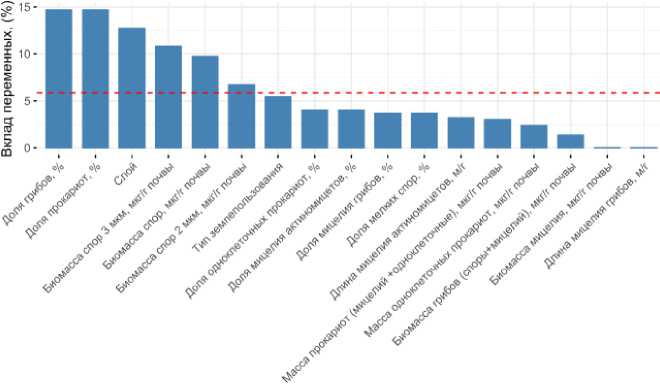
Рис. 5. Вклад показателей люминесцентной микроскопии в выявление различий между исследуемыми черноземами и дерново-подзолистыми почвами на основе факторного анализа.
Fig. 5. The contribution of luminescent microscopy indicators to the revealing of differences between the studied chernozems and soddy-podzolic soils based on factor analysis.
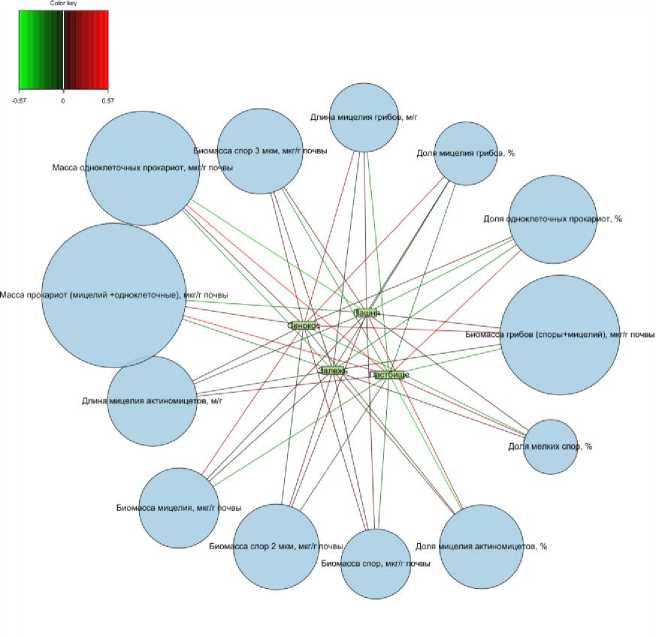
Рис. 6. График связей на основе PLS-DA, демонстрирующий корреляции между параметрами люминесцентной микроскопии и типом землепользования для дерново-подзолистой почвы. Узлы представляют собой переменные, а цвет линий обозначает направление корреляции: красный цвет указывает на положительную связь с типом землепользования, зеленый – на отрицательную связь. Яркость цвета означает силу связи.
Fig. 6. A PLS-DA-based linkage plot illustrates the relationship between fluorescence microscopy parameters and land use type for soddy-podzolic soil. Nodes represent variables, and line colors indicate the correlation direction: red for a positive relationship with land use type and green for a negative one. The brightness of the color reflects the strength of the relationship.
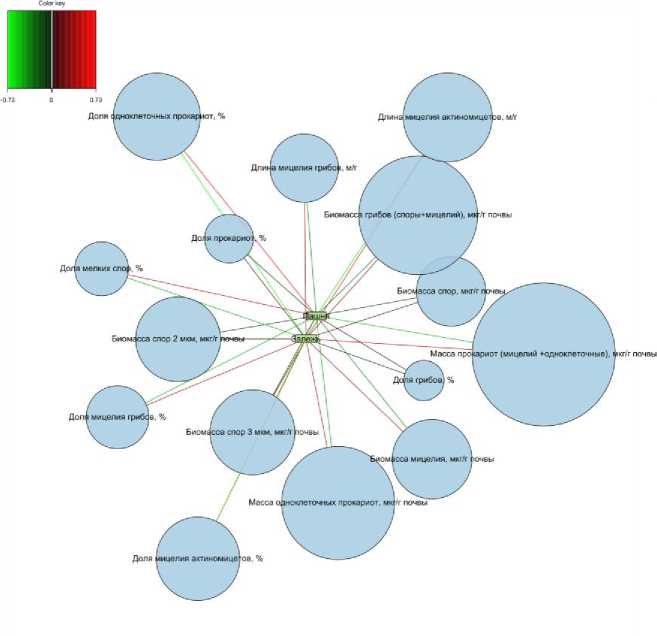
Рис. 7. График связей на основе PLS-DA, демонстрирующий корреляции между параметрами люминесцентной микроскопии и типом землепользования для чернозема. Узлы представляют собой переменные, а цвет линий обозначает направление корреляции: красный цвет указывает на положительную связь с типом землепользования, зеленый – на отрицательную связь. Яркость цвета означает силу связи.
Fig. 7. A PLS-DA-based linkage plot illustrates the relationship between fluorescence microscopy parameters and land use type for chernozem. Nodes represent variables, and line colors indicate the correlation direction: red for a positive relationship with land use type and green for a negative one. The brightness of the color reflects the strength of the relationship.
ЗАКЛЮЧЕНИЕ
Использование метода люминесцентной микроскопии позволило выявить значительное влияние землепользования на размеры и соотношения различных компонентов в составе микробного пула углерода в черноземе. Большинство показателей структуры микробной биомассы (численность грибов, длина мицелия грибов и актиномицетов, биомасса прокариот) были выше в черноземе залежи, по сравнению с пашней, при этом различия проявлялись для более глубинных слоев 60–70 и 80–90 см. Несмотря на различия в содержании общего органического углерода, дерново-подзолистая почва разных типов сельскохозяйственного использования не отличалась по большей части микробиологических показателей, диагностируемых методом люминесцентной микроскопии.
Факторный анализ показал, что биомасса и доля прокариот, а также длина мицелия являются показателями структуры микробного пула углерода, определяемыми методом люминесцентной микроскопии, которые были ассоциированы с разными типами землепользования для обоих типов почв. Выявленные крайне высокие значения соотношений грибы/бактерии, по-видимому, обусловлены недооценкой биомассы бактериальных клеток используемым методом. Тем не менее полученные результаты демонстрируют, что люминесцентная микроскопия может быть использована в качестве дополнительного подхода к более точным методам оценки микробного пула углерода и позволяет определить влияние различных типов сельскохозяйственного землепользования на размеры и структуру микробной биомассы в почвах.


