Оценка морфо-функционального состояния печени при токсическом гепатите
Автор: Ахмедов М.Д., Аскаров Т.А., Файзиев Ё.Н., Ашурметов А.М., Далимов К.С., Усаров А.М., Исмаилов Ф.М.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 10 (89), 2021 года.
Бесплатный доступ
в данном исследование показана активность цитохромоксидазы при токсических поражениях паренхимы печени. Выявлено, что при повреждении печени при различных сроках токсического гепатита приводят к ингибированию цитохромоксидазы. Установлен уровень коэффициента соответствующий определённому количество повреждённой (или сохранной) паренхимы печени.
Острая печеночная недостаточность, паренхима печени, токсическое поражение, ишемия, животные, митохондрия.
Короткий адрес: https://sciup.org/140260824
IDR: 140260824 | УДК: 616-36.36.001-07:577.15
Текст научной статьи Оценка морфо-функционального состояния печени при токсическом гепатите
Актуальность темы. В настоящее время во всём мире отмечается неуклонный рост числа больных с заболеваниями печени. При этом различная печёночная патология в большинстве случаев сопровождается развитием серьёзных осложнений вплоть до появления печёночной недостаточности [1,2,3]. Несмотря на кажущуюся простоту определения ОПН, на практике диагностировать этот синдром непросто из-за зачастую сложной клинической картины, отсутствия явного отягощающего фактора, трудностей в дифференциальной диагностике с терминальной стадией болезни печени и определении необходимости и целесообразности конкретных терапевтических вмешательств. Диагностика ОПН основывается на данных анамнеза, клинической картине, биохимических изменениях [2,4,14].
Материалы и методы.
Для создания экспериментальной модели гепатоцеллюлярной недостаточности эксперименты были проведены на 110 крысах-самцах линии Вис тар массой 180-220гр. Проведено 3 серий экспериментов:
-
1. Контрольная группа.
-
2. После затравки в дозе 150 мг/100 гр массы внутрибрюшинным введением DL-галактозамина [5,6] (исследования через 12ч.,18ч.,24ч., и 48ч.).
-
3. После затравки внутрибрюшинным введением 0,25 мл/100 гр
массы ССL4 [6,7,8] (исследования через 12ч.,18ч.,24ч., и 48ч.).
Животных забивали декапитацией в холодной комнате. Быстро извлекали печень, промывали и готовили гомогенат в среде, состоящей из 0,25 сахарозы, 2x10-4 М ЭДТА (этилендиаминтетраацетат); 0,01 М трис-НСL буфера с рН 7,4 в соотношении ткани и среды 1:2.
Полярографический анализ проводили со стандартным платиновым электродом Кларка закрытого типа на полярографе LР-7 [9].
В полярографическую кювету объемом 1,1 мл. поочерёдно вносили гомогенат из расчёта 1-2 мг. белка, аскорбат натрия в конечной концентрации 2мМ, ТМДФ- [10] (тетраметиленпарафенилендиамин)-1 мкМ и цитохром-С-[11] 1 мкМ. Скорость дыхания выражали в нмоль О2/минут. мг. белка. Высчитывали прогностический коэффициент (ПК) по формуле: ПК = Цитохром С- Аскорбат Nа / ТМФД - Аскорбат Na
Взвесь ксеногенных гепатоцитов получали комбинированным методом Берри-Фриенд в модификации А.И. Арчакова[12]. Степень морфологической сохранности полученных гепатоцитов оценивали методом световой и фазово-контрастной микроскопии, с предварительной окраской витальным красителем - 0,2% трипановым синим. Цифровой материал обработан методом вариационной статистики [13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Через 12 часов после затравки DL-галактозамином (табл.#1),
Таблица# 1.
Скорость потребления кислорода (в нмоль О2 мин-1 мг.белка) печени экспериментальных животных в различных метаболических состояниях
|
Период исследования |
Аскорбат зависимое потребление О2 |
ТМФД-оксидазная активность |
ЦитохромС-оксидазная активность |
|
Контрольная группа |
10,50±0,15 |
20,00±1,50 |
27,90±3,00 |
|
ДL-галактозамин, через (час):12 |
17,10±0,98* |
21,90±1,10 |
41,80±3,50* |
|
18 |
13,10±0,60* |
17,00±0,60 |
40,01±1,16* |
|
24 |
13,50±0,60* |
15,90±0,60* |
36,82±0,60* |
|
48 |
13,00±0,40* |
15,10±0,80* |
39,01±4,43* |
|
CСL4,через12 час |
13,73±0,37* |
21,90±0,41 |
73,20±3,03* |
|
24 |
11,82±0,41 |
14,85±0,44 |
65,90±2,02* |
Примечание :* - различия между показателями контрольной и опытной групп достоверны (Р<0,05).
полярографические исследования показали скорость аскорбат-зависимого потребления О2 возрастала на 62,8% (Р<0,05), в дальнейшем этот показатель постепенно снижается и к концу эксперимента это увеличение составляет лишь 23,8%. В отличие от неё ТМФД-оксидазная активность гомогената печени постепенно снижается (на 24,5% через 48 часов затравки). Цитохром-С оксидазная активность повышена статистически значимо на 30-50% во все сроки исследования.
Морфологическое исследование ткани печени выявило, что уже через 12 часов после затравки DL-галактозамином (рис.#1)- балочное строение печени несколько нарушено ,контуры гепатоцитов нечёткие.
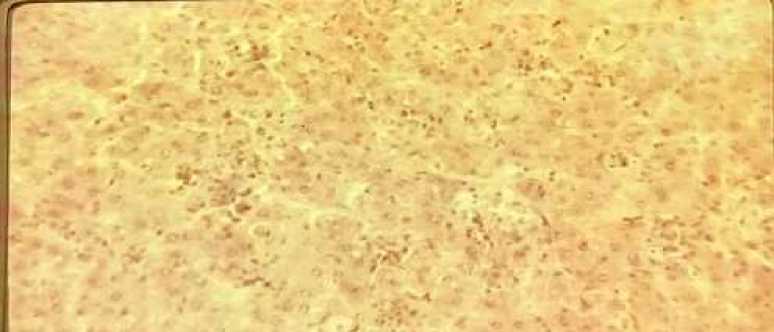
Рис.#1. Очаговая вакуольная дистрофия гепатоцитов с перифокальной лимфо-лейкоцитарной инфильтрацией через 12 часов после затравки DL-галактозамином . Окраска гематоксилином и эозином. Увеличение х 200.
В паренхиматозных клетках наблюдаются обеднение ядер хроматином. Повсеместно встречаются рассеянные по паренхиме круглоклеточные инфильтраты с примесью лейкоцитов. Часто инфильтраты локализуются вблизи венозных сосудов.
С увеличением продолжительности времени от начала затравки (18 и 24 часа) эти изменения усугубляются, и к 48 часам (рис.#2) отражают наиболее тяжёлые повреждения: тотальные некробиотические изменения гепатоцитов.
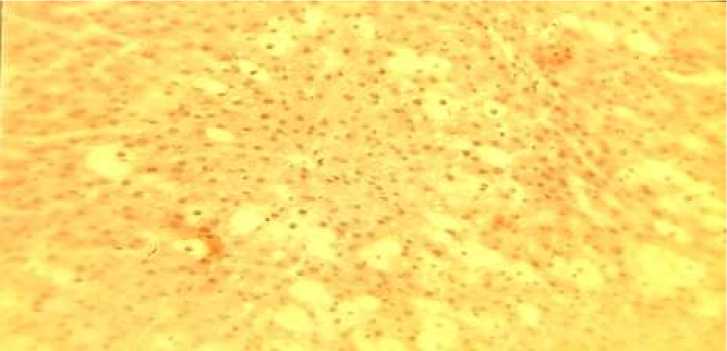
Рис.# 2. Тотальные некробиотические изменения гепатоцитов через 48 часов после затравки DL-галактозамином. Окраска гематоксилином и эозином. Увеличение х 200.
Подсчёт количества жизнеспособных клеток печени показывает, что их количество с увеличением времени от начала затравки уменьшается. Так, через 12 часов количество жизнеспособных клеток составляет 50% а коэффициент 5,05, в то время как через 48 часов составляет 10-12% а коэффициент 13,2 (рис.#3).
Подсчёт количества жизнеспособных клеток печени показывает, что их количество с увеличением времени от начала затравки уменьшается. Так ,через 12 часов количество жизнеспособных клеток составляет 50% а коэффициент 5,05 ,в то время как через 48 часов составляет 10-12% а коэффициент 13,2рис.#3).
Соотношение Цит.С/ТМФА оксидазных активностей и процент жизнеспособных клеток при затравке Д-галактозамином в зависимости от продолжительности её
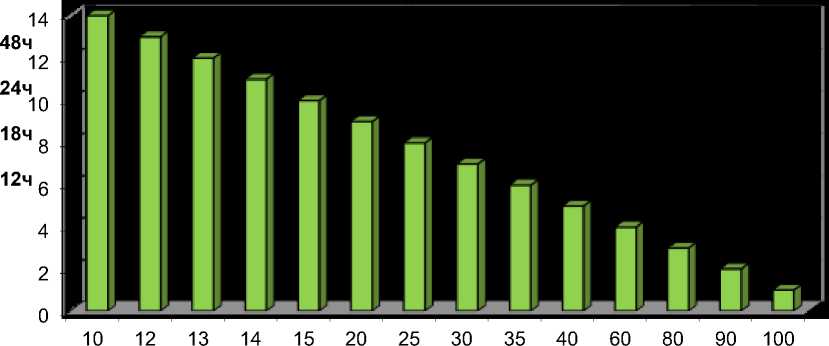
Рис.#3. Подсчёт количества жизнеспособных клеток печени после затравки DL-галактозамином (через 12,18,24 и 48 часов) и их соотношение с коэффициентом.
Наблюдения за этими животными показали, что тяжесть их клинического состояния увеличивается в зависимости от продолжительности времени после затравки. К 48 часам у животных отмечалась выраженная гиподинамия, кровоточивость, снижение болевой чувствительности с последующим наступлением гибели 100% животных.
У крыс, получавших ССL4, нами выявлена такая же динамика изменений скорости потребления О2 в различных метаболических состояниях. Отличительной особенностью данной модели от галактозаминового, была резкая активация цитохром С-оксидазы (табл.1) (превышение на 162,4 и 136,2 % значений интактных крыс через 12 и 24 часа от затравки). В группе с отравлением ССL4 было определенно
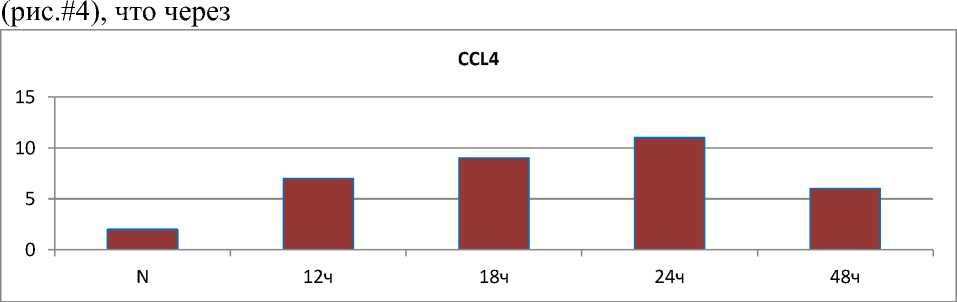
Рис.#4. Величина коэффициента после затравки ССL4 (через 12,18,24 и 48 часов).
-
12 часов после затравки величина коэффициента возрастает до 7,2 , а через 24 часа, когда наблюдалась гибель 50% животных – до 10,9. У выживших крыс в последующем через 36 и 48 часов величина коэффициента снижалась соответственно до 7,0 и 6,0.
Морфологические исследования ткани печени показали, что через 12 часов после затравки ССL4 (рис.#5) встречаются участки некрозов, мелкокапельная вакуолизация гепатоцитов, ожирение клеток по периферии долек.
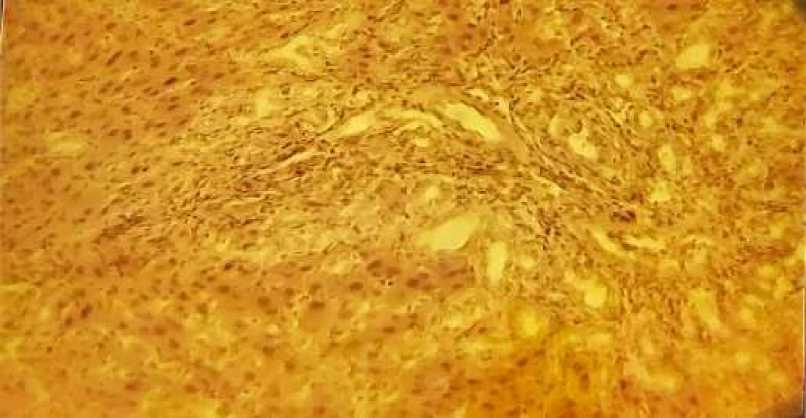
Рис.#5. Встречаются участки некрозов, мелкокапельная вакуолизация гепатоцитов, ожирение клеток по периферии долек через 12 часов после затравки ССL4 . Окраска гематоксилином и эозином. Увеличение х 200.
К 24 часам (рис.#6) эти изменения усугубляются и отражают наиболее тяжёлые повреждения: тотальные некробиотические изменения гепатоцитов.
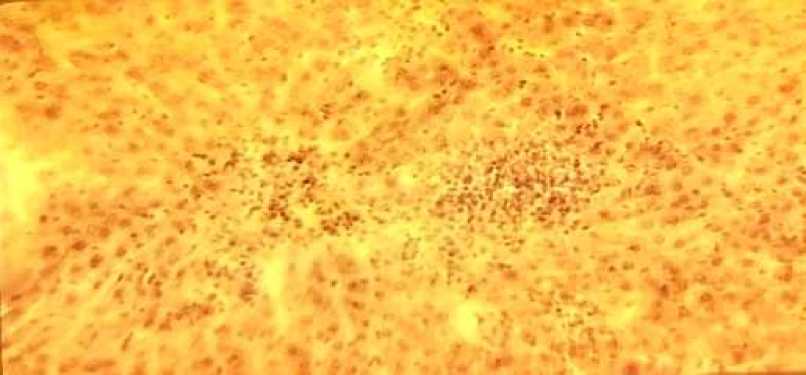
Рис.#6. тотальные некробиотические изменения гепатоцитов через 24 часов после затравки ССL4 . Окраска гематоксилином и эозином. Увеличение х 200.
А на 36 и 48 часу, в сохранившихся участках паренхимы некробиотические изменения гепатоцитов несколько уменьшаются, что соответствует уменьшению коэффициента и наблюдается некоторое улучшение состояния животных (активность, аппетит, опрятность..)
Подсчёт количества жизнеспособных клеток показал (рис.#7) , что через 12 часов после затравки сохраняется 30% интактных клеток,
/коэффициент 7,2/ ,а через 24 часа---15% / коэф.-10,9/.
Соотношение Цит. С/ТМФА оксидазных активностей и процент жизнеспособных клеток при затравке CCL4 в зависимости от продолжительности её
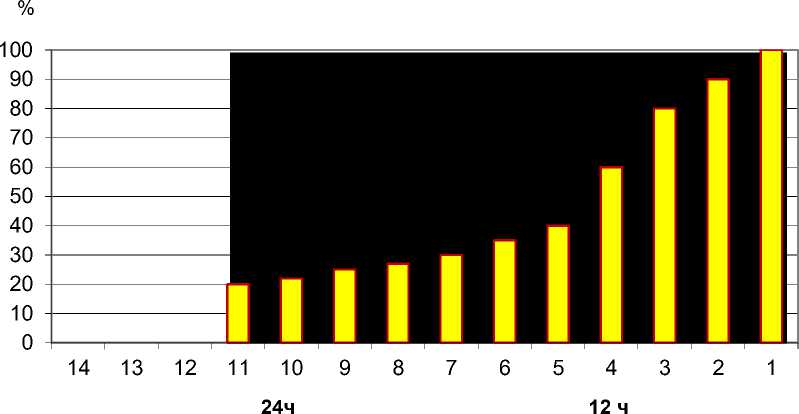
Коэф
Рис.#7. Подсчёт количества жизнеспособных клеток печени после затравки ССL4 (через 12 и 24 часа) и их соотношение с коэффициентом.
Клиническое состояние крыс постепенно ухудшается и к 24 часу достигает своего пика, когда отмечается гибель 50% животных. У выживших к 48 часу частично восстанавливается подвижность, активизируются рефлексы, появляется аппетит, уменьшается кровоточивость, а также несколько увеличивается количество жизнеспособных клеток.
Таким образом, результаты данной серии опытов показали, что используемый нами метод позволяет количественно оценить степень повреждения печёночной паренхимы при отравлении DL-галактозамином, и ССL4. Причём, наибольшая величина коэффициента соответствует наиболее выраженным морфологическим изменениям, количеству жизнеспособных клеток и тяжёлому клиническому состоянию животных.
ВЫВОДЫ:
-
1 .Использование данного теста может служить методом диагностики повреждения печени.
-
2 .Позволит количественно оценить сохранность паренхимы.
-
3 .Создаёт предпосылки для выбора диагностической, лечебной тактики в плане характера и обширности оперативного вмешательства и терапевтических методов коррекции.
-
4 . Определить дальнейшее течение и прогноз данного заболевания у больных.
Список литературы Оценка морфо-функционального состояния печени при токсическом гепатите
- Плеханов А.Н., Товаршинов А.И. Современные подходы к диагностике и лечению печёночной недостаточности (Обзор литературы). Бюллетень ВСНЦСО РАМН, 2016, Том 1,№4(110),с.151-161.
- Черний В.И., Тюменцева С.Г., Шраменко Е.К. Фульминантная печёночная недостаточность. - Донецк, 2010. - 197 c.
- Kumarasena RS, Niriella MA, Ranawaka CK (2016). Predicting acute liver failure in denque infection. Ceylon. Med. J., 61 (1), 35-36.
- Mochida S, Takikawa Y, Nakayama N (2011). Diagnostic criteria of acute liver failure. Hepatol. Res., 41 (9), 805-812.
- Isolation of a Bone Marrow-Derived Stem Cell Line with High Proliferation Potential and Its Application for Preventing Acute Fatal Liver Failure / M. Masa-hiro [et al.] // STEM. CELLS. - 2007. -Vol. 25. - P. 2855-2863.
- Уразметова М. Д., Хаджибаев Ф. А., Мирзакулов А. Г.,Б.Б.Акилов. Методы формирования острой печеночной недостаточности в эксперименте (обзор литературы и собственные исследования) ЖУРНАЛ Вестник экстренной медицины. 2018,Т.11,№4,с.66-71.
- Weber L.W. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model / L.W. Weber, M. Boll, A. Stampfl // Grit. Rev. Toxicol. - 2003. - Vol. 33. - P. 5-36.
- Медведева С.Ю., Сенцов В.Г., Гетте И.Ф., Данилова И.Г. Особенности регуляторных механизмов компенсации диффузного поражения печени при токсическом воздействии четырёххлористого углерода и полигексаметиленгуанидингидрохлорида . Том 15, Клиническая токсикология , 3 мая 2014
- Трушанов А.А. Изготовление в лабораторных условиях закрытого полярографического электрода Кларка. //В кн. Руководство по изучению биологического окисления полярографическим методом. М., Наука, 1973.- С.78-79.
- Earl.E.Jacobs.- Phosphorylation coupled to electron transport initiated by substituted phenylenediamines. Biochem. Biophys. Res.Commun.3, №5,536- 539,1960.
- Ozawa Kazue/ Adaptive response of the liver mitochondrial and its relation to hepatic functional reserve. Evalution by cytochrome a (+ a 3) assay and glucosae intolerance “Asian Med J”, 1980,23 №7, P.499-528.
- Berry M., Friend D. High-yield preparation of isolated parenchimal cells from rat liver // J. Cell. Biol.- 1969.- V. 43,- P. 506- 520.
- Монцевичюте-Эрингене Е.В. Упрощенные математико-статистические методы в медицинской исследовательской работе // Патологическая физиология и экспериментальная терапия. — 1964. — № 4. — С. 71-78.
- Zaccherini G., Weiss E., Moreau R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment. JHEP Rep. 2020 Sep 2;3(1):100176.


