Оценка морфофункционального состояния клеток костного мозга мышей при цитотоксическом воздействии
Автор: Успенская Ю.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария
Статья в выпуске: 11, 2012 года.
Бесплатный доступ
Исследовано цитотоксическое действие доксорубицина в клетках костного мозга мышей in vitro и in vivo, регистрируемое по индукции процессов блеббинга клеточной мембраны и апоптоза клеток, культивируемых в диффузионных камерах.
Мышь, костный мозг, состояние, блеббинг, апоптоз, доксорубицин
Короткий адрес: https://sciup.org/14082113
IDR: 14082113 | УДК: 576.314.38+577.352.5
Текст научной статьи Оценка морфофункционального состояния клеток костного мозга мышей при цитотоксическом воздействии
Введение. Основными механизмами поражения костного мозга, возникающего при действии цитостатиков, являются миелосупрессия в результате глубокого подавления пролиферативной деятельности костного мозга, связанного с гибелью значительной части пролиферирующих клеток и блокированием митотического цикла гемопоэтических элементов, а также свободнорадикальные механизмы, приводящие к индукции окислительного стресса, повреждению липидов и белков мембран и цитоскелета [1, 4].
Одним из ключевых проявлений токсического поражения кроветворных клеток, а также одним из обязательных компонентов морфологической картины запрограммированной и патологической клеточной смерти является феномен блеббинга (пузырения) плазматической мембраны. Развитие блеббинга связывают с нарушением мембран-цитоскелетных взаимодействий, окислением функциональных групп мембранных белков и белков цитоскелета, изменением активности протеинкиназ и протеаз, а также нарушением энергетиче- ского и ионного гомеостаза в примембранной области клетки [5, 8–10]. Блеббинг плазматической мембраны развивается, как правило, в начальной стадии клеточного повреждения и носит при этом обратимый характер. Однако он может стать причиной лизиса клетки или высвобождения во внеклеточную среду мембранных микрочастиц, обладающих прокоагулянтной и антигенной активностью, что имеет важное патогенетическое значение.
Несмотря на многочисленные исследования клеточного механизма повреждающего действия цитостатиков (в частности, доксорубицина) на клетки с высокой репопуляционной способностью, некоторые его аспекты остаются окончательно неизученным. Недостаточно выясненным остается патогенез нарушения мембран-цитоскелетных взаимодействий на ранних этапах обратимого и необратимого повреждения клеток при цитотоксическом воздействии ксенобиотиков антрациклинового ряда.
Цель исследований. Изучение особенностей индукции блеббинга в клетках костного мозга мышей при действии миелотоксического ксенобиотика доксорубицина in vitro и in vivo .
Материалы и методы исследований . Исследования проведены на белых беспородных мышах-самцах массой 20–25 г, по 5 животных в каждой серии.
Регистрация блеббинга плазматической мембраны клеток костного мозга осуществлялась методом фазово-контрастной микроскопии. Под иммерсией (увеличение х 900) анализировалось по 200 клеток в каждом препарате, приготовленном через 5, 15, 30, 45 и 60 мин инкубации клеток костного мозга в концентрации 1 х 10 6 /мл среды 199 при плюс 37 ° С. По морфологии цитоплазматической мембраны дифференцировали: интактные клетки (морфологически неизмененные клетки), клетки в состоянии начального блеббинга (образование небольших пузырей на поверхности мембраны), клетки в состоянии терминального блеббинга (образование крупных пузырей), некротические клетки (в 1,5–2 раза крупнее интактных клеток, отсутствует свечение по периметру клетки, имеют неровную мембрану).
Изучение процессов апоптоза клеток, культивируемых в диффузионных камерах, проводилось методом световой микроскопии. Под иммерсией (х 900) анализировалось по 200 клеток на каждом фильтре, окрашенном гематоксилин-эозином. При этом морфологическими признаками апоптоза считали наличие «карликовых» клеток, кариопикноз, кариорексис, наличие апоптотических телец.
Изучение токсического влияния доксорубицина («Ферейн», Россия) на клетки костного мозга in vitro производилось при совместной инкубации суспензии клеток костного мозга с ксенобиотиком (5 х 10-7 • 10-6 -5 х 10-6 М) в течение 60 мин при плюс 37 ° С, а также при последующем культивировании (5 суток) в диффузионных камерах в перитонеальной полости животных-реципиентов.
Исследование влияния доксорубицина на клетки костного мозга in vivo проводилось при остром однократном введении мышам в максимально переносимой дозе (6 мг/кг) внутрибрюшинно в физиологическом растворе, а также подостром внутрибрюшинном введении в дозе 1/10 LD 50 (0,95 мг/кг) в течение 10 дней с интервалом 24 ч.
Статистическая обработка результатов проведена с использованием t -критерия Стьюдента.
Результаты исследований и их обсуждение. Ранее мы обнаружили, что острое введение доксорубицина мышам in vitro и in vivo оказывает апоптоз-индуцирующий эффект, выявленный по оценке экспрессии фосфатидилсерина на наружной стороне мембраны с помощью FITC-меченого аннексина [2, 3]. Коль скоро известно, что процессы апоптоза сопровождаются блеббингом плазматической мембраны, развивающимся в клетках при токсическом действии ряда ксенобиотиков [11–13], представлялось интересным изучение закономерностей развития данного феномена в условиях цитотоксического действия доксорубицина in vitro и in vivo .
В краткосрочной культуре клеток костного мозга происходила индукция спонтанного блеббинга плазматической мембраны. До 86 % клеток демонстрировали жизнеспособность в течение всего периода инкубации. Инкубирование костномозговых клеток с доксорубицином в концентрациях 5 х 10-7 М, 10-6 М, 5 х 10-6 М приводило к динамическим изменениям плазматической мембраны, проявляющимся образованием мелких пузыреподобных выпячиваний по периметру клетки (начальный блеббинг) и формированием более крупных пузырей (терминальный блеббинг). В концентрации 5 х 10-7 М доксорубицин индуцировал процессы начального блеббинга с первых минут воздействия, тогда как при увеличении концентрации ксенобиотика наибольшей интенсивности блеббинг достигал после 30–45 мин инкубации. Максимальным мембранотоксическим эффектом (регистрируемым по начальному блеббингу плазматической мембраны), но не проявляющим значительного цитолитического действия обладала концентрация доксорубицина 10-6 М (рис. 1).
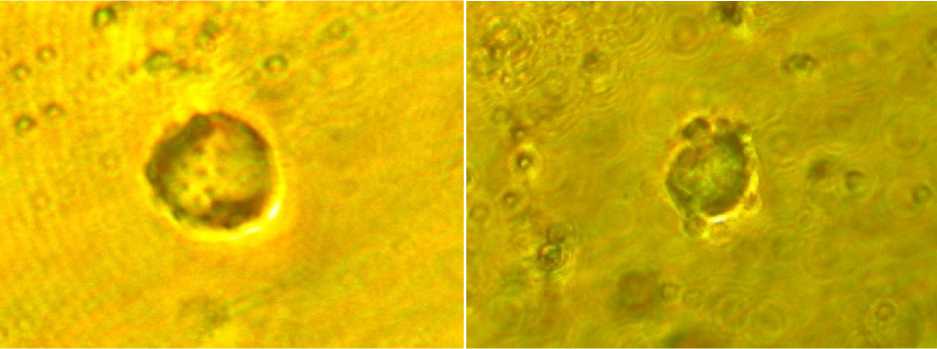
а б
Рис. 1. Индукция начального и терминального блеббинга плазматической мембраны клеток костного мозга при инкубации с доксорубицином (10-6 М, 1 ч): а – 15-я минута инкубации – клетка в состоянии начального блеббинга; б – 45-я минута инкубации – клетка в состоянии терминального блеббинга × 900
Интересно, что процессы терминального блеббинга более отчетливо проявлялись при низких дозах доксорубицина, а с увеличением концентрации ксенобиотика их интенсивность значительно снижалась. В максимальной из тестируемых концентрации (5 x 10 -6 М) доксорубицин оказывал выраженное цитотоксическое действие, проявляющееся развитием некроза (табл.), что согласуется с тем, что умеренное цитотоксическое воздействие индуцирует блеббинг, носящий обратимый характер, а выраженное цитотоксическое воздействие вызывает интенсивный блеббинг и некроз клеток [6, 7].
Мембранотоксичность доксорубицина в отношении клеток костного мозга in vitro и in vivo, % от общего количества клеток
|
Серия |
Показатель |
Время инкубации, мин |
||||
|
5 |
15 |
30 |
45 |
60 |
||
|
Контроль |
Начальный блеббинг |
1,50 ± 0,0 |
1,50 ± 1,06 |
6,33 ± 0,82 |
1,88 ± 0,79 |
1,0 ± 0,47 |
|
Терминальный блеббинг |
0,50 ± 0,33 |
1,25 ± 0,29 |
2,50 ± 0,35 |
2,0 ± 0,53 |
1,58 ± 0,43 |
|
|
Некроз |
7,38 ± 1,57 |
8,38 ± 0,92 |
10,17 ± 1,14 |
10,25 ± 1,46 |
11,50 ± 1,55 |
|
|
ДОК, 5х10-7 М |
Начальный блеббинг |
5,0 ± 0,91 *** |
6,13 ± 1,38 * |
6,33 ± 0,89 |
6,63 ± 1,26 ** |
13,0 ± 1,64 **“ |
|
Терминальный блеббинг |
1,40 ± 0,33 |
1,50 ± 0,31 |
2,10 ± 0,45 |
2,0 ± 0,25 |
1,75 ± 0,27 |
|
|
Некроз |
19,0 ± 2,83 ** |
20,17 ± 3,21“ |
20,67 ± 2,68 * |
21,0 ± 3,74 * |
21,50 ± 2,27“ |
|
|
ДОК, 10-6 М |
Начальный блеббинг |
10,38 ± 3,25 * |
11,20 ± 2,04“ * |
14,10 ± 1,83 *** |
22,10 ± 1,90 **** |
13,90 ± 1,60“ ** |
|
Терминальный блеббинг |
1,08 ± 0,26 |
1,25 ± 0,31 |
1,92 ± 0,33 |
1,92 ± 0,17 |
1,42 ± 0,30 |
|
|
Некроз |
14,90 ± 1,02 *** |
15,0 ± 1,79 ** |
15,60 ± 1,01 ** |
17,10 ± 1,18 *** |
17,60 ± 1,83 * |
|
|
ДОК, 5х10-6 М |
Начальный блеббинг |
7,0 ± 1,41 ** |
5,67 ± 0,41 * |
9,33 ± 0,74 |
5,67 ± 0,54 ** |
5,17 ± 0,89 *** |
|
Терминальный блеббинг |
0,83 ± 0,41 |
1,0 ± 0,35 |
1,50 ± 0,35 |
0,67 ± 0,20 |
0,67 ± 0,54 |
|
|
Некроз |
40,67 ± 2,27 **** |
41,0 ± 2,55 **** |
42,17 ± 0,89 **** |
44,0 ± 0,35 *“* |
44,17 ± 0,41“ ** |
|
|
ДОК, 24 ч |
Начальный блеббинг |
17,0 ± 1,27 *“* |
13,38 ± 0,86“ ** |
12,75 ± 1,71 ** |
11,75 ± 1,67 *** |
8,50 ± 0,85 **“ |
|
Терминальный блеббинг |
2,38 ± 0,36 *** |
2,25 ± 0,37 |
3,63 ± 0,76 |
3,25 ± 0,50 |
1,38 ± 0,28 |
|
|
Некроз |
17,38 ± 1,53 *** |
18,50 ± 1,78“ * |
20,63 ± 0,98 **** |
21,63 ± 1,26 *** |
21,88 ± 1,26“ * |
|
|
ДОК, 10 дней |
Начальный блеббинг |
10,50 ± 2,21 ** |
9,27 ± 1,81 ** |
7,34 ± 1,24 |
5,11 ± 0,41 ** |
4,83 ± 0,89 ** |
|
Терминальный блеббинг |
1,33 ± 0,74 |
1,15 ± 0,20 |
1,49 ± 0,37 |
1,72 ± 0,54 |
1,83 ± 0,74 |
|
|
Некроз |
24,17 ± 1,08 **** |
25,35 ± 1,58“ ** |
26,89 ± 1,83 **** |
28,77 ± 2,06 **** |
30,33 ± 1,08“ ** |
|
Примечание. Достоверность отличий по сравнению с контролем: * Р<0,05; ** Р<0,02; *** Р < 0,01;
**** Р<0,001.
Острое и подострое введение доксорубицина мышам in vivo также сопровождалось индукцией начального блеббинга и некроза, причем максимум начального блеббинга регистрировался на 5-й минуте инкубации с последующим снижением количества блеббингующих клеток при 1- и 10-дневных инъекциях ксенобиотика. Аналогичным образом индукция терминального блеббинга более отчетливо проявлялась на 5й минуте инкубации. Число клеток с морфологическими признаками некроза оставалась достоверно повышенным на протяжении всего периода инкубации с преобладанием интенсивности некроза при подостром воздействии доксорубицина (см. табл.).
Блеббинг-индуцирующий эффект доксорубицина коррелировал с увеличением относительного количества гемопоэтических клеток с морфологическими признаками апоптоза при культивировании их в диффузионных камерах. При этом ксенобиотик проявлял дозозависимый эффект. Максимальная индукция апоптоза отмечалась при использовании доксорубицина в наименьшей концентрации (5 x 10 -7 М) (рис. 2). Это соответствует имеющимся сведениям о том, что чем выше концентрация в клетке молекул с прооксидантной активностью, вызывающих накопление преимущественно нерепарабельных повреждений биомакромолекул клеток, тем выше вероятность индукции не апоптотических, а некротических процессов как варианта пассивной гибели клетки [6].
Таким образом, нами установлен факт наличия дозовой зависимости в характере цитоповреждающего действия ксенобиотика антрациклинового ряда в клетках костного мозга: увеличение дозы доксорубицина сопровождалось наименьшим потенцированием клеточной гибели по пути апоптоза, и, наоборот, применение ксенобиотика в наименьшей концентрации приводило к появлению максимального количества клеток с морфологическими признаками апоптоза.
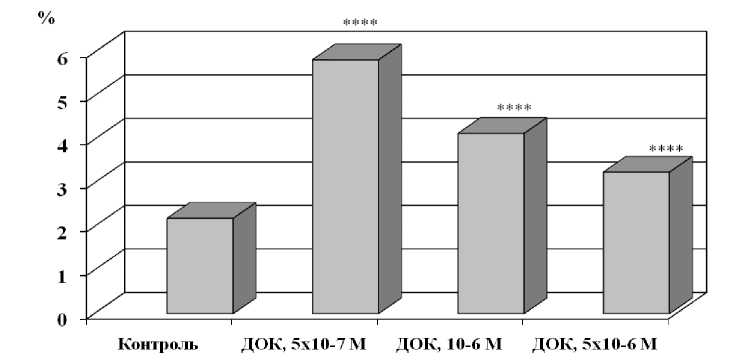
Рис. 2. Влияние доксорубицина на процессы запрограммированной клеточной смерти:
по оси абсцисс: ДОК - инкубация с доксорубицином в концентрации 5 x 10 —7 , 10 6 , 5 x 10- 6 М; по оси ординат -относительное количество клеток с признаками апоптоза
Выявленное цитотоксическое действие доксорубицина сопровождалось потенцированием клеточной гибели по пути апоптоза и динамическими изменениями плазматической мембраны клеток костного мозга (блеббингом), отражающими степень выраженности нарушений мембран-цитоскелетных взаимодействий, и – при увеличении дозы ксенобиотика – разрушением мембраны (некроз).
Дальнейший прогресс в понимании тонких механизмов нарушения мембран-цитоскелетных взаимодействий создаст базу для разработки новых фармакологических подходов в терапии злокачественных заболеваний системы крови, а также значительно расширит наши представления о биологии клеточного повреждения и регуляции функциональной активности клеток.


