Оценка морфологии микроциркуляторного русла и его клеточного микроокружения под влиянием низкоинтенсивного лазерного излучения в условиях экспериментальной раны кожи
Автор: Мнихович Максим Валерьевич, Грачев В.А., Еремин Н.В., Мигляс Владимир Георгиевич, Тернов М.М.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.7, 2012 года.
Бесплатный доступ
Проведено исследование влияния низкоинтенсивного лазерного излучения на состояния микроциркуляторного русла и его клеточного микроокружения в условиях экспериментальной резаной раны кожи. Исследование проводилось с помощью описательной морфологии, гистологического метода и трансмиссивной электронной микроскопии. Показано, что репаративные процессы в резаной ране кожи под воздействием лазерного излучения проходят все классические стадии, однако продолжительность каждой из них значительно сокращается. Под влиянием низкоинтенсивного лазерного излучения в ране кожи уменьшается нейтрофильная инфильтрация, что ведет к сокращению сроков очищения ран от некротических тканей. Гелий - неоновый лазер стимулирует иммунитет через клеточные элементы системы мононуклеарных фагоцитов в кожно - мышечной ране. Лазерная стимуляция изменяет реакцию микроциркуляторного русла, активизируя локальный тканевой кровоток в интактных и регенерирующих тканях за счет включения в кровоток ранее не функционирующих капилляров и более раннего образования новых.
Микроциркуляторное русло, лазер, рана
Короткий адрес: https://sciup.org/140188021
IDR: 140188021 | УДК: 616.5-001.4-091.4:615.849.19
Текст научной статьи Оценка морфологии микроциркуляторного русла и его клеточного микроокружения под влиянием низкоинтенсивного лазерного излучения в условиях экспериментальной раны кожи
Теоретические основы учения о гистогенезе и регенерации позволяют полнее раскрыть сложные процессы, происходящие в области дефекта органа и в прилегающих областях, где возникает сложная по клеточному составу и изменяющаяся во времени гистологическая картина. Мало изучены проблемы межтканевых и межклеточных взаимодействий, пространственно-временная характеристика тканей на разных этапах заживления раны. Регенерация раны рассматривается как результат многофакторных событий. Развитие науки и медицины, позволяет все более детально изучать раневой процесс. Одним из важнейших факторов, открытых при этом является стадийность этого процесса [2, 4, 11]. Практически все репаративные явления проходят на фоне воспалительной реакции, в которой клетки крови и соединительной ткани играют определяющую роль. Воспалительную реакцию с точки зрения морфолога можно подразделить на лейкоцитарную, макрофагальную и фибробластическую стадии. Проблема роли каждого из упомянутых клеточных элементов в воспалении и последующей регенерации многообразна и требует экспериментального изучения по многим направлениям [4, 7, 10]. Соединительнотканные волокна и фибробласты играют важную роль в процессе заживления ран, создание опорно – механического кар- каса и пространственном построении регенерирующей соединительной ткани [2, 5, 11, 13] . Молодая соединительная ткань развивается за счет роста капилляров, которые, в свою очередь, продвигаются за фибробластами и не могут существовать без них. Фибробласт является клеткой наиболее устойчивой к гипоксии и миграция их происходит по гипоксическому градиенту [11].
Цель исследования – изучение связи состояния микро-циркуляторного русла и его клеточного микроокружения под влиянием низкоинтенсивного лазерного излучения (НИЛИ) в условиях экспериментальной раны кожи.
Материалы и методы
Работа проводилась на беспородных белых крысах массой от 100 до 150 г. В области нанесения ран, на правой боковой поверхности тела предварительно выстригался, а затем выбривался участок волосяного покрова. Место нанесения экспериментального повреждения в каждом опыте у всех животных было постоянным. Раны наносились под эфирным наркозом в стерильных условиях. С помощью остроконечных ножниц удалялся лоскут кожи 2,0 х 2,0 см с подкожной клетчаткой.
В эксперименте в качестве источника лазерного излучения использовали аппарат на гелий-неоновой основе
Мнихович М.В., Грачев В.А., Еремин Н.В., Мигляс В.Г., Тернов М.М.
ОЦЕНКА МОРФОЛОГИИ МИКРОЦИРКУЛЯТОРНОГО РУСЛА И ЕГО КЛЕТОЧНОГО МИКРООКРУЖЕНИЯ ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ КОЖИ
ЛГ-75 с длиной волны 0,63 мкм и мощностью на выходе 13 мВт/см2. Облучение проводили 2 раза в неделю в течение 10 минут. Диаметр фокусируемого пятна составлял в среднем 2,0 см.
По окончании экспериментов, в строго определенные сроки (5-е, 10-е, 15-е, 30-е, сутки) животных выводили из опыта согласно «Правил проведения работы с использованием экспериментальных животных» и приказу «О гуманном обращении с экспериментальными животными».
Материал проходил стандартную проводку, заливался в парафин. Парафиновые срезы окрашивались гематоксилином — эозином, по Ван-Гизону, резорцин-фуксином; ретикулярные волокна выявлялись по Футу, определялись РНК по Браше, ДНК по Фельгену, нейтральные PAS и кислые мукополисахариды.
Фрагменты ткани, полученные из различных участков раны были использованы для электронно-микроскопического исследования, при этом материал префиксировали в 2,5% растворе глутарового альдегида, рН 7,3–7,4 в течение 4 часов. Постфиксировали в 1% растворе ОsО4 на 0,1 М фосфатном буфере (рН 7,4). Дегидратацию материала проводили в батарее с возрастающей концентрацией этанола и ацетона. Образцы заключали в заливочную смесь аралдита, аралдита М и эпона- 812. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца.
Для оценки гистологических препаратов использовались основные морфометрические методы: определение абсолютных величин отдельных структур с помощью микроскопической линейки, а также их относительного количества в единице площади с помощью окулярной сетки по Г.Г. Автандилову. При оценке гистологических препаратов определялись следующие морфометрические показатели: количество капилляров на 1 мм площади, диаметр капилляров с последующим расчетом степени капилляризации.
Результаты и их обсуждение
При изучении гистологической картины микроцир-куляторного русла мы получили следующие результаты (таблица 1): как видно из таблицы подсчет количества капилляров на единицу площади к концу лазеротерапии в опытной группе показал существенное увеличение их абсолютного числа – на 49,6% по сравнению с контролем. Одновременно с этим выявлено некоторое уменьшение их диаметра, по сравнению с контролем на 21,5%, а также увеличение их суммарной площади на 27,8%. При этом радиус капиллярной диффузии уменьшался на 7,5%.
У животных контрольной группы, не получавших лазерного воздействия, сосудистая сеть дермы и гиподермы в области нанесения раны увеличивалась за счет расширения капиллярной сети, при этом количество их практически не изменялось.
Достоверно изменяется и плотность капиллярной сети при воздействии лазеротерапии на кожную рану (таблица 2).
Табл. 1. Морфологические показатели после прямого лазерного воздействия на экспериментальную кожную рану (30-е сутки после операции )
|
№№ |
Морфологические показатели |
опыт |
контроль |
|
1 |
Количество капилляров (на 1 мм) |
595±43 |
318±23 |
|
2 |
Диаметр капилляров (в мкм) |
6,9±0,05 |
8,8±0,03 |
|
3 |
Процент площади капилляров |
46,6±1,2 |
38,4±3,0 |
|
4 |
Степень капилляризации |
2,41±0,01 |
1,74±0,06 |
Табл. 2. Динамика изменения числа функционирующих капилляров при воздействии низкоинтенсивным лазерным излучением на экспериментальную кожную рану
|
№№ |
Сроки показатели |
10 сутки |
15 сутки |
30 сутки |
контроль |
|
1 |
Плотность капилляров |
433+86 |
638+79 |
945+52 |
322+55 |
|
2 |
Достоверность |
Р к >0,1 |
Р к >0,1 |
Рк<0,001 |
Рк<0,001 |
Такая реакция капилляров может быть вызвана опосредованным воздействием на сократительные компоненты некоторых клеток эндотелия, располагающихся в ветвлениях капиллярных петель и регулирующих местный кровоток в локальном отрезке этих сосудов.
Микроскопически рана у контрольных групп животных на 5 сутки состоит из трех слоев: поверхностного лейкоцитарно-некротического, фиброзно-лейкоцитарного и слоя молодой грануляционной ткани. Лейкоцитарно-некротический слой содержит скопления фибрина, большое количество расширенных сосудов и сосудистых полостей, скопления лейкоцитов и лимфоцитов, а также очаги деструкции и некроза (рис. 1). Он отделен от молодой грануляционной тонким слоем фибробластов, под которым обнаруживаются поля, состоящие из лейкоцитов, лимфоцитов и фибробластов (Фб) различной степени зрелости (рис. 2).
Грануляционная ткань, выполняющая дно дефекта, состоит преимущественно из лимфоцитов и клеток фибробластического ряда (КФбР). В грануляционной ткани наблюдаются неравномерное расположение сосудов в различных участках, широкие сосудистые полости, в глубоких слоях грануляционной ткани сосуды имеют вертикальный ход. В стенках сосудов выявляются очаги плазматического пропитывания. Вблизи очагов пролиферации эпидермиса обнаруживаются сосуды мелкого калибра, располагающиеся в различных направлениях. В краевых отделах раны наряду с участками десквама-ции некротически измененного эпидермиса имеются зоны с резко истонченным эпидермисом с сохраненным базальным слоем, представленные 1–2 рядами клеток, и небольшие очаги пролиферации эпителиальных клеток. Новообразованный эпидермальный пласт (ЭП) без четкого разграничения на слои проникает под лейкоцитарнонекротический слой грануляционной ткани.
В опытной группе уже на 10 сутки определялась отчетливая регрессия патологических изменений при
Мнихович М.В., Грачев В.А., Еремин Н.В., Мигляс В.Г., Тернов М.М.
ОЦЕНКА МОРФОЛОГИИ МИКРОЦИРКУЛЯТОРНОГО РУСЛА И ЕГО КЛЕТОЧНОГО МИКРООКРУЖЕНИЯ ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ КОЖИ
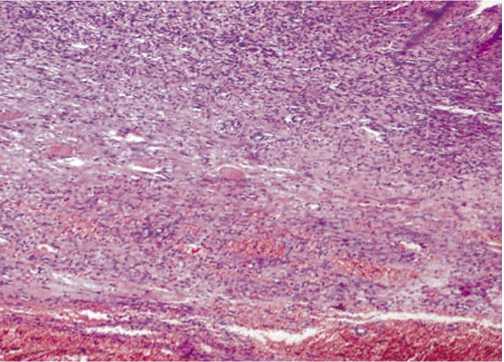
Рис. 1. Морфология раны на 5 сутки после нанесения. Контрольная группа животных. Окраска гематоксилином и эозином; х 120
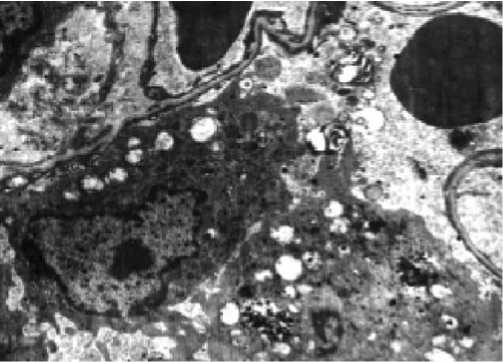
Рис. 2. Ультраструктурные элементы раны на 5 сутки после нанесения. Контрольная группа животных. Контрастирование цитратом свинца; х 2500
высокой активности регенеративных процессов. Зоны предшествующего некроза замещались созревающей грануляционной тканью. Очаговые полиморфноклеточные инфильтраты с примесью нейтрофильных лейкоцитов обнаруживались преимущественно в составе разрозненных масс фибринозного экссудата на поверхности раны. В гиподерме резко сокращалась распространенность экссудативных и деструктивных изменений, приобретающих мелкоочаговый характер. Типичной была активация макрофагов и фибробластов, существенно редуцировалась сосудистая реакция. В формирующемся регенерате в центре раны в поверхностных и глубоких отделах между пучками коллагеновых волокон выявляются лимфоциты, макрофаги и КФбР (рис. 3). Небольшие очаги инфильтрации обнаруживаются и в прилежащей к дефекту дерме. Плотность расположения сосудов здесь высока, но в каудальной области раны она значительно ниже. Отдельные сосуды имеют вертикальный ход. Обнаруживаются также расширенные сосудистые полости (рис. 4).
В контрольной группе раневой процесс отличался более вялой динамикой. Область гнойного воспаления была покрыта сплошным пластом экссудата и продуктов тканевого распада. Достаточно обширные очаги гнойной экссудации и тканевой деструкции выявлялись в различных областях раны, чередуясь с островками формирующейся грануляционной ткани. Обращала на себя внимание стабильность сосудистых расстройств: дилатация капилляров и венул, краевое стояние лейкоцитов, паравазальная гидратация интерстиция. Степень созревания грануляционной ткани была различной – очаги типичной «молодой» грануляционной ткани имели преимущественно поверхностную локализацию.
Раневая полость на 15 сутки у опытных животных заполнена грануляционной ткани. В краевых отделах раны формируется ЭП, наползающий на грануляционную ткань. Отличительной особенностью репаративного процесса является формирование полей соединительной ткани, представленной тонкими, хаотично расположенными пучками КВ. Плотность сосудов и сосудистых полостей остается по-прежнему высокой. В краевых отделах раны выявляются очаги с сохраненным, но резко истонченным эпидермисом, под которым обнаруживаются придатки кожи с высокой плотностью расположения формирующих ЭП эпителиальных клеток, прорастающие над грануляционной тканью в центральные части дефекта. В крупных артериях мышечно-эластического типа и венах отмечали полнокровие. Артериолы также полнокровны, просвет их щелевидный (рис. 5). Проницаемость сосудистой стенки – умеренная, периваскулярный и интерстициальный отек незначительный. Мышечные волокна извитые.
В контрольной группе на 15 сутки патологические изменения были значительно пролонгированы. Поверхность раны контрольной группы животных была локально покрыта экссудатом, в гиподерме разрастание и созревание грануляционной ткани сочеталось с персистенцией очаговых воспалительно-деструктивных явлений. Выявлялись локусы некроза жировой ткани, скопления нейтрофилов. Особенности коллагеногенеза и архитектоники зрелой соединительной ткани, представленной преимущественно плотными фиброзными тяжами (рис. 6), свидетельствовали о риске развития грубого рубца.
Через 30 дней у животных опытной группы наступает полная эпителизация раны. На месте повреждения формируется соединительнотканный рубец, покрытый блестящими чешуйками. Рубец тонкий, подвижный и имеет гладкую поверхность. Новообразованная соединительная ткань состояла из нежных пучков коллагеновых волокон различных клеточных элементов (активных фибробластов, макрофагов, лимфоцитов и др.). Площадь, занимаемая грануляционной ткани, уменьшена. Практически только в центральной части раны сохраняются небольшие очаги с большим количеством капилляров, переполненных кровью. Между капиллярами выявляются круглоядерные клетки, большое количество периваску-

Мнихович М.В., Грачев В.А., Еремин Н.В., Мигляс В.Г., Тернов М.М.
ОЦЕНКА МОРФОЛОГИИ МИКРОЦИРКУЛЯТОРНОГО РУСЛА И ЕГО КЛЕТОЧНОГО МИКРООКРУЖЕНИЯ ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ КОЖИ
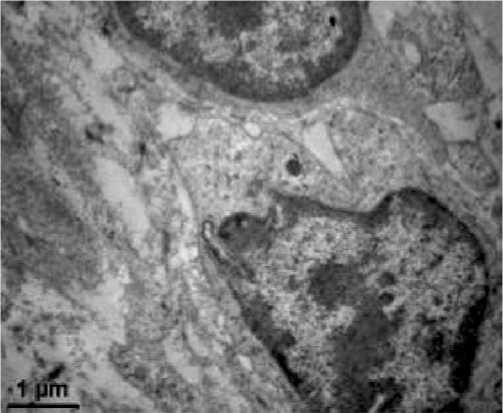
Рис. 3. Ультраструктурные элементы раны на 10 сутки после нанесения. Опытная группа животных. Контрастирование цитратом свинца; х 4500
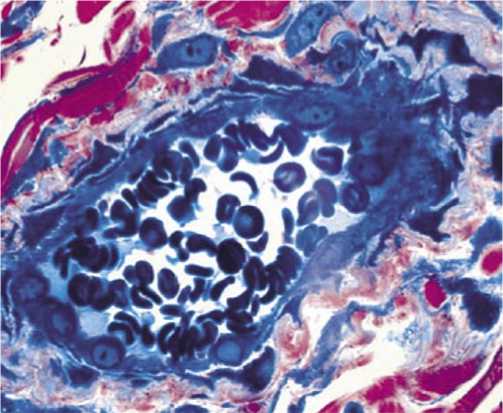
Рис. 4. Полнокровие сосудов с очагами пролиферации эндотелия в опытной группе животных на 10 сутки. Полутонкий срез. Окраска азур 2-фуксином. х 400
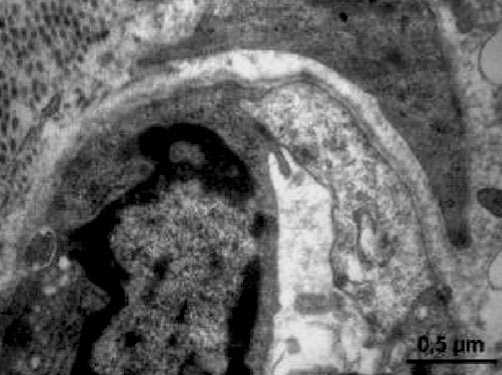
Рис. 5. Ультраструктура артериолы в гиподерме в опытной группе животных на 15 сутки эксперимента. Контрастирование цитратом свинца; х 4500
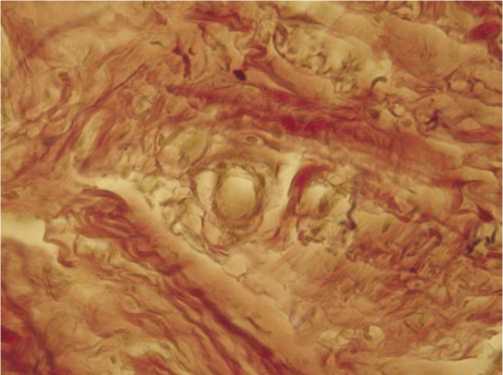
Рис. 6. Хаотичное расположение соединительно тканных элементов в контрольной группе животных на 15 сутки опыта. Формирование рубца. Окраска пикрофуксином; х 240
лярных форм тучных клеток (рис. 7) и в небольшом объеме – КФбр различной степени зрелости, расположенные хаотично. Волокнистая строма в краевых отделах раны представлена тонкими неупорядоченно расположенными коллагеновыми и ретикулиновыми волокнами. В более глубоких отделах грануляционной ткани содержатся более плотные пучки КВ, расположенные параллельно поверхности дефекта. КВ формирующегося регенерата проникают в виде пучков в подлежащую соединительную ткань кожи. Между КВ располагаются фибробласты с резко расширенными цистенрнами эндоплазматической сети (рис. 8) и фиброциты, в основном ориентированные своей длинной осью параллельно пучкам коллагеновых волокон. В краевых отделах раны на значительном протяжении обнаруживается новообразованный утолщенный
ЭП. Он четко разделяется на слои и простирается над участками рубцовой ткани, отличающейся от таковой в предыдущих сериях эксперимента характером расположения КВ и цитоархитектоникой. КВ не формируют плотные пучки, между ними очагами располагаются КФбР и единичные сосуды.
В контрольной группе эффект торможения регенерационного процесса достаточно выражен. Края раны сильно гиперемированы, значительно выдаются над окружающей кожей и имеют неровную поверхность. Образующийся струп имеет вид толстого фрагментированного слоя. Он неплотно прилегает к краям раны и из под него долгое время выделяется серозно-гнойный экссудат. В контрольной группе образующийся рубец имеет неровную поверхность и значительно выступает над окружа-
Мнихович М.В., Грачев В.А., Еремин Н.В., Мигляс В.Г., Тернов М.М.
ОЦЕНКА МОРФОЛОГИИ МИКРОЦИРКУЛЯТОРНОГО РУСЛА И ЕГО КЛЕТОЧНОГО МИКРООКРУЖЕНИЯ ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ КОЖИ
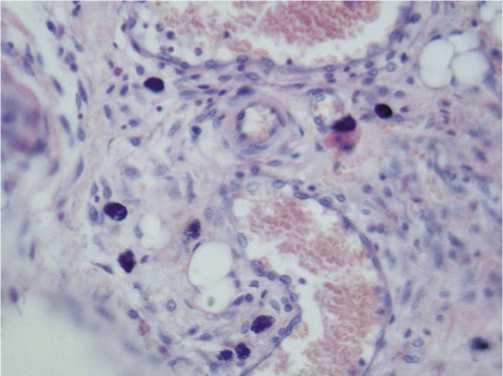
Рис. 7. Периваскулярное расположение тучных клеток и полнокровие сосудов в опытной группе животных на 30 день опыта. Окраска гематоксилином и эозином; х 240
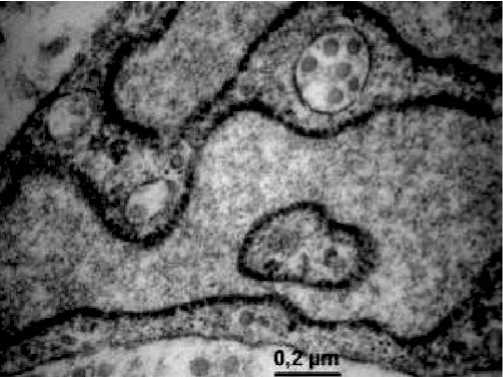
Рис. 8. Ультраструктура фибробласта:резко расширенные цистерны ЭПС в гиподерме в опытной группе животных на 30 сутки эксперимента. Контрастирование цитратом свинца; х 25000
ющей кожей, заметно деформируя ее. Микроскопически наблюдаются три процесса в регенерации полнослойной кожной раны: реорганизация грануляционной ткани, эпителизация, формирование и перестройка рубца. Дно раны выполнено грануляционной тканью с большим количеством сосудов, сохраняющих вертикальное расположение. Определяются участки без эпителизации с плотной фиброзной тканью, представленные пучками параллельно расположенных КВ, между которыми располагаются единичные Фб. Такие участки могут граничить с зонами новообразованного эпидермиса. Плотность расположения сосудов уменьшена. В краевых отделах раны на значительном протяжении обнаруживается новообразованный эпидермис с четким разделением на блестящий и базальный слои, простирающийся над участками соединительной ткани, состоящей из КВ, расположенных параллельно поверхности дефекта. К таким участкам прилежат пласты материнской кожи, имеющие истонченный эпидермальный слой, в дерме сохранены волосяные луковицы. В глубоких отделах дермы определяются расширенные сосуды, закупоренные плотными базофильными массами. Мышечная ткань вблизи зоны дефекта – с деструктивно измененными мышечными волокнами, между которыми определяются тяжи новообразованной соединительной ткани.
Данные визуальных наблюдений находятся в соответствии с микроскопическими изменениями, происходящими в области повреждения.
Таким образом, морфологические исследования показали уменьшение экссудативных явлений, микро-циркуляторных расстройств и нейтрофильной инфильтрации в области раны под действием НИЛИ в ранние сроки эксперимента. В более поздние сроки (начиная с 7 суток) НИЛИ способствует формированию полноценных грануляций, богатых новообразованными сосудами. Характерно, что созревание соединительной ткани под действием таких физиотерапевтических процедур происходит более равномерно по всей зоне дефекта, в то время как у животных, не получавших облучения НИЛИ, на периферии зоны поражения и под новообразованным эпителием расположена более зрелая соединительная ткань, а в центре и дне до 15 суток сохраняются очаги кровоизлияний, лейкоцитарная инфильтрация, отек, нарушения микроциркуляторного русла в виде застойного полнокровия, краевого стояния лейкоцитов, набухания клеток эндотелия. На 30 сутки эксперимента в грануляционной ткани и в дерме прилежащей интактной кожи у крыс основной группы периваскулярно обнаруживается большое количество тучных клеток.
Нам представляется следующая схема ауторегуляции репаративного процесса, по которой сначала происходит резорбция макрофагами продуктов распада коллагеновых фибрилл; затем индукция коллагеноге-неза путем клеточных контактов между макрофагами и фибробластами. По мере накопления коллагена происходит ингибиция фибриллогенеза, что и является заключительным этапом процесса ауторегуляции. В регуляции репаративных процессов велика роль межклеточных контактов и межклеточных взаимодействий. Очевидно, что от них во многом зависит течение и исход фибропластических процессов, сбалансированность коллагенообразования. Кроме контактов макрофагов с фибробластами, о которых уже говорилось, во все фазы регенерации обнаружены лимфоцитарно – фибробластические контакты и макрофагально – тучноклеточные ассоциации. Предполагается, что лимфоцитарно – фибробластические контакты имеют значение в пролиферативной активности фибробластов и служат одним из механизмов контроля правильного развития клеток фибробластического ряда. Во втором случае предполагается , что клетки в ассоциациях могут
Мнихович М.В., Грачев В.А., Еремин Н.В., Мигляс В.Г., Тернов М.М.
ОЦЕНКА МОРФОЛОГИИ МИКРОЦИРКУЛЯТОРНОГО РУСЛА И ЕГО КЛЕТОЧНОГО МИКРООКРУЖЕНИЯ ПОД ВЛИЯНИЕМ НИЗКОИНТЕНСИВНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ КОЖИ обмениваться своим содержимым. Кроме того, выявляются некоторые особенности изменений взаимоотношений клеток разных тканей при регенерационном гистогенезе. Рыхлая соединительная ткань кожи представляет собой многодифферонную структуру, в состав которой входят макрофаги, гранулоциты, тканевые базофилы, плазмоциты. Все они имеют разную степень дифференцировки и специфическую ультраструктур-ную организацию. Фибробласты составляют основной дифферон соединительной ткани . При заживлении ран устанавливается корреляция между клетками одной линии дифференцировки, а также между клеточными элементами различных дифферонов. Взаимодействия осуществляются путем межклеточных соединений, с помощью растворимых медиаторов (лимфокины, монокины, фиброкины и др.), нерастворимых структурных медиаторов (коллагеновые волокна, протеогликаны, гликопротеины), а также продукты распада клеток и промежуточного вещества. При заживлении ран клетки основного фибробластического дифферона постепенно занимают ведущее место в грануляционной ткани.
Таким образом, регенерация, как правило, происходит за счет основного клеточного дифферона ткани, однако в тесном взаимодействии с клетками дополнительных дифферонов. Известно, что разные средства стимуляции регенеративных процессов, по- разному изменяли продолжительность и выраженность его стадий, т. е. влияния на внутреннюю структуру процесса, клеточно – тканевой состав регенерата.
Заживление раны характеризуется комплексом процессов, специфичных для каждого уровня организации живого. В замещении кожно-мышечного дефекта участвует особая структура – «грануляционная ткань». Она является высокоорганизованной развивающейся системой с несколькими источниками происхождения ее клеточных дифферонов и органных структур (кровеносных сосудов). Это позволяет выделить ее в особый тип временно существующей органно – тканевой структуры, осуществляющей регенерацию по заместительному типу в специализированных тканях. Регуляция развития «грануляционной ткани» обеспечивается не только местными клеточными и тканевыми, но и общеорганизменными факторами.
Репаративные процессы в резаной ране кожи под воздействием лазерного излучения проходят все классические стадии, однако продолжительность каждой из них значительно сокращается.
Под влиянием НИЛИ в ране кожи уменьшается нейтрофильная инфильтрация, что ведет к сокращению сроков очищения ран от некротических тканей.
Гелий – неоновый лазер стимулирует иммунитет через клеточные элементы системы мононуклеарных фагоцитов в кожно – мышечной ране.
Лазерная стимуляция изменяет реакцию микро-циркуляторного русла, активизируя локальный тканевой кровоток в интактных и регенерирующих тканях за счет включения в кровоток ранее не функционирующих ка- пилляров и более раннего образования новых.
Список литературы Оценка морфологии микроциркуляторного русла и его клеточного микроокружения под влиянием низкоинтенсивного лазерного излучения в условиях экспериментальной раны кожи
- Васильев Г.И., Иванова И.А., Тюкавкина С.Ю. Цитокины -общая система гомеостатической регуляции клеточных функций//Цитология. 2001. Т. 43. № 12. -С. 1101-1111.
- Гаршин В.Г., Аничков Н.Н, Волкова К.Г. Морфология заживления ран. -М. -1951. 125 с.
- Данилов Р. К., Боровая Т. Г., Клочков Н. Д. Экспериментально-гистологический анализ гистогенеза и регенерации тканей (некоторые итоги ХХ в. и перспективы дальнейших исследований)//Морфология. 2000. Вып. 4. -С. 7-15.
- Карлсон Б.М. Регенерация. -Наука. -М., 1986. -259 с.
- Кузин М.И., Шимкевич Л.Л. Патогенез раневого процесса//Раны и раневая инфекция/Под ред. М. И. Кузина, Б. М. Костюченка. М.: Медицина, 1990. -С. 90-124.
- Мурзабаев Х.Х., Кашапов И.Г. Способ дозированной передачи кинетической энергии снаряда повреждаемым тканям//Морфология. 2001. Т. 120. -С. 83-84.
- Полежаев Л.В., Лиознер Л.Д. Регенерация и развитие. -М. -Наука. -1982. -С. 167.
- Пустошилова Н.М., Путинцева Н.И., Романов В.П., Лебедев Л.Р. Гранулоцитарный колониестимулирующий фактор и его рецептор//Успехи современной биологии. 2001. Т. 121. № 6. -С. 576-588.
- Раны и раневая инфекция/Под ред.М.И Кузина, Б.М.Костиченко, М., 1981. -С.68-70
- Современные проблемы регенерации.//Матер. П Всесоюзн. школы молодых ученых и специалистов по современным проблемам регенерации/Под ред. Г. Л. Билича, В.Э. Коллы. -Йошкар-Ола, 1982. -298 с.
- Шехтер А.Б., Берченко Г.Н., Николаев А.В. Грануляционная ткань: воспаление и регенерацияю.//Арх. патологии. -1984. -№ 2. -С. 20-29.
- Goldberg A.F., Barka T. Acid Phosphatase activity in human blood cells//Nature. 1962. Vol. 195. -Р. 287-299.
- Astaldi G.,Verga L. The glycogen content of the cells of lymphatic leukemia//Acta haematol. 1957. Vol. 17. N 3. -Р. 129-136.


