Оценка остеоинтеграции коллагеновой мембраны при реконструкции связочного аппарата коленного сустава (экспериментальное исследование)
Автор: Мурдалов Э.Э., Лычагин А.В., Тимашев П.С., Липина М.М., Калинский Е.Б., Купряков А.П., Бобров Д.С., Погосян Д.А., Шехтер А.Б., Файзулин А.Л., Сережникова Н.Б., Антошин А.А., Ермилов И.В., Подлесная А.А., Кудрачев Т.Р., Магданов А.М., Зотов С.Е., Шкредина М.И., Шубкина А.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 2 (52), 2023 года.
Бесплатный доступ
Введение. Повреждения связочного аппарата являются наиболее частой патологией коленного сустава. Несмотря на то, что реконструкция связок с использованием сухожильных аутотрансплантатов для стабилизации сустава успешно применяется в клинической практике, у данной методики существует ряд недостатков. В связи с этим остаётся актуальной разработка новых методик восстановления целостности связочного аппарата с применением биоматериалов.Цель исследования. Оценка остеоинтеграции коллагеновой мембраны при реконструкции передней крестообразной и наружной коллатеральной связок коленного сустава в эксперименте на животной модели.Материалы и методы. В экспериментальное исследование было включено 18 особей кроликов породы Советская Шиншилла мужского пола. Возраст животных - от 7 до 12 месяцев. Вес животных- от 2,5 до 4,0 кг. Всем животным была выполнено оперативное вмешательство - реконструкция передней крестообразной (ПКС) и наружной коллатеральной связок (НКС) коленного сустава. Все прооперированные животные были разделены на три группы выведения - 15 дней (6 особей), II группа- 30 дней (6 особей), III группа - 60 дней (6 особей). После выведения животных из эксперимента было проведено гистологическое исследование препаратов с помощью универсального микроскопа LEICA DM4000 B, оснащенного видеокамерой LEICA DFC7000 T.Результаты. Во всех группах выведения в костной ткани вокруг имплантата отмечается регенерация костных трабекул, из чего следует, что имплантат обладает высокими остеоинтеграционными характеристиками. Патологических изменений в окружающих имплантат тканях не выявлено ни в одной из групп выведения, что указывает на высокую биосовместимость имплантированного материала.Заключение. Коллагеновая мембрана, разработанная с применением коллагена I-го типа, может быть применена в хирургическом лечении патологий интра- и экстраартикулярного связочного аппарата, а дальнейшие исследования и доработка техники производства и применения данного материала может открыть новые возможности в ортопедической практике. Современные подходы тканевой инженерии и регенеративной медицины, в частности использование коллагеновых биополимеров, являются многообещающими дополнениями к уже применяемым в данной области медицины.
Коллаген, интра и экстраартикулярные повреждения связок, биополимеры, остеоинтеграция
Короткий адрес: https://sciup.org/142238953
IDR: 142238953 | УДК: 59.084 | DOI: 10.17238/2226-2016-2023-2-32-40
Текст научной статьи Оценка остеоинтеграции коллагеновой мембраны при реконструкции связочного аппарата коленного сустава (экспериментальное исследование)
Связки суставов — это пучки плотной волокнистой соединительной ткани, стабилизирующие и ограничивающие, либо направляющие движение костей суставов. Их повреждение может серьезно нарушить стабильность сустава, и, как следствие, привести к разрушению внутрисуставных структур и нарушению его функции, что свою очередь значительно снижает качество жизни [1, 2].
На травмы связочного аппарата приходится 30 процентов от всех травм опорно-двигательного аппарата. Для решения данной проблемы на сегодняшний день разработаны и широко применяются многочисленные методы и материалы для реконструктивных операций, основанные на проведении пластики аутологичными тканями, ксено-, алло- и синтетическими трансплантатами [3]. Однако, все эти методы реконструкции, наряду с преимуществами, имеют и недостатки. Так, например, забор аутотрансплантата неминуемо является травмирующим фактором стороны забора, что может быть причиной боли. Недостатками аллотрансплантата и ксенотрансплантата являются потенциальный риск иммунного отторжения и передачи инфекций [4]. При применении синтетических материалов возможна потеря механической прочности со временем, недостаточная интеграция в ткани и ранние разрывы [5]. В последнее время тканевая инженерия стала многообещающим и наиболее актуальным направлением для преодоления перечисленных проблем [6]. Рост возможностей и актуальность создания структуры с биологическими и физико-механическими свойствами схожими со здоровой связкой отражает увеличение числа проводимых исследований в данной области. Несмотря на разнообразие исследуемых материалов, предложенных для тканевой инженерии связок и сухожилий, до применения в клинической практике они пока не дошли [8], что подтверждает необходимость дальнейшей доработки и оптимизации тканеинженерных каркасов связок и сухожилий до клинического применения [23].
Идеальный биологический каркас для реконструкции связок должен быть биосовместимым и биоразлагаемым, не только обеспечивая немедленную стабильность сустава, но и способствуя формированию ктуры подобной нативной связки и интегрироваться в кость в костных туннелях [18, 19].
Наиболее распространенным и очевидным выбором для тканевой инженерии (ТИ) связок и сухожилий является коллаген I типа, учитывая его преобладание в нативной ткани [9, 10-13]. Он образует соединительную ткань, на которой пролиферируют фибробласты [14, 15]. По этой причине коллаген был первым натуральным материалом каркаса, который использовался при реконструкции связок [14]. Очищенный коллаген, полученный из тканей животных, требует перекрестного связывания для удаления чужеродного антигена, предотвращения потенциальной передачи болезни, повышения его механической прочности и замедления скорости его деградации [16].
Коллаген применяется в различных формах, таких как мембраны, губки и филлеры. Из них большой интерес для хирургических нужд представляют мембраны, так как они обладают достаточными механическими свойствами [17]. Практически во всех сферах хирургии проводятся исследования по использованию коллагеновой мембраны для дальнейшего внедрения в клиническую практику, так, например в оториноларингологии, в стоматологии, в урологии и т.д. [24, 25, 26].
Целью данного исследования является оценить остеоинтеграцию коллагеновой мембраны при реконструкции передней крестообразной и наружной коллатеральной связок коленного сустава в эксперименте на животной модели.
Материалы и методыДизайн эксперимента.
В настоящем исследовании экспериментальной моделью являются кролики породы «советская шиншилла» весом 2,5-4,0 кг (возраст от 7 до 12 месяцев, 18 особей, самцы). Все методы в работе были выполнены в соответствии с соответствующими руководящими принципами и правилами. Проведение работы регламентировано Приказом Министерства высшего и среднего специального образования СССР № 742 от 13.11.1984 г., утвердившего «Правила проведения работ с использованием экспериментальных животных». Содержание животных осуществлялось в соответствии с требованиями ГОСТ P от 02.12.2009 53434-2009 «Принципы надлежащей лабораторной практики (GLP)». Кормление животных проводилось по нормативам в соответствии с видом животного, без специализированного корма (например, содержащего добавки для стимуляции регенерации).
Всем особям выполнено оперативное вмешательство – реконструкция передней крестообразной (ПКС) и наружной коллатеральной связок (НКС) коленного сустава. В зависимости от сроков выведения из эксперимента сформированы
3 группы: I группа – 15 дней (6 особей), II группа– 30 дней (6 особей), III группа – 60 дней (6 особей). Число животных в каждой группе – 18 штук.
В качестве материала для реконструкции была использована коллагеновая мембрана, созданная в Институте регенеративной медицины Сеченовского Университета. Изделие представляет собой мембрану из коллагена 1 типа, полученного из связок крупного рогатого скота. Химически сшитое при помощи глутарового альдегида. Размеры мембраны – 15х4х0.3 см в сухом виде (могут быть скорректированы интраоперационно). Мембрана прошла физико-химические и биологические испытания in vitro и in vivo [22].
По истечении указанного срока, животные выводились из эксперимента путем медикаментозной эвтаназии летальной дозой ксилазина гидрохлорида. Забор экспериментального сегмента (коленный сустав) проводился путем высокой резекцией бедренной кости и низкой резекции костей голени для предотвращения повреждения коллагенового имплантата. Макропрепарат выделялся со всеми слоями мягких тканей.
Морфологический анализ образцов коллагеновой мембраны, имплантированной в туннели большой берцовой и бедренной костей, а также в мягкие ткани проводился для каждого срока выведения животного из эксперимента в соответствии с выбранной группой (I, II, III) .
Этапы анализа образцов:
-
1. Фиксированные в 10% нейтральном забуференном формалине ткани декальцинировали в течение 3 недель, после чего заливали в парафиновые блоки.
-
2. Срезы толщиной 4-5 микрометров окрашивали гематоксилином и эозином, сафранином О / Fast Green и пикросириусом красным, после чего исследовали с помощью универсального микроскопа LEICA DM4000 B, оснащенного видеокамерой LEICA DFC7000 T. Работа камеры под управлением программного обеспечения LAS V4.8 (Leica Microsystems, Германия).
-
3. Образцы изучали методами стандартной оптической и фазово-контрастной микроскопий. Фотографии при малом увеличении получали с использованием USB микроскопа Bresser.
-
4. Статистический анализ экспериментальных данных проводился с использованием программного обеспечения GraphPad Prism 8.00 для Windows (GraphPad Software, США). Различия оценивали с помощью теста Краскела-Уоллиса с тестом множественного сравнения Данна. P-значения ≤0,05
В каждом препарате оценивались морфологические признаки регенерации и воспаления в зонах фиксации и прохождения имплантата в большой берцовой и бедренной костях (резорбция, разрыхление имплантата, краевая воспалительная реакция, инфильтрация толщи имплантата, фиброзная капсула вокруг имплантата, регенерация кости вокруг имплантата), а также в окружающих имплантат тканях, коже и мышцах (резорбция, разрыхление имплантата, краевая воспалительная реакция, инфильтрация толщи имплантата, фиброзная капсула вокруг имплантата) по 5-балльной шкале (0 - нет, 4 - максимальная интенсивность).
считались статистически значимыми. Результаты статистического анализа были представлены в виде графов соединенных медианных значений и 95% ДИ.
Хирургический протокол.
Эксперимент по реконструкции ПКС и НКС проводили в асептических условиях. После индукции спинальной анестезии раствором Лидокаина 3% коленный сустав правой задней конечности подвергали медиальной парапателлярной артротомии. Производился латеральный вывих надколенника с последующей визуализацией структур коленного сустава и повреждение скальпелем ПКС в месте ее прикрепления к бедренной кости. Затем, выполнялось формирование трёх сквозных костных тоннелей диаметром 2,0 мм для проведения коллагенового имплантата (туннель №1- медиальная поверхность проксимального метаэпифиза большеберцовой кости; туннель №2 - медиальная поверхность латерального мыщелка бедренной кости; туннель №3 - проксимальный отдел большеберцовой кости (дистальнее тоннеля №1), рисунок 1б). После рассверливания через все тоннели последовательно была проведена лигатура-проводник и устанавливался во все тоннели последовательно коллагеновый имплант толщиной 1 мм, шириной 3 мм и длинной 70 мм, имплантат был промеделирован в необходимые размеры инстраоперационно. Таким образом, часть коллагенового импланта находиласть интраартикулярно, а часть — экстра-артикуляно. Оставшиеся снаружи тоннелей свободные концы импланта сшивались между собой отдельными узловыми швами (Рисунок 1а). Разрезы ушивали послойно.
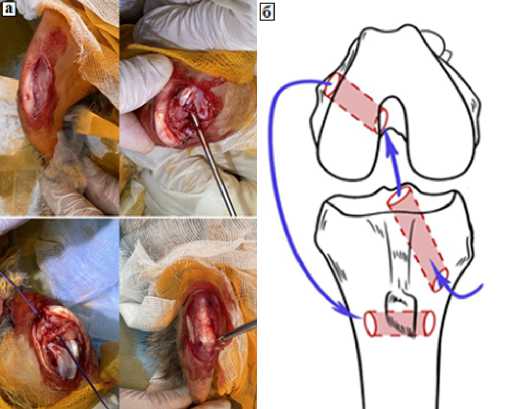
Рисунок 1. а) этапы хирургической операции; б) Схема костных туннелей.
Послеоперационный период.
После выведения из анестезии животных помещали в предварительно маркированную клетку.
Мониторинг и динамика заживления послеоперационных ран выполнялись при перевязках. Перевязки проводились с применением растворов антисептиков, ежедневно в первые 4 суток после операции, далее через день, в течение 12 суток после операции. В течение первых 4-х суток после операции всем особям проводилась анальгетическая терапия, с применением метамизола натрия 50% по 0,4 мл подкожно, и антибактериальная терапия антибиотиками широкого спектра действия (цефтриаксон в растворе прокаина 5%). Оценивалось общее состояние особей, а также проводился физикальное обследование коленного сустава в течение всего периода наблюдения.
Результаты эксперимента.
В послеоперационном периоде инфекционных осложнений не наблюдалось, умеренный отек мягких тканей области операции сохранялся не более 4-х недель после операции и не наблюдался более ни у одной особи на всех остальных точках контроля. У всех особей в послеоперационном периоде отмечалась удовлетворительная стабильность коленного сустава, а объем активных и пассивных движений соответствовал нормальному диапазону.
Результаты морфологического исследования.
Группа I (15 суток после имплантации).
Вокруг имплантата формируется соединительнотканная капсула разной толщины и зрелости в разных образцах, которая состоит из продольно ориентированных коллагеновых волокон и фибробластов между ними (рис. 2 а, б). Следует отметить, что рядом с капсулой имплантата наблюдается костная регенерация: формируются длинные тонкие костные трабекулы с остеобластами и большим количеством остеоцитов (рис. 2 в, г). На данном сроке отмечается хороший уровень резорбции имплантата – примерно 1/3 его резорбирована.
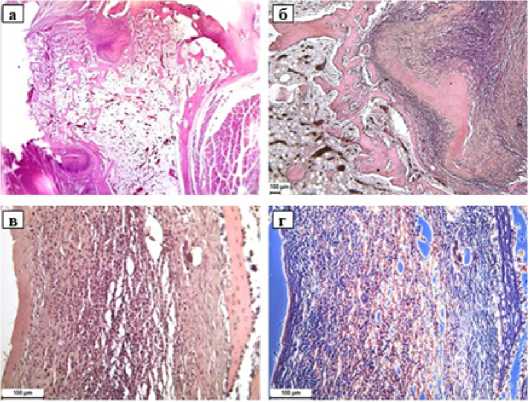
Рисунок 3. Коллагеновый имплантат в туннеле кости. 15 суток после операции. а) Общий вид эпифиза б/б кости. Сверху под суставным хрящом и слева у основания головки видны округлые фрагменты имплантата. Увеличение 30x; б) Справа находится участок имплантата в процессе резорбции, слева оставшиеся и новообразованные костные трабекулы.
Стандартная световая микроскопия, увеличение 50x;
-
в) Справа видна новообразованная костная трабекула, под ней находится фиброзная капсула имплантата, а ближе к центру начинается краевая зона имплантата с разрыхлением коллагеновых волокон и их клеточной инфильтрацией. Стандартная световая микроскопия, увеличение 200x;
-
г) Тот же участок при фазово-контрастной микроскопии, увеличение 200x.
Группа II (30 суток после имплантации).
Через 30 суток после операции интенсивность резорбции имплантата в туннеле кости усиливается - он резорбирован больше, чем на половину (рис. 4 а, б).
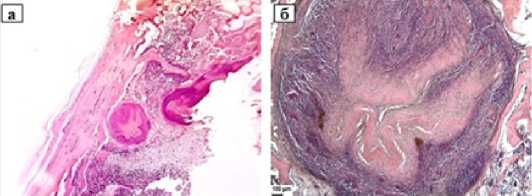
Рисунок 4. Коллагеновый имплантат в туннеле кости. 30 суток после операции. а) Общий вид имплантата в туннеле б/б кости.
Увеличение 30x; б) Активно резорбируемый коллагеновый имплантат, окруженный новообразованными костными трабекулами.
Стандартная световая микроскопия, увеличение 50x;
Группа III (60 суток после имплантации).
Через 60 суток после операции имплантат в туннеле кости практически полностью резорбирован (рис. 5 а, б). Имплантат окружен тонкой фиброзной капсулой, краевая и центральная зоны имплантата уже не выявляются, в имплантате остаются лишь небольшие фрагменты разрыхленных коллагеновых волокон, интенсивно резорбируемых многочисленными гигантскими многоядерными клетками и макрофагами, усиливается прорастание фибробластами (рис. 5 в-ж). Вокруг имплантат также отмечаются участки регенерации костных трабекул (рис. 5 з).
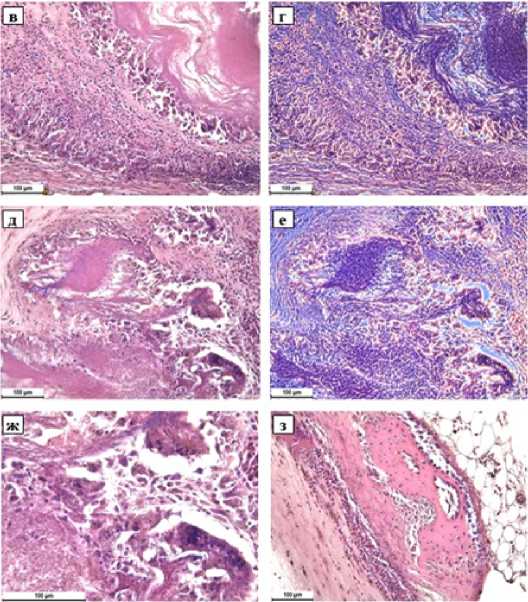
Рисунок 5. Коллагеновый имплантат в туннеле кости. 60 суток после операции. а) Общий вид имплантата в туннеле б/б кости. Увеличение 30x; б) Почти полностью резорбированный имплантат с остатками коллагена эозинофильного цвета. Стандартная световая микроскопия, увеличение 50x; в) Краевая зона имплантата с интенсивным разрыхлением коллагеновых волокон и их резорбцией макрофагами и гигантскими многоядерными клетками. Стандартная световая микроскопия, увеличение 200x; г) Тот же участок при фазово-контрастной микроскопии, увеличение 200x.
-
д) Центральная часть имплантата с оставшимися фрагментами коллагена эозинофильного цвета, активно резорбируемыми гигантскими многоядерными клетками и макрофагами. Стандартная световая микроскопия, увеличение 200x; е) Тот же участок при фазово-контрастной микроскопии, увеличение 200x. ж) Скопление гигантских многоядерных клеток и макрофагов в толще имплантата. Стандартная световая микроскопия, увеличение 400x;
-
з) Регенерация костных трабекул вокруг имплантата. Стандартная световая микроскопия, увеличение 200x. Окраска гематоксилин-эозином.
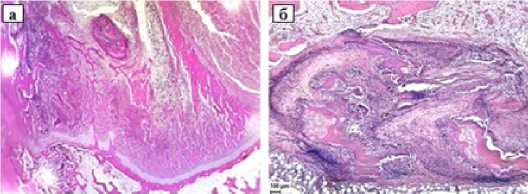
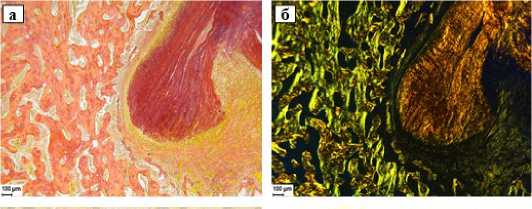
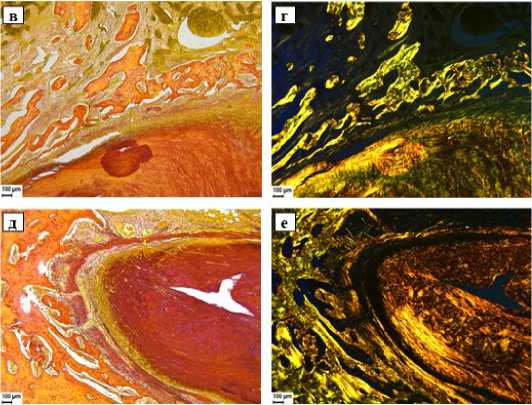
Рисунок 6. Коллагеновый имплантат в туннелях кости на ПОД15 (а,б), ПОД30 (в,г), ПОД60 (д,е), стандартная оптическая (а,в,д) и поляризационная (б,г,е) микроскопии. Снижение интенсивности и усиление дискретности окрашивания (анизотропии в поляризованном свете) пикросириусом красным коллагеновых волокон имплантата может свидетельствовать об усилении разволокнения и резорбции имплантата с увеличением временных сроков наблюдения в большой берцовой кости. При этом структура и анизотропия окружающих имплантат костных трабекул существенно не меняется.
Заключение
После имплантации коллагеновой мембраны в костные туннели происходят активные процессы клеточной инфильтрации и резорбции имплантата. В костной ткани через 15 суток после операции имплантат ещё достаточно плотный, окружен фиброзной капсулой, под которой располагается полоса клеточной инфильтрации, состоящая преимущественно из лимфоцитов и макрофагов. На этом сроке в краевой зоне имплантата происходит разрыхление коллагеновых волокон, их клеточная инфильтрация и резорбция, тогда как в плотную центральную часть имплантата только начинают прорастать немногочисленные макрофаги и фибробласты. Через 30 суток процессы клеточной инфильтрации и резорбции имплантата усиливаются и достигают максимума до полного разрыхления и резорбции коллагеновых волокон имплантата через 60 суток после операции. Следует отметить, что резорбция имплантата идет гораздо интенсивнее в большой берцовой кости, чем в бедренной кости. Также на всех сроках в костной ткани вокруг имплантата отмечается регенерация костных трабекул, что говорит о хорошей способности имплантата к остеоинтеграции. Патологических изменений в окружающих имплантат тканях не выявлено ни на одном временном сроке, что говорит о хорошей биосовместимости имплантированного материала.
Обсуждение.
Проблема остеоинтеграции трансплантатов, применяемых для реконструкции связочного аппарата на сегодняшний день является одной из часто анализируемых. Представленные в клинической практике синтетические материалы обладают низкой биосовместимостью и способностью к остеоинтеграции [20]. Ключевыми компонентами успешной остеоинтеграции на границе сухожилия и кости являются биосовместимый каркас, подходящий к поверхности кости, клетки-предшественники и остеоиндуктивные факторы [21]. Природные полимеры более биосовместимы, биоразлагаемы, обладают лучшими характеристиками остеоинтеграции и стимулируют образование новых тканей, что увеличивает их потенциал при реконструктивных операциях[8].
В мировой литературе описаны много исследований по оценке остеоинтеграции различных биополимеров. Так например, Fanggang B et. исследовали шелко-коллагеновый каркас с гидрооксиапатитом для реконструкции ПКС на животной модели. Данные морфологического исследования показали массивное образование более зрелой кости на границе сухожилия и кости, а иммуногистохимическое окрашивание выявило большее отложение коллагена I и остеокальцина. Однако оценка заживления проводилась только в одной временной точке, что не позволило оценить восстановление и ремоделирование на протяжении всего процесса остеоинтеграции [21].
Целью настоящего экспериментального исследования являлось оценить остеоинтеграцию коллагеновой мембраны при реконструкции передней крестообразной и наружной коллатеральной связок коленного сустава в эксперименте на животной модели. Показано, что после имплантации коллагеновой мембраны в туннели бедренной и большеберцовой костей происходят активные процессы клеточной инфильтрации и резорбции имплантата. На всех сроках в костной ткани вокруг имплантата отмечается умеренная регенерация костных трабекул. Патологических изменений в окружающих имплантат тканях не выявлено ни на одном временном сроке, что говорит о хорошей остеоинтеграции и биосовместимости имплантированного материала. Полученные результаты дают основание предполагать, что применение данного материала для реконструкции связочного аппарата является перспективным. В дальнейшем нами планируется продолжение исследования свойств коллагенового трансплантата на более поздних сроках после его имплантации.
Список литературы Оценка остеоинтеграции коллагеновой мембраны при реконструкции связочного аппарата коленного сустава (экспериментальное исследование)
- Синельников Р.Д., Синельников А.Я., Синельников Я.Р. Атлас анатомии человека в 4 томах. Учебное пособие для мед. ВУЗов. Москва. 1996, 2008, 2010, 2012. [Sinel’nikov R.D., Sinel’nikov A.Ya., Sinel’nikov Ya.R. Atlas anatomii cheloveka v 4 tomakh. Uchebnoe posobie dlya med. VUZov. Moskva. 1996, 2008, 2010, 2012.]
- Lim WL, Liau LL, Ng MH, Chowdhury SR, Law JX. Current Progress in Tendon and Ligament Tissue Engineering. Tissue Engineering and Regenerative Medicine. 2019 Dec;16(6):549-571. DOI: 10.1007/s13770-019-00196-w.
- Chainani A, Hippensteel KJ, Kishan A, et al. Multilayered electrospun scaffolds for tendon tissue engineering. Tissue engineering. Part A. 2013 Dec;19(23-24):2594-2604. DOI: 10.1089/ten.tea.2013.0165.
- Docheva D, Müller SA, Majewski M, Evans CH. Biologics for tendon repair. Advanced Drug Delivery Reviews. 2015 Apr;84:222-239. DOI: 10.1016/j.addr.2014.11.015.
- Dhammi IK, Rehan-Ul-Haq, Kumar S. Graft choices for anterior cruciate ligament reconstruction. Indian Journal of Orthopaedics. 2015 Mar-Apr;49(2):127-128. DOI: 10.4103/0019-5413.152393.
- Cooper JA Jr, Sahota JS, Gorum WJ 2nd, Carter J, Doty SB, Laurencin CT. Biomimetic tissue-engineered anterior cruciate ligament replacement. Proc Natl Acad Sci U S A. 2007 Feb 27;104(9):3049-54. doi: 10.1073/pnas.0608837104. Epub 2007 Feb 20. PMID: 17360607; PMCID: PMC1805619.
- Leong NL, Petrigliano FA, McAllister DR. Current tissue engineering strategies in anterior cruciate ligament reconstruction. J Biomed Mater Res A. 2014 May;102(5):1614-24. doi: 10.1002/jbm.a.34820. Epub 2013 Jun 14. PMID: 23737190.
- Silva M, Ferreira FN, Alves NM, Paiva MC. Biodegradable polymer nanocomposites for ligament/tendon tissue engineering. J Nanobiotechnology. 2020 Jan 30;18(1):23. doi: 10.1186/s12951-019-0556-1. PMID: 32000800; PMCID: PMC6993465.
- Kuo CK, Marturano JE, Tuan RS. Novel strategies in tendon and ligament tissue engineering: Advanced biomaterials and regeneration motifs. Sports Med Arthrosc Rehabil Ther Technol. 2010 Aug 20;2:20. doi: 10.1186/1758-2555-2-20. PMID: 20727171; PMCID: PMC2939640.
- Gentleman E, Lay AN, Dickerson DA, Nauman EA, Livesay GA, Dee KC. Mechanical characterization of collagen fibers and scaffolds for tissue engineering. Biomaterials. 2003;24:3805–3813. doi: 10.1016/S0142-9612(03)00206-0.
- Dunn MG, Liesch JB, Tiku ML, Zawadsky JP. Development of fibroblast-seeded ligament analogs for ACL reconstruction. J Biomed Mater Res A. 1995;29:1363–1371. doi: 10.1002/jbm.820291107.
- Bellincampi LD, Closkey RF, Prasad R, Zawadsky JP, Dunn MG. Viability of fibroblast-seeded ligament analogs after autogenous implantation. J Orthop Res. 1998;16:414–420. doi: 10.1002/jor.1100160404.
- Walters VI, Kwansa AL, Freeman JW. Design and analysis of braidtwist collagen scaffolds. Connect Tissue Res. 2012;53:255–266. doi: 10.3109/03008207.2011.634532.
- Yilgor C, Huri P, Huri G. Tissue engineering strategies in ligament regeneration. Stem Cells Int. 2012;2012:374676. doi: 10.1155/2012/374676.
- Narayanan N, Kuang L, Del Ponte M, Chain C, Deng M. Design and fabrication of nanocomposites for musculoskeletal tissue regeneration. In: Liu H, editor. nanocomposites for musculoskeletal tissue regeneration. Duxford: Woodhead Publishing; 2016. pp. 3–29.
- Vieira AC, Guedes RM, Marques AT. Development of ligament tissue biodegradable devices: a review. J Biomech. 2009;13:2421–2430. doi: 10.1016/j.jbiomech.2009.07.019.
- Patino MG, Neiders ME, Andreana S, Noble B, Cohen RE. Collagen as an implantable material in medicine and dentistry. J Oral Implantol. 2002;28(5):220-5. doi: 10.1563/1548-1336(2002)028<0220:CAAIMI-2.3. CO;2. PMID: 12498470.
- Bi F, Shi Z, Liu A, Guo P, Yan S. Anterior cruciate ligament reconstruction in a rabbit model using silk-collagen scaffold and comparison with autograft. PLoS One. 2015;10(5):e0125900. doi: 10.1371/journal.pone.0125900.
- Ge Z, Yang F, Goh JC, Ramakrishna S, Lee EH. Biomaterials and scaffolds for ligament tissue engineering. J Biomed Mater Res A. 2006;77(3):639–652. doi: 10.1002/jbm.a.30578.
- Mascarenhas R, MacDonald PB. Anterior cruciate ligament reconstruction: a look at prosthetics--past, present and possible future. Mcgill J Med. 2008 Jan;11(1):29-37. PMID: 18523530; PMCID: PMC2322926.
- Bi F, Chen Y, Liu J, Wang Y, Xu D, Tian K. Anterior cruciate ligament reconstruction in a rabbit model using a silk-collagen scaffold modified by hydroxyapatite at both ends: a histological and biomechanical study. J Orthop Surg Res. 2021 Feb 16;16(1):139. doi: 10.1186/s13018-021-02281-0. PMID: 33593365; PMCID: PMC7885370.
- Antoshin, Artem & Dubinin, O. & Lei, Miao & Istranova, Elena & Bikmulina, Polina & Fayzullin, Alexey & Magdanov, Azat & Kravchik, Marina & Kosheleva, Nastasia & Solovieva, Anna & Sadchikova, Elena & Kotova, Svetlana & Efremov, Yuri & qu, Xue & Butnaru, Denis & Evlashin, Stanislav & Shpichka, Anastasia & Liu, Changsheng & Timashev, Peter. (2023). Semipermeable barrier-assisted electrophoretic deposition of robust collagen membranes. Journal of Materials Science. 58. 1-23. 10.1007/s10853-023-08641-x.
- Tangsadthakun C, Kanokpanont S, Sanchavanakit N, Banaprasert T, Damrongsakkul S. Properties of collagen/chitosan scaffolds for skin tissue engineering. J Metals Mater Miner. 2006;16:37–44. ] Leong NL, Petrigliano FA, McAllister DR. Current tissue engineering strategies in anterior cruciate ligament reconstruction. J Biomed Mater Res A. 2014;102:1614–1624. doi: 10.1002/jbm.a.34820.
- Hong P, Bance M, Gratzer PF. Repair of tympanic membrane perforation using novel adjuvant therapies: a contemporary review of experimental and tissue engineering studies. Int J Pediatr Otorhinolaryngol. 2013 Jan;77(1):3-12. doi: 10.1016/j.ijporl.2012.09.022. Epub 2012 Oct 6. PMID: 23044356.
- Santucci RA, Joyce GF, Wise M. Male urethral stricture disease. J Urol. 2007 May;177(5):1667-74. doi: 10.1016/j.juro.2007.01.041. PMID: 17437780.
- Fiala R, Vidlar A, Vrtal R, Belej K, Student V. Porcine small intestinal submucosa graft for repair of anterior urethral strictures. Eur Urol. 2007 Jun;51(6):1702-8; discussion 1708. doi: 10.1016/j.eururo.2007.01.099. Epub 2007 Feb 9. PMID: 17306922.


