Оценка отдаленных результатов однократной интраоперационной электронейростимуляции после аутологичной пластики резекционного дефекта большеберцовой порции седалищного нерва взрослых крыс
Автор: Щудло Н.А., Варсегова Т.Н., Ступина Т.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.30, 2024 года.
Бесплатный доступ
Введение. Данные мировой литературы свидетельствуют об эффективности однократной интраоперационной электростимуляции (ИЭС) проксимального отрезка повреждённого нерва для стимуляции его регенерации, но данные о её влиянии на отдалённые результаты аутопластики резекционных дефектов отсутствуют.Цель работы - оценка отдалённых результатов однократной ИЭС после аутологичной пластики дефекта большеберцовой порции седалищного нерва крыс.Материалы и методы. После аутологичной пластики резекционного дефекта большеберцовой порции седалищного нерва 30 крыс линии Wistar мужского пола распределены на серию 1 (нестимулированный контроль, n = 16) и серию 2 (однократная ИЭС в течение 40 мин., n = 14). Через 4 и 6 мес. после операции проведена оценка статического седалищного функционального индекса (СФИ) и морфометрия эпоксидных поперечных полутонких срезов большеберцового нерва на уровне средней трети голени. Для сравнения с нормой использовали соответствующие данные от 7 интактных крыс.Результаты. Количество животных с отличными результатами восстановления СФИ составило 12,5 % в серии 1 и 50 % в серии 2 (p = 0,05). Численная плотность регенерировавших миелинизированных волокон (МВ) превышала норму: в серии 1 - на 63 % (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Крысы, седалищный нерв, аутопластика, интраоперационная электростимуляция (иэс), седалищный функциональный индекс, гистоморфометрия
Короткий адрес: https://sciup.org/142241868
IDR: 142241868 | УДК: 616.833.58-004.8-089.844-092.9:615.847 | DOI: 10.18019/1028-4427-2024-30-3-417-426
Текст научной статьи Оценка отдаленных результатов однократной интраоперационной электронейростимуляции после аутологичной пластики резекционного дефекта большеберцовой порции седалищного нерва взрослых крыс
Повреждения периферических нервов встречаются в 3,3 % случаев травм верхних конечностей [1] и 1,8 % травм нижних конечностей [2]. Они существенно варьируют по механизмам травмы, степени повреждения и исходам лечения. При вооружённых конфликтах частота повреждения нервов конечностей существенно увеличивается, нередко они приводят к инвалидизации пациентов с тяжёлыми социальными и личностными последствиями [3].
Несмотря на потенциальную возможность восстановления функций повреждённых периферических нервов млекопитающих и человека [4], их регенерация после полных анатомических перерывов, требующих хирургического вмешательства, происходит медленно и обычно неполно: хороших и отличных результатов восстановления чувствительности и движений достигают не более половины пациентов [5]. Неудовлетворительные результаты лечения травм нервов в клинике имеют фундаментальные биологические основы. К ним относятся посттравматический апоптоз чувствительных нейронов [6], латентный период регенерации, в течение которого аксоны проксимального отрезка нерва не прорастают зону повреждения [7], низкая скорость регенераторного роста, особенно у взрослых особей [8], образование рубца [9, 10], деструкция денервированных органов-мишеней [11], в том числе их капилляров [12].
Разнообразные методики электростимуляции периферических нервов позволяют ускорить и улучшить восстановление двигательных и чувствительных функций [13, 14, 15]. Поскольку многие пациенты не имеют возможности получить курсовое реабилитационное лечение, интересы многих исследователей в последние годы сосредоточились на изучении эффектов однократной интраоперационной электростимуляции (ИЭС).
При рандомизированном обследовании 36 пациентов, которым выполнены восстановительные операции на пальцевых нервах, установлено, что один часовой сеанс низкочастотной ИЭС (20 Гц, 1 час) улучшил все виды чувствительности к 5–6 мес. после операции по сравнению с нестимулированной группой, однако разница не подтверждалась статистически [16].
В экспериментах на животных продемонстрированы положительные эффекты однократной ИЭС на разных моделях повреждений нервов бедра и голени. При фокальной демиелинизации большеберцового нерва крыс ИЭС ускоряла уборку продуктов демиелинизации и последующую ремиелинизацию [17]. При моделировании neuroma in continuum седалищного нерва крыс однократная ИЭС проксимального участка поврежденного нерва крыс улучшала восстановление функции конечности через 4–8 нед., однако через 3 мес. различия с нестимулированной группой нивелировались [18]. В опытах по перерезке и шва большеберцового нерва крыс установлено, что даже 10-минутная ИЭС ускоряет прорастание зоны швов регенерирующими аксонами [19]. Аналогичные результаты получены другими авторами при пересечении и шве седалищного нерва мышей [20], которые также доказали увеличение количества нейронов, вступающих в регенерацию, в сериях с электростимуляцией. При пересечении и микрохирургическом шве бедренного нерва 10-недельных крыс часовая ИЭС вызывала более быстрое восстановление функциональных параметров в сравнении с ложно-стимулированными животными, достигавшее дооперационного уровня через 5 мес. после травмы, что, по мнению авторов, связано с увеличением количества мотонейронов, корректно реиннервировавших органы-мишени [21].
После аутопластики общего малоберцового нерва молодых крыс однократная ИЭС проксимального отрезка нерва обеспечила увеличение количества чувствительных и двигательных нейронов, вступающих в регенерацию, а также увеличение количества миелинизированных нервных волокон, регенерировавших в дистальный отрезок повреждённого нерва через 6 нед. после операции [22].
После аутопластики седалищного нерва ИЭС улучшала моторную функцию оперированной конечности крыс в период от 2 до 12 нед. по сравнению с нестимулированными животными, однако сенсорное тестирование и гистоморфометрия дистального отрезка нерва и икроножных мышц преимуществ серии с ИЭС не выявили [23].
В доступной литературе мы не встретили данных о влиянии однократной интраоперационной электростимуляции на отдалённые результаты аутопластики смешанных нервов, что определило цель нашего исследования.
Цель работы — оценка отдалённых результатов однократной интраоперационной электронейростимуляции после аутологичной пластики резекционного дефекта большеберцовой порции седалищного нерва.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент выполнен на 30 лабораторных крысах линии Wistar мужского пола (возраст — 8–15 мес., вес — 360–460 г). Животных содержали в контролируемых гигиенических условиях, они имели доступ к воде и корму. Эксперимент выполнен согласно Европейской Конвенции по защите позвоночных животных, Директиве 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях и СП 2.2.1.3218-14; ГОСТу 33217-2014; ГОСТу 33215-2014. Дизайн исследо- вания одобрен этическим комитетом учреждения (протокол № 2 (57) от 17.05.18). Для наркоза и обезболивания животным вводили внутримышечно 0,8 мг гидрохлорида ксилазина и 0,4 мг тилетамин/золазепама на 100 г массы тела, на правом бедре и голени выстригали шёрстный покров.
В условиях операционной после обработки кожи йодно-спиртовой настойкой и внепроекционного разреза кожи осуществляли доступ к правому седалищному нерву на уровне средней трети бедра остро-тупым способом через двуглавую мышцу. Используя 8-кратное увеличение операционного микроскопа (OPMI-6, Germany) острым сосудистым микрозондом и ножницами для иридэктомии выполняли эпифасцикуляр-ные продольные эпиневротомические разрезы для выделения большеберцовой порции седалищного нерва. После резекции её участка протяжённостью 6 мм осуществляли интерфасцикулярную аутологичную пластику получившегося дефекта с использованием микрохирургического шовного материала калибра 9–0 и 10–0. В серии 1 — нестимулированный контроль ( n = 16) — по окончании аутонейропластики рану послойно ушивали рассасывающимся шовным материалом калибра 3–0. В серии 2 — опыт ( n = 14) — сразу после аутонейропластики на проксимальный участок нерва устанавливали электроды. Используя систему электростимуляции периферических нервов «ЭлСИ.08.ice» (рег. удостоверение № РЗН 2017/5382; ООО «Высокие медицинские технологии»), в течение 40 мин. интраоперационно проводили стимуляцию проксимального отрезка нерва монополярными электрическими импульсами прямоугольной формы с амплитудой 0,25 мА, частотой 20 Гц и длительностью 100 мкс. Рану ушивали по окончании сеанса электростимуляции.
Чтобы обеспечить сопоставимость опытных групп по возрасту, в каждый операционный день оперировали пару крыс: одну без стимуляции, другую со стимуляцией, в одной паре восьмимесячных крыс были обе без стимуляции.
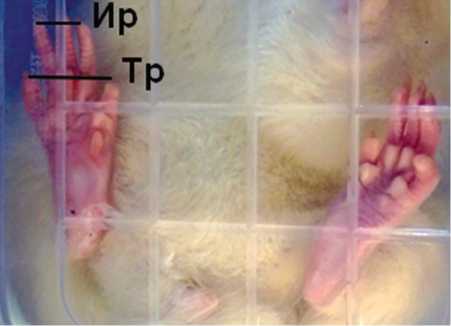
В послеоперационном периоде проводили исследования статического седалищного функционального индекса (СФИ) по методике [24], модифицированной с учётом семиотики денервационно-реиннервационно-го синдрома (табл. 1). Для этого каждую крысу помещали в коробку из прозрачного пластика с отверстиями для доступа воздуха. Коробку закрепляли на штативе и располагали её над столом, на который укладывали зеркало. С помощью лампы дневного света коробку освещали и фотографировали отражение стоп крысы в зеркале — от 3 до 5 кадров от каждой крысы. Цифровые фото сохраняли в памяти компьютера, а затем в программе Photofiltre измеряли размахи пальцев стоп (рис. 1): тотальный (между I и V пальцами) и ин-термедиарный (между вторым и четвёртым пальцем). В качестве СФИ использовали отношение размаха пальцев оперированной стопы к соответствующему размаху контралатеральной стопы в долях единицы. Измерения размаха пальцев у животных не проводилось, если опора стопы оперированной конечности происходила не на подушечки лап, а на тыл и/или боковую поверхность стопы при развитии контрактур и деформаций. Оценочная шкала СФИ также представлена в таблице 1.
Таблица 1
Семиотика денервационно-реиннервационного синдрома и оценка статического седалищного функционального индекса в отдалённый период после аутопластики большеберцовой порции седалищного нерва
|
Симптомы |
Оценка |
|
Опора на тыл и/или боковую поверхность стопы с формированием контрактур и деформаций плюсны и пальцев. Опора на подушечки лап без размаха пальцев либо с частичным восстановлением размахов и переразгибанием в плюснефаланговых суставах и сгибании в межфаланговых |
неудовлетворительно |
|
Правильная установка стопы с наличием интермедиарного размаха и приведением либо I, либо V пальца |
удовлетворительно |
|
Пальцы разведены симметрично. Интермедиарный либо тотальный размах 0,8 и более либо в некоторых кадрах оба размаха 0,8 и более |
хорошо |
|
Индексы интермедиарного и тотального размахов 0,8 и более |
отлично |
Рис. 1. Фото отражения стоп крысы при её посадке в пластиковую коробку. Нормальная установка стопы контралатеральной конечности с выраженным Ир — интермедиарным размахом пальцев и Тр — тотальным размахом пальцев; отсутствие размаха пальцев со сгибанием межфаланговых суставов стопы оперированной конечности и денервационной атрофией мелких мышц стопы
Животных выводили из эксперимента. Иссечённые образцы седалищных и большеберцовых нервов подвергали альдегидно-осмиевой фиксации и заключали в аралдит для получения полутонких срезов. Срезы изготавливали алмазными ножами на ультрамикротоме Nova LKB (Швеция), окрашивали толуидиновым синим и полихромным методом — метиленовым синим, азуром II и основным фуксином. Микроскопию срезов и получение цифровых изображений осуществляли с помощью микроскопа AxioScope.A1 и цифровой камеры AxioCam (Carl Zeiss MicroImaging GmbH, Германия). Гистоморфометрировали 15–30 эндо-невральных микрососудов и 400–500 миелинизированных нервных волокон у каждого животного при увеличении 1000×. Определяли их численные плотности в 1 мм2 площади пучка, измеряли диаметры волокон, их аксонов и толщину миелинизированных оболочек, строили гистограммы распределения волокон по диаметрам с шагом 1 мкм. Рассчитывали долю (в %) деструктивно измененных нервных проводников. Измеряли диаметры микрососудов, их просветов, определяли модифицированный индекс Керногана, как отношение диаметра просвета к диаметру сосуда. Для сравнения с нормой использовали гистоморфометрические данные от 7 взрослых интактных крыс, близких по возрасту к оперированным крысам на момент эвтаназии, — 16–19 мес. (в данной группе отсутствуют межиндивидуальные статистически значимые различия исследуемых количественных показателей).
СтатистическуюобработкуданныхвыполняливкомпьютернойпрограммеAttestat,версия9.3.1(разработчик И.П. Гайдышев, сертификат о регистрации в Роспатенте № 2002611109). Проверку выборок на нормальность распределения значений осуществляли с помощью критериев Колмогорова и Шапиро – Уилка, попарное сравнение экспериментальных серий между собой и с интактным контролем — с помощью критериев Манна – Уитни, Хи-квадрат, точного критерия Фишера. Значения гистоморфометрических параметров представляли в виде медиан и квартилей — Me [Q1; Q3]. Уровень значимости отличий — 0,05.
РЕЗУЛЬТАТЫ
При оценке СФИ в отдалённые сроки после операции получена достоверная разница серий 1 и 2 по частоте отличных результатов (табл. 2).
Таблица 2
Распределение оценок статического седалищного функционального индекса в отдалённом периоде после аутопластики большеберцовой порции седалищного нерва
Существенно то, что возраст 7 крыс, достигших в серии 2 отличных результатов, варьировал от 8 до 13 мес. на момент операции.
Микроскопическое исследование дистальной зоны швов показало, что в сериях 1 и 2 через 4 и 6 мес. после операции эндоневрий и эпиневрий трансплантата обильно невротизирован регенерерирующи-ми миелинизированными и безмиелиновыми волокнами. Некоторые из них располагались в составе минифасцикул или регенерационных кластеров (рис. 2).
В поперечных полутонких срезах большеберцового нерва на уровне средней трети голени (рис. 3) также выявлялась обширная популяция регенерировавших миелинизированных и безмиелинизирован-ных волокон и немногочисленных регенерационных кластеров. В эндоневрии регенерирующих нервов чаще, чем в интакных нервах, встречались фибробласты, макрофаги, периневральные и тучные клетки, а также ядросодержащие профили миелинизированных и безмиелиновых волокон (рис. 3).
Через 6 мес. после операции по сравнению с предыдущим сроком увеличивалось представительство крупных миелинизированных волокон как на уровне трансплантата, так и в большеберцовых нервах на уровне средней трети голени (рис. 2, в, г; рис. 3, в, г), что визуально более заметно у стимулированных животных.
Гистоморфометрическое исследование большеберцового нерва показало, что численная плотность регенерировавших волокон через 4 и 6 мес. после операции достоверно превышает норму: в серии 1 на 63 % и 34 %, в серии 2 — на 58 % и 47 % соответственно (табл. 3). Доля деструктивно измененных проводников через 4 и 6 мес. после операции у оперированных животных достоверно ниже значений интактных нервов (табл. 3).
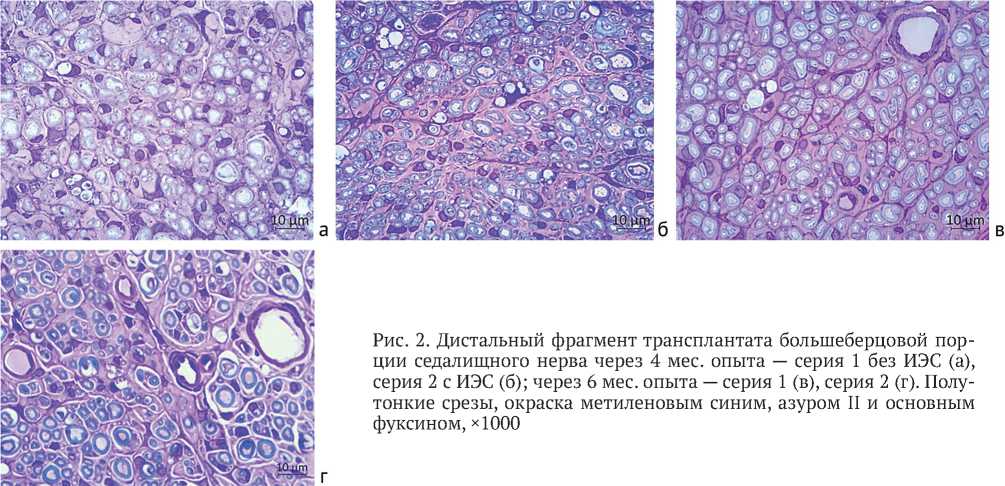
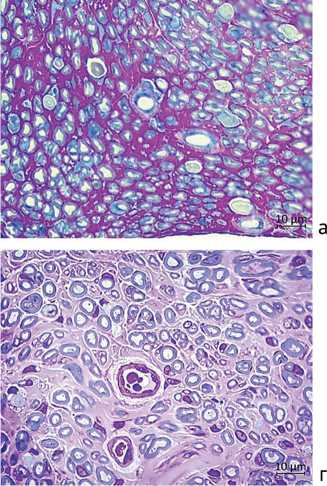
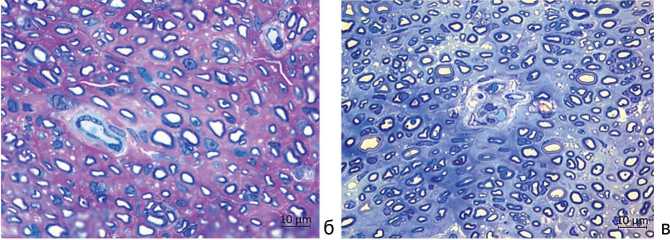
Рис. 3. Большеберцовые нервы через 4 мес. опыта — серия 1 без ИЭС (а), серия 2 с ИЭС (б); через 6 мес. опыта — серия 1 (в), серия 2 (г). Полутонкие срезы, окраска метиленовым синим, азуром II и основным фуксином, ×1000
Таблица 3
Численные плотности и доли (%) деструктивно измененных миелинизированных нервных волокон большеберцового нерва в 1 мм2 площади среза через 4 и 6 мес. после операции, Me [Q1; Q3]
|
Серии/срок опыта |
Численная плотность миелинизированных волокон |
Доля деструктивно измененных миелинизированных волокон |
||
|
4 мес. |
6 мес. |
4 мес. |
6 мес. |
|
|
Серия 1 — аутопластика ( n = 16) |
24444 [19182; 28280] Р1–2 = 0,319465 Р1–К = 0,0000002* |
20207 [18140; 22618] Р1–2 = 0,187249 Р1–К = 0,000573* |
4,46 % [2,79; 5,73] Р1–2 = 0,072117 Р1–К = 0,001244* |
4,05 % [2,38; 5,06] Р1–2 = 0,99999 Р1–К = 0,00046* |
|
Серия 2 — аутопластика + ИЭС ( n = 14) |
23786 [22142; 24882] Р2–К = 0,0000001* |
22142 [20498; 23411] Р2–К = 0,000289* |
5,58 % [3,85; 6,05] Р2–К = 0,030766* |
4,05 % [2,38; 5,06] Р2–К = 0,00014* |
|
Интактный контроль ( n = 7) |
15040 (12859; 15499) |
6,75 % (5,70; 8,13) |
||
P 1–2 — уровни значимости отличий при сравнении групп нестимулированных и стимулированных оперированных животных по критерию Манна – Уитни: P 1–К , P 2–К — уровни значимости отличий каждой из групп оперированных животных от интактного контроля по критерию Манна – Уитни; * — различия достоверны при p < 0,05
Размерные характеристики миелинизированных регенерирующих волокон были достоверно больше в серии 2 по сравнению с серией 1 (табл. 4) через 4 и 6 мес. после операции: медиана диаметров волокон — на 11,7 % и 15,7 %, медиана диаметров их аксонов — на 5,4 % и 11,9 %, медиана толщины миелино- вой оболочки — на 17,0 % и 24,1 % соответственно. Однако даже в конце опыта все размерные характеристики волокон в обеих группах оперированных животных были существенно меньше интактного нерва.
Таблица 4
Размерные параметры миелинизированных волокон большеберцового нерва через 4 и 6 мес. после операции, Me [Q1; Q3]
|
Параметры |
Серия 1 — аутопластика ( n = 16) |
Серия 2 — аутопластика+ИЭС ( n = 14) |
Интактный контроль ( n = 7) |
||
|
4 мес. ( n = 7) |
6 мес. ( n = 7) |
4 мес. ( n = 8) |
6 мес. ( n = 8) |
||
|
Диаметр волокон (мкм) |
3,24 [2,52; 4,03] Р1–К = 0,00119* Р1–2 = 0,00267* |
3,50 [2,79; 4,04] Р1–К = 0,00119* Р1–2 = 0,00982* |
3,62 [2,91; 4,37] Р2–К = 0,00014* |
4,05 [3,14; 5,12] Р2–К = 0,00268* |
6,73 [5,50; 8,75] |
|
Диаметр аксонов (мкм) |
2,23 [1,65; 2,87] Р1–К = 0,00119* Р1–2 = 0,02914* |
2,42 [1,84; 2,84] Р1–К = 0,00119* Р1–2 = 0,00450* |
2,35 [1,82; 2,94] Р2–К = 0,00174* |
2,71 [2,02; 3,53] Р2–К = 0,0027* |
4,34 [3,54; 5,18] |
|
Толщина миелинизированных оболочек (мкм) |
0,53 [0,40; 0,63] Р1–К = 0,00119* Р1–2 = 0,02831* |
0,54 [0,44; 0,62] Р1–К = 0,00119* Р1–2 = 0,0027* |
0,62 [0,50; 0,75] Р2–К = 0,00038* |
0,67 [0,53; 0,83] Р2–К = 0,00255* |
1,02 [0,72; 1,30] |
P 1–2 — уровни значимости отличий при сравнении групп нестимулированных и стимулированных оперированных животных по критерию Манна – Уитни: P 1–К , P 2–К — уровни значимости отличий каждой из групп оперированных животных от интактного контроля по критерию Манна – Уитни; * — различия достоверны при p < 0,05
Распределение миелинизированных волокон по диаметру серии 1 и серии 2 достоверно отличалось от распределения в интактном нерве (рис. 4). Даже через 6 мес. после операции оно оставалось унимодальным, количество классов гистограммы уменьшено. Однако и в 4, и в 6 мес. после операции в серии 2 главный пик гистограммы смещен вправо по сравнению с серией 1, а количество классов гистограммы на один больше, и эта разница между сериями через 6 мес. подтверждается статистически (рис. 4).
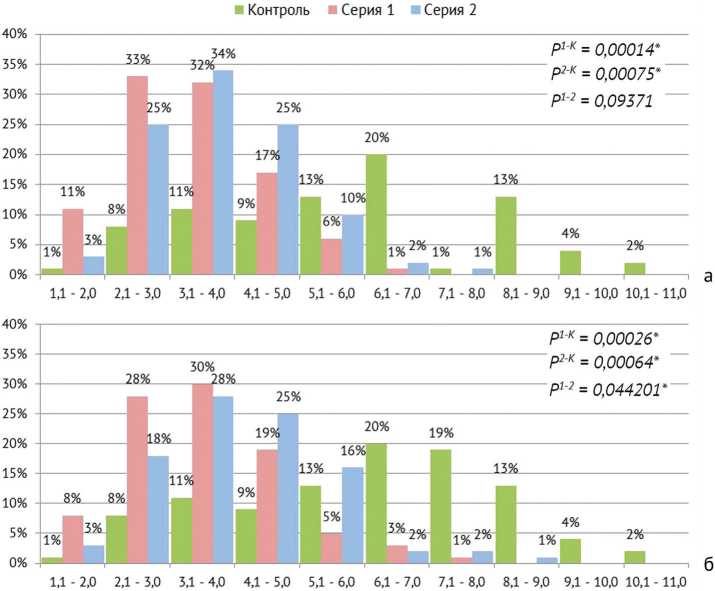
Рис. 4. Гистограммы распределения миелинизированных волокон по диаметрам: а — 4 мес. после операции; б — 6 мес. после операции. Ось абсцисс — диаметры волокон в мкм, ось ординат — их процентные доли в выборке;
P1–2 — уровни значимости различий между нестимулированными и стимулированными животными серий 1 и 2; P1–К , P2–К — уровни значимости отличий каждой из серий с интактным контролем по критерию Хи-квадрат
Исследование эндоневральной васкуляризации показало, что через 4 мес. после операции в сериях 1 и 2 численные плотности эндоневральных сосудов достоверно превышают интактный контроль на 134 % и 156 %, их средние диаметры — на 18 % и 16 % соответственно, а диаметр просвета возрастает только в серии 2 на 8 % (табл. 5). Снижение параметра «индекс Керногана» в серии 1 на этом сроке относительно контроля свидетельствует об ухудшении пропускной способности кровеносных сосудов. Через 6 мес. в сериях 1 и 2 численные плотности микрососудов снижаются, но достоверно превышают контроль на 66 % и 83 %, средние диаметры — на 14 % и 36 %, диаметры просветов — на 26 % и 50 % соответственно (табл. 5). При этом достоверные различия по параметру «индекс Керногана» между сериями на этом сроке опыта отсутствуют (табл. 5).
Таблица 5
Размерные параметры эндоневральных сосудов большеберцового нерва через 4 и 6 мес. опыта, Me [Q1; Q3]
|
Параметры |
Серия 1 — аутопластика ( n = 16) |
Серия 2 — аутопластика+ИЭС ( n = 14) |
Интактный контроль ( n = 7) |
||
|
4 мес. ( n = 7) |
6 мес. ( n = 7) |
4 мес. ( n = 8) |
6 мес. ( n = 8) |
||
|
Численная плотность сосудов |
200 [109; 219] Р1–К = 0,01935* Р1–2 = 0,25751 |
142,13 [130,69; 168,27] Р1–К = 0,00618* Р1–2 = 0,715001 |
219 [109; 274] Р2–К = 0,00695* |
156,31 [132;183] Р2–К = 0,03213* |
85,64 [82,21; 127,88] |
|
Диаметр сосудов (мкм) |
14,49 [12,56; 16,88] Р1–К = 0,00206* Р1–2 = 0,854221 |
14,08 [11,91; 17,82] Р1–К = 0,00138* Р1–2 = 0,01454* |
14,29 [11,86; 17,53] Р2–К = 0,00743* |
16,76 [13,45; 19,14] Р2–К = 0,00007* |
12,32 [9,31; 15,30] |
|
Диаметр просвета (мкм) |
4,81 [1,75; 6,72] Р1–К = 0,355172 Р1–2 = 0,126962 |
5,97 [3,64; 7,77] Р1–К = 0,06917 Р1–2 = 0,00692* |
5,10 [3,62; 7,29] Р2–К = 0,49948 |
7,09 [5,30; 10,01] Р2–К = 0,00001* |
4,72 [3,28; 5,92] |
|
Индекс Керногана |
0,30 [0,15; 0,43] Р1–К = 0,00075* Р1–2 = 0,002664* |
0,42 [0,30; 0,44] Р1–К = 0,14051 Р1–2 = 0,05255* |
0,39 [0,28; 0,46] Р2–К = 0,29573 |
0,42 [0,39; 0,52] Р2–К = 0,31603 |
0,41 [0,32; 0,48] |
P 1–2 — уровни значимости отличий при сравнении групп нестимулированных и стимулированных оперированных животных по критерию Манна – Уитни: P 1–К , P 2–К — уровни значимости отличий каждой из групп оперированных животных от интактного контроля по критерию Манна – Уитни; * — различия достоверны при p < 0,05
ОБСУЖДЕНИЕ
Компенсация функционального дефицита, вызванного повреждением нерва, происходит за счёт трёх механизмов: реиннервации денервированных органов-мишеней путём регенерации повреждённых аксонов, реиннервации за счёт коллатерального спраутинга неповреждённых аксонов, ремоделирования схем центральной нервной системы, относящихся к утраченным функциям [25].
Для оценки выраженности регенерационного компонента морфофункционального восстановления в животных моделях повреждений нервов наиболее информативен метод гистоморфометрии поперечных полутонких срезов дистальнее зоны повреждения, который нашёл широкое применение в доклинических исследованиях нейрорегенерации.
Так, по данным E.F. Oliveira et al., при повреждении седалищного нерва крыс в ранние сроки регенерации (до 2 мес. после операции) отмечена корреляция седалищного функционального индекса с численной плотностью регенерирующих волокон, которая оценена авторами как адекватный инструмент оценки функционального дефицита [26]. По данным R.S. Martins et al., через 6 мес. после операции из 17 исследованных гистоморфометрических и электрофизиологических параметров только средний диаметр миелинизированных волокон проксимальнее и дистальнее зоны повреждения коррелировал с седалищным функциональным индексом [27].
Отмеченная закономерность, по-видимому, не случайна. Радиальный рост аксонов, увеличивающий диаметр регенерировавших волокон, начинается только после контакта конусов роста с органами-мишенями [28]. Однако восстановление нормальных размеров регенерирующих волокон не происходит вплоть до 6 мес. после травмы даже в модели передавливания нерва крыс, когда регенерация аксонов происходит внутри сохранивших целостность эндоневральных трубок [29]. По данным M. Ikeda et al., через 7 мес. после перерезки и шва седалищного нерва крыс средний диаметр регенерировавших нервных волокон не превышал 50 % значения интактного нерва [30].
В нашем исследовании медиана диаметров регенерировавших миелинизированных волокон на уровне средней трети голени составила 52 % от значения интактной группы у нестимулированных крыс и превысила 60 % у стимулированных. Это даёт основание считать, что реиннервация органов-мишеней в наших экспериментах осуществляется активно как у стимулированных, так и нестимулирован-ных животных, но к 6 мес. после аутонейропластики не завершена. Наиболее существенный результат нашего исследования — статистически значимая разница всех размерных параметров регенерирующих нервных волокон в группах нестимулированных и стимулированных животных, доказывающая эффективность однократного 40-минутного сеанса ИЭС проксимального отрезка нерва. Следует также отметить, что разница между стимулированными и нестимулированными животными по всем размерным параметрам миелинизированных волокон через 6 мес. после операции была больше, чем через 4 мес., что указывает на стойкий нейрорегенераторный эффект.
Выполненная в нашем исследовании оценка эндоневральной васкуляризации большеберцового нерва через 4 и 6 мес. после аутонейропластики большеберцовой порции седалищного нерва также свидетельствует о реваскуляризирующем эффекте ИЭС.
Исследования васкуляризации регенеририрующих нервов немногочисленны, однако они свидетельствуют об увеличении размеров интраневральных сосудов под действием нейропептидов, а также о ва- зодилатации и неоангиогенезе, связанных с усилением секреции вазогенных факторов резидентными и рекрутированными макрофагами [31]. В нашем исследовании численная плотность эндоневральных сосудов и их диаметры значимо превышали соответствующие параметры интактных нервов в обеих группах оперированных животных. Однако через 4 мес. после операции диаметр просвета возрастал только у стимулированных крыс на 8 %, что наряду с изменениями индекса Керногана указывает на лучшую пропускную способность эндоневральных сосудов в данной серии по сравнению с нести-мулированным контролем. Через 6 мес. после операции гиперваскуляризация эндоневрия сохраняется в обеих сериях, но у стимулированных крыс диаметры эндоневральных сосудов и их просветов достоверно превышают значения нестимулированных на 19 %.
Полученные гистоморфометрические данные согласуются с результатами функциональной оценки.
По данным клинических исследований, хорошее восстановление функции нервов после аутонейропластики могут быть получены только у пациентов моложе 25 лет [32]. В наших экспериментах использованы крысы таких возрастных групп, которые, по данным других авторов, характеризуются снижением уровня антиоксидантов и развитием метаболического синдрома [33]. То есть, результаты нашего исследования могут быть транслированы в клиническую практику для пациентов не только молодого, но и среднего возраста.
ЗАКЛЮЧЕНИЕ
Значимое увеличение диаметров регенерирующих нервных волокон в большеберцовом нерве, а также диаметров их аксонов и толщины миелинизированных оболочек через 4 и 6 мес. после аутопластики большеберцовой порции седалищного нерва в группе животных с однократной 40-минутной ИЭС проксимального участка седалищного нерва свидетельствует о промотирующем влиянии применённого аддитивного воздействия на регенераторный аксоно- и миелиногенез.
Увеличение просветов и улучшение пропускной способности эндоневральных сосудов большеберцового нерва в серии с ИЭС обеспечило стойкость нейрорегенераторного эффекта.
Функциональная значимость эффектов однократной интраоперационной стимуляции подтверждается достоверно более высоким процентом животных с отличными результатами восстановления статического функционального индекса (50 % против 12,15 % в нестимулированном контроле).
Финансирование . Научная работа финансирована в рамках государственного задания.
Список литературы Оценка отдаленных результатов однократной интраоперационной электронейростимуляции после аутологичной пластики резекционного дефекта большеберцовой порции седалищного нерва взрослых крыс
- Huckhagel T, Nüchtern J, Regelsberger J, et al. Nerve injury in severe trauma with upper extremity involvement: evaluation of49,382 patients from the TraumaRegister DGU® between 2002 and 2015. Scand J Trauma Resusc EmergMed. 2018;26(1):76. doi: 10.1186/s13049-018-0546-6
- Huckhagel T, Nüchtern J, Regelsberger J, et al. Nerve trauma of the lower extremity: evaluation of 60,422 leg injured patients from the TraumaRegister DGU® between 2002 and 2015. Scand J Trauma Resusc Emerg Med. 2018;26(1):40. doi: 10.1186/s13049-018-0502-5
- Литвиненко И.В., Одинак М.М., Живолупов С.А. и др. Клинико-инструментальные характеристики травматических поражений периферических нервов конечностей. Вестник Российской Военно-медицинской академии. 2018;20(3):50-56. doi: 10.17816/brmma12231
- Ferguson TA, Son YJ. Extrinsic and intrinsic determinants of nerve regeneration. J Tissue Eng. 2011;2(1):2041731411418392. doi: 10.1177/2041731411418392
- Grinsell D, Keating CP. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. Biomed Res Int. 2014;2014:698256. doi: 10.1155/2014/698256
- Raginov IS, Chelyshev YA. Post-traumatic survival of sensory neurons of different subpopulations. Neurosci Behav Physiol. 2005;35(1):17-20. doi: 10.1023/b:neab.0000049647.19397.30
- Gordon T. Peripheral Nerve Regeneration and Muscle Reinnervation. Int J Mol Sci. 2020;21(22):8652. doi: 10.3390/ ijms21228652
- Lamoureux PL, O'Toole MR, Heidemann SR, Miller KE. Slowing of axonal regeneration is correlated with increased axonal viscosity during aging. BMC Neurosci. 2010;11:140. doi: 10.1186/1471-2202-11-140
- Lemke A, Penzenstadler C, Ferguson J, et al. A novel experimental rat model of peripheral nerve scarring that reliably mimics post-surgical complications and recurring adhesions. Dis Model Mech. 2017;10(8):1015-1025. doi: 10.1242/ dmm.028852
- Wang ML, Rivlin M, Graham JG, Beredjiklian PK. Peripheral nerve injury, scarring, and recovery. Connect Tissue Res. 2019;60(1):3-9. doi: 10.1080/03008207.2018.1489381
- Mu L, Chen J, Li J, et al. Immunohistochemical Detection of Motor Endplates in the Long-Term Denervated Muscle. JReconstrMicrosurg. 2018;34(5):348-358. doi: 10.1055/s-0038-1627463
- Borisov AB, Huang SK, Carlson BM. Remodeling of the vascular bed and progressive loss of capillaries in denervated skeletal muscle. AnatRec. 2000;258(3):292-304. doi: 10.1002/(SICI)1097-0185(20000301)258:3<292::AID-AR9-3.0.C0;2-N
- ElAbd R, Alabdulkarim A, AlSabah S, et al. Role of Electrical Stimulation in Peripheral Nerve Regeneration: A Systematic Review. Plast Reconstr Surg Glob Open. 2022;10(3):e4115. doi: 10.1097/G0X.0000000000004115
- Худяев А.Т., Мартель И.И., Самылов В.В. и др. Малоинвазивные методы лечения повреждений периферических нервов. Гений ортопедии. 2012;(1):85-88.
- Бажанов С.П., Шувалов С.Д., Бахарев Р.М. и др. Сравнительный анализ ближайших результатов хирургического лечения пациентов с закрытыми тракционны-ми повреждениями плечевого сплетения. Гений ортопедии. 2022;28(5):631-635. doi: 10.18019/1028-4427-2022-28-5-631-635. EDN: RIGWJV.
- Wong JN, Olson JL, Morhart MJ, Chan KM. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Ann Neurol. 2015;77(6):996-1006. doi: 10.1002/ana.24397
- McLean NA, Verge VM. Dynamic impact of brief electrical nerve stimulation on the neural immune axis-polarization of macrophages toward a pro-repair phenotype in demyelinated peripheral nerve. Glia. 2016;64(9):1546-1561. doi: 10.1002/glia.23021
- Shapira Y, Sammons V, Forden J, et al. Brief Electrical Stimulation Promotes Nerve Regeneration Following Experimental In-Continuity Nerve Injury. Neurosurgery. 2019;85(1):156-163. doi: 10.1093/neuros/nyy221
- Roh J, Schellhardt L, Keane GC, et al. Short-Duration, Pulsatile, Electrical Stimulation Therapy Accelerates Axon Regeneration and Recovery following Tibial Nerve Injury and Repair in Rats. Plast Reconstr Surg. 2022;149(4):681e-690e. doi: 10.1097/PRS.0000000000008924
- Sayanagi J, Acevedo-Cintrón JA, Pan D, et al. Brief Electrical Stimulation Accelerates Axon Regeneration and Promotes Recovery Following Nerve Transection and Repair in Mice. J Bone Joint Surg Am. 2021;103(20):e80. doi: 10.2106/ JBJS.20.01965
- Raslan A, Salem MAM, Al-Hussaini A, et al. Brief Electrical Stimulation Improves Functional Recovery After Femoral But Not After Facial Nerve Injury in Rats. AnatRec (Hoboken). 2019;302(8):1304-1313. doi: 10.1002/ar.24127
- Zuo KJ, Shafa G, Antonyshyn K, et al. A single session of brief electrical stimulation enhances axon regeneration through nerve autografts. Exp Neurol. 2020;323:113074. doi: 10.1016/j.expneurol.2019.113074
- Koh GP, Fouad C, Lanzinger W, Willits RK. Effect of Intraoperative Electrical Stimulation on Recovery after Rat Sciatic Nerve Isograft Repair. NeurotraumaRep. 2020;1(1):181-191. doi: 10.1089/neur.2020.0049
- van Neerven SG, Bozkurt A, O'Dey DM, et al. Retrograde tracing and toe spreading after experimental autologous nerve transplantation and crush injury of the sciatic nerve: a descriptive methodological study. J Brachial Plex Peripher Nerve Inj. 2012 A;7(1):5. doi: 10.1186/1749-7221-7-5
- Navarro X, Vivó M, Valero-Cabré A. Neural plasticity after peripheral nerve injury and regeneration. Prog Neurobiol. 2007;82(4):163-201. doi: 10.1016/j.pneurobio.2007.06.005
- Oliveira EF, Mazzer N, Barbieri CH, Selli M. Correlation between functional index and morphometry to evaluate recovery of the rat sciatic nerve following crush injury: experimental study. J Reconstr Microsurg. 2001;17(1):69-75. doi: 10.1055/s-2001-12691
- Martins RS, Siqueira MG, da Silva CF, Plese JP. Correlation between parameters of electrophysiological, histomorphometric and sciatic functional index evaluations after rat sciatic nerve repair. Arq Neuropsiquiatr. 2006;64(3B):750-756. doi: 10.1590/s0004-282x2006000500010
- Regeneration of Neural Tissues. In: Stocum DL. Regenerative Biology and Medicine (Second Edition). San Diego: Academic Press Publ.; 2012:67-97.
- Muratori L, Ronchi G, Raimondo S, et al. Can regenerated nerve fibers return to normal size? A long-term post-traumatic study of the rat median nerve crush injury model. Microsurgery. 2012;32(5):383-387. doi: 10.1002/micr.21969
- Ikeda M, Oka Y. The relationship between nerve conduction velocity and fiber morphology during peripheral nerve regeneration. BrainBehav. 2012;2(4):382-390. doi: 10.1002/brb3.61
- Caillaud M, Richard L, Vallat JM, et al. Peripheral nerve regeneration and intraneural revascularization. Neural Regen Res. 2019;14(1):24-33. doi: 10.4103/1673-5374.243699
- Kuffler DP, Foy C. Restoration ofNeurological Function FollowingPeripheral Nerve Trauma. Int JMol Sci. 2020;21(5):1808. doi: 10.3390/ijms21051808
- Ghezzi AC, Cambri LT, Botezelli JD, et al. Metabolic syndrome markers in wistar rats of different ages. DiabetolMetab Syndr. 2012;4(1):16. doi: 10.1186/1758-5996-4-16


