Оценка пятилетнего риска летального исхода и развития сердечно-сосудистых событий у пациентов с острым инфарктом миокарда на основе синхронизации 0,1 Гц-ритмов в сердечно-сосудистой системе
Автор: Киселев А.Р., Гриднев В.И., Караваев А.С., ПосненковА. О.М., ПономаренкО. В.И., ПрохороВ. М.Д., БезручкО. Б.П., Шварц В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 2 т.6, 2010 года.
Бесплатный доступ
Цель - оценка значения показателей вегетативной регуляции сердца как факторов пятилетнего риска смерти и развития сердечно-сосудистых осложнений у больных острым инфарктом миокарда (ИМ) и изучение динамики указанных показателей в ближайшем и отдаленном постинфарктных периодах. Материал и методы. В проспективное обсервационное исследование были включены 125 пациентов с острым ИМ (42 % женщин), в возрасте 30-83 лет (min-max). Длительность наблюдения - 6 лет. Контрольные точки: 1 неделя, 3 неделя, 6 месяцев, 1 год, далее - ежегодно. В течение первого года наблюдения изучалась динамика показателей вариабельности сердечного ритма (ВСР) и синхронизации 0,1 Гц-ритмов в сердце и микроциркуляции крови (S). Конечные точки: смерть, ИМ, мозговой инсульт. Результаты. Наибольшее значение для оценки пятилетнего риска смерти у больных, перенесших острый ИМ, имеет развитие острой сердечной недостаточности Killip 2-4 при остром ИМ и значения показателя S
1 гц-ритм, инфаркт миокарда, микроциркуляция, сердце, синхронизация, факторы риска
Короткий адрес: https://sciup.org/14917071
IDR: 14917071
Текст научной статьи Оценка пятилетнего риска летального исхода и развития сердечно-сосудистых событий у пациентов с острым инфарктом миокарда на основе синхронизации 0,1 Гц-ритмов в сердечно-сосудистой системе
-
1 В ведение . Нарушениям вегетативной регуляции системы кровообращения придается большое значение в патогенезе ишемической болезни сердца (ИБС) и развитии ее осложнений [1, 2]. Более того, существуют обширные данные, посвященные прогностической роли оценки вариабельности сердечного ритма (ВСР), как наиболее доступного маркера вегетативной дисфункции в предсказании тяжести течения и исхода инфаркта миокарда (ИМ) – наиболее тяжелой формы ишемической болезни сердца [3], являясь надежным предиктором летальности, превосходя в этом даже левожелудочковую систолическую дисфункцию [4, 5].
В настоящее время в клинической практике при описании вегетативной регуляции сердечнососудистой системы, наряду с классическими методами оценки ВСР, все чаще используются нелинейные методы анализа. Известно, что в сердечно-сосудистой системе человека выявляются несколько основных колебательных процессов [6], при этом согласно представлениям о функционировании сложных систем данные процессы могут быть синхронизованы между собой [7, 8]. Особый интерес представляют исследования синхронизации 0,1 Гц-ритмов в системе кровообращения, выявляемых в ВСР [9], колебаниях артериального давления [10] и микроциркуляции крови [11]. Считается, что данные ритмы характеризуют свойства центрального звена вегетативной регуляции [12]. При этом обнаружение синхронизации является свидетельством адекватного взаимодействия функциональных компонентов системы кровообращения при адаптации к внешним и внутренним изменениям.
В ранее опубликованной нами работе было показано, что синхронизация 0,1 Гц-ритмов в ВСР и микроциркуляции крови является индикатором динами-
ческих вегетативных нарушений у больных острым ИМ [11].
Целью данной работы являлось изучение особенностей динамики показателей вегетативной регуляции сердечно-сосудистой системы у больных острым ИМ, таких как параметры ВСР и синхронизация 0,1 Гц-ритмов в ближайшем и отдаленном постинфарктном периодах, а также выявление и сравнительная оценка прогностических факторов пятилетнего риска смерти и развития сердечно-сосудистых событий (ИМ и мозговой инсульт) у данной категории пациентов.
Методы. В проспективное обсервационное исследование были включены 125 пациентов с острым инфарктом миокарда (72 мужчины и 53 женщины) в возрасте от 30 до 83 лет (min-max), находившихся на лечении в клинике Саратовского НИИ кардиологии. Испытуемые дали добровольное согласие на включение их в данное исследование. Клинико-анамнестическая характеристика больных острым ИМ в исследуемой группе и результаты основных клинических исследований представлены в таблице 1.
Длительность проспективного наблюдения за включенными в исследование пациентами составила 5 лет. Контрольные точки исследования (по сроку давности острого ИМ): 2-5 сутки, 3 недели, 6 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 6 лет (дополнительная контрольная точка). В течение первого года после наступления ИМ на контрольных точках исследования оценивалась динамика показателей вегетативной регуляции сердечно-сосудистой системы. В качестве конечных точек исследования были приняты следующие критерии: 1) смерть, 2) инфаркт миокарда, 3) мозговой инсульт. Необходимо отметить, что в дизайне исследования была предусмотрена возможность как единовременного комбинирования конечных точек (например, летальный исход + ИМ, летальный исход + мозговой инсульт), так и поочередного их наступления (например, ИМ – 1 год, летальный
Таблица 1
Клинико-анамнестическая характеристика больных острым ИМ в исследуемой группе (n = 125)
|
Показатели |
Ед. измер. |
Значения |
|
Пол |
% жен. |
42 % женщин |
|
Возраст |
лет |
65 (57; 74) |
Данные анамнеза
|
ИБС, стенокардия |
% |
79,2 % |
|
Перенесенный инфаркт миокарда |
% |
47,2 % |
|
Давность перенесенного инфаркта миокарда |
лет назад |
3 (1; 8) |
|
Хроническая сердечная недостаточность |
% |
36,8 % |
|
Артериальная гипертония |
% |
62,4 % |
|
Длительность АГ |
лет |
10 (5; 20) |
|
Перенесенный инсульт |
% |
7,2 % |
|
Заболевания периферических артерий |
% |
1,6 % |
|
Хроническая почечная недостаточность |
% |
3,2 % |
|
Сахарный диабет 2 типа |
% |
8,8 % |
|
Хроническая обструктивная болезнь легких |
% |
11,2 % |
|
Курение |
% |
22,6 % |
Данные объективного обследования
|
Острый коронарный синдром с подъемом ST |
% |
64,0 % |
|
Патологический зубец Ԛ на ЭКГ |
% |
63,2 % |
|
Острая сердечная недостаточность, Killip 2-4 |
% |
9,6 % |
|
Госпитальная летальность |
% |
1,6 % |
|
Осложненное течение ОИМ |
% |
12,0 % |
|
САД при поступлении |
мм рт.ст. |
140 (120; 160) |
|
ДАД при поступлении |
мм рт.ст. |
85 (80; 90) |
|
ИМТ |
кг/м2 |
27,7 (24,8; 29,3) |
Лабораторные данные
|
Холестерин общий |
мг/дл |
189 (166; 218) |
|
Триглицериды |
мг/дл |
99 (86; 130) |
|
Креатинин крови |
мг/дл |
0,79 (0,76; 0,82) |
|
Фракция выброса левого желудочка |
% |
50 (46; 57) |
Проводимое лечение в период госпитализации с ОИМ (основные показатели)
|
Тромболизис |
% |
32,0 % |
|
Антикоагулянты |
% |
96,8 % |
|
Антиагреганты |
% |
100 % |
|
β-адреноблокаторы |
% |
84,0 % |
|
Ингибиторы АПФ |
% |
91,9 % |
|
Антагонисты кальция |
% |
6,5 % |
|
Диуретики |
% |
43,5 % |
|
Сердечные гликозиды |
% |
2,4 % |
|
Статины |
% |
7,3 % |
Примечание : данные представлены в виде медианы и квартильного диапазона – Ме (25%; 75%).
исход – 5 лет). При наступлении летального исхода без комбинации его с ИМ или мозговым инсультом анализировалась причина смерти по следующим категориям: вследствие осложнений сопутствующих заболеваний; причина смерти не была установлена (внезапная смерть; не проводилось патологоанатомическое исследование).
В течение первого года после развития острого ИМ на контрольных точках исследования (2-5 сутки, 3 недели, 6 месяцев, 1 год) оценивались: наступление клинических исходов исследования, динамика клинического статуса пациентов и динамика показателей вегетативной регуляции сердечно-сосудистой системы (ВСР и синхронизация 0,1 Гц-ритмов в системе кровообращения). В дальнейшем (контрольные точки: 2 года – 5 лет) проводился только анализ конечных точек исследования.
В период госпитализации всем больным острым ИМ проводилось лечение в соответствии с современными рекомендациями по лечению острого коронарного синдрома. Данные о частоте применения различных групп лекарственных препаратов в исследуемой выборке больных острым ИМ приведены в таблице 1.
Изучение вегетативной регуляции сердечнососудистой системы на этапах исследования (в течение первого года после перенесенного ИМ) проводилось на основе следующих методик: 1) спектральный анализ ВСР, 2) временной анализ ВСР, 3) оценка синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови.
Для изучения вегетативной регуляции сердечнососудистой системы всем обследованным проводилась одновременная регистрация электрокардиограммы (ЭКГ), фотоплетизмограммы (ФПГ) и механической записи дыхания в горизонтальном положении тела. Продолжительность каждой записи составляла 10 минут. Во время регистрации сигналов дыхание у всех обследованных было произвольным. В исследуемой группе пациентов с перенесенным ИМ выполнялись вышеуказанные записи на всех контрольных точках исследования в течение первого года после перенесенного ИМ (см. перечень контрольных точек выше по тексту). Все записи сделаны в период с 13 до 15 часов.
Регистрация ЭКГ, ФПГ и дыхания осуществлялась при помощи многоканального электроэнцефалографа-анализатора ЭЭГА-21/26 «Энце-фалан-131-03» модель 10 (НПКФ «Медиком-МТД», Россия) с комплектом стандартных датчиков. Регистрация сигналов производилась с частотой 250 Гц при 12 разрядном разрешении. Запись ФПГ проводилась при помощи пульсоксиметрического датчика (в проходящем свете), помещенного на дистальной фаланге указательного пальца. При помощи записи дыхания контролировались спонтанность дыхания, отсутствие форсированных вдохов и задержек дыхания во время регистрации записей, тем самым из анализа исключались случайные влияния на сердечно-сосудистую систему со стороны дыхания, т.е. все исследования проводились в относительно стандартных условиях спонтанного дыхания. Для дальнейшего анализа отбирались записи сигналов ЭКГ и ФПГ, не содержащие помех, экстрасистол, заметного линейного тренда и переходных процессов.
Спектральные оценки ВСР получали при помощи параметрического метода построения спектра RR-ряда на основе авторегрессионной модели. Компьютерная программа анализа спектра ВСР, разработанная в Саратовском НИИ кардиологии, обеспечивает разрешение по частоте 0,01 Гц в диапазоне от 0,0002 Гц до 0,5 Гц; период квантования массива RR-интервалов – 0,5 сек (Свидетельство об официальной регистрации программы для ЭВМ № 980656 от 12.11.1998). Для анализа выделялись частотные диапазоны: высокочастотный (HF: 0,15-0,4 Гц) и низкочастотный (LF: 0,05-0,15 Гц) [13], в которых вычислялась частотная мощность спектра. Кроме того, оценивали уровень средней частоты сердечных сокращений (ЧСС) и ряд временных показателей ВСР (SDNN, RMSSD, PNN50, CV) при помощи «Программы для расчета статистических характеристик кар-диоритмограммы (Кардиостат)» (Свидетельство о государственной регистрации программы для ЭВМ № 2008613910 от 15.08.2008).
Для исследования синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови использовался метод изучения функционального состояния сердечнососудистой системы на основе анализа синхронизо-ванности 0,1 Гц-ритмов (Патент на изобретение № 2374986 от 10.12.2008, приоритет от 22.07.2008) с применением Программы для исследования синхро-низованности между ритмами сердечно-сосудистой системы человека с контролем статистической значимости результатов (Синхрокард) (Свидетельство об официальной регистрации программы для ЭВМ №2008613908 от 15.08.2008).
При выделении периодики в ВСР с частотой 0,1 Гц проводил полосовую фильтрацию последовательности R-R инт е рвало в устранением высокоч а стотные колебания – HF (более 0,15 Гц), связанные преимущественно с дыханием, и очень низкочастотные колебания – ULF (менее 0,05 Гц). После полосовой фильтрации мы вычисляли фазу z 1 периодических колебаний на частоте 0,1 Гц в ВСР, используя преобразование Гильберта. При обработке сигнала ФПГ выделялись колебания с частотой 0,1 Гц, аналогичные таковым в ВСР. Записи ФПГ анализировалась нами как периодический волновой процесс, а специального изучения отдельных показателей кривой сигнала мы не проводили. Сигнал ФПГ подвергался такой же фильтрации, как сигнал ВСР, - устранялись HF-, и ULF-колебания. Затем вычислялась фаза z 2 периодических 0,1 Гц-колебаний в ФПГ, используя преобразование Гильберта.
Наличие синхронизации между ритмами с частотой 0,1 Гц, выделенными из последовательности R-R интервалов и из ФПГ, мы определяли, вычисляя разность фаз:
{ = ]1 - ] 2 , где φ — обобщенная разность фаз, или относительная фаза. При этом на графике зависимости относительной фазы от времени имелся участок, на котором φ колебался около некоторого постоянного значения, т.е. очевидно, что имела место фазовая синхронизация.
По показателю разности фаз мы подсчитывали общую длительность всех участков синхронизации, т.е. время, на протяжении которого 0,1 Гц-ритмы были синхронизованы во время записи ЭКГ и ФПГ, а также выражали его в процентах от длительности всей записи, т.е. рассчитывали суммарный процент синхронизации S. Участки синхронизации мы определяли по внешнему виду графика зависимости разности фазы от времени, выделяя участки на которых относительная фаза колебалась около некоторого постоянного значения. С помощью такого показателя синхронизации S мы характеризовали относитель- ное время синхронизации между ритмами с частотой около 0,1 Гц в микроциркуляции крови и ВСР.
В качестве «порогового» значения показателя S , выше которого можно считать качество функционального взаимодействия 0,1 Гц-механизмов регуляции сердца и микроциркуляции крови удовлетворительным, у больных ишемической болезнью сердца, перенесших острый ИМ, нами эмпирически было принято 20% (для первичного анализа). Данное значение выбрано на основе предположения, что для обеспечения адекватных адаптационных способностей сердечно-сосудистой системы наравне с механизмами местной и гуморальной регуляции у данной категории пациентов необходимо участие центральных 0,1 Гц-механизмов вегетативной регуляции в течение не менее 20% общего времени функционирования системы кровообращения. В дальнейшем обоснованность выбора «порогового» значения показателя S анализировали при помощи характеристической кривой (ROC-кривая).
Статистическую обработку данных выполняли при помощи программного пакета «Statistica 6.1». С целью выбора дальнейшей методики анализа полученных данных произведена проверка соответствия их закону нормального распределения на основе вычисления критерия Шапиро-Уилка Ԝ. Выявлено, что структура данных по большинству изучаемых показателей не описывается законом нормального распределения, поэтому дальнейшие исследования зависимостей производились методами непараметрической статистики. Сравнения переменных выполнялись при помощи критерия парных сравнений Вилкоксона. Сравнение групп проводилось с использованием U-критерия Манна-Уитни. Данные представлены в виде медианы и значений квартильного диапазона, – Ме (25%; 75%). Анализ значения изучаемых показателей для оценки пятилетнего риска смерти и развития осложнений (инфаркт миокарда, мозговой инсульт) у больных, перенесших острый ИМ, производился на основе оценок Каплана-Мейера, F-критерия Кокса и регрессионных моделей
Кокса. Для каждого из исследуемых показателей рассчитывались вероятностные прогностические оценки (отношение шансов), относительно вышеуказанных конечных точек исследования. Для решения ряда задач использовался кластерный анализ. Надежность используемых статистических оценок принималась не менее 95%.
Результаты. Динамика основных временных и спектральных показателей ВСР в течение первого года после перенесенного ИМ.
Проведен анализ динамики основных временных и спектральных показателей ВСР в исследуемой группе больных, перенесших ИМ, в течение первого года наблюдения (табл. 2). Показано, что в течение первых шести месяцев после наступления острого ИМ не отмечалось достоверной динамики (р>0,05) указанных показателей ВСР. Через год после развития острого ИМ в целом по исследуемой группе пациентов отмечалось достоверное (р<0,05) снижение мощности в HF-диапазоне спектра ВСР, а также значений SDNN и RMSSD (табл. 2). В LF-диапазоне спектра ВСР к концу первого года после развития острого ИМ можно отметить недостоверную (р>0,05) тенденцию к некоторому снижению значений спектральной мощности. Значения среднего уровня ЧСС в изучаемой группе пациентов в течение первого года после развития острого ИМ достоверно не изменялись (р>0,05).
Половых и возрастных особенностей динамики временных и спектральных показателей ВСР в течение первого года после перенесенного ИМ выявлено не было.
Динамика показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови в течение первого года после перенесенного ИМ.
При анализе динамики показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови ( S ) в течение первого года наблюдения после перенесенного острого ИМ в целом по исследуемой группе больных ишемической болезнью сердца выявлено достоверное (р<0,05) снижение показателя S к концу
Таблица 2
Динамика основных показателей ВСР, показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови у больных, перенесших ИМ, в течение первого года наблюдения
|
Показатели |
1-я неделя ИМ |
3-я неделя ИМ |
6 месяцев после развития ИМ |
1 год после развития ИМ |
|
Спектральные характеристики ВСР |
||||
|
LF-диапазон, мс2 |
127 (51; 313) |
116 (65; 243) |
123 (57; 361) |
115 (65; 209) |
|
HF-диапазон, мс2 |
181 (79; 438) |
214 (81; 676) |
201 (77; 520) |
157 (85; 263)* |
|
Временные показатели ВСР |
||||
|
ЧСС средняя, уд/мин |
68 (60; 75) |
66 (59; 74) |
69 (62; 78) |
70 (63; 79) |
|
SDNN, мс |
40,2 (22,9; 81,9) |
35,0 (23,1; 99,6) |
40,2 (24,1; 76,4) |
33,5 (22,5; 53,7)* |
|
RMSSD, мс |
48,1 (27,3; 105,8) |
46,2 (25,2; 139,3) |
44,3 (27,0; 93,8) |
38,2 (21,4; 74,5)* |
|
PNN50, % |
2,9 (0,6; 9,7) |
3,7 (0,3; 14,1) |
3,3 (0,6; 10,2) |
2,5 (0,6; 7,1) |
|
CV, % |
4,4 (2,7; 8,9) |
3,5 (2,5; 11,1) |
4,4 (2,7; 8,3) |
3,9 (2,6; 6,9) |
|
Показатель синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови (S) |
||||
|
S, % |
16,3 (9,4; 24,6) |
18,4 (11,2; 28,2) |
17,4 (12,9; 26,0) |
14,8 (8,8; 21,5)+# |
|
∆Sn-исход, % |
- |
+3,4 (-8,4; +13,1) |
-2,6 (-11,8; +8,9) |
-5,4 (-10,8; +6,2) + |
|
Доля пациентов с Sn<20%, % |
61,3 |
57,1 |
61,2 |
71,4 |
П р и м еч а н и е : * – достоверное (р<0,05) отличие от значений данного показателя на 1-й неделе течения ИМ; + – достоверное (р<0,05) отличие от значений данного показателя на 3-й неделе течения ИМ; # – достоверное (р<0,05) отличие от значений данного показателя на 6-й неделе после перенесенного острого ИМ.
Таблица 3
Динамика показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови ( S ) в подгруппах больных, перенесших ИМ, выделенных в результате кластерного анализа, в течение первого года наблюдения
|
Показатели |
1-я неделя ИМ |
3-я неделя ИМ |
6 месяцев после развития ИМ |
1 год после развития ИМ |
Кластер №1 (80% пациентов из общей группы)
|
S, % |
15,7 (10,0; 24,8) |
15,9 (9,9; 20,1) |
17,2 (13,1; 21,2) |
14,7 (7,5; 21,4)* |
|
∆Sn-исход, % |
- |
-1,8 (-10,4; +6,3) |
-3,6 (-12,3; +6,7) |
-6,4 (-10,8; +4,6) |
|
Доля пациентов с Sn<20%, % |
61,7 |
75,0 |
64,3 |
71,4 |
Кластер №2 (20% пациентов из общей группы)
|
S, % |
18,0 (9,4; 24,3) |
40,7 (36,1; 46,2)* |
23,7 (8,9; 32,5)+ |
15,6 (9,4; 20,2)+ |
|
∆Sn-исход, % |
- |
+23,8 (+13,3; +32,2) |
-2,5 (-7,6; +8,9)+ |
+1,2 (-12,0; +10,3)+ |
|
Доля пациентов с Sn<20%, % |
60,0 |
100,0* |
59,2+ |
71,3+ |
П р и м еч а н и е : * – достоверное (р<0,05) отличие от значений данного показателя в данной подгруппе на 1-й неделе течения ИМ; + – достоверное (р<0,05) отличие от значений данного показателя в данной подгруппе на 3-й неделе течения ИМ; # – достоверное (р<0,05) отличие от значений данного показателя в данной подгруппе на 6-й неделе после перенесенного острого ИМ; жирный шрифт – достоверное (р<0,05) отличие от значений данного показателя в подгруппе «кластер №1».
первого года. Для наглядности в таблице 2 представлены групповые значения индивидуальной динамики показателя S на контрольных точках исследования (3 недели, 6 месяцев, 1 год), относительно его исходных значений на 1-й неделе течения ИМ ( ∆S n-исход ).
Учитывая данные, полученные нами в ранее проведенном исследовании [12], свидетельствующие о том, что в первые три недели после развития острого ИМ наблюдается разнородность динамики показателя синхронизации S у пациентов, проведен анализ индивидуальных особенностей динамики качества синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови. Для решения поставленной задачи был использован кластерный анализ с учетом индивидуальных значений показателя S на первой и третьей неделях после перенесенного острого ИМ, было выделено две подгруппы (кластера) больных, перенесших острый ИМ, различающиеся по индивидуальным особенностям динамики значений показателя S с первой по третью неделю течения ИМ. В таблице 3 представлены данные о динамике показателя S в течение первого года наблюдения у пациентов в выделенных подгруппах. Показано, что в общей группе у 20% больных с острым ИМ (кластер №2, 25 чел.) в течение первых трех недель отмечается повышение значений показателя S в 1,5-2 раза, относительно его исходных значений на первой неделе течения ИМ (р<0,001), достоверно (p<0,001) отличаясь этим от других 80% пациентов (кластер №1, 100 чел.) изучаемой общей группы. В дальнейшем (через 6 и 12 месяцев после развития острого ИМ) различия между выделенными подгруппами не выявлись. Отметим, что выделенные подгруппы-кластеры не имели значимых отличий по основным клиническим, лабораторным и инструментальным показателям.
Выявленная при кластерном анализе неоднородность общей группы больных, перенесших ИМ, свидетельствует о наличии индивидуальных особенностей системной вегетативной дисфункции у данной категории пациентов. Однако кластерный анализ в данном случае выявил наиболее полярные подгруппы пациентов с точки зрения динамики качества синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови в первые три недели течения ИМ, при этом значения показателя S варьировали в обеих подгруппах в достаточно широком диапазоне (от 0% до 70%) в течение всего первого года наблюдения, достоверно отличаясь только на третьей неделе после острого
ИМ, поэтому дополнительно был проведен анализ динамики доли пациентов со значениями показателя S меньше 20% (условный «пороговый» уровень, см. раздел «Методы») за период наблюдения в течение первого года. Показано, что доля пациентов со значением показателя S меньше 20% в выделенных подгруппах-кластерах была сопоставима на всех этапах наблюдения, кроме третьей недели наблюдения (табл. 3); в среднем же по общей группе данный показатель достоверно не изменялся в течение первого года наблюдения (табл. 2).
Для анализа из общей группы больных, перенесших ИМ, были выделены две подгруппы: со значением показателя S <20% в первую неделю течения ИМ и со значением S ≥20%. Показано, что пациенты со значением показателя S <20% в первую неделю течения острого ИМ статистически достоверно отличались от других пациентов (со значением S ≥20%) по полу (32,9% женщин в подгруппе с S <20%, относительно 55,8% в подгруппе со значением S ≥20%; р<0,05) и динамике показателя S с первой по третью неделю после острого ИМ (+6,6 (-1,7; +18,3) % в подгруппе с S <20%, относительно -9,3 (-22,1; +4,2) % в альтернативной подгруппе; р<0,001). При этом достигнутые к третьей неделе течения ИМ уровни значений показателя S сопоставимы между собой у обеих категорий пациентов и остаются таковыми в дальнейшем до конца первого года наблюдения. По другим клиническим, лабораторным и инструментальным показателям указанные категории пациентов были сопоставимы.
Половых и возрастных особенностей динамики показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови в течение первого года после перенесенного ИМ выявлено не было.
Анализ прогностической значимости клинических показателей и показателей вегетативной регуляции для оценки пятилетнего риска смерти и развития сердечно-сосудистых осложнений у пациентов, перенесших острый ИМ.
Проведен анализ выживаемости и частоты развития сердечно-сосудистых осложнений (ИМ, мозговой инсульт) в изучаемой группе больных, перенесших острый ИМ, в течение всего пятилетнего срока наблюдения.
Общий уровень смертности в изучаемой группе больных, перенесших ИМ, составил 19,2% за период пятилетнего наблюдения. В структуре причин смертности в изучаемой группе пациентов 70,8% приходи- лось на сердечно-сосудистые заболевания (66,6% – повторный острый ИМ, 4,2% – мозговой инсульт), в 29,2% случаев – на другие причины (4% – осложнения сопутствующих заболеваний), или же причина смерти не была установлена (23% – внезапная смерть, не проводилось патологоанатомическое исследование).
Частота развития ИМ в изучаемой группе больных ИБС за период пятилетнего наблюдения составила 23,2%, а мозгового инсульта – 4%.
Был проведен сравнительный анализ кумулятивных кривых Каплана-Мейера по критериям выживаемости и частоты развития сердечно-сосудистых осложнений (ИМ, мозговой инсульт) между выделенными подгруппами пациентов, перенесших острый ИМ, с S 1 нед. <20% и S 1 нед. ≥20% (рис. 1). Показано достоверное . (р<0,05) отли . чие между данными подгруппами больных ишемической болезнью сердца, перенесших острый ИМ, по выживаемости и риску развития острого ИМ за период пятилетнего наблюдения (подтверждено F-критерием Кокса) (рис. 1а и 1б). При этом частота летальных исходов за пятилетний период наблюдения в подгруппе пациентов, перенесших острый ИМ, с S 1 нед. <20% составила 23,3%, относительно 13,5% в подгр . уппе пациентов с
S 1 нед ≥20% (р<0,05), а частота развития острого ИМ соста . вила 28,2%, относительно 17,2% (р<0,05). Отметим, что различия по показателям смертности и частоте развития ИМ между указанными подгруппами выявляются, уже начиная с первого года наблюдения. Статистически значимых различий по риску развития мозгового инсульта за период наблюдения между анализируемыми подгруппами больных не выявлено (р>0,05) (рис. 1 в).
Также был проведен сравнительный анализ частоты летальных исходов и развития острого ИМ и мозгового инсульта в зависимости от индивидуального типа динамики показателя S в течение первых трех недель после перенесенного острого ИМ. Выделены две подгруппы пациентов, перенесших ИМ: с ∆S с первой по третью неделю после острого ИМ больше 0 ( ∆S 1-3 нед. >0) и с ∆S 1-3 нед. ≤0. На рисунке 2 представлены кумулятивные кривые Каплана-Мейера по критериям выживаемости и частоте развития ИМ и мозгового инсульта в выделенных подгруппах пациентов. Показано достоверное (р<0,05) отличие между выделенными подгруппами больных ишемической болезнью сердца, перенесших острый ИМ, по риску развития острого инфаркта миокарда за период пя-
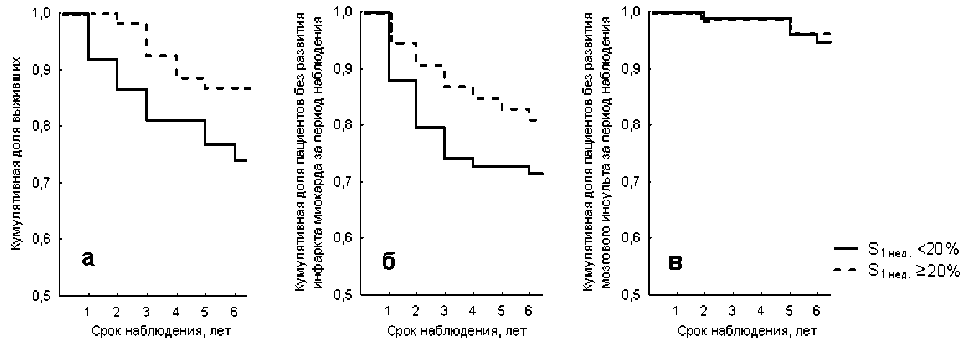
Рис. 1. Кумулятивные кривые Каплана-Мейера, иллюстрирующие динамику выживаемости (а), частоты развития острого ИМ (б) и мозгового инсульта (в) за период шестилетнего наблюдения в подгруппах больных ишемической болезнью сердца, перенесших ИМ, с S1 нед <20% и S1 нед ≥20%
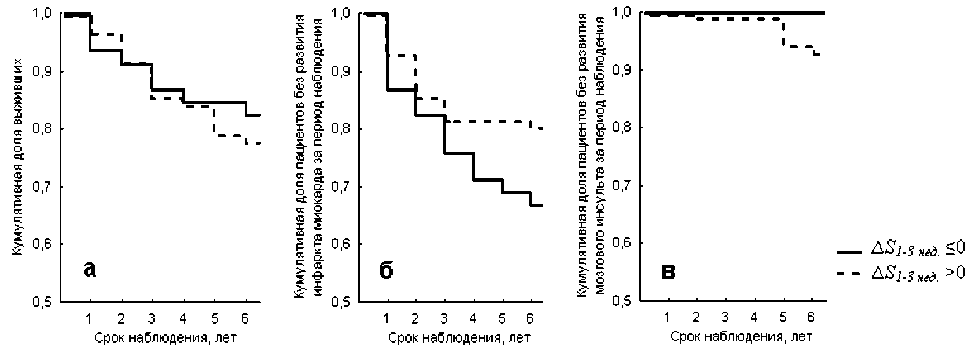
Рис. 2. Кумулятивные кривые Каплана-Мейера, иллюстрирующие динамику выживаемости (а), частоты развития острого ИМ (б) и мозгового инсульта (в) в подгруппах больных ишемической болезнью сердца, выделенных на основе индивидуальных особенностей синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови в первые три недели течения ИМ, за период шестилетнего наблюдения
тилетнего наблюдения (подтверждено F-критерием Кокса) (рис. 2б). Частота развития острого ИМ за пятилетний период наблюдения в подгруппе пациентов, перенесших острый ИМ, с ∆S 1-3 нед. ≤0 составила 33,3%, относительно 20,1% в подгрупп . е с ∆S 1-3 нед. >0 (р<0,05). Статистически значимых различий по ри . ску летальных исходов и частоте развития мозгового инсульта за период наблюдения между анализируемыми подгруппами больных не выявлено (р>0,05) (рис. 2а и 2в). Отметим, что данные подгруппы не имели значимых отличий по основным клиническим, лабораторным и инструментальным показателям.
Наблюдение за исследуемой группой больных острым ИМ в течение шестого года наблюдения полностью подтверждает выявленные тенденции в различиях выделяемых подгрупп (см. текст выше) по риску развития летального исхода и острого повторного ИМ.
На рис. 3 приведены результаты сравнительного анализа прогностического значения основных клинико-инструментальных показателей для оценки риска летального исхода и развития острого инфаркта миокарда в течение первых пяти лет после перенесенного острого инфаркта миокарда. Анализ риска развития мозгового инсульта не проводился по причине низкой частоты встречаемости данного осложнения в изучаемой группе больных ишемической болезнью сердца, перенесших острый ИМ, в течение шестилетнего наблюдения.
Выявлено, что с повышенным риском наступления летального исхода в течение пяти лет после перенесенного острого ИМ ассоциированы следующие клинические показатели: возраст старше 65 лет, наличие ишемической болезни сердца в виде стенокардии на- пряжения и перенесенного ранее инфаркта миокарда, артериальная гипертония, мозговой инсульт и преходящие нарушения мозгового кровообращения в анамнезе, хроническая обструктивная болезнь легких, острая сердечная недостаточность при развитии острого ИМ, дислипидемия, систолическая дисфункция левого желудочка, прием диуретиков, значения показателя S меньше 20% на первой и третьей неделях течения острого ИМ, сниженная мощность LF- и HF-диапазонах спектра ВСР (рис. 3). Снижают же риск летального исхода у пациентов, перенесших ИМ, проводимый тромболизис при наличии на ЭКГ подъема сегмента ST, лечение статинами и β-адреноблокаторами, отсутствие повышения значений показателя S в первые три недели течения острого ИМ.
Относительно риска развития острого ИМ в течение пяти лет после перенесенного острого ИМ можно отметить, по нашим данным, что его повышают следующие показатели: возраст старше 65 лет, принадлежность к мужскому полу, наличие в анамнезе перенесенного инфаркта миокарда, артериальная гипертония, мозговой инсульт и преходящие нарушения мозгового кровообращения в анамнезе, острая сердечная недостаточность при развитии острого ИМ, систолическая дисфункция левого желудочка, значения показателя S меньше 20% на первой неделе и/или снижение его значений в течение первых трех недель после острого ИМ (рис. 3).
Проведен анализ прогностической значимости вышеуказанных показателей, применительно к риску развития летального исхода и острого ИМ на основе регрессионных моделей Кокса. Было выполнено по-
Арте р. ги п е рто ни я Моз ГОЕ: ой И Н СуЛ ЬТ ( 3 Н.)
ПНМК(ан.)
ХП Н 0 аха р н ы й ди з б ет 2 т ип а ХОБЛ Ку ре н и е Ож прение ОС Н, ИIIip 2-4
Q-ИМ
Подъ ем ST на 3 КГ ХС >190 мг/дп
ТГ >100 мг/дл ФВ <50% ФВ <35%
Тромболизис
Диуретики
Статины
Ф В через 1 год <50%
S <20% (1 нед после И М)
S <20% (3 нед после И М)
Д5<0 (с1 поЗ нед после ИМ)
LF <200 мс2
HF <200 мс2
Возраст >65 лет
Мужской пол И ВС, стенокардия Перенесенный ИМ
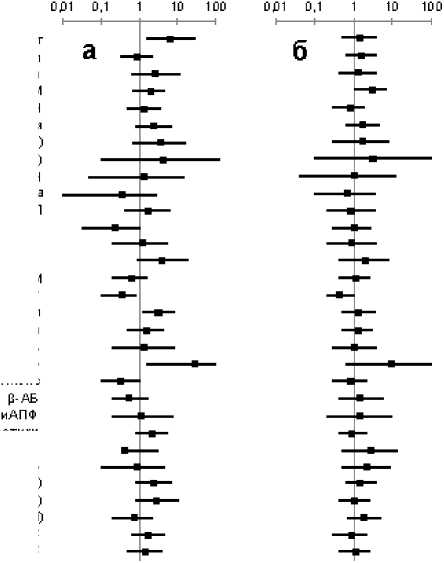
Рис. 3. Значение основных клинических, лабораторных и инструментальных показателей у больных ишемической болезнью сердца, перенесших ИМ, в оценке пятилетнего риска смерти (а) и развития острого ИМ (б).
Примечания: приведены значения отношений шансов вероятности развития конечной точки исследования (смерть, ИМ) и его 95%-ного доверительного интервала для каждого из показателей. Масштаб шкалы – логарифмический. Сокращения: ан. – в анамнезе, ХСН – хроническая сердечная недостаточность, ПНМК – преходящие нарушения мозгового кровообращения, ХПН – хроническая почечная недостаточность, ХОБЛ – хроническая обструктивная болезнь легких, ОСН – острая сердечная недостаточность при развитии последнего острого ИМ, ХС – общий холестерин крови, ТГ – триглицериды крови, ФВ – фракция выброса, β-АБ – бета-адреноблокаторы
= 40%
= 30%
= 20%
= 40%
= 30%
= 20%
= 10%
= 10% наличие ОСН при остром ИМ
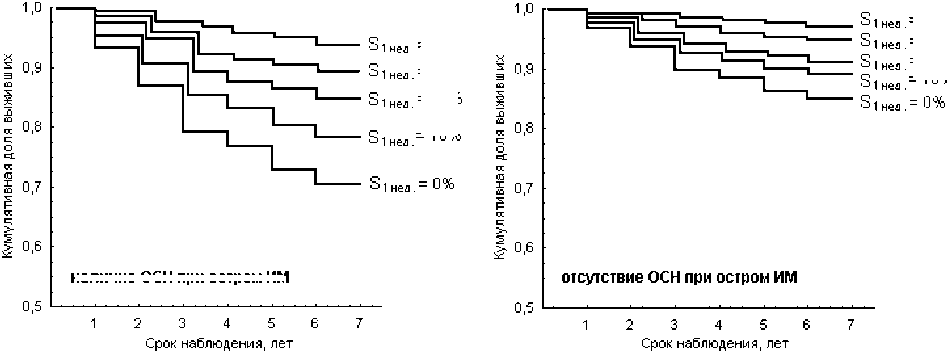
Рис. 4. Модельные кривые выживаемости на основе регрессионной модели Кокса оценки пятилетнего риска летального исхода на основе двух показателей (острая сердечная недостаточность, показатель синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови) – иллюстрация модельной оценки риска для различных комбинаций значений данных показателей.
строение ряда регрессионных моделей для выявления наиболее прогностически значимых показателей.
Показано, что с точки зрения оценки пятилетнего риска наступления летального исхода у больных, перенесших острый ИМ, наибольшее прогностическое значение имеют следующие клинические показатели: наличие острой сердечной недостаточности как осложнения острого ИМ и низкие значения показателя синхронизации 0,1 Гц-ритмов S , регистрируемые на первой неделе течения острого ИМ ( S 1нед ) (χ2 = 10,5, p = 0,005 для модели Кокса; р<0,05 для . критерия Вальда по каждому из показателей). Значимость других показателей, указанных ранее в тексте, для оценки пятилетнего риска летального исхода статистически недостоверна (р>0,05 для критерия Вальда по каждому из показателей) на основе регрессионной модели Кокса относительно указанных двух показателей (острая сердечная недостаточность и S 1нед. ). На рис. 4 представлены модельные кривые выжи . ваемости, построенные на основе разработанной модели Кокса для данных двух показателей, для случаев с наличием или отсутствием острой сердечной недостаточности как осложнения острого ИМ и различным уровнем показателя S на первой неделе течения острого ИМ.
Проведен анализ адекватности выбранного «порогового» уровня (т.е. точки разделения на характеристической кривой) показателя синхронизации 0,1 Гц-ритмов S . На рисунке 5 представлена кривая операционных характеристик (ROC-кривая) используемого метода оценки качества синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови. Показано, что наиболее оптимальное соотношение чувствительности и специфичности с точки зрения оценки пятилетнего риска летального исхода у больных с острым ИМ наблюдается при «пороговом» уровне показателя S на первой неделе после развития острого ИМ =20%, в частности, чувствительность (Se) сос т авила 76%, а специфичность (Sp) – 43%.
Независимым важным прогностическим критерием смертности является также наличие выраженной систолической дисфункции левого желудочка (фракция выброса менее 35%) (χ2 = 3,8, p = 0,04 для модели Кокса с одним указанным показателем).
При анализе значимости выделенных показателей (см. текст выше) для оценки пятилетнего риска развития повторного ИМ у больных, перенесших острый
ИМ, на основе регрессионной модели Кокса показано, что наиболее значимым с данной позиции показателем является наличие ранее перенесенных ИМ в анамнезе (χ2 = 4,1, p = 0,03 для модели Кокса с одним указанным показателем). Комбинации других показателей, изучаемых в данной работе, не позволяют достичь статистически достоверного уровня значимости при регрессионном анализе по модели Кокса.
Также был проведен сравнительный анализ прогностической значимости значений суммарного процента синхронизации 0,1 Гц-ритмов S , регистрируемых на разных сроках в течение первого года после развития острого ИМ, для оценки пятилетнего фатального риска. Показано, что наибольшей значимостью для оценки фатального риска характеризуются значения показателя S на первой неделе после острого ИМ, что подтверждается в модели Кокса (см. текст выше). Значения показателя S на третьей неделе, через шесть месяцев и через год после развития острого ИМ характеризуются сопоставимой прогностической значимостью для оценки фатального пятилетнего риска (отношение шансов для S 3 нед приведено на рис. 3).
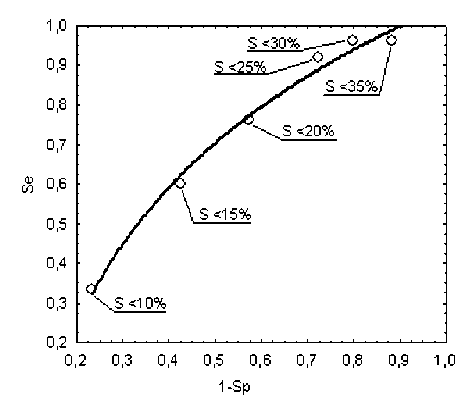
Рис. 5. ROC-кривая для разных уровней «пороговых» значений показателя синхронизации S на первой неделе после развития острого ИМ. П ри м ечан ие : Se – чувствительность, Sp – специфичность
Обсуждение. Результаты данного проспективного исследования позволяют сделать заключение о динамике параметров вегетативной регуляции сердечно-сосудистой системы в течение первого года после перенесенного острого ИМ.
Показано, что при развитии острого ИМ у больных ишемической болезнью сердца отмечается выраженная вегетативная дисфункция, что проявляется снижением оценок ВСР и показателя синхронизации 0,1 Гц-ритмов в сердечно-сосудистой системе (в частности, в ритме сердца и микроциркуляции крови), относительно значений данных показателей у здоровых лиц (данные для сравнения взяты из работы [12]). Отметим, что у ~50% пациентов при остром ИМ наблюдается повышенная активность симпатического отдела вегетативной нервной системы, проявляющаяся значениями SDNN ниже 40 мс [9]. При этом вегетативный статус около 60% пациентов (достоверно чаще у мужчин) при остром ИМ характеризуется значительным функциональным разобщением отделов сердечно-сосудистой системы (сердца и периферических сосудистых территорий), что проявляется снижением показателя синхронизации изучаемых 0,1 Гц-ритмов ниже эмпирически определенного «критического» уровня (т.е. <20%, см. раздел «Материал и методы»).
В последующие три недели после развития острого ИМ наблюдается разнонаправленная динамика качества синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови при относительно стабильном уровне спектральных показателей ВСР, что согласуется с результатами ранее проведенного нами исследования [11]. Вероятно, подобное значительное (в 1,5-2 раза) повышение качества синхронизации 0,1 Гц-ритмов с первой по третью неделю после острого ИМ у ряда пациентов (20% от общей группы) обусловлено индивидуальными особенностями адаптационных реакций вегетативной регуляции сердечно-сосудистой системы, которые не связаны напрямую с особенностями клинического статуса пациента при развитии острого ИМ, но имеют значение для оценки пятилетнего фатального и нефатального рисков. При этом в дальнейшем (уже к шестому месяцу после острого ИМ) у данной категории пациентов наблюдается стабилизация вегетативного статуса на уровне, характерном для больных с перенесенным ИМ в целом. У другой категории пациентов (80% от общей группы) в течение первых шести месяцев после перенесенного острого ИМ значимой динамики показателей вегетативной регуляции не наблюдалось. Кроме того, в данном исследовании было показано, что в среднем по общей группе повышение качества синхронизации 0,1 Гц-ритмов в первые три недели после острого ИМ ассоциировано с исходным его «критическим» снижением ( S <20%).
В конце первого года после перенесенного ИМ отмечается небольшое дальнейшее снижение дыхательнопарасимпатических влияний (оценивается по мощности HF-диапазона спектра ВСР) на вегетативную регуляцию сердца и повышение симпатического тонуса (по динамике SDNN). Исходно сниженная активность 0,1 Гц-механизмов вегетативной регуляции сердца (оценивается по мощности LF-диапазона спектра ВСР) сохраняется на относительно стабильном уровне в течение всего первого года после острого ИМ; тем не менее, у приблизительно четверти пациентов, перенесших острый ИМ, наблюдается незначительное снижение активности данного механизма регуляции сердца (выражается в тенденции к снижению мощности LF-диапазона спектра ВСР в целом по группе, см. табл. 2). Относительная стабильность среднего уровня ЧСС, косвенно отражающая состояние вегетативного баланса в течение всего первого года наблюдения, вероятно, обусловлена проводимым лечением, в частности, приемом бета-адреноблокаторов. Необходимо отметить также, что в изучаемой группе доля пациентов с «критическим» уровнем десинхронизации 0,1 Гц-механизмов регуляции функции сердца и микроциркуляции крови (т.е. <20%) была относительно неизменной в течение всего первого года наблюдения после перенесенного острого ИМ.
Таким образом, при развитии острого ИМ у большинства пациентов с ишемической болезнью сердца наблюдается выраженная вегетативная дисфункция, характеризующаяся функциональным разобщением механизмов вегетативной регуляции отделов сердечно-сосудистой системы (сердца и периферических сосудистых территорий) и смещением вегетативного баланса в сторону симпатикотонии. Дальнейшая динамика вегетативного статуса у данных пациентов в подострой стадии ИМ определяется индивидуальными особенностями системной вегетативной регуляции и степенью вегетативной дисфункции на момент развития острого ИМ. Основной целью адаптационных изменений в вегетативной регуляции сердечно-сосудистой системы является обеспечение наиболее адекватного уровня ее функционирования с учетом имеющихся функциональных и органических нарушений, обусловленных острым ИМ, ишемической болезнью сердца и сопутствующими патологиями. В более отсроченный период после развития ИМ (шестой месяц и далее) системный вегетативный статус пациентов, перенесших ИМ, стабилизируется на оптимальном уровне, обеспечивающем наиболее адекватные адаптационные возможности вегетативной регуляции сердечно-сосудистой системы без избыточного напряжения ее регуляторных механизмов. Отметим, что в изучаемой группе (около 70% пациентов) сохранялась выраженная системная вегетативная дисфункция ( S <20%), что коррелировало с их общим клиническим статусом: систолическая дисфункция левого желудочка наблюдалась у 50% пациентов; ранее перенесенный ИМ – у 47,2%; артериальная гипертония – у 62,4% и т.д.
Изученные особенности вегетативного статуса в группе больных ишемической болезнью сердца, перенесших острый ИМ, представляют особый клинический интерес с учетом результатов проспективного обсервационного пятилетнего наблюдения за данной группой. В результате анализа были выделены наиболее прогностически значимые показатели с точки зрения смертности и развития повторных ИМ; при этом установлено важное значение показателя качества синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови в оценке фатального риска.
Более того, применительно к оценке пятилетнего фатального риска качество функционального взаимодействия 0,1 Гц-механизмов вегетативной регуляции отделов сердечно-сосудистой системы у больных ишемической болезнью сердца, перенесших острый ИМ, уступает по значимости только острой сердечной недостаточности, как осложнения течения острого ИМ, и сопоставимо с таким важным предиктором риска, как систолическая дисфункция левого желудочка. При этом показатель синхронизации 0,1 Гц-ритмов превосходит по прогностической значимости другие важные клинические показатели (возраст старше 65 лет, наличие в анамнезе ишемической болезни сердца в виде стенокардии напряжения и перенесенного ранее инфаркта миокарда, артериальная гипертония, мозговой инсульт и др.), которые также повышают риск смертности у больных, перенесших ИМ.
Кроме того, низкие значения показателя синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови у больных ИБС на отдаленных сроках после развития острого ИМ (три недели и более) также являются значимыми предикторами фатальных осложнений, сопоставимыми с другими клиническими факторами риска (рис. 3), уступая, однако, по прогностической значимости значению показателя синхронизации на первой неделе после острого ИМ (подтверждено при анализе Кокса).
Полученные результаты доказывают, что десинхронизация 0,1 Гц-ритмов в сердечно-сосудистой системе у больных, перенесших острый ИМ, снижает адаптационные возможности системы кровообращения и значительно повышает риск развития летального исхода.
Применительно к пятилетнему прогнозу развития ИМ значение показателей вегетативной регуляции сердечно-сосудистой системы значительно ниже, несмотря на то что качество синхронизации 0,1 Гц-ритмов в ВСР и микроциркуляции крови входит в список факторов риска по риску развития данного исхода. Это вполне объяснимо, так как вегетативная дисфункция не является ведущим инициирующим фактором в патогенезе острого ИМ, а может лишь рассматриваться как фактор, повышающий вероятность его развития при наличии прочих факторов риска. При этом применительно к оценке пятилетнего риска развития повторного ИМ чувствительность и специфичность показателя S на первой неделе после острого ИМ составили 68% и 41% соответственно.
Заключение. Полученные результаты данного проспективного обсервационного исследования свидетельствуют о важной роли состояния функционального взаимодействия 0,1 Гц-механизмов регуляции отделов сердечно-сосудистой системы (сердца и микроциркуляции крови) для оценки риска смертности и развития инфаркта миокарда. При этом низкие значения показателя синхронизации 0,1 Гц-ритмов S (менее 20%) при остром ИМ являются чувствительными индикаторами повышенного риска смерти как в течение последующего первого года, так и в последующие пять лет.
Список литературы Оценка пятилетнего риска летального исхода и развития сердечно-сосудистых событий у пациентов с острым инфарктом миокарда на основе синхронизации 0,1 Гц-ритмов в сердечно-сосудистой системе
- Зорин А.В., Ноева Е.А., Хаспекова Н.Б. и др. Нарушения вегетативной регуляции при ишемии миокарда//Терапевтический архив. 1999. № 9. C. 57-61.
- Жемайтите Д.И. Вегетативная регуляция и развитие осложнений ишемической болезни сердца//Физиология человека. 1989. № 2. С. 3-13.
- Явелов И.С., Грацианский Н.А., Зуйков Ю.А. Вариабельность ритма сердца при острых коронарных синдромах: значение для оценки прогноза заболевания (часть 1)//Кардиология. 1997. № 2. C. 61-69.
- Odemuyiwa O., Malik M., Farrell T. et al. Comparison of the predictive characteristics of heart rate variability index and left ventricular тejection fraction for all-cause mortality, arrhythmic events and sudden death after acute myocardial infarction//Am. J. Cardiol. 1991. Vol. 68. P. 434-439.
- Bauer A., Kantelhardt J.W., Barthel P. et al. Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study//Lancet. 2006. Vol. 367. Iss. 20. P. 1639-1641.
- Malpas S. Neural influences on cardiovascular variability: possibilities and pitfalls//Am. J. Physiol. Heart Circ. Physiol. 2002. Vol. 282. P. 6-20.
- Glass L. Synchronization and rhythmic processes in physiology//Nature. 2001. Vol. 410. P. 277-284.
- Janson N.B., Balanov A.G., Anishchenko V.S., P.V.E. Mc-Clintock Phase relationships between two or more interacting processes from one-dimensional time series. II. Application to heart-rate-variability data//Phys. Rev. E 2002. Vol. 65. P. 036212.
- Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. и др. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (методические рекомендации)//Вестник аритмологии. 2001. Т. 24. С. 66-85.
- De Boer R.W., Karemuker J.M., Stracker J. On the spectral analysis of blood pressure variability//Am. J. Physiol. 1986.Vol. 251. P. 685-687.
- Киселев А.Р., Беспятов А.Б., Посненкова О.М. и др. Внутренняя синхронизация основных 0,1Гц -частотных ритмов в системе вегетативного управления сердечно-сосудистой системой//Физиология человека. 2007. Т. 33. № 2. С.69-75.
- Whittam A.M., Claytont R.H., Lord S.W. etal. Heart rate and blood pressure variability in normal subjects compared with data from beat-to-beat models developed from de Boer's model of the cardiovascular system//Physiol Meas. 2000. Vol. 21. Iss. 2. P. 305-318.
- Heart Rate Variability. Standarts of Measurement, Physiological Interpretation and Clinical Use//Circulation. 1996. Vol. 93. P. 1043-1065.


